Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Imaging Glykane in Zebrafisch-Embryonen durch metabolische Markierung und Bioorthogonale Click-Chemie
In diesem Artikel
Zusammenfassung
Ein Klick-Chemie basierende Methode, die für die schnelle, nichtinvasive und robuste Kennzeichnung von Alkin-markierten Glykane in Zebrafisch-Embryonen erlaubt wird beschrieben. Fucosylierte Glykane in der umhüllenden Schicht von Zebrafisch-Embryonen in den späten Gastrulation Bühne wurden in dieser Studie abgebildet.
Zusammenfassung
Imaging Glykane in vivo wurde vor kurzem durch die Verwendung einer bioorthogonale chemischen Reporter, indem man Zellen oder Organismen mit Azid-oder Alkin-markierten Monosacchariden 1, 2. Die modifizierte Monosaccharide, durch die Glykan Biosynthese-Maschinerie verarbeitet, sind in der Zelloberfläche Glycokonjugate eingearbeitet. Die bioorthogonale Azid-oder Alkin-Tags dann eine kovalente Konjugation mit fluoreszierenden Sonden für die Visualisierung oder mit Affinitätssonden zur Anreicherung und glycoproteomic Analyse. Dieses Protokoll beschreibt die Verfahren in der Regel für nicht-invasive Bildgebung von fucosylierte Glykane in Zebrafisch-Embryonen verwendet werden, einschließlich: 1) Mikroinjektion von one-Zell-Stadium Embryos mit einem BIP-5-alkynylfucose (BIP-FucAl), 2) Kennzeichnung fucosylierte Glykane in der umhüllenden Schicht aus Zebrafisch-Embryos mit Azid-konjugierten Fluorophore über biokompatible Cu (I)-katalysierten Azid-Alkin-Cycloaddition (CuAAC) und 3) Bildgebung durch konfokale Mikroskopie 3. Die hier beschriebene Methode kann leicht erweitert werden, um andere Klassen von Glykane, zB Glykane mit Sialinsäure 4 und N-Acetyl-5, 6, bei der Entwicklung von Zebrafisch und in anderen Lebewesen zu visualisieren.
Protokoll
1. Egg Collection und Dechorionation
- Sammeln und Transfer Zebrafisch-Eier zu 35mm Petrischale, so viel Wasser wie möglich zu entfernen und fügen Sie dann 1 mg / ml Pronease E in E3 Embryo Medium (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl 2 · 2H 2 O, 0,33 mM MgSO 4, pH = 7,4), um das Chorion zu verdauen.
- Nach 3-5 Minuten verschmelzen die Schüssel in ein Becherglas mit Fisch Wasser (60 mg "Instant Ocean" pro Liter destilliertem H 2 O) gefüllt und sanft Übertragung der Eier in das Becherglas und lassen die Eier zu "stürzen" ins Wasser.
- Spülen Sie die Eier mit Fisch Wasser dreimal. Die meisten Eier werden aus ihren Chorion veröffentlicht werden.
- Mit einem Feuer-poliertem Glas Pasteur Pipette die dechorionated Eier Agarose beschichteten Petrischalen mit E3 Embryo Medium gefüllt ist.
2. Mikroinjektion mit einem BIP-FucAl
- Bereiten Sie die Injektion Gerichte nach dem Berichtsmonat Protokoll 7.
- Transfer dechorionated Eier in Injektion Gerichte mit E3 Embryo Medium gefüllt ist.
- Bereiten Sie die Nadel und Last mit 2 ul Injektionslösung. Diese Lösung enthält 20 mM GDP-FucAl synthetisiert chemoenzymatisch 8 und entweder Alexa Fluor 594-Dextran (5% w / v) als Tracer oder Phenolrot Loading Dye (0,1% w / v) in 0,2 M KCl. Als Negativ-Kontrolle, ersetzen BIP-FucAl mit GDP-Fucose in Injektionslösung.
- Break the Nadel und stellen Sie den Einspritzdruck und die Dauer einer 1 nL drop 9 ergeben.
- Spritzen Sie die Eier mit 1 nL der jeweiligen Lösung.
- Übertragen Sie die Eier in Agarose-beschichteten Petrischalen mit E3 Embryo Medium gefüllt ist.
- Inkubieren Eier bei 28 ° C und entfernen Sie die unbefruchteten Eier in drei Minuten vor vier Stunden nach der Befruchtung.
3. BTTES-Cu (I)-katalysierten Klick-Chemie Reaction
- Wenn die Embryonen erreichen Entwicklungsstadien (zB verspätete Gastrula-, Gewebe-Segmentierung und der frühen Larve), Mantel der Basis einer 96-Well-Platte mit Agarose gewünscht.
- Add 92 ul E3 Embryo Medium in jede Vertiefung, durch Zugabe von 4 ul Alexa Fluor-488-Azid gefolgt (von 2,5 mM Lager in H 2 O), 2 ul BTTES-CuSO 4 6.01 komplex, und schütteln Sie sie leicht zu mischen.
- Transfer-Embryonen in den Brunnen mit dem Klick-Chemie-Reagenz mit einem Feuer-poliertem Glas Pasteur Pipette. Jedes der gut sollte weniger als fünf Embryonen.
- Add 2,5 ul frisch zubereiteten Natriumascorbat (von 100 mM Lager in H 2 O), um die Klick-Reaktion 3 einzuleiten. Endkonzentration jedes Reagenz: Alexa Fluor-488-Azid: 100 nM; CuSO 4: 50 uM; BTTES: 300 nM; Natriumascorbat: 2,5 mm.
- Nach 3 min, add 2 ul Bathocuproin sulfonat (50 mM Lager in H 2 O), einem biokompatiblen Kupfer-Chelator, um die Reaktion dann zu löschen verdünnen sofort mit 100 ul E3 Embryo Medium.
- Übertragen Sie die Embryonen einer Glas-Petrischale und waschen Sie die behandelten Embryonen 2 mal mit 15 mL E3 Embryo Medium.
4. Imaging
- Geben Sie einen Tropfen extrem niedrigen Schmelzpunkt Agarose (1,2% (w / v) in E3 Embryo medium) auf einem MatTek Glasboden Mikrotiterplatten Schale und setzen ein Embryo in die Agarose fallen.
- Position der Embryonen dorsal oder lateral und die Schale auf Eis für 5 min auf die Agarose Tropfen erstarren. Add E3 Embryo Medium vorsichtig in die Schale, bis sie die Agarose Tropfen abdeckt.
- Fluoreszenz-und Hellfeld-Bilder erworben werden nacheinander mit einem konfokalen Mikroskop. Alle Embryo Bilder aufgenommen mit einem 5 um Schritt Intervall. Zusammengesetzte Zahlen werden unter Verwendung von ImageJ-Software.
5. Repräsentative Ergebnisse
Abbildung 1 zeigt den Workflow unserer Zwei-Schritt-Kennzeichnung Strategie. Abbildung 2 zeigt die Kennzeichnung von Zebrafisch-Embryonen via BTTES-vermittelte CuAAC bei 9,5 Stunden nach der Befruchtung (HPF). BTTES ist ein Tris (triazolylmethyl) amin-Liganden. Er beschleunigt CuAAC dramatisch, wenn die Abstimmung mit den in situ erzeugten Cu (I), und fördert die Cycloaddition schnell in lebenden Systemen ohne erkennbare Toxizität. Unmittelbar nach einem 3-min-Klick-Reaktion, sind wir in der Lage, robuste Kennzeichnung des BIP-FucAl behandelten Embryonen (Abbildung 2, linkes Bild) zu erkennen. Nur Hintergrundfluoreszenz wird für die Steuerung von Embryonen mit GDP-Fucose (Abbildung 2, rechts Panels) mikroinjiziert erkannt.

Abbildung 1. Die Strategie der Kennzeichnung fucosylierte Glykane in der umhüllenden Schicht von Zebrafisch-Embryonen.
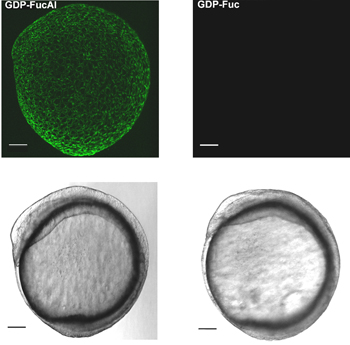
Abbildung 2. In-vivo-Bildgebung von fucosylierte Glykane in Zebrafisch-Embryogenese über BTTES-Cu (I)-katalysierten Klick-Chemie. Ein-Zell-Stadium Zebrafischembryonen sind mit einer einzigen Dosis des BIP-FucAl mikroinjiziert und dürfen develop auf 9,5 hpf. Die Embryonen werden dann mit Alexa Fluor 488-Azid, katalysiert durch BTTES-Cu (I) umgesetzt. Reagierte Embryonen abgebildet werden mit Hilfe der konfokalen Mikroskopie. Maximale Intensität z-Projektion Bilder von Alexa Fluor 488-Fluoreszenz (oberes Bild); Hellfeld (unteres Bild). Maßstab: 100 um.
Fehlerbehebung
| Problem | Ursache | Abhilfe |
| Die Embryonen ungesund aussehen | Die mikroinjiziert Lösung enthält Schadstoffe | Die Reinheit des Nucleotidzucker sollte größer sein als 85%. Überprüfen Sie Ihre Hand. |
| Es gibt keine Kennzeichnung nach der Reaktion | Kupfer-Konzentration unterhalb von 30 pM | Achten Sie darauf, die Reaktionslösung durch Zugabe überschüssiger E3 Embryo Medium bei Zugabe der Embryonen, wie die Reaktionsgeschwindigkeit sinkt deutlich, wenn die Kupfer-Konzentration unter 30 uM zu verdünnen. |
| Die Embryonen sterben nach der Reaktion | Unsachgemäße Behandlung der Embryonen | Sicherstellen, dass die Pipette ist feuerpolierte und das Reaktionsgefäß mit einer sehr dünnen Schicht von 0,5% Agarose beschichtet. |
| Die Bilder sehen fleckig | Die Reagenzien sind nicht richtig, bevor Sie die Embryonen gemischt | Befolgen Sie die empfohlene Reihenfolge der Zugabe der Reagenzien, und stellen Sie sicher, dass der Klick-Chemie Reagenzien wurden ordnungsgemäß vor der Zugabe des Embryos vermischt. |
| Die Bilder zeigen die Embryonen geschädigt werden | Heftiges Schütteln Schäden die Embryonen während der Reaktion | Sanft für weniger als 10 Sekunden schütteln, wenn die Embryonen in der Lösung sind. |
Diskussion
Imaging Biomolekülen In vivo Liefert wichtige Erkenntnisse ihrer biologischen Aktivitäten in ihrer natürlichen Umgebung. In diesem Video zeigen wir, wie die Kennzeichnung von fucosylierte Glykane in der umhüllenden Schicht von Zebrafisch-Embryonen durch Mikroinjektion one-Zell-Stadium Embryos mit einem BIP-FucAl und eine zweite für-Schritt-Fluorophor Konjugation über BTTES-vermittelte biokompatiblen CuAAC realisiert 3. Robust Kennzeichnung kann innerhalb von 2-3 Minuten erreicht ...
Offenlegungen
Danksagungen
Und Anschubfinanzierung von Albert Einstein College of Medicine; Diese Arbeit wurde teilweise durch die National Institutes of Health (3U54AI057158-06S1 zu RDS GM093282 zu PW) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Kupfer (II)-sulfat-Pentahydrat | Sigma-Aldrich | 203165 | |
| Alexa Fluor 488 Azid | Invitrogen | A10266 | |
| Dextran, Alexa Fluor 594 | Invitrogen | D-22913 | |
| (+)-Natrium-L-Ascorbat | Sigma-Aldrich | A7631 | |
| Bathocuproinedisulfonic Säure | Acros Organics | 164060010 | |
| Glasboden Mikrotiterplatten Gericht | MatTek | P35G-1,5-14-C |
Referenzen
- Laughlin, S. T., Bertozzi, C. R. Imaging the glycome. Proc. Natl. Acad. Sci. U. S. A. 106, 12-17 (2009).
- Baskin, J. M., Bertozzi, C. R. Bioorthogonal click chemistry: Covalent labeling in living systems. Qsar Comb. Sci. 26, 1211-1219 (2007).
- Soriano del Amo, D. Biocompatible copper(I) catalysts for in vivo imaging of glycans. J. Am. Chem. Soc. 132, 16893-16899 (2010).
- Chang, P. V. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Angew. Chem. Int. Ed. 48, 4030-4033 (2009).
- Laughlin, S. T., Baskin, J. M., Amacher, S. L., Bertozzi, C. R. In vivo imaging of membrane-associated glycans in developing zebrafish. Science. 320, 664-667 (2008).
- Baskin, J. M., Dehnert, K. W., Laughlin, S. T., Amacher, S. L., Bertozzi, C. R. Visualizing enveloping layer glycans during zebrafish early embryogenesis. Proc. Natl. Acad. Sci. U. S. A. 107, 10360-10365 (2010).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. J. Vis. Exp. , (2009).
- Wang, W. Chemoenzymatic synthesis of GDP-L-fucose and the Lewis X glycan derivatives. Proc. Natl. Acad. Sci. U. S. A. 106, 16096-16101 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J. Vis. Exp. , (2009).
- Westerfield, M. . THE ZEBRAFISH BOOK, A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Kimmel, C. B., Warga, R. M., Schilling, T. F. Origin and organization of the zebrafish fate map. Development. 108, 581-594 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten