Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Seven Steps to Cells Stellate
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode zur Isolierung von hepatischen Sternzellen aus Maus-Leber. Für Sternzellen Zellreinigung werden Maus-Leber verdaut In situ Und In-vitro- Nach Pronase-Kollagenase-Behandlung vor der Dichtegradientenzentrifugation. Diese Technik liefert hochreine Lebersternzellen.
Zusammenfassung
Hepatische Sternzellen sind Leber-residenten Zellen des sternförmigen Morphologie und sind in den Raum der Disse zwischen Leber sinusförmige Endothelzellen und Hepatozyten 1,2 liegt. Sternzellen sind aus dem Knochenmark Vorstufen abgeleitet und bis zu 80% der gesamten Körper Vitamin A 1, 2. Nach der Aktivierung, Differenzierung Sternzellen in Myofibroblasten um extrazelluläre Matrix produzieren und damit einen Beitrag zur Leberfibrose 3. Auf der Grundlage ihrer Fähigkeit zur Kontraktion kann myofibroblastischer Sternzellen regulieren den Gefäßtonus mit portaler Hypertonie 4 zugeordnet. Kürzlich haben wir gezeigt, dass Lebersternzellen sind potente Antigen-präsentierende Zellen und können NKT-Zellen als auch konventionelle T-Lymphozyten 5 zu aktivieren.
Hier präsentieren wir eine Methode zur effizienten Erstellung von hepatischen Sternzellen aus Maus-Leber. Aufgrund ihrer perisinusoidal Lokalisation, ist die Isolierung von hepatischen Sternzellen in einem mehrstufigen Prozess. Um Sternzellen zugänglich Isolierung aus dem Raum der Disse machen, Maus Leber in situ mit den Verdauungsenzymen Pronase E und Collagenase P. Nach Perfusion perfundiert werden, wird das Lebergewebe, um zusätzliche enzymatische Behandlung mit Pronase E und Collagenase P in unterzogen vitro. Anschließend findet die Methode den Vorteil der großen Menge an Vitamin A-Speicherung Fetttröpfchen in hepatischen Sternzellen. Diese Funktion ermöglicht die Trennung von sternförmigen Zellen aus anderen Leber Zelltypen durch Zentrifugation auf einem 8% Nycodenz Gradienten. Die hier beschriebene Protokoll ergibt sich eine sehr reine und homogene Population von Sternzellen. Die Reinheit der Präparate können durch Färbung für die Marker-Molekül sauren Gliafaserproteins (GFAP), vor der Analyse mittels Fluoreszenzmikroskopie oder Durchflusszytometrie beurteilt werden. Zeigt ferner, wie die Lichtmikroskopie das einzigartige Erscheinungsbild der sternförmigen Lebersternzellen, dass große Mengen von Fetttröpfchen Hafen.
Zusammen bilden wir ein detailliertes Protokoll für die effiziente Isolierung von hepatischen Sternzellen, darunter repräsentative Bilder ihrer morphologischen Erscheinungsbild und GFAP Ausdruck, der den sternförmigen Zellen Einheit definieren helfen.
Protokoll
C57BL / 6 Mäusen sollte bei ~ 20 Wochen alt oder älter verwendet werden. Die Verwendung von männlichen Mäusen mit einem Gewicht von 25-30g wird empfohlen. Die Ausbeute an Sternzellen kann durch die Fütterung Mäusen ein Vitamin A angereicherte Diät für 2 Monate vor Zellisolation Sternzellen erhöht werden. Etwa 2x10 5 Lebersternzellen kann aus der Leber von einem C57BL / 6 Maus gereinigt werden, während die Ausbeute der Sternzellen aus Balb / c Mäusen deutlich höher. Das folgende Protokoll ist auf 5 Mäusen angepasst. Tierpflege und Experimente wurden in Übereinstimmung mit genehmigten Institutional Animal Care und Verwenden Ausschuss-Protokolle durchgeführt.
1. In situ Perfusion der Maus Leber mit Verdauungsenzymen
- Warm die SC1 Puffer und Enzym Perfusionslösungen in einem 37 ° C Wasserbad.
- Montieren Sie einen geflügelten Infusion auf den Silikonschlauch einer Schlauchpumpe gesetzt.
- Kalibrieren Sie die Pumpe mit PBS zu einer laminaren Strömung der 6.5ml/min, die den Durchfluss, die für die in situ Perfusion der Leber verwendet wird, ist zu erhalten. Äquilibrieren der Silikonschlauch mit SC1-Lösung.
- Anesthetize der Maus durch intraperitoneale Injektion von Ketamin (90 mg / kg) und Xylazin (10 mg / kg) Lösung und testen für den Verlust von Reflexen, tiefe Betäubung zu gewährleisten.
- Befestigen Sie die Maus in Rückenlage auf einer geeigneten Unterlage.
- Mit einer Schere und Pinzette, um einen Längsschnitt in der Bauchhaut führen und setzen das Bauchfell.
- Öffnen Sie vorsichtig das Bauchfell und bewegen Sie den Darm aus der Bauchhöhle auf die linke Seite des Tieres, um die Pfortader aussetzen.
- Legen Sie die Kanüle der Infusion in die Pfortader gesetzt. Für diesen Schritt ist die Verwendung von einem Stereomikroskop empfohlen.
- Starten Sie die Durchblutung der Leber mit 30ml SC1-Lösung. Öffnen Sie die Vena cava inferior unmittelbar nach Beginn der Strömung. Erfolgreiche Spülung der Leber wird durch einen Verlust der Farbe des Lebergewebes angegeben.
- Perfundieren der Leber mit 30 ml Pronase E Lösung. Nach erfolgreicher Verdauung wird die Leberlappen schwellen an, und die Läppchen erscheinen verschiedene durch die Kapsel.
- Perfundieren der Leber mit 30 ml Collagenase P-Lösung. Die Leber an diesem Punkt hat seine Form verloren und sieht atonische und amorph.
- Sorgfältig trennen die Leber vom Zwerchfell und den umliegenden Organen und speichern Sie es in 70ml SC2-Lösung auf Eis.
- Wiederholen Sie den Vorgang für weitere Mäuse.
2. In-vitro-Verdauung der Maus Leber
Alle weiteren Arbeitsschritte sind unter sterilen Bedingungen in einer Sterilbank durchgeführt werden.
- Schneiden Sie die Leber in Stücke von ca. 2x2x2mm 3 mit einer scharfen Schere.
- Kombinieren Sie die Aussetzung der 70ml SC2 einschließlich der Leber Stücke mit 50 ml Pronase E-Collagenase P-Lösung und 1ml von DNase I-Lösung.
- Digest der Leber für 20min bei 37 ° C unter Rühren.
3. Dichtegradientenzentrifugation
- Filtern Sie die Zellsuspension durch 70μm Zelle Siebe in 6 50ml Falcon-Röhrchen und bis zu 50ml mit SC2-Puffer. Zentrifuge für 10 min bei 600 g und 4 ° C.
- Vorsichtig absaugen 40ml der Überstand, fügen Sie dann 150 &mgr; l DNase I-Lösung in jedes Röhrchen und Zellen.
- Pool der Zellsuspensionen in 4 50ml Falcon-Röhrchen und wäscht mit GBSS-B, Zentrifuge für 10 min bei 600 g und 4 ° C.
- Vorsichtig absaugen so viel von der Überstand wie möglich, ohne das Pellet und fügen 150 &mgr; l DNase I-Lösung in jedes Röhrchen. Resuspendieren der Zellpellets in 10ml GBSS-B pro Röhre.
- Pool der Zellen in 2 50ml Falcon-Röhrchen und fügen GBSS-B auf ein Gesamtvolumen von 36ml pro Tube. Fügen Sie 14ml Nycodenz Lösung in jedes Röhrchen und gut mischen.
- Transfer-10ml der Zellsuspension in ein 12ml Gradientenzentrifugation Röhre, die sich in 10 Röhren in total. Gently überlagern die Zellsuspension mit 1,5 ml GBSS-B pro Röhre.
- Centrifuge die Gradienten für 15 min bei 1500g und 4 ° C ohne Bremse. Anschließend wird Hepatozyten werden am Boden des Röhrchens pelletiert während sternförmigen Zellen in der Interphase als weißer Ring zu finden sind.
- Sorgfältig Ernte der Interphase mit den sternförmigen Zellen und waschen Sie sie mit GBSS-B; Zentrifuge für 10 min bei 600 g und 4 ° C.
- Saugen Sie den Überstand und Zellen in 20ml DMEM mit 10% Hitze-inaktiviertes FBS, 1% Penicillin / Streptomycin, 2 mM L-Glutamin, 1 mM Natriumpyruvat, und 10mm HEPES ergänzt. Übertragen Sie die Zellen in Zellkulturflaschen mit einer Konzentration von 2x10 4 Zellen / cm 2. Inkubieren Sie die Zellen bei 37 ° C und 5% CO 2.
- Ändern Sie die Medien so schnell wie der hepatischen Sternzellen Anhänger (ca. 2h nach der Herstellung) abzuwaschen toten Zellen und Zelltrümmer werden.
- Am folgenden Tag, dem sternförmigen Zellens sollten ihre charakteristischen sternförmigen Morphologie mit perinukleären Vitamin A-Speicherung Lipidvesikel.
- Für nachfolgende Experimente können Lebersternzellen leicht von nicht-beschichteten Kunststoff-Oberflächen mit einer milden enzymatischen Lösungen wie Accutase, zB gelöst werden
4. Repräsentative Ergebnisse:
Nach der Vorbereitung der hepatischen Sternzellen mit dem Protokoll vorgesehen ist, kann die Reinheit der isolierten Population getestet erwägt drei wichtigsten Merkmale dieser Zelltyp, wie etwa sternförmig, perinukleären Fetttröpfchen, und die Expression von sauren Gliafaserproteins (GFAP werden ). Vertreter Bilder für das charakteristische Aussehen der hepatischen Sternzellen 2h nach Zellisolation, sowie am Tag 1 und 3 der in-vitro-Kultur sind in Abbildung 1 dargestellt. Abbildung 2 zeigt eine repräsentative Immunfluoreszenzfärbung für GFAP in hepatischen Sternzellen, die für 3 Tage nach der Zell-Isolierung wurden kultiviert. Lebersternzellen differenzieren sich in myofibroblastischer Zellen während der in vitro-Kultur. Ein charakteristisches Merkmal dieser aktiviert Sternzellen ist der Ausdruck von alpha smooth muscle actin (αSMA). Abbildung 3 zeigt Immunfluoreszenzfärbung für Asma und Myosin IIA in aktivierten Sternzellen am Tag 7 der in vitro-Kultur.
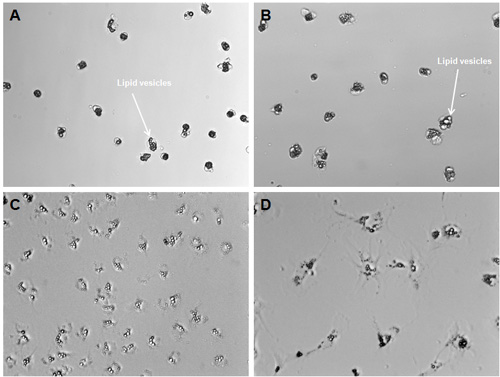
Abbildung 1. Charakteristischer Morphologie von hepatischen Sternzellen. Sternzellen wurden von der Maus Leber unter Verwendung des Protokolls zur Verfügung gestellt isoliert. Die Bilder zeigen Sternzellen 2h nach Zellisolation (a, b), sowie am Tag 1 (c) und Tag 3 (d) der in vitro-Kultur. Hepatische Sternzellen weisen eine hohe Mengen an Lipid-Vesikel an perinukleären Websites und erhalten ihre unverwechselbare astral-Morphologie in den ersten Tagen der in vitro-Kultur (Vergrößerung 200x).
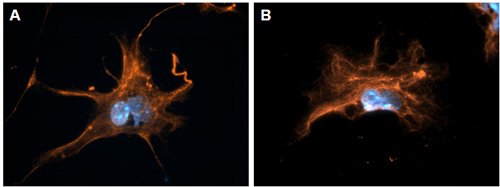
Abbildung 2. Lebersternzellen speziell ausdrückliche GFAP in der Leber. Stellate Zellen wurden isoliert und immunofluorescently für GFAP (rot) gefärbt am Tag 3 der In-vitro-Kultur. Zellkerne sind blau (Hoechst-Färbung) dargestellt.
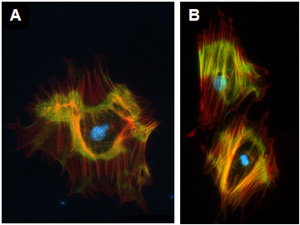
Abbildung 3. Liver Sternzellen differenzieren sich in Myofibroblasten. Hepatische Sternzellen aus C57BL / 6 Mäusen isoliert wurden für 7 Tage kultiviert. Anschließend wurden sie an die Kammer Dias übertragen und gefärbt Asma (rot dargestellt) und Myosin IIA (dargestellt in Grün). Die Zellkerne wurden mit Hoechst (blau) gegengefärbt.
| SC1 Buffer | |
| EGTA | 190 mg |
| Glucose | 900mg |
| HEPES | 10 ml 1 M Stammlösung |
| KCl | 400mg |
| Na 2 HPO 4 x 2 H 2 O | 151mg |
| NaCl | 8g |
| NaH 2 PO 4 x H 2 O | 78mg |
| NaHCO 3 | 350mg |
| Phenol Red | 6mg |
| dH 2 O | auffüllen auf 1l |
| SC2 Buffer | |
| CaCl 2 x 2H 2 O | 560mg |
| HEPES | 10 ml 1M Stammlösung |
| KCl | 400mg |
| Na 2 HPO 4 x 2 H 2 O | 151mg |
| NaCl | 8g |
| NaH 2 PO 4 x H 2 O | 78mg |
| NaHCO 3 | 350mg |
| Phenol Red | 6mg |
| dH 2 O | auffüllen auf 1l |
| GBSS-A-Puffer | |
| KCl | 370mg |
| CaCl 2 x 2H 2 O | 225mg |
| Glucose | 991mg |
| KH 2 PO 4 | 30mg |
| MgCl 2 x 6 H 2 O | 210mg |
| MgSO 4 x 7 H 2 O | 70mg |
| Na 2 HPO 4 x 2 H 2 O | 75mg |
| NaHCO 3 | 227mg |
| Phenol Red | 6mg |
| dH 2 O | auffüllen auf 1l |
| GBSS-B Buffer | |
| CaCl 2 x 2H 2 O | 225mg |
| Glucose | 991mg |
| KCl | 370mg |
| KH 2 PO 4 | 30mg |
| MgCl 2 x 6 H 2 O | 210mg |
| MgSO 4 x 7 H 2 O | 70mg |
| Na 2 HPO 4 x 2 H 2 O | 75mg |
| NaCl | 8g |
| NaHCO 3 | 227mg |
| Phenol Red | 6mg |
| dH 2 O | auffüllen auf 1l |
| Pronase E Perfusionslösung | |
| Pronase E | 100mg (4000 PU / mg min) |
| SC2 Buffer | 200ml |
| Collagenase P Perfusionslösung | |
| Collagenase P | 85mg (1,78 U / mg lyo) |
| SC2 Buffer | 200ml |
| Pronase E-Collagenase P-Lösung | |
| Pronase E | 50mg (4000 PU / mg min) |
| Collagenase P | 85mg (1,78 U / mg lyo) |
| SC2 Buffer | 50ml |
| DNase I-Lösung | |
| DNase I | 6mg (ca. 2000U/mg) |
| GBSS-B | 3ml |
| Nycodenz Lösung | |
| Nycodenz | 8g |
| GBSS-A | 28ml |
Tabelle 1. Puffer und Enzym-Lösungen für die Isolierung von hepatischen Sternzellen erforderlich. Der pH-Wert aller Puffer sollte 7,3-7,4 eingestellt werden. Darüber hinaus ist Sterilfiltration aller Puffer empfohlen. Es ist wichtig, die Menge des Enzyms, die gemäß der gegebenen enzymatischen Aktivität anzupassen.
Diskussion
Lebersternzellen regeln wesentliche physiologische und pathophysiologische Prozesse in der Leber. Darüber hinaus besitzen Sternzellen Antigen-präsentierenden Eigenschaften, wodurch sie ein wichtiger Bestandteil der Leber Immunantwort. Obwohl Lebersternzellen 10-15% der gesamten Zellzahl in der Leber enthalten, ist die Isolation dieser Zellen Herausforderung aufgrund ihrer Lokalisation in der perisinusoidal Raum der Disse.
Hier präsentieren wir Ihnen eine einfache Methode, um Lebersternzel...
Offenlegungen
Danksagungen
Diese Arbeit wurde durch die Smith Family Award for Excellence in Biomedical Research und NIH RO1 AI083426-01 (FW) gefördert. Patrick Maschmeyer und Melanie Flach von PhD-Stipendien des Boehringer Ingelheim-Stiftung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name Of Reagent | Firma | Katalog Nr. | |
|---|---|---|---|
| 70μm Zellsieb | BD | 352350 | |
| CaCl 2 x 2H 2 O | Sigma-Aldrich | C3306 | |
| Collagenase P | Roche | 11249002001 | |
| DMEM | Gibco | 11960 | |
| DNase I | Roche | 10104159001 | |
| DPBS | CellGro | 21 bis 031-cv | |
| EGTA | Fluka | 3777 | |
| Fetal Bovine Serum | Gibco | 16000 | |
| Glucose | Sigma-Aldrich | G7528 | |
| Gradientenzentrifugation Tubes | Greiner Bio-One | 163160 | |
| HEPES | Gibco | 15630 | |
| KCL | Sigma-Aldrich | P9541 | |
| KH 2 PO 4 | Sigma-Aldrich | P9791 | |
| L-Glutamin | Gibco | 25030 | |
| MgCl 2 x 6 H 2 O | Fluka | 63068 | |
| MgSO 4 x 7H 2 O | Sigma-Aldrich | M2773 | |
| Na 2 HPO 4 x 2H 2 O | Fluka | 71643 | |
| NaCl | Sigma-Aldrich | S3014 | |
| NaH 2 PO 4 x H 2 O | Fluka | 71507 | |
| NaHCO 3 | Fluka | 71628 | |
| Nycodenz | Accudenz AG | AN7050/BLK | |
| Penicillin / Streptomycin | Gibco | 15140 | |
| Schlauchpumpen | Cole Parmer | HV-7523 bis 70 | |
| Phenol Red | Sigma-Aldrich | P4633 | |
| Pronase E | Calbiochem | 7433-2 | |
| Silikonschlauch | Masterflex | HV-96440-14 | |
| Natriumpyruvat | Gibco | 11360 | |
| Zellkulturflasche (25cm 2) | BD | 353108 | |
| Winged Infusion Set | Terumo | 1SV27EL |
Referenzen
- Friedman, S. L. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 88, 125-172 (2008).
- Geerts, A. H. i. s. t. o. r. y. heterogeneity, developmental biology, and functions of quiescent hepatic stellate cells. Semin Liver Dis. 21, 311-335 (2001).
- Gressner, A. M. &. a. m. p. ;. a. m. p., Weiskirchen, R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 10, 76-99 (2006).
- Reynaert, H., Thompson, M. G., Thomas, T., Geerts, A. Hepatic stellate cells: role in microcirculation and pathophysiology of portal hypertension. Gut. 50, 571-581 (2002).
- Winau, F. Ito cells are liver-resident antigen-presenting cells for activating T cell responses. Immunity. 26, 117-129 (2007).
- Minicis, S. D. e. Gene expression profiles during hepatic stellate cell activation in culture and in vivo. Gastroenterology. 132, 1937-1946 (2007).
- Knittel, T. Localization of liver myofibroblasts and hepatic stellate cells in normal and diseased rat livers: distinct roles of (myo-)fibroblast subpopulations in hepatic tissue repair. Histochem Cell Biol. 112, 387-401 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten