Method Article
A Quantitative Assay für Insulin-exprimierenden Koloniebildende Vorläufern
In diesem Artikel
Zusammenfassung
Eine dreidimensionale klonogene Test, dass Pankreas-like Vorläuferzellen in Insulin-exprimierenden Kolonien unterscheiden können beschrieben. Diese Methode nutzt die Vorteile von halbfesten Medien mit Methylcellulose, Matrigel und Wachstumsfaktoren, in denen einzelne Vorläuferzellen proliferieren und differenzieren In-vitro-, Erlauben die Quantifizierung der Anzahl der funktionellen Vorfahren in einer Population.
Zusammenfassung
Das Gebiet der Pankreas-Stamm-und Vorläuferzellen der Zellbiologie hat durch einen Mangel an in vitro funktionale und quantitative Tests, die für die Analyse der einzelnen Zelle ermöglichen behindert. Analysen der einzelnen Vorfahren sind von entscheidender Bedeutung, weil sie definitive Möglichkeiten, eindeutig beweisen die Abstammung Potenzial der einzelnen Vorfahren geben. Obwohl Methoden entwickelt worden, um "pancreatospheres" in Suspensionskultur aus einzelnen Zellen zu generieren, gibt es einige Einschränkungen. Erstens ist es zeitaufwendig, einzelne Zelle Deposition für eine große Zahl von Zellen, was wiederum Befehle große Mengen von Nährmedien und Raum. Durchführen Zweitens, Nummerierung der resultierenden pancreatospheres ist arbeitsintensiv, vor allem, wenn die Frequenz des pancreatosphere-Einleitung Vorfahren niedrig ist. Drittens ist die pancreatosphere Assay keine effiziente Methode, um damit sowohl die Proliferation und Differenzierung von Vorläuferzellen der Bauchspeicheldrüse in der gleichen Kultur gut, restricting die Nützlichkeit des Tests.
Um diese Einschränkungen zu überwinden, hat eine halbfeste Medien basieren Kolonie Assay für Pankreas-Vorläuferzellen entwickelt worden und wird in diesem Bericht vorgestellt. Diese Methode nutzt eine bestehende Konzept von der hämatopoetischen Kolonie-Assay, in dem Methylcellulose verwendet, um die Viskosität zu den Medien geben wird, so dass die Vorläuferzellen in drei-dimensionalen Raum bleiben, wie sie die Proliferation sowie Differenzierung zu unterziehen. Zur Bereicherung Insulin-exprimierenden koloniebildenden Vorläuferzellen aus einer heterogenen Bevölkerung, verwendeten wir Zellen, die Express Neurogenin (NGN) 3, ein Pankreas endokrine Vorläuferzellen Zell-Marker. Murine embryonale Stammzellen (ES)-Zellen abgeleiteten Ngn3 exprimierenden Zellen mit dem Enhanced Green Fluorescent Protein Reporter getaggt wurden sortiert und bis zu 25.000 Zellen pro Vertiefung ausplattiert in low-Anlage 24-Well-Kulturschalen. Jedes Well enthielt 500 ul von halbfesten Medien mit den folgenden Hauptkomponenten: methylcellulose, Matrigel, Nicotinamid, Exendin-4, Activin βB und konditionierten Medien von murinen ES-Zellen abgeleiteten Pankreas-ähnlichen Zellen gesammelt. Nach 8 bis 12 Tagen Kultur, Insulin-exprimierenden Kolonien mit ausgeprägter Morphologie wurden gebildet und könnte weiter für Pankreas-Genexpression mittels quantitativer RT-PCR und immunoflourescent Färbung der Linie Zusammensetzung der einzelnen Kolonie bestimmen analysiert werden.
Zusammenfassend können unsere Kolonie Assay leicht Detektion und Quantifizierung von funktionellen Vorfahren innerhalb einer heterogenen Population von Zellen. Darüber hinaus ermöglicht der halbfesten Medien-Format einheitliche Darstellung der Komponenten der extrazellulären Matrix und Wachstumsfaktoren auf Zellen, so dass Vorläuferzellen zu vermehren und in vitro zu differenzieren. Diese Kolonie Assay bietet einzigartige Möglichkeiten für mechanistische Untersuchungen von Pankreas-Vorläuferzellen an der einzelnen Zelle Ebene.
Protokoll
1. Differenzierung von murinen ES-Zellen zu Pankreas-ähnliche Zellen in vitro zu konditionierten Medien (CM) für Kolonie-Assay zu erzeugen
Die Verfahren für murine ES-Zell-Wartung, haben Embryoidkörper (EB)-Bildung in Suspensionskultur, und Anhänglichkeit Kultur zur weiteren Differenzierung zuvor beschriebenen 1-3 und sind nicht im Mittelpunkt dieses Berichts. Eine schematische Darstellung der Schritte in unserer Differenzierung Protokoll eingebunden ist in Abbildung 1 dargestellt.
Um qualitativ hochwertige konditionierten Medien zu erhalten, ist es wichtig, zuerst zu erzeugen 6-Tage alten EBs, in denen mindestens 30-40% von ihnen sind mit einem Durchmesser von mindestens 150 um. Je größer EBs sollte dunkle Flecken unter dem Lichtmikroskop, was darauf hindeutet verstärkte Differenzierung (Abbildung 2). Die Auswahl von qualitativ hochwertigen fötalem Kälberserum (FCS) ist entscheidend, solche EBs zu generieren. Hochwertige FCS Lose sind auf der Grundlage ihrer Fähigkeit, die differentiat Unterstützung ausgewähltion von EBs gegenüber Insulin 1, Glukagon und Amylase 2A Genexpression in den späteren Phasen (Tag 18-20) durch RT-PCR-Analyse nachgewiesen. Darüber hinaus, wenn der Tag-6 EBs aus Suspensionskultur, um die Befestigung Kultur (ca. 80 bis 100 EBs pro Well in 6-Well-Platten) übertragen ist es wichtig, vorsichtig drehen die Platten auf den Tag-6 EBs in der Mitte der Brunnen zu sammeln. Aus unbekannten Gründen, Manöver, die Zell-Zell-Kontakte führen zu einer besseren Entwicklung von Pankreas-ähnliche Zellen aus EBs in der anschließenden Befestigung Kultur Bühne zu verbessern.
- Am Tag der Kultur 13, ersetzt die Anlage Kulturmedien (DMEM/F-12 (1:1), 15% Knockout Serumersatz, 2 mM L-Glutamin, 50 U / ml Penicillin, 50 ug / ml Streptomycin) mit frischem Befestigung Kultur Medien containing10 mM Nicotinamid, 0,1 nM Exendin-4 und 10 ng / mL, menschliches rekombinantes Aktivin SSB (alle Konzentrationen sind endgültig).
- Am Tag der Kultur 16, sammeln die Medien aus Schritt 1,1 und filtern durch einen 0,2 um Polyetherulfone Membran. Von diesem Punkt an die gesammelten Medien werden als konditionierte Medien (CM) bezeichnet werden. Aliquot der CM in 15 mL Falcon-Röhrchen und bewahren Sie sie bei -80 ° C bis unmittelbar vor dem halbfesten Kultur (siehe Abschnitt 3 unten).
2. Beziehen Pankreas-like Vorfahren in einzelne Zell-Suspension mit einem Fluoreszenz-Activated Cell Sorter
Ein Knock-in Maus-ES-Zelllinie, 4 als Ngn3-EGFP, wo die EGFP-Reportergen ersetzt ein Allel des Ngn3 locus wie zuvor beschrieben. 2 Ngn3 ist ein basic helix-loop-helix (bHLH) mit Transkriptionsfaktor wurde differenziert bezeichnet . ausgedrückt durch pankreatische endokrine Vorläuferzellen während der Entwicklung 5-Tages-16 Kulturen wurden in der Regel sortiert, um differenzierte Ngn3-EGFP + und Ngn3-EGFP zu erhalten -. Zellen 1,2
- Die Dissoziation von differenzierten Zellen zu einer einzigen Zellsuspension.
- Inkubieren Tage-16 Kulturen with 0,25% Trypsin-EDTA (3 min, 37 ° C) zu verdrängen die Zellen aus der Kultur Brunnen.
- Fügen Sie 10% FCS Trypsin zu stoppen.
- Wash-Zellen mit Magnesium und Calcium-freier Phosphat-gepufferter Salzlösung (PBS) mit 0,1% Rinderserumalbumin (BSA), und bei 300 g zentrifugiert für 5 min.
- Überstand entfernen und inkubieren Sie die Zellklumpen mit 4 mg / ml Collagenase B und 2000 U / mL Desoxyribonuclease (DNase) I (30 min, 37 ° C) auf eine einzelne Zelle Suspension erzeugt werden. Verwenden Sie ein 1000 ul Pipette zu stören die Zellpellets alle 10 min, um die Dissoziation Prozess zu beschleunigen.
- Wash-Zellen mit PBS mit 0,1% BSA, und bei 300 g zentrifugiert für 5 min.
- Überstand entfernen und Zellen in PBS mit 0,1% BSA.
- Vorbereitung der Zellen für die Sortierung.
- Add 2 ul DNase I (1 MU / ml) für jeden mL Zellsuspension zu Zelle Reaggregation bei der Sortierung zu verhindern.
- Pass die einzige Zellsuspension durch ein 40 bis 70 &mgr; mesh zu großen Zellverbänden zu entfernen.
- Add DAPI (1 pg / ml Endkonzentration) zu den einzelnen Zell-Suspension.
- Erwerben Sie Durchflusszytometrie Daten auf einer Zell-Sorter. Ein MoFlo MLS (Beckman Coulter) Zellsortierer wurde für diesen Bericht verwendet.
- Gating von Zellpopulationen für die Sortierung. Ngn3-EGFP + und Ngn3-EGFP - Zellen sind gated zuerst mit Vorwärtsstreuung vs side scatter (Abbildung 3A), gefolgt von DAPI vs side scatter (3B), Pulsbreite vs side scatter (3C) und schließlich FL1 vs Autofluoreszenz (Abb. 3D). Die letzte Art Tor Ngn3-EGFP + Zellen ist absichtlich nach rechts (Abbildung 3E; Pfeil) bewegt, um eine Verunreinigung des Ngn3-EGFP Grenze - Zellen während der Sortierung. Für Negativ-Kontrolle Gating, entweder Tag-6 EBs aus Ngn3-EGFP ES Linie oder der gleichen Bühne, Tag-16 Kultur aus einer nicht-transgenen Linie, wie TL1 ES-Zellen (Abbildung 3D, links), verwendet werden kann.
- Sortieren Ngn3-EGFP + und Ngn3-EGFP - Zellen.
3. Plating sortierten Zellen bis halbfeste Kultur
- Matrigel Vorbereitung.
- Aliquot der Matrigel zu 1 ml pro Röhrchen und bei -20 ° C vor der Verwendung.
- Gefrorene Aliquots sollten bei 4 ° C über Nacht oder auf Eis für 3 Stunden auf kurz vor Tauwetter zu bedienen. Aufgetaute Aliquots müssen auf Eis während halbfeste Kultur Vorbereitung bleiben Wiederverfestigen vermeiden.
- Methylcellulose-Lösung (3,3%) Vorbereitung.
Methylcellulose Pulver kann nicht autoklaviert werden. Um Bakterien-freie Methylcellulose-Lösung zu erhalten, verwenden Sie reinigen mit einem Gewicht von Booten und autoklaviert Rührstäbchen, Becher, Flaschen und andere Hardware im Herstellungsverfahren.- Einen Tag vor der Methylcellulose-Lösung Vorbereitung, speichern 200 ml sterilem doppelt destilliertem Wasser bei 4 ° C. Auch vorbereiten 500 ml 2x DMEM/F12 Medien (Vorbereitung durch Auflösen von pulverförmigen DMEM / F-12 in doppelt destilliertem Wasser) mit 100 U / ml Penicillin und100 ug / ml Streptomycin und lagern bei 4 ° C.
- Am Tag der Methylcellulose Vorbereitung, 500 ml steriler doppelt destilliertem Wasser in einem 1000 mL Becherglas mit einem Stück Alufolie auf der Oberseite. Kochen für mindestens 30 min, um das Wasser von Luftblasen zu befreien.
- Legen Sie eine großformatige Rührstab (mindestens 3 cm in der Länge) in einem 2000 ml-Glasflasche.
- Messen Sie 300 ml kochendes Wasser und überträgt es auf den Kolben.
- Der Kolben wird auf einer Rührplatte (ohne Heizung). Langsam rühren das heiße Wasser zu vermeiden Erzeugung von Luftblasen.
- Wiegen Sie 33 Gramm Methylcellulose Pulver und sehr langsam fügen Sie es dem heißen Wasser. Heißes Wasser ist notwendig, um die Methylcellulose Pulver effizient nass und Hilfe der anschließenden Auflösung in kalten Temperaturen.
- Fahren Sie mit dem Pulver rühren, bis die Temperatur auf ca. 40-45 ° C reduziert wird
- Fügen Sie die 200 ml kaltem sterilem doppelt destilliertem Wasser zur Kühlung Methylcellulose Mischung. Sofortnach, sollten Sie beginnen, um zu sehen, die Lösung wiederum transparent und viskos, was darauf hinweist, dass Methylcellulose ist in der wässrigen Phase gelöst. Hand der Kolben geschwenkt, um die Lösung zu gewährleisten, wird gründlich gemischt.
- Fügen Sie die 500 ml kaltes 2x DMEM/F12 Medien. Weiter zu wirbeln von Hand zu mischen.
- Der Kolben wird auf einer Rührplatte in einem kalten Raum, und langsam rühren die Methylcellulose-Lösung für 24-48 Stunden.
- Aliquot der Lösung in 125 mL pro Vorratsflasche und bei -20 ° C. Eine Probe sollte in eine sterile Petrischale verzichtet werden und in 37 ° C Inkubator, um die Sterilität zu testen. Aufgetaute Methylcellulose-Lösung kann im Kühlschrank aufbewahrt werden bis zu 2 Monaten.
- Konditionierten Medien Vorbereitung.
Thaw CM (siehe Abschnitt 1) unmittelbar vor der Verwendung. Halten Sie die CM auf Eis in halbfesten Kultur Vorbereitung. - Bereiten Sie die folgenden Wachstumsfaktoren: 1,0 M Nicotinamid, 0,1 uM Exendin-4, 10 ug / ml rekombinantes humanes Activin βB und 10 & mu; g / mL VEGF-A. Bewahren Sie die Nicotinamid und Exendin-4 bei -20 ° C und Aktivin βB und VEGF-A bei -80 ° C und Auftauen sie unmittelbar vor dem Gebrauch. Alle halbfesten Kulturmedien Komponenten sollten auf Eis während der Beschichtung gehalten werden. Es ist anzumerken, dass die Zugabe von VEGF-A wurde später gefunden, nicht notwendig für Koloniebildung. 2.
- Fötalem Kälberserum Vorbereitung. FCS muss Hitze vor dem Gebrauch inaktiviert werden. Inkubieren Sie die FCS für 30 Minuten bei 56 ° C in einem Wasserbad auf Komplement-Proteine zu inaktivieren. Wenn das erste FCS Vorratsflasche hält mehr als 500 mL Aliquot es in 125 ml-Fläschchen. Die vergrößerte Oberfläche gewährleistet gleichmäßige und gründliche Erwärmung des gesamten Volumens. Lassen Sie die Flaschen bei Raumtemperatur für mindestens 1 Stunde kalt stellen vor dem Speichern bei -20 ° C. Aufgetaute FCS ist 0,2 um vor dem Gebrauch gefiltert.
- Mix Kultur-Komponenten mit sortierten Zellen.
Halten Sie die Zellen und alle halbfesten Medien-Komponenten auf Eis während der Vorbereitung zu jeder Zeit zur Verfestigung der verhindernMatrigel. Alle Lieferungen, die in Kontakt mit Matrigel darunter kommen, sollten Pipettenspitzen, Spritzen und Nadeln, kalt sein. Legen Sie diese liefert bei -20 ° C mindestens eine halbe Stunde vor dem Gebrauch.- Bestimmen Sie die Menge der Zellen pro Well in einer 24-Well-Platte ausgesät werden. Bis zu 25.000 Zellen pro 24-well beschichtet werden. Man könnte eine Titration der Zelldichte in den ersten Experimenten durchführen, um die optimale Aussaat Zellzahl zu bestimmen.
- Fügen Sie die Kultur-Komponenten zu einem 5 mL Polystyrol Röhrchen mit einer Schnappdeckel in der Reihenfolge, in Tabelle 1 beschrieben (beachten Sie, dass die Zellen aufgenommen werden zuletzt zu einer vorzeitigen Stimulation zu vermeiden). Fügen Sie die 3,3% Methylcellulose auf die Polystyrol-Röhrchen erste und der sortierten Zellen dauern. Beachten Sie, dass die 3,3% Methylcellulose-Lösung zu erstellen und in die Polystyrol-Röhrchen mit einem 16 ½-Gauge-Nadel und eine ausreichend markiert graduierte Spritze braucht. In der Regel in Ordnung korrekt messen das Volumen der viskosen Lösungen, wie die 3,3% Methylcellulose solution und die endgültige Mischung Kultur, ist es wichtig, eine Lösung in der Spritze ersten absaugen und dann sofort drücken Sie die Lösung aus, um die Luft auszutreiben. Die 3,3% Methylcellulose-Lösung kann auf Raumtemperatur erwärmt werden, wenn es zu schwierig zu ziehen ist. Allerdings sorgen sie auf Eis gekühlt wird, nachdem es in der Polystyrol-Röhrchen und vor der Zugabe von Matrigel verzichtet wird.
- Platte der halbfesten Medien mit sortierten Zellen.
- Nachdem sichergestellt wurde, die Kappen der Polystyrol-Röhrchen werden fest an seinem Platz, schütteln Sie die Rohre mit den Händen kräftig und gründlich. Luftblasen wird während dieses Prozesses generiert werden.
- Die Röhrchen auf Eis für 5 min oder bis die kleinen Luftbläschen Oberfläche.
- Verwenden Sie eine 1-ml-Spritze mit einer 16 ½ bzw. 18 ½-Gauge-Nadel, um den Inhalt abzusaugen. Beachten Sie die Hinweise in 3.6.2 eine genaue Volumen der viskosen Lösung ohne Luft in Spritzen zu ziehen.
- Langsam verzichten 500 uL der Medien in jedem 24-well. Verwendungdie geringe Bindung 24-Well-Platten nur. Fügen Sie die Medien direkt in die Mitte des Brunnens. Das halbfeste Medien werden automatisch verteilt in die Vertiefungen geben. Für jede experimentelle Probe werden vervierfacht Brunnen routinemäßig eingesetzt, um statistisch signifikante Ergebnisse zu erhalten. Nur die 4 innersten Spalten einer horizontal ausgerichteten 24-Well-Platte für die Kultur verwendet. Füllen Sie die restlichen Brunnen mit sterilem Wasser zur Befeuchtung der Zellen enthaltende Kultur zu unterstützen.
- Inkubieren Sie die Zellen in 37 ° C und 5% CO 2 Luft.
- Verzögerte Zugabe von Wachstumsfaktoren. Es ist möglich, Wachstumsfaktoren nach der Einleitung der Kultur hinzufügen. Solche Manöver können verwendet werden, um das Überleben bei bestimmten Wachstumsfaktoren Adresse sein. Growth-Factor-Lösungen bis zu 100 ul pro Well kann über eine 1 ml-Spritze werden tropfte mit einer 26 G 3 / 8 Nadel und dürfen in den halbfesten Medien zu verbreiten.
4. Observing Koloniebildung unter dem Licht microsbewältigen
Die Zellen sollten sofort nach der Beschichtung beobachtet werden, um sicherzustellen, dass einzelne Zellen zufällig und gleichmäßig über die Näpfe verteilt. Wenn die meisten der Zellen oder die entstehenden Kolonien am Rande der Brunnen verteilt sind, wird dies darauf hindeuten, daß die Aufhebung der halbfesten Medien in die Vertiefungen war zu stark (siehe Abschnitt 3.7.4). Aufgrund der Meniskus Wirkung Kolonie Dichte an den Rändern der Kultur Brunnen kann höher sein, im Vergleich zu denen mit Wohnsitz in der Mitte.
- Colony Zahl Quantifizierung. Durch die 3-dimensionale Funktion der Medien, werden die Kolonien auf unterschiedlichen Schwerpunkten erscheinen. So kann eine Anpassung der Fokus für jede Kolonie während der Beobachtung durch Licht-Mikroskopie benötigt werden. Bringen Sie ein Gitter unter dem 24-Loch beim Zählen, um zu vermeiden Registrierung der gleichen Kolonie zweimal. Ein Raster kann, indem man die Wand eines NUNC Petrischale (Kat. No.169558) bezogen werden. Ein 10x Objektiv auf einem Lichtmikroskop sollte obs verwendet werdenErve und zählen Sie die Kolonien.
5. Repräsentative Ergebnisse:
Frühere Experimente hatten gezeigt, dass beginnend mit 2,5 x 10 5 murine R1 ES-Zellen (in 50 mL Medien insgesamt) könnte man erwarten, dass rund 5000 der richtigen Größe Tage-6 EBs zu generieren. Die Ngn3-EGFP ES-Zellen wurden weniger effizient; 4-mal mehr Zellen wurden benötigt, um ähnlich große EBs am Tag 6 zu erzeugen. Weil 25 Tage-6 EBs enthalten durchschnittlich von 1,88 ± 0,67 x 10 5 Zellen, 1 ca. 37,6 x 10 6 Zellen können ab 5000 EBs bezogen werden. Während Befestigung Kultur werden die Zellen erwartet auf 2,72 ± 0,32 fache erweitern. 1 So, 5000 Tage-6 EBs werden ca. 100 x 10 6 Tage-16-Zellen vor der Sortierung zu erhalten. Nach Gating wird die Ngn3-EGFP + Zellen machen etwa 10% der Tag vollkommener-16-Zell-Population (Protokoll Text Abschnitt 2.2.5 und Abbildung 3).
Beispiel für die photomicrogrAPHS von Insulin-exprimierenden Kolonien von murinen ES-Zellen abgeleitet ist in Abbildung 4 dargestellt. Diese Kolonien haben eine ausgeprägte Morphologie, kleine (~ 60-100 um) runde Kolonien mit einzelnen Zellen in den Kolonien, die kleinen, dunklen und nicht Licht reflektierend sind. In unserer früheren Veröffentlichung, ergab 2 real-time RT-PCR und Doppel-Immunfluoreszenzfärbung von individuell von Hand gepflückt Kolonien Ausdruck von Insulin, C-Peptid und Glukagon. Diese Ergebnisse zeigen die Fähigkeit der einzelnen Ngn3-EGFP +-Zellen in Zellen mit mindestens zwei Inselchen Hormone gleichzeitig zu differenzieren, ähnlich primitive ersten Welle wie endokrine Zellen.
Die Kolonie-Assay für verteilte Einzelzellen können die Studie für jene Vorfahren, die die Fähigkeit zur Proliferation und Differenzierung in vitro (Abbildung 5) zu initiieren. So, dies ist ein Test, dass die eigentliche Funktion der einzelnen Vorläuferzellen messen können. Die Vorfahren, die capabi habenkeit des Werdens Insulin-exprimierenden Kolonien werden als Insulin-exprimierenden Kolonie bildenden Einheiten (ICFUs) (Abbildung 5). Konsequente die Idee, dass Ngn3 markiert endokrinen Vorläuferzellen in den Entwicklungsländern Bauchspeicheldrüse, 5 Ngn3-EGFP +, aber nicht Ngn3-EGFP -. Zellen aus mES cell-derived Populationen sind für die ICFUs angereicherten 2 jedoch die Häufigkeit dieser Vorfahren noch niedrig; etwa 0,1% bis 0,6% der gesamten Ngn3-EGFP + Bevölkerung von Tag 16 Kultur isoliert sind ICFUs 2 Unabhängig, ein deutlicher Unterschied in koloniebildenden Effizienz zu erwarten ist, mit Ngn3-EGFP +-Zellen die höchsten, gefolgt von der. vorsortiert Zellen, und dann die Ngn3-EGFP - Zellen.

Abbildung 1. Timeline von in-vitro-Maus-ES-Zellen Differenzierung zu Pankreas-Zellen. Für konditionierte Medien (CM) Generation, murine ES cells in Suspension mit 15% FCS für die ersten sechs Tage mit abnehmender Dosen von Monothioglycerol (6,0 x 10 -3 M für die ersten zwei Tage und 6,0 x 10 -4 M für die folgenden 4 Tage), um EBs generieren gewachsen. Day-6 EBs (80-100 pro Well) werden dann um die Befestigung übertragen 6-well Schalen mit 15% Knockout Serumersatz. 5% FCS kann zwischen den Tagen 6-10 von Kultur hinzugefügt werden, um die Befestigung von EBs zu beschleunigen. Nikotinamid sind Exendin-4 und humanen rekombinanten Activin βB dann die Medien über Kulturtag 13 (siehe Abschnitt 1.1) aufgenommen. Media ist auf die Kultur Tag 16 gesammelt und an diesem Punkt hat sich konditionierten Medien. Tag 16 Zellen werden dann sortiert und vernickelt in halbfesten Medien für Kolonie-Assay.
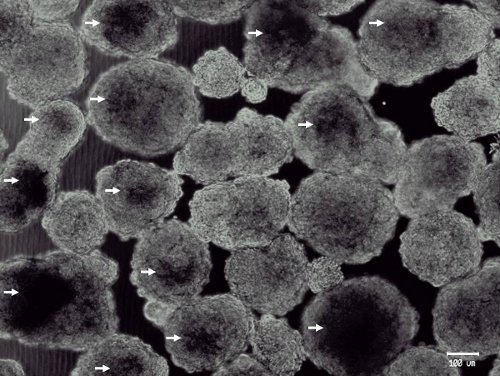
Abbildung 2. Representative Mikrofotografie große Tag-6 Embryoidkörpern aus murinen embryonalen Stammzellen. Idealer Tag-6 EBs sind mindestens 150 um diameter und haben dunkle Zentren (Pfeile). Expression des frühen Pankreas-Vorläuferzellen Marker (wie PDX-1 und Sox9) ist in dieser EBs (Daten nicht gezeigt). 3 Enhanced

Abbildung 3. Sorting Tore für MES-cell-derived Tage-16 Ngn3-EGFP exprimierenden Zellen. (A) Vorwärts-und Seitwärts-Streulicht Tore, bezeichnend für die Zellgröße und Granularität bzw. beseitigen nicht Zelltrümmer. (B) DAPI wird verwendet, um abgestorbene Zellen, die positiv gefärbt werden, wenn bei 405-413 nm und Emission mit einer 450/40 Filter erkannt aufgeregt wird zu identifizieren. (C) Impulsbreite, die Breite der elektronischen Vorwärtsstreuung Puls, zeigt Dubletten, die, bevor sie durch die Fluoreszenz Activated Cell Sorter bestanden, beseitigt werden müssen. (D) Gating von EGFP (Kanal FL1) versus Autofluoreszenz mit Tag-16 Zellen aus einer Kontrolle der Eltern-Zelllinie wie TL1 (linkes Bild) leuchtet wahr Fluoreszenz und damit die Ngn3-EGFP + Zellpopulation (rechts). (E) Roter Pfeil zeigt manuelle Verschiebung nach rechts von EGFP + Tor kurz vor der Sortierung zur Trennung von falsch-positiven Zellen zu erhöhen. Veranstaltungen in beiden (D) und (E) sind gated basierend auf Regionen (R1 - R3) in (AC) dargestellt.

Abbildung 4. Representative Aufnahmen von Insulin-exprimierenden Kolonien in semi-solid Kultur. Die Kolonien sind zufällig verteilt und erscheinen als kleine, dunkle, nicht reflektierende Licht-Cluster. Einzelne Kolonien können später für die Gen-und Protein-Expression mittels RT-PCR und Immunhistochemie analysiert bzw. (siehe Video nicht gezeigt) getestet werden.

Abbildung 5. Eine Kolonie Assay, funktionale und quantitative Bewertungen der einzelnen Vorläuferzellen ermöglicht. Nummerierung der resultierenden Kolonien wird verwendet, um die Frequenz zu berechnenuency der Vorläuferzellen unter den insgesamt plattierten Zellen. Die Zusammensetzung der Zellen innerhalb jeder Kolonie ist ein Hinweis auf die Abstammung Potenzial der Einleitung Vorläuferzellen. Mit diesem Assay haben wir festgestellt, dass Ngn3-EGFP + Zellen aus embryonalen Stammzellen der Maus gewonnen für Insulin-exprimierenden Kolonie-bildenden Einheiten (ICFUs), Vorläuferzellen, die die Fähigkeit zu differenzieren Insulin-exprimierenden Kolonien. 2 wurden angereichert
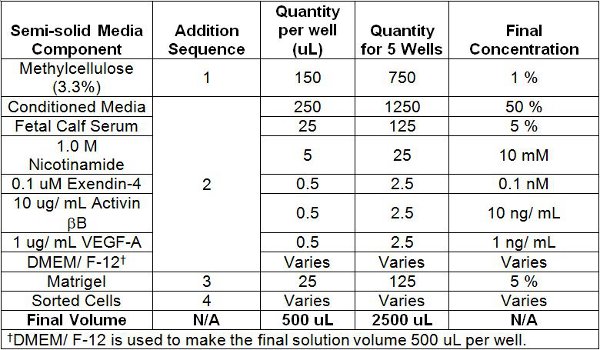
Tabelle 1. Halbfeste Culture Media Components und Reihenfolge der Zugabe.
Diskussion
Colony Assays, die quantitative und funktionale Bewertung der einzelnen Pankreas-Vorläuferzellen ermöglichen wurden bisher begrenzt, die stark die Fortschritte in den Studien von Pankreas-Stamm-und Vorläuferzellen Zellbiologie behindert. Das Wesen einer Kolonie Assay ist, dass sie die intrinsische Fähigkeit von Vorläuferzellen, anstatt ausschließlich deren Phänotyp Maßnahmen, indem sie die Funktionalität und die Linie Potenziale der Vorläuferzellen zu beachten. Es ist auch ein quantitatives Werkzeug, dass die Zahl der Vorfahren in einer bestimmten Population bestimmen können. In der hämatopoetischen Stammzelltransplantation Bereich haben Kolonie-Assays eine wichtige Rolle bei der Identifizierung spielte, sowie die Entschlüsselung der Wachstumsfaktor Anforderungen, Wechselwirkungen und Mechanismen, die die Linie Engagement dieser Zellen. 6 In dem Gebiet der Pankreas-Vorläuferzellen Zellbiologie, Bauchspeicheldrüsen-Orgel 7 , 8 oder Bulk-Kulturen 9-13 entwickelt worden, aber solche Tests nicht auf biologische questions in der einzelnen Zelle Ebene. Ohne einzelne Zelle analysiert, kann die Existenz von mehreren möglichen Bauchspeicheldrüse Stammzellen / Vorläuferzellen nicht zweifelsfrei nachgewiesen werden. 14
Hier zeigen wir, dass Insulin-exprimierenden koloniebildenden Vorläuferzellen können untersucht unter Verwendung einer dreidimensionalen, Matrigel-haltigen, halbfeste Kultur-System. Obwohl eine Suspensionskultur System 15,16 entwickelt worden ist, die es erlaubt einzelne erwachsene Bauchspeicheldrüse Vorläuferzellen zur Proliferation und Differenzierung in "pancreatospheres" bietet unsere Kolonie Assay weitere Vorteile. Erstens ermöglicht es unseren halbfesten Kulturmedien System Beschichtung von bis zu 25.000 sortierten Zellen pro 500 ul Kulturmedium pro 24-well und gleichzeitig die daraus resultierenden Koloniebildung im linearen Bereich. 2 Im Gegensatz, die Aussetzung pancreatosphere Test die Verwendung einzelner erfordert Zellablagerungsvorrichtung Methode aus der Zell-Sorter, damit einzelne Zelle analysiert, und somit ein größeres Volumen von Kulturmedien und Platz im Inkubatorerforderlich sind. Deshalb ist unsere Kolonie Assay relativ einfach und kostengünstig durchzuführen, wenn eine große Anzahl von verschiedenen Zellen gleichzeitig für Vorläuferzellen Aktivitäten verglichen werden müssen. Zweitens ermöglicht es unseren halbfesten Medien gleichmäßige Verteilung der Komponenten der extrazellulären Matrix und Wachstumsfaktoren, die sowohl die Proliferation und Differenzierung in der gleichen auch auftreten können. Im Gegensatz dazu ist es schwieriger, eine solche Umgebung, vor allem die Matrix, die Zellen in Suspension Kultur. Wir sind uns bewusst, dass wir mit unserer Methode ist es nicht endgültig bewiesen werden, dass jede Kolonie aus einer einzigen Zelle abgeleitet ist, als zwei Vorläufern kann zufällig nahe beieinander und bilden eine Kolonie positioniert werden. Allerdings kann dieses Problem durch die sekundäre Analyse mit einzelnen Zelle Manipulation überwunden werden. Direkte Handlese der sortierten Einzelzellen konnte endgültig zeigen die einzelne Zelle Ursprung jeder Kolonie.
Zusammenfassend ist der Insulin-exprimierenden koloniebildenden Aktivität progenitors in halbfesten Medien hierin beschriebenen bietet einzigartige Möglichkeiten für mechanistische Untersuchungen von Pankreas-Vorläuferzellen an der einzelnen Zelle Ebene. Zum Beispiel, in einem früheren Bericht haben wir festgestellt, dass neben der Matrigel, eine krude Mischung aus Proteine der extrazellulären Matrix, in die Kulturmedien für die Bildung des Insulin-exprimierenden Kolonien von Ngn3-EGFP +-Zellen, 2 was auf die extrazelluläre Matrix wird benötigt wichtig für die Vorfahren. Mit dieser Kolonie Assay, wird es nun möglich sein, weitere sezieren und definieren spezifische Matrix Anforderungen für eine solche Tätigkeit. Neben dem Studium Vorläuferzellen aus embryonalen Stammzellen der Maus gewonnen, untersuchen wir derzeit, ob diese in-vitro-Assay-System unterstützt auch die Bildung von anderen charakteristischen Kolonien aus der Bauchspeicheldrüse und der Leber von perinatalen und erwachsenen Mäusen stammen, sowie von menschlichen Leichen Pankreasgewebe ohne von Inselchen.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Dr. Klaus Kaestner für das Geschenk des murinen Ngn3-EGFP embryonale Stammzell-Linie, Mrs. Lucy Brown und die Analytische Cytometry Core-Unterstützung bei der Zellsortierung danken. Diese Arbeit wurde zum Teil durch NIH gewährt R21DK069997 und R01DK081587 verliehen HTK und vom California Institute for Regenerative Medicine (CIRM) Ausbildung Zuschüsse, MW-und LS-finanziert
Materialien
| Name | Company | Catalog Number | Comments |
| Material / Reagent | Firma | Katalog Anzahl | Kommentare |
| 1X DMEM / F-12 (1:1) | Mediatech | 15 bis 090-CV | |
| Fetal Calf Serum | Tissue Culture Biologicals | 201 | Siehe Abschnitt 1,1 |
| L-Glutamin | Gibco | 25030-081 | |
| 1X Dulbecco PBS | Mediatech | 21 bis 031-CV | |
| Bovine Serum Albumin | Sigma | A8412 | 7,5% |
| Matrigel | Becton Dickinson | 356231 | Reduziertes Wachstum Faktor |
| Methylcellulose | Sinetsu Chemical, Tokyo, Japan | 1.500 centipoise (High-viscosity) | |
| Nicotinamid | Sigma | N0636 | |
| Mensch Rekombinante Activin βB | R & D Systems | 659-AB-025 | |
| Exendin-4 | Sigma | E7144 | |
| Mensch Rekombinante VEGF-A | R & D Systems | 293-VE-010 | |
| 24-Well-Platten | Costar | 3473 | Ultra-low Befestigung |
| 60mm Petrischale mit Grid | Nunc | 169558 |
Referenzen
- Ku, H. T. Committing embryonic stem cells to early endocrine pancreas in vitro. Stem cells. 22, 1205-1217 (2004).
- Ku, H. T. Insulin-expressing colonies developed from murine embryonic stem cell-derived progenitors. Diabetes. 56, 921-929 (2007).
- Chen, C. Characterization of an in vitro differentiation assay for pancreatic-like cell development from murine embryonic stem cells: detailed gene expression analysis. Assay. Drug. Dev. Technol. 9, 403-419 (2011).
- Lee, C. S., Perreault, N., Brestelli, J. E., Kaestner, K. H. Neurogenin 3 is essential for the proper specification of gastric enteroendocrine cells and the maintenance of gastric epithelial cell identity. Genes. 16, 1488-1497 (2002).
- Gu, G., Dubauskaite, J., Melton, D. A. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 129, 2447-2457 (2002).
- Ogawa, M. Differentiation and proliferation of hematopoietic stem cells. Blood. 81, 2844-2853 (1993).
- Gittes, G. K., Galante, P. E., Hanahan, D., Rutter, W. J., Debase, H. T. Lineage-specific morphogenesis in the developing pancreas: role of mesenchymal factors. Development. 122, 439-447 (1996).
- Miralles, F., Battelino, T., Czernichow, P., Scharfmann, R. TGF-beta plays a key role in morphogenesis of the pancreatic islets of Langerhans by controlling the activity of the matrix metalloproteinase MMP-2. J. Cell. Biol. 143, 827-836 (1998).
- Bonner-Weir, S. In vitro cultivation of human islets from expanded ductal tissue. Proc. Natl. Acad. Sci. U. S. A. 97, 7999-8004 (2000).
- Gao, R. Characterization of endocrine progenitor cells and critical factors for their differentiation in human adult pancreatic cell culture. Diabetes. 52, 2007-2015 (2003).
- Gao, R., Ustinov, J., Korsgren, O., Otonkoski, T. In vitro neogenesis of human islets reflects the plasticity of differentiated human pancreatic cells. Diabetologia. 48, 2296-2304 (2005).
- Suarez-Pinzon, W. L., Lakey, J. R., Brand, S. J., Rabinovitch, A. Combination therapy with epidermal growth factor and gastrin induces neogenesis of human islet beta-cells from pancreatic duct cells and an increase in functional beta-cell mass. J. Clin. Endocrinol. Metab. 90, 3401-3409 (2005).
- Hao, E. Beta-cell differentiation from nonendocrine epithelial cells of the adult human pancreas. Nature Medicine. 12, 310-316 (2006).
- Ku, H. T. Minireview: pancreatic progenitor cells--recent studies. Endocrinology. 149, 4312-4316 (2008).
- Seaberg, R. M. Clonal identification of multipotent precursors from adult mouse pancreas that generate neural and pancreatic lineages. Nature Biotechnology. 22, 1115-1124 (2004).
- Rovira, M. Isolation and characterization of centroacinar/terminal ductal progenitor cells in adult mouse pancreas. Proc. Natl. Acad. Sci. U. S. A. 107, 75-80 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten