Method Article
Imaging Leukozytenadhäsion an das vaskuläre Endothel bei hohen intraluminalen Druck
In diesem Artikel
Zusammenfassung
Dies ist eine Methode zur Leukozyten-Adhäsion an das Endothel in geerntet Druckbehälter zu visualisieren. Die Technik ermöglicht das Studium vaskulären Haftung unter Scherströmung mit unterschiedlichen intraluminale Drücke bis 200 mmHg damit nachahmen-Ing den pathophysiologischen Bedingungen des hohen Blutdrucks.
Zusammenfassung
Worldwide, Bluthochdruck wird berichtet, dass in etwa ein Viertel der Bevölkerung und ist der führende biomedizinische Risikofaktor für die Mortalität weltweit. In den Gefäßen Hypertonie ist mit einer endothelialen Dysfunktion und erhöhte Entzündung führt zu Arteriosklerose und verschiedenen Krankheiten wie chronischen Nierenerkrankungen 2, 3 und Schlaganfall Herzinsuffizienz 4 zugeordnet. Ein erster Schritt in Gefäßentzündungen führt zu Arteriosklerose ist die Haftung Kaskade, die die Rollen, Anbindehaltung, die Einhaltung und anschließende Transmigration von Leukozyten durch das Endothel handelt. Rekrutierung und Akkumulation von Leukozyten an das Endothel wird durch eine Hochregulation von Adhäsionsmolekülen wie vascular cell adhesion molecule-1 (VCAM-1), intrazelluläre Adhäsionsmolekül-1 (ICAM-1) und E-Selektin sowie Erhöhungen in vermittelter Zytokin-und Chemokin-Freisetzung und eine Hochregulation von reaktiven Sauerstoff-Spezies 5. In-vitro-Methoden wie z. B. statische Haftung Assays helfen, die Mechanismen der Zell-Zell-Adhäsion beteiligt sowie die Analyse von Zell-Adhäsionsmoleküle zu bestimmen. Methoden in der früheren in vitro Studien verwendet haben gezeigt, dass akute Erhöhungen der Druck auf das Endothel kann Monozytenadhäsion, eine Hochregulation von Adhäsionsmolekülen und Entzündungsmarker 6 hingegen, ähnlich wie bei vielen in-vitro-Assays, diese Erkenntnisse noch nicht in Echtzeit durchgeführt führen unter physiologischen Strömungsverhältnisse, noch mit Vollblut. Daher sind in-vivo-Untersuchungen zunehmend in Tiermodellen genutzt werden, um vaskuläre Entzündungen und die Bildung von Zahnbelag zu demonstrieren. Intravital Mikroskopie ist mittlerweile weit verbreitet, um Leukozytenadhäsion, Walzgut, Migration und Transmigration 7-9 zu bewerten. Bei der Kombination der Auswirkungen von Druck auf die Leukozyten an endotheliale Adhäsion der in-vivo-Studien sind weniger umfangreich. Eine solche Studie untersucht die Echtzeit-Effekte von Strömungs-und Scherung auf arterielle Wachstum und Umbau, sondern Entzündungsmarker waren nur über Immunhistochemie 10 beurteilt. Hier präsentieren wir ein Modell für die Aufnahme Leukozytenadhäsion in Echtzeit in intakten Druck Blutgefäße mit Vollblut Perfusion. Die Methodik ist eine Modifikation eines Ex-vivo-Perfusion Schiff Kammer-Modell 9, die Echtzeit-Analyse von Leukozyten-Endothel-adhäsiven Wechselwirkungen in intakten Behältern ermöglicht. Unsere Modifikation ermöglicht die Manipulation der intraluminale Druck bis 200 mmHg Berücksichtigung Studie nicht nur unter physiologischen Strömungsverhältnisse, sondern auch Druckbedingungen. Während der Druck Myographie Systeme zuvor unter Beweis gestellt haben, um Gefäßwand und Lumen Durchmesser 11 sowie Gefäß Kontraktion zu beobachten ist dies das erste Mal zeigen, Leukozyten-Endothel-Interaktionen in Echtzeit. Hier zeigen wir die Technik mit Halsschlagadern von Ratten entnommen und Kanüle eingeführt, um eine maßgeschneiderte Flusskammer gekoppelt mit einem Fluoreszenzmikroskop. Das Schiff Kammer ist mit einem großen unteren Deckglas so einem großen Durchmesser Objektiv mit kurzer Arbeitsabstand zum Bild des Schiffes ausgestattet. Darüber hinaus können ausgewählte Agonisten und / oder Antagonisten eingesetzt zur weiteren Untersuchung der Mechanismen, die Zelladhäsion werden. Die Vorteile dieses Verfahrens gegenüber Intravitalmikroskopie sind keine Beteiligung von invasiven Chirurgie und somit ein höherer Durchsatz erreicht werden kann. Diese Methode ermöglicht auch die Verwendung von lokalisierten Inhibitor Behandlung, um die gewünschte Gefäß während intravital nur ermöglicht systemische Inhibitor Behandlung.
Protokoll
1. Isolating Halsschlagadern
- Euthanase10 Wochen alte Sprague Dawley Ratten über CO 2 / O 2 Ersticken.
- Excise links und rechts Arteria carotis communis mit Aorta und Herz sicherzustellen minimal Dehnung der Gefäße.
- In eiskalten Krebs-Puffer trennen die Halsschlagadern aus der Aorta und Herz und führen in der Nähe Dissektion.
- Halten Sie isolierten Gefäßen in Krebs auf Eis vor der Montage.
Ca. Zeit = 45 Minuten
2. Priming des Schiffes Kammer
- An der proximalen und distalen Anschlüsse des Schiffes Kammer bündig Krebs-Puffer bei einem physiologischen pH durch Infusion Carbogen Gas (95% O 2, 5% CO 2) aufrechterhalten durch den Puffer bei 37 ° C.
- Stellen Sie sicher, Schläuche und Kanülen sind komplett gespült und ausgerichtet sind.
- Flush Kreb-Puffer durch das P1 (proximal) und P2 (distalen) Wandler. Close Hähne keine Luftblasen in den Wandlern zu gewährleisten.
- Schließen Sie die Sensoren an den entsprechenden Anschlüssen und wieder bündig mehr Krebs-Puffer gewährleistet keine Luftblasen. Close abgreift, um die Kammer.
Ca. Zeit = 15 Minuten
3. Durch das Aufdrücken des Schiffes Kammer
- Schalten Sie Druckgeräte: Druck Servo-, Druck-Monitor, Schlauchpumpe (Abbildung 1).
- Mit der Schlauchpumpe auf Druck und der Druck auf Servo automatisch ablaufenden Krebs-Puffer durch den Schlauch bei 20 mmHg (Zifferblatt bei 1), sodass keine Luftblasen.
- Die Leitungen zu den geschlossenen P2 Wandler. Der Druck wird sich stabilisieren.
- Öffnen P2 tippen, um das Schiff Kammer zu spülen, keine Blasen schließen Sie dann ab.
- Füllen Sie das Bad mit Krebs-Puffer (5 bis 7 mL).
Ca. Zeit = 10 Minuten
4. Montage des Schiffes
- Unter einem Binokular statt schwarzem Polyester Bande auf jede Kanüle (Abbildung 2).
- Bewegen Sie Kanülen und Kanüle Inhaber auseinander und montieren ¼ Gefäß (Aortenbogen Ende) auf die P1 Kanüle. Stellen Sie sicher nicht, das Schiff zu reißen.
- Mit einer Spritze mit Krebs-Puffer gefüllt sanft spülen überschüssiges Blut aus dem Gefäß über P1 Wandler. Schließen Sie P1 an die Kammer.
- Sichere Schiff in den P1 Kanüle mit dem Polyester Krawatte.
- Bewegen Kanülen / Kanüle Inhaber näher für die Montage auf der P2-Kanüle.
- Berg distale Ende des Schiffes (~ ¼ der Länge) auf distalen Kanüle. Sicherer mit Polyester-Krawatte.
Ca. Zeit = 20 Minuten
5. Durch das Aufdrücken des Schiffes
- Passen Sie die Kanüle Inhaber keine beugen oder strecken in das Schiff zu sichern.
- Mit P1 und P2 geschlossen, um die Kammer-Schalter der Druck Servo von automatisch auf manuell. Überprüfen Sie auf der Druck-Servo gibt es keine kontinuierliche Abnahme der Druck innerhalb von 10 Sekunden. Wenn ja, ist ein Leck auftritt und die Anschlüsse und Sensoren benötigen, um im Platz zu sichern.
- Passen Sie den Druck Servo zurück zur automatischen öffnen P2 in die Kammer. Unter dem Mikroskop beobachten, das Schiff ausdehnen, wenn der Hahn in die Kammer geöffnet wird.
- Schalten Sie den Druck Servo-Handbuch. Kontrollieren Sie wieder für eine kontinuierliche Abnahme des Drucks innerhalb von 10 Sekunden. Wenn ein Leck vorhanden ist dann ist das System nicht dicht Druck und es wird wahrscheinlich ein Loch in das Schiff sein.
- Zurück zur automatischen Öffnen P1 in die Kammer. Auf die manuelle Einstellung zu überprüfen, dass der Druck stabil bleibt.
- Wenn kein Leck, auf manuelle Einstellung zu erhöhen Rad 2 (40 mmHg).
- Passen Sie die automatische und beobachten das Schiff unter dem Mikroskop. Wenn nötig, passen Sie die Kanülenhalter keinen Knick in der vessel.Check auf Undichtigkeiten auf manuelle Einstellung zu gewährleisten.
- Wiederholen Sie die Schritte 5,6 bis 5,7 erhöht die Wählscheibe auf 3 (60 mmHg), 4 (80 mmHg) und so weiter, bis der gewünschte Druck erreicht ist.
Ca. Zeit = 15 bis 30 Minuten
6. Inkubation des unter Druck stehenden Behälter
- Verbinden Sie den Temperaturregler eingestellt auf 37 ° C.
- Mit einem zweiten Schlauchpumpe perfuse Krebs-Puffer (1 mL / min) in das Gefäß Kammer Bad.
- Connect Aspirator an die Kammer sicher, dass nur die oberste Schicht des Bades entfernt wird.
- Inkubieren unter Druck stehenden Behälter bei 37 ° C für 1 Stunde mit dem Druck auf automatisch.
- Überprüfen Sie den Druck nicht undicht ist (Umschalten auf manuelle) in regelmäßigen Abständen.
- Die Auswirkungen der verschiedenen pharmakologischen Interventionen können durch einfaches Hinzufügen der Verbindung zum Bad während der Inkubation beobachtet werden.
Ca. Zeit = 1 Stunde
7. Perfusion der unter Druck stehenden Behälter mit Vollblut
- Während der Inkubation erhalten mindestens 7,5 mL Vollblut / Schiff in 40 U Heparin / ml Blut gesammelt. Inkubieren in einem 50 ml Falcon bei 37 ° C.
- 10 Minuten vor dem Ende der ter Inkubation Label Blut mit VybrantDil (1:1000) für 10 Minuten bei 37 ° C im Dunkeln.
- Nach 10 Minuten sammeln Blut in eine Spritze Clearing keine Blasen und legen auf eine Spritzenpumpe mit einem Heizmantel auf 37 ° C.
- Schließen Sie P1 Wandler, um die Kammer / Schiff und verbinden Spritze und Ablaufschlauch.
- Purge Blut bei 1000 ul / min durch den Ablaufschlauch keine Luftblasen zu entfernen.
- Öffnen P1 in die Kammer. Der Druck Servo wird automatisch angepasst, um gewünschten Druck zu halten.
- Perfundieren Blut bei 100 ul / min.
- Mit einem Fluoreszenz-Mikroskop gekoppelt mit einer digitalen Kamera aufnehmen zwei Felder des perfundierten Gefäß für 15 Sekunden bei 1, 3, 5, 7,5 und 10 Minuten.
- Beitrag Perfusion endothelialen Integrität und Funktion kann über pharmakologische Techniken wie Myographions und Adhäsionsmolekül Expression kann immunhistochemisch bestimmt werden, um weiter zu validieren die entzündliche Reaktion zu beurteilen.
Ca. Zeit = 15 Minuten
8. Repräsentative Ergebnisse:
Eine schematische Darstellung der Druckkammer Aufbau ist in Abbildung 1 dargestellt. Mit einer Digitalkamera gekoppelt mit einem Fluoreszenzmikroskop Ergebnisse können sofort per Live-Video-Aufnahmen sichtbar gemacht werden. Vertreter Videobilder werden in Abbildung 3, wo Leukozyten gelten als Anhänger des Endothels, wenn sie 10 Sekunden lang stationär geblieben zu sehen sind. Mit Video-Aufnahmen auf Endlosschleife eingehalten Zellen können als Mittelwert pro Feld gezählt werden. Während beide niedrig sind (Abbildung 3A) und hoch (Abbildung 3B) Druck ein gewisses Maß an Haftung verursachen einen signifikanten Anstieg der Leukozyten-Adhäsion an der höheren intraluminalen Druck gesehen, und das ist auch quantitativ (Abbildung 4) demonstriert.
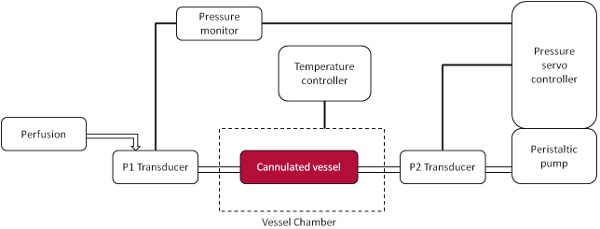
Abbildung 1. Unter Druck ex vivo Schiff Kammer schematisch. Ein kanülierten Schiff verbunden mit einem proximalen (P1) Wandler und einem distalen (P2) Wandler, dass der Blutdruck ermöglicht, innerhalb des Behälters manipuliert werden. Perfusion wird durch die P1 Wandler und Druck über P2 Wandler gewartet.

Abbildung 2. Cannuala mit Krawatten. Schwarze Polyester-Verbindungen sind zu jeder Kanüle befestigt.

Abbildung 3. Vertreter von Videobildern. Dynamische Zelladhäsion (roter Pfeil) unter Fluoreszenz bei 80 mmHg (A) und 120 mmHg (B) nach 10 Minuten Perfusion.
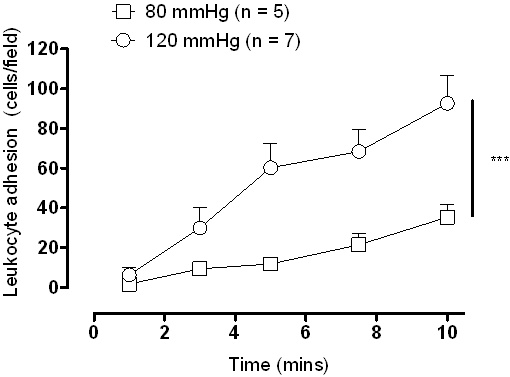
Abbildung 4. Leukozytenadhäsion in Sprague Dawley Halsschlagadern nach 1 Stunde Inkubation bei niedrigen (80 mmHg) und hohem Druck (120 mmHg). *** P <0,001, wie 2-Wege-ANOVA mit wiederholten Messungen mit Bonferroni post hoc Test analysiert.
Diskussion
Dies ist eine modifizierte Methode zur Leukozyten-Adhäsion an das Endothel in intakten isolierten Blutgefäßen unter Druckbedingungen in Echtzeit zu studieren. Perfusion des Schiffes Kammer allein ermöglicht eine schnelle Validierung von pro-inflammatorischen Stämme von großen Mäusen und Ratten Schiffe. Aktivieren Druck Manipulation ermöglicht dynamische Zell-Interaktionen von niedrig bis sehr hoch intraluminalen Druck, damit eine bessere Mimik-Ing physiologischen und pathophysiologischen Bedingungen eingehalten werden. Durchmesser der Gefäße können ebenfalls gemessen mit einer ausreichenden Zell-Imaging-Programm und damit Scherströmung und kann ermittelt werden und somit manipuliert werden.
Mit seiner Myographions Fähigkeiten, fügen pharmakologische Interventionen in das Bad gelegt weitere Dimension der experimentellen Bedingungen möglich mit diesem Modell ermöglicht Untersuchungen von mechanistischen und Signalwege. Während endothelial Erhaltung kann nicht während der Druck Manipulation bestätigt werden, können Reaktionen auf ACh und PE post Perfusion 9 geführt werden.
Anzumerken ist, dass dieses Setup die Auswirkungen der intraluminale Druck auf Zell-Zell-Interaktionen nicht die Auswirkungen des pulsierenden Blutflusses noch systolische oder diastolische Druck zeigt werden. Hinzu kommt, dass akute Druckänderungen auf Leukozytenadhäsion beobachtet wurden, kann dieses Setup auch genutzt werden, um bei chronischen Druck-Effekte (dh die Erhöhung Inkubationszeiten und mit einem chronischen Druck Tiermodell) zu suchen. Sprague Dawley Arteria carotis communis werden in dieser Einrichtung aber gezeigt, andere Stämme und Arten können mit entsprechenden Anpassungen an die Kanüle Größe verwendet werden. In der Tat ist es wichtig zu beachten, dass das Alter und Gewicht der Tiere Gefäßgröße beeinflussen und damit, dass die Einrichtung muss für jedes Schiff individuell angepasst werden. Close und sorgfältige Dissektion des Bindegewebes kann Visualisierung der Leukozyten immens verbessern.
Offenlegungen
Das Studienprotokoll wurde von der Alfred Medical Research and Education Precinct Animal Ethics Committee und der Alfred Hospital Ethics Committee genehmigt.
Danksagungen
Diese Studie wurde zum Teil durch die Regierung von Victoria ist OIS Programm, das National Health and Medical Research Council of Australia Programm-und Projektmanagement Zuschüsse (JPF Chin-Dusting) und Postgraduate-Stipendium (D Michell) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes / Ausrüstung | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Mikroskop | Carl Zeiss, Inc | SteREO Discovery V.20 | |
| PHD 2000 Spritzenpumpe | Harvard Apparatus | 70-2016 | |
| Digitalkamera und Controller | Hamamatsu ORCA-ER | C4742-95 | |
| Fluoreszenz-Beleuchtungssystem | Lumen Dynamics | X-Cite 120 | |
| Vessel Kammer | Living Systems Instrumentation | CH/1/SH | |
| Pressure Servo Controller und Schlauchpumpen | Living Systems Instrumentation | PS - 200 | |
| Perfusion Pressure Monitor | Living Systems Instrumentation | PM - 4 | |
| 2 x Druckaufnehmer | Living Systems Instrumentation | PT - F | |
| Temperaturregler | Living Systems Instrumentation | TC-01 | |
| Schlauchpumpen | Instech Laboratories, Inc | P720 | |
| VybrantDil Zell-Kennzeichnung Lösung | Invitrogen | V-22885 | Verwenden 1:1000 |
Referenzen
- Lopez, A. D., Mathers, C. D., Ezzati, M., Jamison, D. T., Murray, C. J. Global and regional burden of disease and risk factors. Lancet. 367, 1747-1757 (2001).
- Szczech, L. A. Acute kidney injury and cardiovascular outcomes in acute severe hypertension. Circulation. 121, 2183-2191 .
- Rodriguez-Garcia, J. L., Botia, E., de La Sierra, A., Villanueva, M. A., Gonzalez-Spinola, J. Significance of elevated blood pressure and its management on the short-term outcome of patients with acute ischemic stroke. Am J Hypertens. 18, 379-384 (2005).
- Levy, D., Larson, M. G., Vasan, R. S., Kannel, W. B., Ho, K. K. The progression from hypertension to congestive heart failure. JAMA. 275, 1557-1562 (1996).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 7, 678-689 (2007).
- Riou, S. High pressure promotes monocyte adhesion to the vascular wall. Circ Res. 100, 1226-1233 (2007).
- Ley, K., Gaehtgens, P. Endothelial, not hemodynamic, differences are responsible for preferential leukocyte rolling in rat mesenteric venules. Circ Res. 69, 1034-1041 (1991).
- Bernhagen, J. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13, 587-596 (2007).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ Res. 103, 1128-1138 (2008).
- Eberth, J. F. Importance of pulsatility in hypertensive carotid artery growth and remodeling. J Hypertens. 27, 2010-2021 (2009).
- Cooke, J. P., Rossitch, E., Andon, N. A., Loscalzo, J., Dzau, V. J. Flow activates an endothelial potassium channel to release an endogenous nitrovasodilator. J Clin Invest. 88, 1663-1671 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten