Method Article
Adhésion leucocytaire imagerie de l'endothélium vasculaire au Haute pression intraluminale
Dans cet article
Résumé
C'est une méthode pour visualiser l'adhésion des leucocytes à l'endothélium dans les vaisseaux sous pression récoltés. La technique permet l'étude de l'adhérence vasculaires sous flux de cisaillement avec différentes pressions intraluminale jusqu'à 200 mmHg donc imitent-ment les conditions physiopathologiques de l'hypertension artérielle.
Résumé
Dans le monde, l'hypertension est rapporté pour être dans environ un quart de la population et est le principal facteur de risque pour la mortalité dans le monde biomédical. Dans l'hypertension vasculaire est associée à une dysfonction endothéliale et l'inflammation accrue menant à l'athérosclérose et de maladies diverses telles que la maladie rénale chronique 2, 3 temps et 4 une insuffisance cardiaque. Une première étape dans l'inflammation vasculaire conduisant à l'athérogenèse est la cascade d'adhésion qui implique le laminage, tethering, l'adhérence et la transmigration des leucocytes subséquentes à travers l'endothélium. Le recrutement et l'accumulation de leucocytes à l'endothélium est médiée par une régulation positive des molécules d'adhésion telles que l'adhérence des cellules vasculaires molécule-1 (VCAM-1), molécule d'adhérence cellulaire intracellulaire-1 (ICAM-1) et E-sélectine ainsi que l'augmentation des la libération de cytokines et de chimiokines et une régulation positive des espèces réactives de l'oxygène 5. Les méthodes in vitro tels que des dosages adhérence statique aider à déterminer les mécanismes impliqués dans la cellule à cellule d'adhésion ainsi que l'analyse des molécules d'adhésion cellulaire. Les méthodes employées dans les précédentes études in vitro ont démontré que l'augmentation de la pression aiguë sur l'endothélium peut conduire à l'adhésion des monocytes, une régulation positive des molécules d'adhésion et de marqueurs de l'inflammation 6 cependant, semblable à de nombreux tests in vitro, ces résultats n'ont pas été réalisées en temps réel dans des conditions physiologiques de flux, ni avec du sang total. Par conséquent, les essais in vivo sont plus utilisés dans des modèles animaux pour démontrer l'inflammation vasculaire et le développement des plaques. Microscopie intravitale est maintenant largement utilisée pour évaluer l'adhérence des leucocytes, le laminage, la migration et de transmigration 7-9. Lorsque l'on combine les effets de la pression sur les leucocytes à l'adhésion endothéliales les études in vivo sont moins étendus. Une telle étude examine les effets en temps réel des flux et de cisaillement sur la croissance des artères et des marqueurs de remodelage, mais inflammatoires étaient seulement évalués par immunohistochimie 10. Ici, nous présentons un modèle pour l'enregistrement de l'adhésion des leucocytes en temps réel dans intacts les vaisseaux sanguins sous pression en utilisant une perfusion de sang total. La méthodologie est une modification d'un modèle de vaisseau vivo perfusion ex chambre 9 qui permet l'analyse temps réel des interactions adhésives des leucocytes et l'endothélium dans les vaisseaux intacts. Notre modification permet la manipulation de la pression intraluminale jusqu'à 200 mmHg permettant d'étudier non seulement dans des conditions physiologiques de flux mais aussi des conditions de pression. Alors que les systèmes myographie pression ont déjà été démontrée pour observer la paroi des vaisseaux et la lumière de diamètre 11 ainsi que la contraction des vaisseaux c'est la première fois la démonstration des leucocytes et l'endothélium des interactions en temps réel. Ici, nous montrer la technique en utilisant les artères carotides récoltés à partir de rats et de canule à une chambre de flux sur-mesure couplé à un microscope à fluorescence. La chambre de navire est équipé d'une lamelle en bas grandes permettant une lentille de grand diamètre objectif avec une distance de travail de courte à l'image du navire. Par ailleurs, un agoniste sélectionnés et / ou antagonistes peuvent être utilisés pour étudier plus les mécanismes contrôlant l'adhésion cellulaire. Avantages de cette méthode sur la microscopie intravitale comprennent pas l'implication de la chirurgie invasive et donc un débit plus élevé peut être obtenu. Cette méthode permet également l'utilisation d'un traitement inhibiteur de la localisées à la cuve souhaitée tandis intravitale permet seulement un traitement inhibiteur de la systémique.
Protocole
1. Isoler les artères carotides
- Euthanase10 semaine anciens rats Sprague-Dawley par l'intermédiaire de CO 2 / O 2 asphyxie.
- Accise gauche et à droite des artères carotides communes avec l'aorte et le coeur assurant un minimum d'étirement des vaisseaux.
- En glacée tampon Krebs séparer les artères carotides de l'aorte et le coeur et effectuer la dissection proche.
- Gardez les bateaux isolés dans Krebs sur la glace avant le montage.
Env. temps = 45 min
2. Amorçage de la chambre de cuve
- Au connecteurs proximales et distales de la chambre de cuve affleurant tampon Krebs maintenue à pH physiologique en infusant de gaz carbogène (95% d'O 2, 5% CO 2) grâce à la mémoire tampon à 37 ° C.
- Assurez-tubes et canules sont vidées complètement et sont alignés.
- Rincer tampon Krebs par la P1 (proximale) et P2 (distale) transducteurs. Fermer les robinets afin de s'assurer qu'aucune bulle d'air dans les transducteurs.
- Connectez les capteurs aux connecteurs correspondants et encore plus ras tampon Krebs assurant aucune bulle d'air. Fermer les robinets de la chambre.
Env. temps = 15 minutes
3. Pressurisation de la chambre de cuve
- Allumez l'équipement sous pression: la pression d'asservissement, de contrôler la pression, pompe péristaltique (Figure 1).
- Avec la pompe péristaltique sur la pression et la pression sur les servo-automatiques fonctionner tampon Krebs à travers le tube à 20 mmHg (cadran à 1), garantissant aucune bulle d'air.
- Relier les tubes du capteur P2 fermé. La pression sera devenue stable.
- Ouvrir le robinet de P2 à la chambre des navires pour évacuer les bulles, puis fermer.
- Remplissez le bain avec tampon de Krebs (5 - 7 ml).
Env. temps = 10 min
4. Montage du navire
- En vertu d'une dissection liens endroit en polyester noir sur microscope à chaque canule (figure 2).
- Déplacer les canules et les détenteurs de la canule en dehors et monter des navires (¼ arc aortique fin) sur la canule P1. Assurez-vous de ne pas déchirer le navire.
- En utilisant une seringue remplie de tampon Krebs doucement rincer l'excès de sang hors de la cuve par sonde P1. Fermez P1 à la chambre.
- Navire sécurisé à la canule P1 avec la cravate en polyester.
- Déplacer canules / détenteurs canule plus pour le montage sur la canule P2.
- Mont extrémité distale du vaisseau (~ ¼ de la longueur) sur la canule distale. Fixez avec cravate en polyester.
Env. temps = 20 min
5. Pressurisation du navire
- Ajuster les détenteurs canule afin de s'assurer qu'aucun plier ou étirer dans le vaisseau.
- Avec P1 et P2 fermée de la chambre de changer le servo de pression automatique au mode manuel. Vérifiez la pression sur le servo il n'ya pas de baisse continue de la pression dans les 10 secondes. S'il ya une fuite se produit et les connexions et les capteurs doivent être fixés en place.
- Ajuster le servo-pression à P2 puis ouvrez automatique à la Chambre. Sous le microscope, d'observer le navire se dilatent lorsque le robinet est ouvert à la chambre.
- Mettre le servo pression manuelle. Encore une fois vérifier diminution continuelle de la pression dans les 10 secondes. S'il ya une fuite, alors le système n'est pas étanche à la pression et il est susceptible d'être un trou dans le bateau.
- Revenez à P1 ouverte automatiquement à la chambre. Sur le réglage manuel vérifier que la pression reste stable.
- Si aucune fuite, sur le cadran de réglage manuel pour augmenter 2 (40 mmHg).
- Régler sur automatique et d'observer le navire sous le microscope. Si nécessaire, ajuster le titulaire canule afin de s'assurer qu'aucun coude de la vessel.Check des fuites sur le réglage manuel.
- Répétez les étapes 5.6 à 5.7 augmente le cadran à 3 (60 mmHg), 4 (80 mmHg) et ainsi de suite jusqu'à la pression désirée est atteinte.
Env. le temps = 15 - 30 min
6. L'incubation de la cuve sous pression
- Connectez l'ensemble régulateur de température à 37 ° C.
- Avec une deuxième pompe péristaltique perfuser tampon Krebs (1 mL / min) dans le bain de la chambre du navire.
- Connectez aspiration à la chambre de s'assurer que la couche supérieure du bain est enlevé.
- Incuber récipient sous pression à 37 ° C pendant 1 heure à la pression réglée sur automatique.
- Vérifiez la pression ne fuit pas (passer à manuel) périodiquement.
- Les effets de diverses interventions pharmacologiques peuvent être observés en ajoutant simplement le composé dans le bain pendant l'incubation.
Env. temps = 1 heure
7. Perfusant le récipient sous pression avec du sang total
- Durant l'incubation d'obtenir au moins 7,5 mL de sang total humain / navire recueillies dans 40 héparine U / ml de sang. Incuber dans un falcon de 50 ml à 37 ° C.
- 10 minutes avant la fin de tIl sanguins étiquette incubation avec VybrantDil (1:1000) pendant 10 minutes à 37 ° C dans l'obscurité.
- Après 10 minutes, prélever du sang dans une seringue de compensation des bulles et de fixer sur un pousse-seringue avec une veste thermique fixée à 37 ° C.
- Fermez capteur P1 à la chambre / navire et les raccorder la seringue et la tubulure de déchets.
- Purge du sang à 1000 ul / min à travers la tubulure de déchets à éliminer les bulles.
- Ouvrez P1 à la chambre. Le servo de pression pour régler automatiquement pour maintenir la pression désirée.
- Perfuser le sang à 100 ul / min.
- En utilisant un microscope à fluorescence couplé à un appareil photo numérique d'enregistrer deux champs de la cuve perfusé pendant 15 secondes à 1, 3, 5, 7,5 et 10 minutes.
- L'intégrité de perfusion et de la fonction endothéliale message peut être évaluée par des techniques pharmacologiques comme myographe et d'expression des molécules d'adhésion peut être déterminé par immunohistochimie pour valider davantage la réponse inflammatoire.
Env. temps = 15 minutes
8. Les résultats représentatifs:
Un diagramme schématique de la configuration de la chambre de pression est montré dans la figure 1. Avec un appareil photo numérique couplé à un microscope à fluorescence des résultats peuvent être visualisés instantanément via des enregistrements vidéo en direct. Images vidéo représentant sont vus dans la figure 3 où les leucocytes sont considérés comme des adhérents à l'endothélium, si elles sont restées stationnaires pendant 10 secondes. Avec les enregistrements vidéo sur les cellules boucle continue respectées peut être compté comme un champ moyen par. Bien que les deux bas (figure 3A) et élevé (figure 3B) la pression va causer une certaine quantité d'adhérence une augmentation significative de l'adhérence des leucocytes à la pression plus élevée intraluminale est vu et cela est également démontré quantitativement (figure 4).
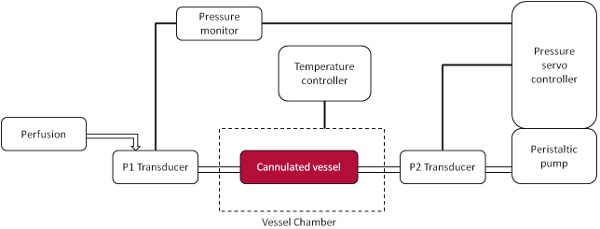
Figure 1. Pressurisée ex vivo navire schématiques chambre. Un navire canulées connecté à un proximale (P1) et un capteur distal (P2) qui permet aux capteurs de pression sanguine pour être manipulés dans le vaisseau. La perfusion est à travers le transducteur P1 et la pression est maintenue par l'intermédiaire du transducteur P2.

Figure 2. Cannuala avec des liens. Liens polyester noir sont attachés à chaque canule.

Figure 3. Images vidéo représentant. Adhérence des cellules dynamiques (flèche rouge) sous la fluorescence à 80 mmHg (A) et 120 mmHg (B) après 10 minutes de la perfusion.
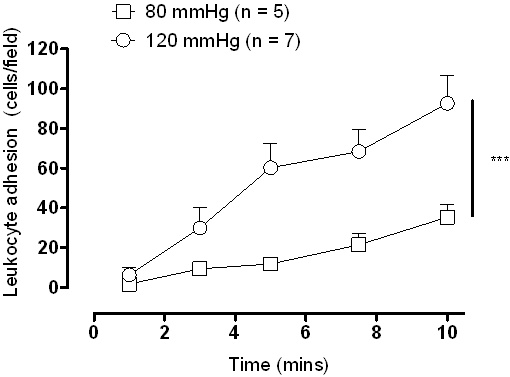
Figure 4. Adhérence des leucocytes dans les Sprague-Dawley carotide artères après 1 heure d'incubation à basse (80 mmHg) et haute pression (120 mmHg). *** P <0,001, analysé par deux voies à mesures répétées ANOVA en utilisant le test post hoc de Bonferroni.
Discussion
C'est une méthode modifiée d'étudier l'adhésion des leucocytes à l'endothélium dans les vaisseaux sanguins intacts isolés dans des conditions sous pression en temps réel. Perfusion de la chambre de récipient seul permet une validation rapide des pro-inflammatoire des souches de souris et de grands vaisseaux de rat. Manipulation de la pression d'habilitation permet des interactions cellulaires dynamiques pour être observée à partir de faible à très haute pression intraluminale, et ainsi mieux imitent-tion des conditions physiologiques et physiopathologiques. Diamètre de navires peut également être mesurée en utilisant un nombre suffisant de cellules-imagerie du programme et de flux donc cisaillement et le taux peut être déterminé et donc manipulé.
Grâce à ses capacités myographe, les interventions pharmacologiques placé dans le bain ajouter une autre dimension aux conditions expérimentales possibles avec ce modèle permettant des études mécanistes et des voies de signalisation. Alors que la préservation endothéliales ne peut pas être confirmé lors de la manipulation de pression, des réponses à l'ACh et PE peuvent être menées 9 perfusion post.
Il convient de noter que cette configuration montre les effets de la pression intraluminale sur la cellule à cellule interactions non pas les effets du flux sanguin pulsatile, ni systolique ou diastolique. Par ailleurs, si les changements de pression aiguë sur l'adhérence des leucocytes ont été observés, cette configuration peut aussi être utilisé pour examiner les effets de pression chronique (augmentation du temps d'incubation et en utilisant un modèle pression chronique des animaux). Sprague-Dawley des artères carotides communes sont mises en évidence dans cette mise en place, mais d'autres souches et des espèces peuvent être utilisées avec les ajustements appropriés à la taille de la canule. En effet, il est important de noter que l'âge et du poids des animaux affectent la taille des navires et donc que l'ensemble des besoins jusqu'à être individualisée pour chaque navire. Fermer une dissection minutieuse et du tissu conjonctif peut améliorer la visualisation des leucocytes immensément.
Déclarations de divulgation
Le protocole d'étude a été approuvée par la recherche médicale et l'éducation Alfred Cité éthique animale Comité et le Comité d'éthique Alfred Hospital.
Remerciements
Cette étude a été financée en partie par le Programme du Gouvernement de l'époque victorienne OIS, la National Health and Medical Research Council du programme de subventions et de projets en Australie (JPF Chin-époussetage) et bourse d'études supérieures (D Michell).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipements | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Microscope | Carl Zeiss, Inc | STEREO Discovery V.20 | |
| Pompe seringue PHD 2000 | Harvard Apparatus | 70-2016 | |
| Appareil photo numérique et le contrôleur | Hamamatsu ORCA-ER | C4742-95 | |
| Système d'illumination par fluorescence | Dynamique Lumen | X-Cite 120 | |
| Chambre des navires | Vivre Instrumentation Systems | CH/1/SH | |
| Contrôleur de servomoteurs de pression et pompe péristaltique | Vivre Instrumentation Systems | PS - 200 | |
| Surveiller la pression de perfusion | Vivre Instrumentation Systems | PM - 4 | |
| 2 Capteur de pression x | Vivre Instrumentation Systems | PT - F | |
| Régulateur de température | Vivre Instrumentation Systems | TC-01 | |
| Pompe péristaltique | Instech Laboratories, Inc | P720 | |
| VybrantDil cellule étiquette de la solution | Invitrogen | V-22885 | Utilisez 1:1000 |
Références
- Lopez, A. D., Mathers, C. D., Ezzati, M., Jamison, D. T., Murray, C. J. Global and regional burden of disease and risk factors. Lancet. 367, 1747-1757 (2001).
- Szczech, L. A. Acute kidney injury and cardiovascular outcomes in acute severe hypertension. Circulation. 121, 2183-2191 .
- Rodriguez-Garcia, J. L., Botia, E., de La Sierra, A., Villanueva, M. A., Gonzalez-Spinola, J. Significance of elevated blood pressure and its management on the short-term outcome of patients with acute ischemic stroke. Am J Hypertens. 18, 379-384 (2005).
- Levy, D., Larson, M. G., Vasan, R. S., Kannel, W. B., Ho, K. K. The progression from hypertension to congestive heart failure. JAMA. 275, 1557-1562 (1996).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 7, 678-689 (2007).
- Riou, S. High pressure promotes monocyte adhesion to the vascular wall. Circ Res. 100, 1226-1233 (2007).
- Ley, K., Gaehtgens, P. Endothelial, not hemodynamic, differences are responsible for preferential leukocyte rolling in rat mesenteric venules. Circ Res. 69, 1034-1041 (1991).
- Bernhagen, J. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13, 587-596 (2007).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ Res. 103, 1128-1138 (2008).
- Eberth, J. F. Importance of pulsatility in hypertensive carotid artery growth and remodeling. J Hypertens. 27, 2010-2021 (2009).
- Cooke, J. P., Rossitch, E., Andon, N. A., Loscalzo, J., Dzau, V. J. Flow activates an endothelial potassium channel to release an endogenous nitrovasodilator. J Clin Invest. 88, 1663-1671 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon