Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Produktion und Nachweis von reaktiven Sauerstoffspezies (ROS) in Cancers
In diesem Artikel
Zusammenfassung
Hier schlagen wir einfache Methoden zu testen und auszuwerten Anwesenheit von reaktiven Sauerstoffspezies in den Zellen.
Zusammenfassung
Reaktive Sauerstoffspezies sind eine Reihe von Molekülen, die Schäden von DNA und RNA und oxidieren Proteine und Lipide (Lipid peroxydation). Diese reaktiven Moleküle enthalten eine Sauerstoff und sind H 2 O 2 (Wasserstoffperoxid), NO (Stickstoffmonoxid), O 2 - (Oxid-Anionen), Peroxynitrit (ONOO -), hydrochlorous Säure (HOCl) und Hydroxyl-Radikal (OH -) .
Oxidativer Arten sind nicht nur unter pathologischen Situationen (Krebs, ischämischer / Reperfusion, neurologischen und Herz-Kreislauf-Erkrankungen, Infektionskrankheiten, Entzündungskrankheiten 1, Autoimmunerkrankungen 2, etc ...), sondern auch während der physiologische (nicht krankhafte) Situationen wie Zellstoffwechsel 3 hergestellt , 4. In der Tat spielen ROS eine wichtige Rolle in vielen zellulären Signalwege (Proliferation, Zell-Aktivierung 5, 6, 7 etc. Migration.). ROS können schädlich sein (es wird dann bezeichnet als"Oxidativen Stress und nitrosative"), wenn in großen Mengen in den intrazellulären Kompartimenten und Zellen produziert allgemein ROS reagieren heraufregulierende Antioxidantien wie Superoxid-Dismutase (SOD) und Katalase (CAT), Glutathionperoxidase (GPx) und Glutathion (GSH), das schützt sie durch die Umwandlung gefährlichen freien Radikale in unschädliche Moleküle (zB Wasser). Vitamine C und E sind auch als ROS-Fänger (Antioxidantien) beschrieben worden.
Freie Radikale sind vorteilhaft in niedrigen beträgt 3. Makrophagen und neutrophilen Granulozyten-vermittelte Immunantwort beinhalten die Produktion und Freisetzung von NO, die Viren, Krankheitserreger und Tumorproliferation 8 hemmt. NO reagiert auch mit anderen ROS und somit hat auch eine Rolle als detoxifier (ROS Scavenger). Schließlich NO wirkt auf Schiffen, um den Blutfluss, die wichtig für die Anpassung der Muskel längere Übung 9, 10 zu regulieren. Mehrere Veröffentlichungen haben auch gezeigt, dass ROS in Insulin-sens beteiligt sinditivity 11, 12.
Zahlreiche Methoden zur ROS-Produktion zu bewerten sind. In diesem Artikel schlagen wir mehrere einfache, schnelle und kostengünstige Assays; diese Tests wurden von zahlreichen Publikationen validiert und werden routinemäßig verwendet werden, um ROS oder ihre Auswirkungen in Säugetierzellen zu erkennen. Während einige dieser Tests mehrere ROS erkennen, erkennen andere nur ein einziges ROS.
Protokoll
1. Detektion von ROS mit Carboxy-H 2 DCFDA
Carboxy-H 2 DCFDA ist nicht fluoreszierenden, aber in Anwesenheit von ROS, wenn dieses Reagenz oxidiert wird, wird es grün fluoreszierend.
- Unmittelbar vor der Verwendung, eine frische Stammlösung von Carboxy-H 2 DCFDA in sterile Dimethylsulfoxid (DMSO) oder 100% Ethanol. Vermeiden Sie mehrere Tau-/ freeze-Zyklen Ihrer Farbstoff.
- Waschen Sie die Zellen mit HEPES gepufferte Salzlösung (HBSS) oder Phosphat-gepufferter Salzlösung (PBS), um Spuren der ursprünglichen Medium zu entfernen.
- Laden Sie die Zellen mit dem Farbstoff (und die Kontrolle Farbstoff, vgl. Anm. Abschnitt). In diesem Test verwendeten wir Jurkat, einer menschlichen Leukämie-Zelllinie. Verwenden Sie Carboxy-H 2 DCFDA in einer Endkonzentration von 1 &mgr; in regelmäßigen Kulturmedium mit reduzierter Serum (2%).
- Inkubieren Sie die Kulturen für 30 Minuten im Dunkeln, in einer konventionellen Inkubator (37 ° C, 5% CO2). Entsorgen Sie alle unbenutzten Farbstofflösungen.
- Entfernen carboxy-H 2 DCFDA Medium und waschen zweimal mit HBSS oder PBS. Von diesem Schritt, schützen Sie Ihre Zellen aus Licht.
- Fügen Sie frisches Medium mit Ihrem Medikament der Wahl zum Carboxy-H 2 DCFDA-beladenen Zellen und inkubieren, wie gewünscht. Für dieses Beispiel verwenden wir H 2 O 2 (0,03%) für 1 Stunde.
- Bewerten ROS durch eine sofortige Analyse Ihrer Zellen mittels Durchflusszytometrie mit dem FL1-Kanal (grüne Fluoreszenz), oder durch Fluoreszenz-Reader oder durch Fluoreszenz-Mikroskopie. Die Fluoreszenz kann durch Anregungs-und Emissionswellenlänge, die sich für grüne Fluoreszenz nachgewiesen werden.
Hinweis: Die Kontrollen sollten Carboxy-H 2 DCFDA-geladen unbehandelten Zellen und ungefärbten unbehandelten Zellen beinhalten. Carboxy-H 2 DCFDA ist bekannt, Peroxide erkennen, sondern könnten auch durch andere ROS oxidiert werden. Dieses Reagenz kann auch durch andere Mittel geändert werden, Oxidation unempfindlich Kontrolle Farbstoff wie 5 - (und-6)-Carboxy-2 ', 7'-Dichlorofluorescein Diacetat (Carboxy-DCFDA) sollte daher in den Test einbezogen werden.
2. Messung von Stickstoffmonoxid (NO)-Produktion
Sie müssen Sulfanilamid und N-1-napthylethylenediamine dihydrochlorid (NED)-Lösungen, und Nitrit-Standard. Dieser Test wird als Griess-Assay.
NED: Mach eine 0,1% ige Lösung von N-1-napthylethylenediamine dihydrochlorid in sterile water.Sulfanilamide verdünnt: Machen Sie eine 1% ige Lösung von Sulfanilamid in 5%-iger Phosphorsäure verdünnt. Nitrit Standard: Verdünnen Sie die 0,1 Standard-Lager Natriumnitrit zu 100 &mgr; in steriles Medium, keine serielle Verdünnung in dem gleichen Medium.
Lagerbedingungen: Chemikalien, die als vom Hersteller bei Raumtemperatur geleitet. Nach dem Auflösen sind NED und Sulfanilamide Lösungen sofort nach Gebrauch bei 4 ° C gelagert, in der Dunkelheit, und für maximal 3 Monate.
- Kultur-Zellen in einer 96-Well-Platte,Verwendung dreifach für jede Bedingung und umfassen angemessene Kontrollen nach Ihren Experimenten.
- Gönnen Zellen die NO-Produktion zu induzieren. In unserem Experiment nutzen wir Lipopolysaccharid (LPS) (100 ng / ml) und rekombinantem IL-4, um unsere Zellen zu behandeln. In diesem Protokoll verwendeten wir RAW 264.7, eine Maus-Makrophagen-Zelllinie (Maus leukämischen Monozyten-Makrophagen-Zelllinie).
- Am Tag des Tests, bringen beide Reagenzien auf Raumtemperatur.
- Spin Ihrem Teller, sammeln Zellüberständen und Transfer 50 ul, um eine neue 96-Well-Platte. Bereiten Grenzverdünnung Brunnen Ihrer Standard-Stammlösung zu einer Standard-Kurve machen.
- Add 50 ul Sulfanilamide Lösung für jede Probe und Kontrolle gut und gut mischen.
- Inkubieren bei Raumtemperatur für 10 Minuten im Dunkeln.
- Add 50 ul N-1-napthylethylenediamine dihydrochlorid Lösung für jede Probe und Kontrolle gut und gut mischen.
- Inkubieren bei Raumtemperatur für 10 Minuten im Dunkeln.
- Messen ABSORBAnce sofort mit einem Platten-Lesegerät mit Filter der Wellenlängen zwischen 520nm und 550nm.
Wenn Sie verschiedene Teller / Schale Größen nutzen, verwenden 1/1/1 Lautstärke für jede Lösung und Probenüberstand.
Eine violette Farbe wird in der positiven Vertiefungen erscheinen. Ergebnisse mit dem Standard erhalten wird Ihnen helfen, prüfen Sie die Stabilität Ihres Lösungen.
3. Detektion von ROS Aktion: oxidierten Proteinen
Eine andere Methode, um die Produktion von ROS zu identifizieren, ist am Ende Ergebnisse durch den Nachweis der Oxidation von Proteinen zu suchen. In der Tat spielt ROS ändern Glutathion, ein Antioxidans, das in den meisten Zellen exprimiert wird und eine schützende Rolle gegen ROS. Nach Oxidation durch ROS, Änderung des reduzierten Glutathion (GSH) Ergebnisse in der Sulfhydryl (Thiol)-Gruppe der Cystein mit einem zweiten Glutathion über eine Disulfidbrücke verbunden. Dies führt zu der Bildung eines dimerisierten Protein (oxidierte Protein GSSG). GSH kann über Modifikation von GSSG durch das Enzym Glutathion-Reduktase wiederhergestellt werden. Der Anstieg des GSSG / GSH-Verhältnis spiegelt oxidativen Stress. Die folgenden Test basiert auf der Detektion und Quantifizierung dieser oxidierten Proteinen. Diese Methode ist nicht für spezifische ROS selektive, sondern erkennt die Auswirkungen von NO, H 2 O 2, O 2 - und andere ROS. Hier messen wir die Gesamtmenge der oxidierten (GSSG) und reduziertem (GSH) Glutathion mit Biolumineszenz-Signale.
- Seed Ihre Zellen in einer 96-Well-Platte (weiß / transparent, flache Böden) wie gewohnt. Für unser Experiment haben wir 1x10 4 Zellen pro Well für adhärente RAW 264.7 und A549-Zellen und Fahrwerk Jurkat-Zellen. Je nach Größe Ihrer Zellen diese Zahlen weiter angepasst werden kann. Wir empfehlen die Platte anhaftenden Zellen am Tag vor dem Test, damit sie auf die Platte zu befestigen. Genug Vertiefungen sollten für oxidierte und reduzierte Protein-Erkennung sowie für "medium nur" vorbereitet werden undunbehandelte Zellen als Kontrolle. Verwenden Sie dreifach für alle Bedingungen.
- Verwöhnen Sie Ihre Zellen mit Ihrem Medikament für die erforderliche Zeit. Hier haben wir behandelt, Jurkat-Zellen und A549 Zellen für 1h mit H 2 O 2 (bei 5 mm und 2,5 mm bzw.). RAW 264.7 Zellen wurden mit 200ng/ml LPS für 16 h behandelt Während dieser Inkubationszeit, bringen alle Ihre Reagenzien auf Raumtemperatur (RT). Nehmen Sie alle Reagenzien nicht mehr als 30 Minuten vor der Durchführung des Tests. Die folgende Tabelle zeigt die Volumina der Reagenzien pro Vertiefung. Wenn möglich, ist es wichtig, die Medien mit dem Reduktionsmittel, bevor Sie mit dem Test zu entfernen.
| Adhärenten Zellen | Suspensionszellen | |||
| Insgesamt Glu Lysis | Oxidierte Glu Lysis | Insgesamt Glu Lysis | Oxidierte Glu Lysis | |
| NEM, 25mm | keiner | 0.5μl | keiner | 0.5μl |
| Luciferin-NT | 1 ul | 1 ul | 1 ul | 1 ul |
| Passive Lysis Buffer, 5X | 10 &mgr; l | 10 &mgr; l | 10 &mgr; l | 10 &mgr; l |
| Destilliertes Wasser | 39.0μl | 38.5μl | 14μl | 13.5μl |
| Das endgültige Volumen pro Well | 50 ul | 50 ul | 25 &mgr; l | 25 &mgr; l |
- Entfernen Sie Medium aus Brunnen mit adhärenten Zellen. Entfernen Sie nicht mittelfristig in Brunnen mit Suspensionszellen.
- Add reduziertes Glutathion Lyse-Reagenz oder oxidiertem Glutathion Lysereagens in die entsprechenden Wells und schütteln für 5 Minuten bei RT.
- Fügen Sie die Luciferin Generation Reagenz und INCUBATe für 30 Minuten bei RT.
- Fügen Sie die Luciferin Nachweisreagenz und Inkubation für 15 Minuten bei RT.
- Lesen Sie die Biolumineszenz-Signal an Integrationszeit von 0,25-1 Sekunde pro auch mit einem Platten-Lesegerät Luminometer.
| Adhärenten Zellen | Suspensionszellen | |
| Die Zellzahl pro Well | 1x10 4 | 1x10 4 |
| Zellsuspension pro Well + Drogen | 100 ul, vor 3,4 entfernt werden | 25 &mgr; l, darf nicht entfernt werden |
| Reduziertes Glutathion Lysereagens | 50 pl | 25 &mgr; l |
| Oxidiertem Glutathion Lysereagens | 50 pl | 25 &mgr; l |
| Luciferin-Generation Reagent | 50 pl | 50 pl |
| Luciferin Nachweisreagenz | 100 ul | 100 ul |
4. Repräsentative Ergebnisse:
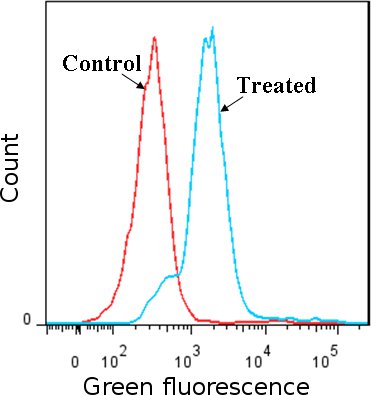
Abbildung 1: Nachweis von ROS mit Carboxy-H2DCFDA Farbstoff. Jurkat-Zellen (humane Leukämie-Zelllinie) mit H 2 O 2 behandelt wurden, zu nicht behandelten Zellen im Vergleich. ROS induziert die Änderung der Carboxy-H 2 DCFDA, dass grüner fluoresziert wie mittels Durchflusszytometrie, die fluoreszierende Gipfel in H 2 O 2 behandelten Zellen bis zu den Gipfeln in der Kontrollgruppe (H 2 O 2 behandelten Zellen gefärbt mit Oxidations-und Kleinschreibung Farbstoff und nicht im Vergleich Verschiebung erkannt behandelten Zellen mit Carboxy-H 2 DCFDA gebeizt). Die Ergebnisse bestätigen das Vorhandensein von ROS in den behandelten Zellen.

Abbildung 2: Nachweis of NO mit Griess-Reagenzien. RAW 264.7 Zellen (Maus-Makrophagen) wurden mit LPS und IL-4 behandelt. Ein signifikant erhöhtes in NO-Produktion wurde in den behandelten Zellen im Vergleich zu unbehandelten Zellen steuern erkannt.
| Zell-Linien | Unbehandelte | Behandelte |
| RAW 264.7 | 13,0 | 8,3 |
| A549 | 21,6 | 10,5 |
| Jurkat | 5,2 | 2,8 |
Tabelle 1: Nachweis von ROS vermittelten Oxidation von Proteinen. RAW 264.7 Zellen mit LPS, Jurkat und A549 behandelt wurden (menschlichen Lungenkrebs-Zellen) wurden mit H 2 O 2 behandelt. Die Ergebnisse werden ausgedrückt als das Verhältnis reduziert (GSH) / oxidiert (GSSG) Glutathion. Niedrigere Verhältnisse von Glutathion (GSH) / (GSSG) wurden in den behandelten Zellen im Vergleich zu erfassendeKontrolle unbehandelte Zellen und enthüllt, dass Proteine mehr wurden in den behandelten Zellen oxidiert.
Diskussion
Mehrere pathologischen Situationen wie entzündlichen Erkrankungen, Krebs, Ischämie / Reperfusion und auch Behandlungen wie Bestrahlung oder Chemotherapie (dh Cisplatin) induzieren ROS Überproduktion. So erkennen und zu messen ROS Ebenen ist in vielen grundlegenden, präklinischen und klinischen Studien wichtig. Allerdings haben ROS sehr kurze Halbwertszeiten und könnte kompliziert zu erkennen. Hier schlagen wir vor, einfache Tests, die routinemäßig verwendet werden, und weithin akzeptierte für den Nachweis von Pr...
Offenlegungen
Wir erhielten Unterstützung von Promega für diese Veröffentlichung.
Danksagungen
Diese Arbeit wurde vom National Institutes of Health (CA142664) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| 5 - (und-6)-Carboxy-2 ', 7'-Dichloro-diacetat (Carboxy-DCFDA) | Molecular Probes | C369 | Steuerung |
| Carboxy-H 2 DCFDA | Molecular Probes | C400 | |
| Sulfanilamid | Sigma | S9251-100G | |
| N-1-napthylethylenediamine dihydrochlorid | Sigma | N9125-10G | |
| Nitrit-Standard | Sigma | 237213-100G | |
| GSH / GSSG-Glo Assay | Promega | V6612 | Um oxidiert, reduziert quantifizieren oder oxidierten / reduzierten Glutathion |
Referenzen
- Guzik, T. J., Korbut, R., Adamek-Guzik, T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol. 54, 469-487 (2003).
- Perl, A., Gergely, P., Banki, K. Mitochondrial dysfunction in T cells of patients with systemic lupus erythematosus. Int Rev Immunol. 23, 293-313 (2004).
- Valko, M., Leibfritz, D., Moncol, J., Cronin, M. T., Mazur, M., Telser, J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 39, 44-84 (2007).
- Droge, W. Free radicals in the physiological control of cell function. Physiol Rev. 82, 47-95 (2002).
- Nakamura, K., Yube, K., Miyatake, A., Cambier, J. C., Hirashima, M. Involvement of CD4 D3-D4 membrane proximal extracellular domain for the inhibitory effect of oxidative stress on activation-induced CD4 down-regulation and its possible role for T cell activation. Mol Immunol. 39, 909-921 (2003).
- Los, M., Droge, W., Stricker, K., Baeuerle, P. A., Schulze-Osthoff, K. Hydrogen peroxide as a potent activator of T lymphocyte functions. Eur J Immunol. 25, 159-165 (1995).
- Deem, T. L., Cook-Mills, J. M. Vascular cell adhesion molecule 1 (VCAM-1) activation of endothelial cell matrix metalloproteinases: role of reactive oxygen species. Blood. 104, 2385-2393 (2004).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87, 315-424 (2007).
- Griendling, K. K., Sorescu, D., Lassegue, B., Ushio-Fukai, M. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol. 20, 2175-2183 (2000).
- Loh, K., Deng, H., Fukushima, A., Cai, X., Boivin, B., Galic, S., Bruce, C., Shields, B. J., Skiba, B., Ooms, L. M., Stepto, N., Wu, B., Mitchell, C. A., Tonks, N. K., Watt, M. J., Febbraio, M. A., Crack, P. J., Andrikopoulos, S., Tiganis, T. Reactive oxygen species enhance insulin sensitivity. Cell Metab. 10, 260-272 (2009).
- Goldstein, B. J., Mahadev, K., Wu, X. Redox paradox: insulin action is facilitated by insulin-stimulated reactive oxygen species with multiple potential signaling targets. Diabetes. 54, 311-321 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten