Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство и обнаружения активных форм кислорода (АФК) в Раки
В этой статье
Резюме
Здесь мы предлагаем простые методы, чтобы проверить и оценить наличие активных форм кислорода в клетках.
Аннотация
Активные формы кислорода включают число молекул, что повреждения ДНК и РНК и окисляют белки и липиды (липид перекисное). Эти реактивные молекулы содержат кислорода и включают в себя H 2 O 2 (перекиси водорода), NO (оксид азота), O 2 - (оксида анион), пероксинитрита (ONOO -), хлорноватистая кислота (HOCl) и гидроксильных радикалов (OH -) .
Окислительный видов выпускаются не только при патологических ситуациях (рак, ишемическая / реперфузии, неврологические и сердечно-сосудистой патологии, инфекционные заболевания, воспалительные заболевания 1, аутоиммунными заболеваниями 2, и т.д. ...), но и при физиологическом (не патологическим) ситуациях, таких как клеточный метаболизм 3 , 4. В самом деле, АФК играют важную роль во многих клеточных путей передачи сигналов (распространение, активации клеток 5, 6, 7 и т.д. миграции.). АФК может быть вредно (тогда оно называется"Окислительного стресса и nitrosative"), когда производятся в больших количествах в внутриклеточные отсеки и клетки в целом реагируют на ROS по upregulating антиоксидантов, таких как супероксиддисмутаза (СОД) и каталазы (КАТ), глутатионпероксидазы (GPx) и глутатион (GSH), которая защищает их преобразования опасных свободных радикалов в безвредные молекулы (то есть вода). Витамины С и Е, также были описаны в качестве поглотителей ROS (антиоксиданты).
Свободные радикалы полезны в небольших количествах 3. Макрофагов и нейтрофилов-опосредованный иммунный ответ включают производство и выпуск NO, который ингибирует вирусы, болезнетворные микроорганизмы и пролиферации опухолевых 8. NO также вступает в реакцию с другими АФК и, таким образом, также играет определенную роль, как детоксикантом (АФК мусорщик). Наконец NO действует на суда для регулирования притока крови, что важно для адаптации мышц к длительной упражнение 9, 10. Ряд публикаций также продемонстрировали, что АФК участвуют в инсулине Sensitivity 11, 12.
Многочисленные методы оценки АФК имеются. В этой статье мы предлагаем несколько простых, быстрых и доступных тестов, эти анализы были подтверждены многими изданиями и обычно используются для обнаружения ROS или его эффекты в клетках млекопитающих. Хотя некоторые из этих анализов обнаружить несколько ROS, другие обнаружить только одну АФК.
протокол
1. Обнаружение АФК использованием карбокси-H 2 DCFDA
Карбокси-H 2 DCFDA не является люминесцентная, но в присутствии ROS, когда этот реагент окисляется, становится зеленый флуоресцентный.
- Непосредственно перед применением, готовить свежий раствор запас карбокси-H 2 DCFDA в стерильных диметилсульфоксид (ДМСО) или 100% этанола. Избегайте нескольких оттепели / заморозки циклов вашего красителя.
- Вымойте клеток с HEPES буфером раствор соли (HBSS) или фосфатно-солевом буфере (PBS), чтобы удалить следы оригинальной среде.
- Нагрузка клеток с красителем (и красителя управления, см. примечание раздел). В данном анализе мы использовали Jurkat, линии клеток человека лейкемии. Используйте карбокси-H 2 DCFDA в конечной концентрации 1 мкм в регулярных культуральной среде с пониженным сыворотки (2%).
- Инкубируйте культур в течение 30 минут в темноте, в обычных инкубатор (37 ° С, 5% CO2). Удалите все неиспользуемые решения красителя.
- Удалить карбокси-H 2 DCFDA среде, содержащей и мыть дважды HBSS или PBS. С этого шаг вперед, защищать ваши клетки от воздействия света.
- Добавить свежую среду, содержащую препарат выбора для карбокси-H 2 DCFDA загружены клеток и инкубировать как хотелось бы. Для этого примера мы используем Н 2 О 2 (0,03%) в течение 1 часа.
- Оценка ROS, немедленно анализа ваших клеток методом проточной цитометрии с использованием FL1 канала (зеленая флуоресценция), или флуоресценции читателя пластины, или флуоресцентной микроскопии. Флуоресценции можно обнаружить с помощью возбуждения и излучения волн, которые подходят для зеленую флуоресценцию.
Примечание: Элементы управления должны включать в себя карбокси-H 2 DCFDA загружены необработанных клетках и неокрашенных необработанными клетками. Карбокси-H 2 DCFDA, как известно, обнаружить пероксиды но также может быть окисляется других АФК. Этот реагент может быть изменен с помощью других средств, окисление нечувствительны красителя управления, например, 5 - (а-6)-карбокси-2 ', 7'-дихлорofluorescein диацетат (карбокси-DCFDA) должны быть включены в тест.
2. Измерение оксида азота (NO) производства
Вам нужно будет сульфаниламидных и N-1-napthylethylenediamine дигидрохлорид (NED) решений, и нитритов стандарта. Этот анализ называется Грисса анализа.
NED решение: Сделать 0,1% раствора N-1-napthylethylenediamine дигидрохлорид разводят в стерильный раствор water.Sulfanilamide: Сделайте 1% раствора сульфаниламидных разводят в 5% фосфорной кислоты. Нитриты Стандарт: Развести фондовом 0,1 стандартного раствора нитрита натрия в 100 мкм в стерильной среде, делают серийные разведения в той же среде.
Условия хранения: хранить химические вещества в соответствии с указаниями производителя при комнатной температуре. Когда восстановленный, NED и сульфаниламидные решений хранятся сразу же после использования при температуре 4 ° С, в темноте, и в течение максимум 3 месяцев.
- Культуры клеток в 96 ячейках,использование трем образцам для каждого условия, и включают в себя надлежащий контроль в соответствии с вашими экспериментами.
- Лечить клетки не вызывают производства. В нашем эксперименте мы используем липополисахарида (ЛПС) (100 нг / мл) и рекомбинантный IL-4 для лечения наших клеток. В этом протоколе, мы использовали RAW 264,7, клетка мыши линии макрофагов (мышь лейкозных моноцитов линии клеток макрофагов).
- В день теста, доведите обоих реагентов до комнатной температуры.
- Спиновые вашей тарелке, собирать ячейки супернатанты и передачи 50 мкл на новый 96-луночный планшет. Подготовка предельного разбавления скважин вашего стандартное решение, чтобы сделать запас стандартной кривой.
- Добавить 50 мкл сульфаниламидных Решение каждого образца и контроля хорошо, и хорошо перемешать.
- Инкубируйте при комнатной температуре в течение 10 минут в темноте.
- Добавить 50 мкл N-1-napthylethylenediamine дигидрохлорид решение каждого образца и контроля хорошо, и хорошо перемешать.
- Инкубируйте при комнатной температуре в течение 10 минут в темноте.
- Мера absorbaNCE немедленно используя ридер с фильтром длиной волны между 520nm и 550nm.
Если вы используете различные пластины / размеров тарелки, используйте 1/1/1 объем для каждого решения и образцы супернатант.
Фиолетовый цвет появится в положительном скважин. Результаты, полученные при стандартных поможет вам проверить стабильность вашего решения.
3. Обнаружение АФК действие: окисленных белков
Другой метод для выявления производства АФК, чтобы смотреть на конечные результаты, обнаруживая при окислении белков. В самом деле, АФК изменить глутатион, антиоксидант, который выражается в большинстве клеток организма и играет защитную роль против АФК. После окисления АФК, модификация восстановленный глутатион (GSH) приводит к сульфгидрильных (тиоловых) группа цистеина его в связях с второй глутатиона через дисульфида моста. Это приводит к образованию белка димеризованной (окисленных белков GSSG). GSH может быть восстановлен с помощью модификации GSSG с помощью фермента глутатион-редуктазы. Увеличение GSSG / GSH соотношение отражает окислительного стресса. Следующий анализ основан на выявлении и количественной оценки этих окисленных белков. Этот метод не является селективным для конкретных АФК, а обнаруживает эффекты NO, H 2 O 2, O 2 - и других АФК. Здесь мы измеряем общую сумму окисленного (GSSG) и пониженной (GSH) глутатиона использования биолюминесцентного сигналов.
- Семенной ваши клетки в 96 ячейках (белый / прозрачный, плоским дном), как обычно. Для нашего эксперимента мы использовали 1x10 4 клеток на лунку для приверженца Сырье 264,7 и A549 клетки и клетки Jurkat подвески. В зависимости от размера вашей клетки эти цифры могут быть скорректированы. Мы рекомендуем пластины прилипшие клетки день до теста, чтобы они могли прикрепить к пластинке. Достаточно скважин должны быть готовы к окисленного и восстановленного белка обнаружения, а также для "среды только" инеобработанных клеток в качестве контроля. Используйте трем образцам для всех условий.
- Относитесь к своим клеткам с наркотиками в течение требуемого времени. Здесь мы относились Jurkat клетках и клетках A549 в течение 1 ч с Н 2 О 2 (на 5 мм и 2,5 мм соответственно). Сырье 264,7 клетки обрабатывали 200ng/ml ЛПС в течение 16 часов В течение этого времени инкубации, довести все ваши реагенты до комнатной температуры (РТ). Сделать все реагенты не более 30 минут, прежде чем выполнять тест. Приведенная ниже таблица показывает объемы реагентов на скважину. Когда это возможно, важно, чтобы удалить средах, содержащих восстановитель прежде чем приступить к тест.
| Приверженец клетки | Подвеска клетки | |||
| Всего Лизис Glu | Окисленный Glu Лизис | Всего Лизис Glu | Окисленный Glu Лизис | |
| NEM, 25мм | ни один | 0.5μl | ни один | 0.5μl |
| Люциферин-NT | 1 мкл | 1 мкл | 1 мкл | 1 мкл |
| Пассивный буфера для лизиса, 5X | 10 мкл | 10 мкл | 10 мкл | 10 мкл |
| Дистиллированная вода | 39.0μl | 38.5μl | 14μl | 13.5μl |
| Конечный объем на скважину | 50 мкл | 50 мкл | 25 мкл | 25 мкл |
- Удаление среды из скважин с прилипшие клетки. Не снимайте среды в скважинах с подвеской клеток.
- Добавить восстановленный глутатион Реактив для лизиса или окисленного глутатиона реагента лизис к соответствующему скважин и встряхивают в течение 5 минут при комнатной температуре.
- Добавить реагента люциферин поколения и incubatE в течение 30 минут при комнатной температуре.
- Добавить реагента люциферин обнаружения и инкубировать 15 минут при комнатной температуре.
- Прочитано биолюминесцентного сигнала на время интеграции 0,25-1 секунду на хорошо использование люминометра ридер.
| Приверженец клетки | Подвеска клетки | |
| Сотовый номер на одну скважину | 1x10 4 | 1x10 4 |
| Суспензии клеток на лунку + наркотиков | 100 мкл, должны быть удалены до 3,4 | 25 мкл, не должен быть удален |
| Уменьшение Лизис Глутатион реагент | 50 мкл | 25 мкл |
| Окисленный глутатион реагент Лизис | 50 мкл | 25 мкл |
| Люциферин поколения реагентов | 50 мкл | 50 мкл |
| Люциферин обнаружения реагентов | 100 мкл | 100 мкл |
4. Представитель Результаты:
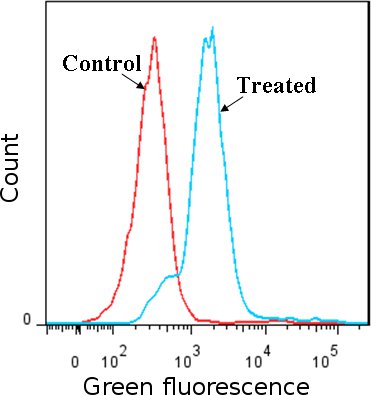
Рисунок 1 Обнаружение АФК использованием карбокси-H2DCFDA красителя. Jurkat клеток (линии клеток человека лейкемия), получавших Н 2 О 2 были по сравнению с необработанными клетками. АФК вызывает изменение карбокси-H 2 DCFDA что флуоресцирует зеленым, обнаруженных с помощью проточной цитометрии, флуоресцентные пика в H 2 O 2 обработанных клеток сдвиг по сравнению с пиками в контрольной группе (H 2 O 2 обработанных клеток окрашивали красителем окисления нечувствительны и не обработанных клеток, окрашенных карбокси-H 2 DCFDA). Результаты подтверждают наличие АФК в клетках.

Рисунок 2 Обнаружение ое NO использованием Грисса реагентов. RAW 264,7 клеток (макрофагов мышей) получали LPS и ИЛ-4. Значительного увеличения в NO производства был обнаружен в клетках, обработанных по сравнению с контрольными необработанными клетками.
| Клеточные линии | Неочищенные | Обработанные |
| Сырье 264,7 | 13,0 | 8,3 |
| A549 | 21,6 | 10,5 |
| Jurkat | 5,2 | 2,8 |
Таблица 1 Обнаружение АФК опосредованного окисления белков. RAW 264,7 клетки обрабатывали ЛПС, Jurkat и A549 (человека рак легких) клетки обрабатывали H 2 O 2. Результаты выражены как отношение снижается (ГШ) / окисленной (GSSG) глутатиона. Нижняя отношения глутатион (GSH) / (GSSG) были обнаружены в клетках, обработанных по сравнению сконтроль необработанных клетках, показывая, что белки были более окисляется в обработанных клетках.
Обсуждение
Несколько патологических ситуациях, таких как воспалительные заболевания, рак, ишемии / реперфузии, а также процедур, таких, как радиация или химиотерапия (т.е. цисплатин) индуцируют АФК перепроизводства. Таким образом, обнаружения и измерения уровня РОС важна во многих основных, доклин...
Раскрытие информации
Мы получили поддержку Promega для этой публикации.
Благодарности
Работа выполнена при поддержке Национального института здоровья (CA142664).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
|---|---|---|---|
| 5 - (а-6)-карбокси-2 ', 7'-дихлорфлуоресцеина диацетат (карбокси-DCFDA) | Молекулярные зонды | C369 | контроль |
| карбокси-H 2 DCFDA | Молекулярные зонды | C400 | |
| Сульфаниламид | Сигма | S9251-100G | |
| N-1-napthylethylenediamine дигидрохлорид | Сигма | N9125-10G | |
| Нитриты стандартных | Сигма | 237213-100G | |
| GSH / GSSG-Glo Пробирной | Promega | V6612 | Чтобы количественно окисляется, уменьшены или окисленный / восстановленный глутатион |
Ссылки
- Guzik, T. J., Korbut, R., Adamek-Guzik, T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol. 54, 469-487 (2003).
- Perl, A., Gergely, P., Banki, K. Mitochondrial dysfunction in T cells of patients with systemic lupus erythematosus. Int Rev Immunol. 23, 293-313 (2004).
- Valko, M., Leibfritz, D., Moncol, J., Cronin, M. T., Mazur, M., Telser, J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 39, 44-84 (2007).
- Droge, W. Free radicals in the physiological control of cell function. Physiol Rev. 82, 47-95 (2002).
- Nakamura, K., Yube, K., Miyatake, A., Cambier, J. C., Hirashima, M. Involvement of CD4 D3-D4 membrane proximal extracellular domain for the inhibitory effect of oxidative stress on activation-induced CD4 down-regulation and its possible role for T cell activation. Mol Immunol. 39, 909-921 (2003).
- Los, M., Droge, W., Stricker, K., Baeuerle, P. A., Schulze-Osthoff, K. Hydrogen peroxide as a potent activator of T lymphocyte functions. Eur J Immunol. 25, 159-165 (1995).
- Deem, T. L., Cook-Mills, J. M. Vascular cell adhesion molecule 1 (VCAM-1) activation of endothelial cell matrix metalloproteinases: role of reactive oxygen species. Blood. 104, 2385-2393 (2004).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87, 315-424 (2007).
- Griendling, K. K., Sorescu, D., Lassegue, B., Ushio-Fukai, M. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol. 20, 2175-2183 (2000).
- Loh, K., Deng, H., Fukushima, A., Cai, X., Boivin, B., Galic, S., Bruce, C., Shields, B. J., Skiba, B., Ooms, L. M., Stepto, N., Wu, B., Mitchell, C. A., Tonks, N. K., Watt, M. J., Febbraio, M. A., Crack, P. J., Andrikopoulos, S., Tiganis, T. Reactive oxygen species enhance insulin sensitivity. Cell Metab. 10, 260-272 (2009).
- Goldstein, B. J., Mahadev, K., Wu, X. Redox paradox: insulin action is facilitated by insulin-stimulated reactive oxygen species with multiple potential signaling targets. Diabetes. 54, 311-321 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены