Method Article
Solid-Phase Submonomer Synthese von Peptoid Polymere und ihre Self-Assembly in hoch geordneten Nanoschichten
In diesem Artikel
Zusammenfassung
Eine einfache und allgemeine manuelle Peptoid Syntheseverfahren mit Grundausstattung und kommerziell erhältlichen Reagenzien beschrieben, so dass Peptoide problemlos in den meisten Labors synthetisiert werden. Die Synthese, Reinigung und Charakterisierung eines amphiphilen Peptoid 36mer beschrieben, sowie deren Selbstorganisation zu hoch geordneten Nanoschichten.
Zusammenfassung
Peptoide sind eine neue Klasse von biomimetischen, nicht-natürliche, Sequenz-spezifischen Heteropolymere dass Proteolyse zu widerstehen, weisen starke biologische Aktivität und falten sich in höherer Ordnung Nanostrukturen. Strukturell ähnlich Peptide sind Peptoide Poly N-substituierten Glycine, wo die Seitenketten an den Stickstoff gebunden sind und nicht die alpha-Kohlenstoff. Ihre einfache Synthese und strukturelle Vielfalt ermöglicht das Testen der grundlegenden Konstruktionsprinzipien zu de-novo-Design und Engineering von neuen biologisch aktiven und nanostrukturierter Materialien hin zu fahren.
Hier ist eine einfache manuelle Peptoid Syntheseprotokoll vorgestellt, ermöglicht die Synthese von langkettigen polypeptoids (bis 50mers) in sehr guten Ausbeuten. Nur Grundausstattung, einfache Techniken (z. B. flüssig übertragen, Filtration), und im Handel erhältlichen Reagenzien benötigt werden, so dass Peptoide einem zugänglichen Neben vielen Forschern Toolkits. Die Peptoid Backbone ist ein Monomer in einer Zeit, v gewachsenia der Submonomer Methode, die von einem zweistufigen Monomerzugabe Zyklus besteht aus: Acylierung und Verdrängung. Zunächst Bromessigsäure in situ mit N aktiviert, Acylate N'-Diisopropylcarbodiimid ein Harz-gebundenen sekundären Amins. Zweitens nucleophile Verdrängung des Bromids durch ein primäres Amin folgt vor, um die Seitenkette einzuführen. Die Zwei-Schritt-Zyklus wird so lange wiederholt, bis die gewünschte Kettenlänge erreicht ist. Die Kopplungseffizienz dieser zweistufigen Zyklus regelmäßig mehr als 98% und ermöglicht die Synthese von Peptoide solange 50 Reste. Sehr abstimmbaren, präzise und chemisch unterschiedlicher Sequenzen sind erreichbar mit dem Submonomer Methode als Hunderte von leicht verfügbaren primären Aminen direkt integriert werden können.
Peptoide sind als vielseitige biomimetische Material für nanobioscience Forschung wegen ihrer synthetischen Flexibilität, Robustheit Schwellenländern und die Bestellung auf atomarer Ebene. Die Faltung eines single-chain, amphiphile, InformationenTION-rich polypeptoid zu einem hoch geordneten nanosheet wurde kürzlich demonstriert. Diese Peptoid ist ein 36-mer, die nur aus drei verschiedenen im Handel erhältlichen Monomeren besteht: hydrophobe, kationische und anionische. Die hydrophobe phenylethyl Seitenketten sind in der nanosheet Kern begraben, während die ionischen Amin-und Carboxyl-Seitenketten auf der hydrophilen Gesichter auszurichten. Die Peptoid Nanoschichten dienen als mögliche Plattform für Membran-Mimetika, Protein-Mimetika, Bauelementherstellung und Sensoren. Methoden zur Synthese Peptoid, Blattbildung und Mikroskopie werden beschrieben und bieten eine einfache Methode, um zukünftige Peptoid nanosheet Designs.
Protokoll
1. Solid-Phase Submonomer Synthese von Polypeptoids
Festphasensynthese (SPS) ist eine gängige Methode zur Synthese von Sequenz-spezifische Biopolymere stufenweise, direkt auf einem inerten festen Träger, wie einem polymeren Harz Perle. Hohe Kupplungsausbeuten und Leichtigkeit des überschüssigen Reaktanden Entfernung sind wichtige Vorteile der SPS. Nach einer Kupplung an das Harz werden überschüssige Reagenzien einfach abgelassen und die Perlen werden gewaschen, um bereit für den nächsten Reaktionsschritt. Nach dem abschließenden Synthese-Reaktion werden die full-length-Oligomere vom Harz abgespalten und die Lösung-Phasen-Material kann weiter untersucht werden. Hier passen wir die SPS Verfahren zur Sequenz-spezifischen Peptoid Polymere zu erzeugen.
- Setup: Alle Schritte der manuellen Peptoid Synthese kann in einem Einweg-, Polypropylen (PP) mit Fritte Patrone oder eine Glasfritte Reaktionsgefäß mit einem 3-Wege-Hahn ausgestattet ist, durchgeführt werden. Führen Sie alle Aktivitäten in einer Abzugshaube. Für Inkubationen in der glass Gefäß-oder Kunststoff-Kartusche, verbinden Sie einen Arm, um eine Versorgung mit Stickstoff, um sanft Blase die Lösung für die richtige Mischung. Alternativ zur Reaktion Inkubationen in der Einweg-Kartusche, Dichtung an beiden Enden der Patrone mit Kappen und Ort auf einem Schüttler. Um Reaktionsgemische oder wäscht drain, eine Verbindung zum Vakuum über eine Siphon Haus. Das Schiff sollte mit einer groben Fritte Fritte werden. Siliconpastenfilme Glasreaktionsgefäß um Perlen vom Kleben an den Wänden des Glases zu vermeiden. Bereiten Sie eine Lösung von 5% Dichlordimethylsilan in Dichlorethan (v / v). Füllen Sie eine saubere und trockene Reaktionsgefäß bis zum Rand mit Silikonisierung Lösung, lassen Sie sich für 30 Minuten, dann abtropfen lassen. Waschen Sie den Behälter einmal mit DCE und dann noch einmal mit Methanol. Die Silikonisierung Lösung wiederverwendet werden können, so dass es gespeichert werden soll. Entweder an der Luft trocknen oder abzuschütteln überschüssige Lösung und backen Sie die Glaswaren, bis es trocken nach dem Entfernen der Hahn. Coole Reaktionsgefäß vor dem Hinzufügen von Harz.
- Fügen Sie 100 mg (0,06 mmol) der Rink-Amid-resin eine Fritte Reaktionsgefäß. Swell das Harz durch Zugabe von 2 ml Dimethylformamid (DMF). Agitieren durch Schütteln oder sprudelnden für 10 Minuten. Lassen Sie die Lösung durch Vakuum an die schwoll Harz zu isolieren.
- 1 ml 20% 4-Methyl-piperidin in DMF (v / v), um die Fmoc-Gruppe entschützen. Agitieren für 2 Minuten und abtropfen lassen. Wiederholen Sie mit einem 12-minütigen Inkubation.
- Spülen Sie das Harz durch Zugabe von 2 mL DMF, Rühren für 15 Sekunden, und Entleeren. Wiederholen Sie die 3x.
- Bromoacetylation: 1 ml von 0,6 M Bromessigsäure (0,6 mmol) in DMF und 86 ul von N, N'-Diisopropylcarbodiimid (0,93 Äquivalent, 0,56 mmol). Inkubieren unter leichtem sprudelnden für 30 Minuten, dann abtropfen lassen und gründlich mit 2 ml DMF (Wiederholung 4x).
- Hubraum: 1 ml von 1-2 M Amin in N-Methylpyrrolidinon. Inkubieren mit blubbernden für 30-120 Minuten, dann abtropfen lassen und gründlich mit DMF (4x 2 ml).
- Fahren Sie mit dem Peptoid Kette durch Wiederholung der Submonomer Zyklus, Schritte 1,5 (bromoacetylation) und 1,6 (displacemen wachsent).
- Nach der endgültigen Vertreibung geschehen ist, mit 2 ml DMF (Wiederholung 4x) abspülen, dann 2 mL Dichlormethan (repeat 3x). Cap und speichern das Reaktionsgefäß bis Spaltung.
- Pause in der Synthese (optional): So halten Sie während eines Peptoid Synthese, beenden Sie die Verschiebung Reaktion und weiter auf 1,8 Schritt. Um weiter zu wachsen die Peptoid Kette, starten die Synthese von re-Schwellung des getrockneten Harzes (Schritt 1,2) und das Wiederholen der Submonomer Zyklus (Schritt 1,5 und 1,6). Das Harz kann getrocknet und gelagert werden, nachdem jede Verschiebung mit Ausnahme der 2. Verschiebung, weil das Harz-Peptoid Konjugat eine zyklische Diketopiperazin Nebenprodukt bilden können.
- Für mehrere gleichzeitige Synthese, ist eine Festphasenextraktion Vakuumkammer empfohlen, um die Effizienz zu maximieren. Peptoid Synthese kann auch durch geeignete Programmierung Methoden in handelsüblichen Peptidsynthesizern, wie die Aapptec Apex 396, CEM Mikrowellen-Synthesizer Liberty-und Protein Techno automatisiert werdenlogien Inc. Prelude Synthesizer.
2. Spaltung und Side-Chain Entschützung
- Übertragen Sie alle getrockneten Harz zu einem 20 mL Szintillations Glasfläschchen.
- Arbeiten in einer Kapuze und Verwendung der richtigen persönlichen Schutzausrüstung, 4 ml Trifluoressigsäure (TFA)-Spaltung Cocktail 1 (z. B. 95% aq. TFA, siehe Diskussion), die Szintillation Glasfläschchen und fest verschließen. Schütteln für 10 Minuten bis 2 Stunden bei Raumtemperatur (siehe Diskussion).
- Sammeln Sie die TFA-Spaltung Lösung durch Filtrieren des Harzes durch eine Einweg-, PP Fritte Patrone in eine neue, vorher gewogenen 20 mL Szintillations Glasfläschchen. Ein Einweg-, PP-Pipette ist zweckmäßig, die Spaltung Cocktail-Lösungen übertragen.
- 1 ml frischer Spaltung Cocktail an das Harz gründlich und sammeln restliche Peptoid. Wiederholen Sie 2x.
- Man dampft TFA durch Einblasen eines leichten Stickstoffstrom oder mit einem Biotage V10 Verdampfer.
- Abgeblasen, und der Rohöl in 6 mLAcetonitril / Wasser 1:1 (v / v) für die HPLC. Freeze und lyophilisiert. Wiederholen.
- Das Gewicht des Rohproduktes. Shop als trockenes Pulver bei -20 ° C
- Test-Spaltung (optional): Ein Test-Spaltung auf 0,5% des Harzes kann durchgeführt werden, um schnell festzustellen, die Reinheit und die Masse der synthetisierten Peptoid und ob korrekte Spaltung Bedingungen wurden gewählt werden. Testen Sie Spaltungen sind besonders nützlich, um den Fortschritt der Synthese überwachen.
3. Charakterisierung und Reinigung der Polypeptoid
- Durch eine Kombination von analytischen HPLC-Elektrospray LC-MS und / oder MALDI-TOF, bestimmen die Reinheit des Rohproduktes und ob das gewünschte Molekulargewicht vorhanden ist.
- Bereiten Sie ein ~ 5-10 mg / ml-Lösung des trockenen Peptoid Pulver in Wasser mit minimalem Acetonitril als für die Löslichkeit benötigt. Filter klare Lösung von rohem Peptoid Produkt mit 0,45 um Spritzenfilter, um Staub und Partikel zu entfernen.
- Analytische HPLC und Elektrospray LC-MS: Vorbereiten einer ~ 20 pg / mL Rohöl Peptoid Lösung. Filter 200 ul mit einem 0,45 um Filter und injizieren 20 uL.
- MALDI: Mix 1 ul ~ 20 mg / mL Peptoid mit 1 ul-Matrix. Spot 1 ul auf MALDI Platte und an der Luft trocknen. Matrix und den Erwerb Modus ist abhängig von Probe (Abb. 5).
- Das rohe Peptoid Mischung mit Reverse-Phase-HPLC prep. Wählen Sie die Steigung und Spalte (C4 oder C18) auf der Hydrophobie polypeptoid basiert. Kombinieren gereinigten Fraktionen, eingefroren, und lyophilisiert, was zu einem flauschigen weißen Pulver. Das Gewicht des Endproduktes.
- Die Bildung von HCl-Salz (optional): abgeblasen, und der lyophilisierten Pulvers in 100 mM HCl (aq.) mit minimalem Acetonitril. Transfer zum vorgewogen Glasfläschchen. Freeze und re-lyophilisieren. Wiederholen Sie 2x. Erneut gewogen, um Masse Peptoid Pulver zu bestimmen.
4. Peptoid Nanosheet Formation
Dieser Abschnitt describes das Protokoll, um Blätter von einem single-chain, Sequenz-spezifischen, amphiphile 36-mer Peptoid (Abb. 1). Nach dem Peptoid Strang synthetisiert, gereinigt und lyophilisiert, wie oben beschrieben, wird die erhaltene weiße Pulver in DMSO gelöst, um eine 2 mM Stammlösung zu machen.
- Bereiten Sie 500 mL der 20 uM Peptoid Lösung in Blattbildung Puffer (10 mM Tris-HCl, 100 mM NaCl, pH 8,0 in Wasser) in einem 1 Dram Glasfläschchen. Fügen Sie zunächst 445 ul des Milli-Q Wasser, 50 uL 10x Blattbildung Puffer und Wirbel zu mischen. Anschließend 5 pl 2 mM Peptoid Stammlösung und schwenken Lösung. Cap der Glasflasche.
- Die Bettwäsche wird durch die sanfte Bewegung des verdünnten wässrigen Peptoid Lösung gebildet. Langsam Kippen der Glasflasche aus der horizontalen Lage in die aufrechte Position führt zu Rate ziehen. Leichtem Schütteln ergibt sich auch Blätter, jedoch neigen die Blätter sind kleiner und mit weniger geraden Kanten. Eine gründlichere Analyse der Blattbildung Mechanismus ist Reported getrennt. 2
- Für viele hochwertige Bettwäsche, drehen Sie das Glasfläschchen um die horizontale Achse langsam (<1 min) für 1-3 Tage. Eine geeignete technische Mittel RKVSD Rotamix Rohr Rotator oder ein individuelles Wippe kann dies kontinuierlich durchzuführen.
- Dialyse von Nanoschichten (optional): Bei bestimmten Anwendungen kann es notwendig sein, um jede freie Peptoid Ketten oder Puffer / Salze zu entfernen. Tränken Sie ein Float-a-Lyzer 100 kD-Membran in die gewünschte Puffer für 15 Minuten. Legen Sie 500 ul Peptoid Blatt-Lösung in den Probenraum. Tauchen Sie ein in 500 mL des gewünschten Puffer, Rühren mit einem Magnetrührer bei 60 Umdrehungen pro Minute. Lassen Dialyse von Blechen bis 4 Stunden gehen. Jede Stunde, den Austausch mit einem frischen Stamme der Pufferlösung.
5. Fluoreszenz-Mikroskopie von Nanoschichten
- Fluoreszenz-Bilder von der Nanoschichten wurden mit Nile Red, einem ökologisch sensiblen Farbstoff, dessen Fluoreszenzintensität steigt, wenn es in hydr lokalisiert ist abgebildetophobic Umgebungen (Abb. 2).
- Add 1 ul 100 uM Nile Red und 100 ul der nanosheet Lösung auf eine Endkonzentration von 1 uM Nile Red zu erhalten.
- Machen Sie einem 1% igen Lösung in heißem Wasser vermischen und in einer Kunststoff-Petrischale. Sicherstellen, dass die Agarose-Lösung beträgt etwa 1 / 8 Zoll dick und lassen Sie die Lösung abkühlen auf eine ebene Fläche ungestört. Nach der Agarose-Sets, mit einem Spatel zu schneiden und je 1 cm x 1 cm große Quadrate auf ein Glasplättchen.
- Um das Blatt in der gleichen Ebene, Spot 1 ul Blatt Lösung auf dem Stück Agarose zu sammeln. Lassen Sie die Agarose auf den Puffer für 2 Minuten absorbieren, so dass die Blätter an der Oberfläche. Bild innerhalb von 15 Minuten, sonst wird die Agarose beginnt sich zu verformen wegen Austrocknung.
- Um Bild-Blätter in der Lösung, Last 15 ul in einem 20 mm Durchmesser 0,12 mm Dichtung auf einem Glasträger. Deckel mit einem Deckglas. Wenn die Blätter einfach liegen zwischen einem Glasträger und Deckglas ohne eine Dichtung eingelegt, viele Blätter will Scher-und die scheinbar geringfügige Verdunstung bewirkt, dass die Platten ständig verschieben.
- Bild Blatt unter Epifluoreszenz-Beleuchtung (z. B. eine Olympus IX81 inversen Mikroskop mit einem Andor iXonEM + EMCCD-Spektren mit einem Texas-Rot-Filter eingebaut).
6. Rasterelektronenmikroskopie (SEM) von Nanoschichten
- Plasma Etch von Silikon-Substrat (optional): Die Silizium-Chips sind Plasma geätzt werden, um bei der Adsorption von Blatt zu unterstützen. Legen Sie die Silizium-Chips in der Vakuumkammer eines Plasma-Reiniger (zB Harrick Plasma Cleaner / Sterilisator PDC-32G). Pump bis zu 200 mTorr und stellen Sie die HF-Spule bis 18W (hohe Einstellung für PDC-32G). Etch für 2 Minuten.
- Drop 20 uL Peptoid Blatt-Lösung auf einem Plasma-behandelten Silizium-Substrat. Lassen Sie sich für 3 Minuten sitzen. Entfernen Sie überschüssige Lösung mit der Spitze des Kim-wischen. Je 20 ul Wasser auf die Oberfläche und entfernen Sie überschüssige Lösung wieder in den Puffer und Salze zu entfernen. Wiederholen 4x.
- Alternativ wählen SieYZE die Peptoid Blatt Lösungen gegen Wasser zu puffern und Salz zu entfernen. Drop 20 uL dialysiert Blatt Lösung auf Plasma behandelte Silizium-Substraten. An der Luft trocknen Probe.
- Bild Blätter mit SEM (zB Zeiss Gemini-Ultra-Analytical-55 Scanning Electron Microscope) mit einer in-lens-Detektor und Strahlenergien zwischen 1 kV und 5 kV (Abb. 3).
7. Sicherheitshinweise:
- Dimethylformamid und Dichlormethan sind recht Verdachtskategorie.
- N, N'-Diisopropylcarbodiimid, 4-methylpiperdine und Bromessigsäure sind gefährlich für die Haut, Augen und Atemwege. Sie sollten in der Haube mit Vorsicht verwendet werden. Es kann sein, giftig beim Einatmen oder durch die Haut absorbiert, und die Belichtung kann in Sensibilisierung führen. Leere Behälter enthalten Produktreste (Flüssigkeit / Dampf) und sollte gründlich, bevor sie aus der Motorhaube gespült werden.
- TFA ist eine starke Säure, und ist extrem schädlich für die oberen Atemwege, Augen undHaut. TFA ist auch volatile-halten konzentrierte Lösungen von TFA in die Haube zu allen Zeiten der Atemwege zu vermeiden. Verwenden Sie eine korrekte PPE, und Vorsicht beim Umgang mit Lösungen von TFA. Wechseln Sie die Handschuhe sofort, wenn sie kommen in Kontakt mit TFA, und sofort Verschüttetes.
8. Repräsentative Ergebnisse:
Dieser Abschnitt beschreibt die Synthese, Charakterisierung und Reinigung einer Sequenz-spezifischen 36-mer Peptoid Kette, faltet sich zu einer hoch geordneten nanosheet 3 (Abb. 1).
Der Block-charge Peptoid H-[Nae-NPE] 9 - [NCE-NPE] 9-NH 2 wurde auf 100 mg Rink-Amid-Harz synthetisiert. A 2 M Amin-Lösung wurde für alle Verdrängungsreaktionen, das für 60 Minuten Rückstand 1-18 und 120 Minuten für Rückstände 19-36 durchgeführt wurden verwendet. t-Butyl Beta-Alanin HCl wurde die freie Base (siehe Diskussion) umgewandelt, während phenethylamine und Boc-Ethylendiamin wurden beide verwendet directly. Das Harz wurde mit 95% TFA, 2,5% triispropylsilane, 2,5% Wasser für 2 Stunden gespalten. TFA wurde eingedampft und der erhaltene viskose Öl (~ 180 mg) wurde in 6 ml Acetonitril wieder gelöst: Wasser 1:1 (v / v). Produktreinheit (Abb. 4) und die Präsenz des Produktes Masse wurde von der analytischen RP-HPLC (30-80% Acetonitril in Wasser-Gradienten, die beide mit 0,1% (v / v) TFA, mit 1 ml / min über 30 Minuten bestätigt bei 60 ° C mit einem C18, 5 um, 50 X 2 mm Spalte) und MALDI (Abb. 5).
Reinigung mit Umkehrphasen-HPLC auf einer Vydac C18-Säule (10 mu m, 22 mm x 250 mm) ging, mit einem Gradienten von 30-60% Acetonitril in Wasser mit 0,1% TFA über 60 Minuten bei 10 mL / min. Die Säule wurde mit 60 mg Rohprodukt für jeden chromatographischen Lauf geladen. Die gereinigten Fraktionen wurden basierend auf Reinheit der analytischen RP-HPLC (Abb. 4) vereinigt und lyophilisiert, um ~ 80 mg eines flauschigen weißen Pulver.
Gereinigtes Block-charge Peptoid molekularenGewicht wurde durch MALDI bestätigt. 1 ul 100 uM gereinigt Peptoid in Acetonitril: Wasser 1:1 (v / v) wurde mit 1 ul der Matrix (5 mg / ml α-cyano-4-Hydroxy-Säure in Acetonitril gemischt: Wasser 1:1 v / v und 0,1% TFA) und 1 ul war auf der MALDI Platte entdeckt. Nachdem die Probe an der Luft getrocknet, war es in der Applied Biosystem / MDS SCIEX 4800 MALDI TOF / TOF Analyzer platziert. Die Erfassung und Verarbeitung Modi wurden linear mit geringer Masse. Der errechnete Gewicht wurde in der gezielten Masse eingegeben werden, um automatisch die Verzögerungszeit anpassen. Die Laserintensität wurde bis 3400 eingestellt. Die beobachtete Masse, 4981,2, Streichhölzer eng mit der berechneten Masse von 4981,74.
Das lyophilisierte gereinigt Pulver wurde in DMSO gelöst, um eine 2 mM Stammlösung, die bei 4 gespeichert werden können ° C machen Blätter wurden von der vorstehenden Vorschrift hergestellt und abgebildet mit der Fluoreszenz-Mikroskopie und SEM (Abb. 2 und 3). Eine Vielzahl von Formen mit Strukturgrößen von bis zu 300 pm beobachtet werden, und notably, sind gerade Kanten im Vordergrund.
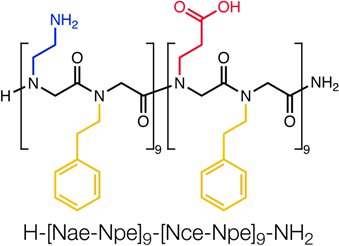
Abbildung 1 Ablauf der Block-charge Peptoid H-[Nae-NPE] 9 -. [NCE-NPE] 9-NH 2. A single-chain-, Block verantwortlich, amphiphile polypeptoid 36-mer selbst montiert in höchst geordnete, zweidimensionale Nanoschichten 3. Die berechneten Molekulargewicht 4981,74.

Abbildung 2. Fluoreszenzmikroskopaufnahme Peptoid Nanoschichten. Blätter wurden von einem 20 uM Peptoid Lösung in 10 mM Tris, 100 mM NaCl, pH 8,0 gebildet. Die Platten wurden auf Agarose mit 1 &mgr; Nile Red abgebildet. Scale-Bars sind 100 um.

Abbildung 3. Rasterelektronenmikroskopie Bildervon Peptoid Nanoschichten. Blätter wurden von einem 20 uM Peptoid Lösung in 10 mM Tris, 100 mM NaCl, pH 8,0 gebildet. Scale-Bars sind 5 um.

Abbildung 4: Analytische RP-HPLC Spur von H-[Nae-NPE] 9 -. [NCE-NPE] 9-NH 2. Das rohe und gereinigte analytischen HPLC-Spur (30-80% Steigung mit 1 ml / min über 30 Minuten bei 60 ° C mit einem C18, 5 um, 50 x 2 mm Spalte) des rohen und gereinigten Block-charge Peptoid H-[ Nae-NPE] 9 - [NCE-NPE] 9-NH 2 dargestellt.
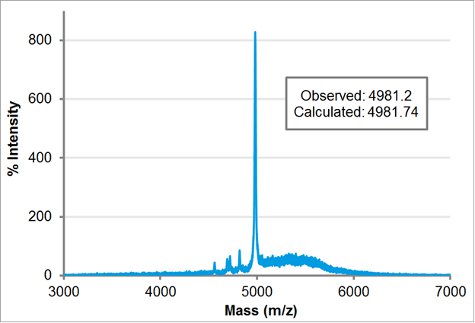
Abbildung 5 MALDI-TOF Massenspektroskopie Spur von H-[Nae-NPE] 9 -. [NCE-NPE] 9-NH 2. Die beobachtete Masse, 4981,2, wird in enger Abstimmung auf die berechnete Masse 4981,74.
Diskussion
Anwendungen und Bedeutung
Dieses Protokoll beschreibt eine einfache und effiziente Methode zur Synthese Peptoid und die wässrige self-assembly der Peptoide in Nanoschichten. Die meisten Labors sind leicht synthetisieren können Peptoide weil kostengünstige Materialien, grundlegendes Know-how und unkompliziert Techniken 4 sind eingesetzt. Auch die Selbstorganisation von ultra-dünnen, hoch geordneten Nanoschichten erfordert lediglich wiederholt Kippen ein Fläschchen einer verdünnten wässrigen Peptoid Lösung 2. Peptoide sind vielversprechende Materialien für biomedizinische und Nanowissenschaft, weil sie robust und synthetisch flexible und dennoch Sequenz-spezifische und gut einstellbare 5 sind. Peptoide haben biologische Aktivität (Therapeutika 6,7, Diagnose 8, intrazelluläre Abgabe 9-10) und Falten in hierarchische Nanostrukturen 3, 11-14 gezeigt. Aufgrund ihrer modularen Synthese, kombinatorische Peptoid librWidder 15-19 können leicht hergestellt werden und gesiebt für eine breite Reihe von Aktivitäten oder Eigenschaften. Insbesondere dienen die Nanoschichten als mögliche Plattform für zweidimensionale Darstellung Gerüste, Membran-Mimetika, biologische Sensoren, Protein-Mimetika und Bauteilen. Mit der praktisch unerschöpflich verschiedenen Sequenzen möglich ist, wird das Reich der Peptoid Forschung schnell expandiert.
Variablen in fester Phase Submonomer Synthese von polypeptoids
Aufgrund der Fähigkeit, von einem unglaublich großen und vielfältigen Alphabet der Monomere 20 Wählen Sie muss die Submonomer Methode gelegentlichen Modifikationen für Fälle, in denen die Erhöhung der Kopplungseffizienz jedem Schritt das gesamte Produkt-Ausbeute zu verbessern. Der Einbau von ungeschützten heterocyclischen Seitenketten erfordert die Verwendung von Chloressigsäure statt Bromessigsäure 21. Erweiterte Verschiebung und höhereAmin-Konzentrationen sind in der Regel nach etwa 20 Kupplungen für lange Peptoid Sequenzen oder weniger nucleophile Amine. Heizung Reaktionsgefäß auf 35 ° C, mit einem Wasser-ummanteltes Reaktionsgefäß, hilft, die Reaktion zu fahren. Für hoch-flüchtige Amine wie Isopropylamin, muss darauf geachtet werden, um Verdunstung zu vermeiden.
Amine in Form einer HCl-Salz, wie t-Butyl-Beta-Alanin HCl, müssen frei-basierte, bevor sie in die Verschiebung Reaktion eingeführt. Dies kann durch Lösen oder Suspendieren des Amins in DCM (~ 5g amine/25 mL DCM), und Neutralisierung mit einer äquimolaren Lösung von Natronlauge in einen Scheidetrichter erreicht werden. Die DCM Schicht wird gesammelt und die wässrige Schicht ist mit zusätzlichen DCM gewaschen. Die kombinierte DCM-Schichten werden über Natriumsulfat getrocknet und filtriert in einen vorher gewogenen Rundkolben. Entfernen von Rotationsverdampfung Lösungsmittel, um ein Öl ergeben, und notieren Sie das Produkt Gewicht.
During der Spaltung Schritt TFA-Spaltung Cocktail und Spaltung ist abhängig von der Anzahl und Vielfalt der Schutzgruppen verwendet. Richtlinien für die Spaltung Cocktails sind ähnlich zu traditionellen Peptid Entschützung Spaltungen 1. Im Allgemeinen sind 10 Minuten Inkubation bei Sequenzen ohne Schutzgruppen oder Sequenzen mit wenigen sehr säurelabile Schutzgruppen (z. B. BOC, Trityl) erforderlich. Zwei Stunden Inkubationen für Sequenzen mit schwieriger Schutzgruppen (zB t-Butyl-Ester, Mtr, Pbf) oder Sequenzen mit vielen Schutzgruppen empfohlen, sich Entschützung jeder Kette gewährleisten. Crude Peptoid Produkte werden in der Regel in Acetonitril lösen: Wasser 1:1 (v / v), aber höher Acetonitril Proportionen sind häufig mit Seitenketten mit einem insgesamt hohen Hydrophobizität.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Byoung-Chul Lee, Philip Choi und Samuel Ho für wertvolle Unterstützung danken. Diese Arbeit wurde bei der Molecular Foundry am Lawrence Berkeley National Laboratory, die durch das Office of Science, Office of Basic Energy Sciences unterstützt wird durchgeführt, der US-Department of Energy unter Vertrag Nr. DE-AC02-05CH11231 und die Defense Threat Reduction Agentur unter Vertrag Nr.: IACRO-B0845281.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Dimethylformamid | EMD | EM-DX1726P-1 | 99 +% |
| N-Methylpyrrolidinon | BDH | BDH1141-4LP | 99% |
| Bromessigsäure | Acros Organics | 200000-106 | 99% |
| 4-Methylpiperidine | Sigma Aldrich | M73206 | 96% |
| N, N'-Diisopropylcarbodiimid | Chem-Impex | 001100 | 99,5% |
| Dichlormethan | EMD | EMD-DX0835 | ACS-Qualität |
| Acetonitril | EMD | EM-AX0145P-1 | 99,8% |
| Trifluoressigsäure | Sigma Aldrich | T6508 | 99% |
| Triisopropylsilan | Sigma Aldrich | 233781 -10G | Für TFA-Spaltung |
| 1,2-Dichlorethan | JT Baker | JTH076-33 | Für Silikonisierung von Glas-Reaktionsgefäße |
| Phenethylamine | Sigma Aldrich | 407267-100ML | > 99,5% Hydrophobe Seitenketten-Amin |
| Boc-Ethylendiamin | CNH Technologies | C-1112 | Kationische Seitenketten-Amin |
| t-Butyl Beta-Alanin HCl | Chem-Impex International | 04407 | Anionische Seitenketten-Amin |
| α-Cyano-4-Hydroxy-Säure | Sigma Aldrich | C8982-10X10MG | Für MALDI-Matrix |
| Nile Red | Sigma Aldrich | 19123-10MG | Für Fluoreszenz-Imaging |
| Dichlordimethylsilan | Sigma Aldrich | 80430-500G-F | Für Silikonisierung von Glas-Reaktionsgefäße |
| Einweg PP Fritte WarenkorbGrat | Applied Separations | 2416 | 6 mL Polypropylen-Kassette mit 20 mm PE Fritte |
| Einweg-3-Wege-Luer-Adapter | Cole Parmer | 31200-80 | Hahn für Einweg manuelle Synthese Reaktionsgefäß |
| Luer-Lock-Ring | Cole Parmer | 45503-19 | ¼ "-Anschluss für Einweg manuellen Synthese Reaktionsgefäß |
| Fittings Luer | Cole Parmer | 45500-20 | ¼ "-Anschluss für Einweg manuellen Synthese Reaktionsgefäß |
| Einweg PP Pipetten | VWR | 16001-194 | Für TFA Transfers |
| Luer-Lock-Kunststoff-Spritze | National Scientific | S7515-5 | 6 ml-Spritzen |
| 1 Dram Glasfläschchen | VWR | 66011-041 | Mit Phenol-Schraubkappe mit Polyvinyl-faced Zellstoff-Liner geformt |
| 20 mL SCINDestillation Fläschchen | VWR | 66022-060 | Mit angebautem PP Kappe und Zellstoff Folieneinlage |
| Secure-Seal Klebstoff spacer | Invitrogen | S-24736 | Für Fluoreszenz-Imaging |
| Glasträger | Electron Microscopy Sciences | 63411 | Für Fluoreszenz-Imaging |
| Deckglas | VWR | 48366-067 | Für Fluoreszenz-Imaging |
| 4 "Silicon Wafer | Ted Pella | 16007 | Pre-Würfel in 5x7 mm-Chips |
| 0,45-Filter | VWR, Acrodisc | 28143-924 | Für die HPLC. PTFE-Membran |
| Agarose | BD | 212272 | Für Fluoreszenz-Imaging |
| SPE Vakuum Manifold | Sigma Aldrich | 57044 | Beispiel SPE Vakuumkammer |
| Glasfritte Schiff | Ace Glas | 6402-12 | Porosität CFritte |
| Plasma Cleaner / Sterilisator | Harrick Plasma | PDC-32G | Beispiel Plasma-Reiniger, um Silizium-Chips für SEM vorbereiten |
Referenzen
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Pro. Res. 36, 255-266 (1990).
- Sanii, B., Kudirka, R., Cho, A., Venkateswaran, N., Oliver, G. K., Olson, A. M., Tran, H., Harada, R. M., Tan, L., Zuckermann, R. N. Shaken, not stirred: Collapsing a peptoid monolayer to produce free-floating, stable nanosheets. J. Am. Chem. Soc. , (2011).
- Kudirka, R., Tran, H., Sanii, B., Nam, K. T., Choi, P. H., Venkateswaran, N., Chen, R., Whitelam, S., Zuckermann, R. N. Folding of a single-chain, information-rich polypeptoid sequence into a highly-ordered nanosheet. Bioploymers: Peptide Science. 96, 586-595 (2011).
- Utku, Y., Rohatgi, A., Yoo, B., Zuckermann, R., Pohl, N., Kirshenbaum, K. Rapid multistep synthesis of a bioactive peptidomimetic oligomer for the undergraduate laboratory. J. Chem. Ed. 87, 637-639 (2010).
- Fowler, S. A., Blackwell, H. E. Structure-function relationships in peptoids: Recent advances toward deciphering the structural requirements for biological function. Org. Biomol. Chem. 7, 1508-1524 (2009).
- Zuckermann, R. N., Kodadek, T. Peptoids as potential therapeutics. Curr. Op. Mol. Ther. 11, 299-307 (2009).
- Chongsiriwatana, N. P., Patch, J. A., Czyzewski, A. M., Dohm, M. T., Ivankin, A., Gidalevitz, D., Zuckermann, R. N., Barron, A. E. Peptoids that mimic the structure, function and mechanism of helical antimicrobial peptides. , 105-2794 (2008).
- Yam, A. Y., Wang, X., Gao, C., Connolly, M. D., Zuckermann, R. N., Bleua, T., Halla, J., Fedynyshyn, J., Allauzen, S., Peretz, D., Salisbury, C. M. A Universal method for detection of amyloidogenic misfolded proteins. Biochem. 50, 4322-4329 (2011).
- Huang, C. -Y., Uno, T., Murphy, J. E., Lee, S., Hamer, J. D., Escobedo, J. A., Cohen, F. E., Radhakrishnan, R., Dwarki, V., Zuckermann, R. N. Lipitoids - novel cationic lipids for cellular delivery of plasmid DNA in vitro. Chem. Biol. 5, 345-354 (1998).
- Schroeder, T., Niemeier, N., Afonin, S., Ulrich, A. S., Krug, H. F., Bräse, S. Peptoidic amino- and guanidinium-carrier systems: Targeted drug delivery into the cell cytosol or the nucleus. J. Med. Chem. 51, 376-379 (2008).
- Murnen, H. K., Rosales, A. M., Jaworski, J. N., Segalman, R. A., Zuckermann, R. N. Hierarchical self-assembly of a biomimetic diblock copolypeptoid into homochiral super helices. J. Am. Chem. Soc. 132, 16112-16119 (2010).
- Nam, K. T., Shelby, S. A., Marciel, A. B., Choi, P. H., Chen, R., Tan, L., Chu, T. K. Free-floating ultra-thin two-dimensional crystals from sequence-specific peptoid polymers. Nature. Mater. 9, 454-460 (2010).
- Burkoth, T. S., Beausoleil, E., Kaur, S., Tang, D., Cohen, F. E., Zuckermann, R. N. Toward the synthesis of artificial proteins: The Discovery of an amphiphilic helical peptoid assembly. Chemistry & Biology. 9, 647-654 (2002).
- Murphy, J. E., Uno, T., Hamer, J. D., Cohen, F. E., Dwarki, V., Zuckermann, R. N. A Combinatorial approach to the discovery of efficient cationic peptoid reagents for gene delivery. Proc. Natl. Acad. Sci. U. S. A. 95, 1517-1522 (1998).
- Mora, P. uig, Masip, I. sabel, Cortés, N. uria, Marquina, R. egina, Merino, R. amón, Merino, J. esús, Carbonell, T. eresa, Mingarro, I. smael, Messeguer, A. ngel, Pérez-Payá, E. nrique Identification from a positional scanning peptoid library of in vivo active compounds that neutralize bacterial endotoxins. J. Med. Chem. 48, 1265-1268 (2005).
- Zuckermann, R. N. Discovery of nanomolar ligands for 7-transmembrane G-protein coupled receptors from a diverse (N-substituted)glycine peptoid Library. J. Med. Chem. 37, 2678-2685 (1994).
- Alluri, P., Liu, B., Yu, P., Xiao, X., Kodadek, T. Isolation and characterization of coactivator-binding peptoids from a combinatorial library. Moleular Biosystems. 2, 568-579 (2006).
- Figliozzi, G. M., Goldsmith, R., Ng, S., Banville, S. C., Zuckermann, R. N. Synthesis of N-(substituted)glycine peptoid libraries. Methods Enzymol. 267, 437-447 (1996).
- Culf, A. S., Ouellette, R. J. Solid-phase synthesis of N-substituted glycine oligomers (α peptoids) and derivatives. Molecules. 15, 5282-5335 (2010).
- Burkoth, T. S., Fafarman, A. T., Charych, D. H., Connolly, M. D., Zuckermann, R. N. Incorporation of unprotected heterocyclic side chains into peptoid oligomers via solid-phase submonomer synthesis. J. Am. Chem. Soc. 125, 8841-8845 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten