Method Article
Überwachung Cleaved Caspase-3 Aktivität und Apoptose von Immortalized Oligodendrozyten mit Live-cell Imaging und Cleaveable Fluorogenic-Farbstoff-Substrate Nach Kalium-induzierten Membrandepolarisation
In diesem Artikel
Zusammenfassung
Live-Cell-Imaging von Caspase-3-vermittelte Apoptose in verewigt N19-Oligodendrozyten-Zellkulturen unter Verwendung des NucView 488 Caspase-3-Substrat. Diese Technik ist für den programmierten Zelltod-Assays in Echtzeit in einer Vielzahl von Zelltypen und Geweben.
Zusammenfassung
Das zentrale Nervensystem erleben können eine Reihe von Belastungen und neurologischen Beleidigungen, die zahlreiche negative Auswirkungen, die letztendlich zu einer Verringerung der neuronalen Population und Funktion führen haben kann. Verletzte Axone Freisetzung erregenden Moleküle wie Kalium-oder Glutamat in die extrazelluläre Matrix, die wiederum weitere Beleidigung und Verletzung der Unterstützung Gliazellen einschließlich Astrozyten und Oligodendrozyten 8, 16 produzieren kann. Wenn die Beleidigung besteht, werden die Zellen durchlaufen den programmierten Zelltod (Apoptose), die geregelt und wird durch eine Reihe von etablierten Signaltransduktionskaskaden 14 aktiviert. Apoptose und Nekrose Gewebe kann nach Schädel-Hirn-Verletzungen, zerebrale Ischämie und Krampfanfälle auftreten. Ein klassisches Beispiel für apoptotische Regulation ist die Familie der Cystein-abhängige Aspartat-Proteasen gerichtet, oder Caspasen. Aktivierte Proteasen einschließlich Caspasen wurden auch in den Zelltod als Reaktion auf chronische neuro verwickeltdegenerative Krankheiten wie Alzheimer, Huntington und Multiple-Sklerose-4, 14, 3, 11, 7.
In diesem Protokoll beschreiben wir die Verwendung des NucView 488 Caspase-3-Substrat, um die Rate der Caspase-3-vermittelte Apoptose in verewigt N19-Oligodendrozyten (OLG) Zellkulturen 15, 5 zu messen, nach Exposition mit verschiedenen extrazellulären Belastungen wie hohe Konzentrationen von Kalium-oder Glutamat. Das bedingt, verewigt N19-OLG-Zelllinie (als Vertreter der O2A Vorläuferzellen) wurde von Dr. Anthony Campagnoni (UCLA Semel Institute for Neuroscience) 15, 5 erhalten und wurde bereits verwendet, um molekulare Mechanismen der Myelin-Genexpression und Signaltransduktion führenden Studie zu OLG Differenzierung (z. B. 6, 10). Wir haben diese Zelllinie gefunden werden im Hinblick auf die Transfektion mit exogenen Myelin basisches Protein (MBP) robust konstruiert fusioniert entweder RFP oder GFP (rot oder grün fluoreszierendes Protein) 13,12. Hier wurden die N19-OLG Zellkulturen entweder mit 80 mM Kaliumchlorid oder 100 mM Natrium-Glutamat zu axonalen Leckage in der extrazellulären Matrix zu imitieren, um Apoptose zu induzieren 9 behandelt. Wir verwendeten eine bi-funktionale Caspase-3-Substrat mit einer DEVD (Asp-Glu-Val-Asp) Caspase-3 Anerkennung Untereinheit und einer DNA-bindenden Farbstoff 2. Der Untergrund schnell geht das Zytoplasma, wo sie von intrazellulären Caspase-3 gespalten wird. Der Farbstoff, NucView 488 ist freigegeben und gelangt in den Zellkern, wo sie DNA und fluoresziert grün bindet bei 488 nm, Apoptose zu signalisieren. Die Nutzung der NucView 488 Caspase-3-Substrat ermöglicht live-cell imaging in real-time 1, 10. In diesem Video beschreiben wir auch die Kultivierung und Transfektion von immortalisierten N19-OLG-Zellen, sowie Live-Cell-Imaging-Techniken.
Protokoll
1. Auftauen und Kultivieren von Zellen
- Erhalten Lager von gefrorenem verewigt N19-Oligodendrozyten aus langfristigen flüssigem Stickstoff speichert.
- Tauchen Fläschchen mit Zellen bei 37 ° C Wasserbad, bis die Zellsuspension vollständig aufgetaut.
- 7 ml DMEM (Dulbecco modifiziertes Eagle-Medium) mit High-Glucose mit 10% FBS (Fetal Bovine Serum) und 1% Penicillin / Streptomycin zu einer 10 cm Kulturschale ergänzt.
- Fügen Sie die Zell-Suspension auf die Platte tropfenweise, und vorsichtig geschwenkt und Rock der Petrischale, um die Zellen gleichmäßig zu verteilen.
- Kultur-Zellen bei 34 ° C / 5% CO 2-Inkubator.
- Nach 4 Stunden absaugen Medien aus Platten, um alle verbleibenden DMSO (Dimethylsulfoxid), das als Frostschutzmittel verwendet worden zu entfernen, und ersetzen Sie sie durch frische Medien (7 ml DMEM High-glucose Medien ergänzt mit 10% FBS und 1% Penicillin / Streptomycin) .
2. Die Passage Cells
- Bei 70-80%Zusammenfluss (4-7 Tage Wachstum), absaugen Medien von Zellen.
- 1 ml 0,25% Trypsin-to-Plate. Pipette Trypsin zu lösen Zellen (ca. 5 Minuten).
- Nehmen Sie die entsprechenden Verdünnungen für experimentellen Bedingungen und Passage eine zusätzliche 10 cm Teller für zukünftige Experimente mit einer Zelldichte nicht weniger als 0,1 x 10 6 Zellen / ml.
Hinweis: Sie sollten Durchgang Ihre Zellen mindestens zweimal nach dem Auftauen, bevor Sie sie für Experimente.
3. Zählen und Plating Cells
- Um Platte Zellen für live-cell imaging, trypsinize wie zuvor beschrieben.
- Entfernen Sie ca. 30 ul der Zellen und zählen mit einem Hämocytometer.
- Legen Sie eine unbeschichtete Deckglas in einer 6-Well-Platte. Hinzufügen von Zellen, die auch bei einer Dichte von 0,1 x 10 6 Zellen / ml in 2 ml Phenol-freiem DMEM High-glucose Medien, mit 10% FBS und 1% Penicillin / Streptomycin bei 34 ° C / 5% CO 2 ergänzt.
- ErlaubenZellen wachsen über Nacht (16-20 h) bei 34 ° C / 5% CO 2 vor der Transfektion.
4. Transfektion
- Kombinieren Sie 100 ul Serum-freien Medien, 0,5-4 pg gereinigte Plasmid-DNA, und 4 ul FuGENE HD (Roche). Vortex vorsichtig mischen.
- Vortex noch einmal kurz und lassen Sie die DNA zu komplex für 5 min bei Raumtemperatur, und fügen Sie dann FuGENE HD DNA-Gemisch direkt in den kultivierten Zellen. Kippen Sie die Platte vorsichtig mischen.
- Kultur der Zellen für weitere 48 h bei 34 ° C / 5% CO 2 vor der Behandlung oder Experimentieren.
5. Vorbereitung Cells für Live-Cell Imaging (LCI)
- Schalten Sie die LCI Chamlide Live-cell Instrument Schaltkasten mindestens 1 h, bevor Sie zu Ihrem Experiment starten wollen. Der Schaltkasten regelt auch die Temperatur und Luftfeuchtigkeit innerhalb des LCI Chamlide und reguliert den Fluss des vorgemischten 5% CO 2.
Hinweis: Es ist ratsam,Schalten Sie das Kontrollkästchen bis zu 3 h vor Beginn der Experimente, um sicherzustellen, dass die gesamte Stufe 34 ° C erreicht Dieser Schritt reduziert Schwerpunkt Drift, die durch fluxulation und die thermische Ausdehnung des Metalls der Bühne verursacht wird, wie es wärmt, während der Bildgebung.
- Die Arbeit in einem Flow-Haube, sprühen Chamlide magnetisch-Type Culture Kammer und Pinzette, mit 70% Ethanol und ihnen erlauben, für 5 Minuten trocknen lassen.
- Entfernen Zellen aus Inkubator und bestätigen, dass sie gesund sind. Sie sollten erscheinen Anhänger und auf dem Deckglas mit zahlreichen Membranverfahren gut verteilt. Zellen, die aus der Transfektion betont werden, sind nicht geeignet für Experimente und eine reduzierte Anzahl von Prozess-Erweiterungen haben, und haben oft eine unregelmäßig geformte Kern.
- Neigen Sie den 6-Well-Platte und entfernen Sie das Deckglas mit einer Pinzette. Raschen Platzierung der Deckglas-Zelle nach oben in die Bodenplatte der Kultur Kammer. Nicht in das Deckglas, um zu trocknen.
- Befestigen Sie den Magnetstreifen wichtigstenKörper der Kultur Kammer und fügen 500 ul der Medien von der ursprünglichen 6-Well-Platte auf der Oberseite des Deckglases. Re-using dieses Medium verringert die Menge der Stress auf die Zellen, die durch Veränderungen der Umwelt verursacht gelegt, und kann auch nützlich sein für die Beurteilung der extrazellulären sekretierten Faktoren.
- Setzen Sie die Glasabdeckung auf die Kultur Kammer.
- Verwenden Sie ein Kimwipe mit 70% Ethanol besprüht, um restliche Material von der Unterseite des Deckglases zu entfernen, die sich mit Mikroskopie stören würde.
- Legen Sie die Kultur Kammer in der 34 ° C / 5% CO 2-Inkubator für 30 min. Dieser Schritt stellt sicher, dass die Kammer selbst zu 34 ° C erwärmt zu reduzieren Verschiebung des Deckglases als das Metall erwärmt.
6. Mikroskop-Einstellungen
Die Bilder wurden hier mit einem Leica DMIRE2 inversen Mikroskop mit einer benutzerdefinierten Relais-Linse und Emission Filterrad Gehäuse für Kartusche Laden von mehreren Rädern (Quorum Technologies Inc., G erworbenuelph, ON).
- Hellfeld - Lampe bis 2,5 V und Belichtungszeit auf 240 ms eingestellt.
- Red Fluorescent Protein (RFP) - Verstärkung bei 140 für 200 ms eingestellt.
- Green Fluorescent Protein (GFP) - Verstärkung bei 140 für 500 ms eingestellt.
- Unser Mikroskop hat eine dimmbare Lampe anstatt einer rotierenden Scheibe, um die Menge an Licht zur Verfügung, um Zellen zu steuern. Wir führen unsere Experimente mit dem Licht bei 90% der maximalen Intensität Lampe.
7. Behandlung der Zellen mit Apoptose-Induktoren und NucView 488 Caspase-3 Substrat
- Es ist wichtig, um große Bestände von Apoptose induzieren im Voraus vorbereiten und einfrieren in Portionen, so dass die Konzentrationen werden sich im Einklang zwischen den Experimenten.
- Die NucView 488 Substrat ist lichtempfindlich. Bereiten Aliquots von 15 ul auf Einfrieren / Auftauen, und speichern Röhrchen bei -20 ° C in Aluminiumfolie abgedeckt reduzieren. Die Arbeit mit der Umgebungsluft Raumbeleuchtung so gering wie möglich, um die Exposition der NucV reduziereniew 488 Substrat, Licht, vor dessen Verwendung.
- Rufen Sie die Kultur Kammer schnell aus dem Inkubator, so dass die Zellen nicht zu einer Verringerung der Temperatur ausgesetzt sind. Legen Sie die Kultur Kammer auf die Klimakammer des Mikroskops, und verwenden Sie Klammern, um die Kultur Kammer nicht bewegen kann. An dieser Stelle sollten Sie auch dim die Raumbeleuchtung.
- Schalten Sie die 5% vorgemischte CO 2-Tank mit zwei Regler.
- Mit dem 10fach Objektiv, Fokus auf Zellen, die auf dem Computer-Monitor mit Hellfeld-Mikroskopie finden. Hinweis: Sie möchten, um die größte numerische Apertur des Objektivs mit der gewünschten Vergrößerung zu verwenden, um die Belichtungszeit zu reduzieren.
- Deliver Induktoren der Apoptose der Zellen (in unserem Fall 80 mM Kalium oder 100 mM Glutamat), kann eine der folgenden Methoden verwendet werden. Wir werden Anlieferung von 80 mM Kalium als Beispiel nehmen, mit KCl als 10x-Konzentrat in unserem typischen Kulturmedien aufgelöst.
- Medien Austausch by langsam und lokale Perfusion:
- Verwenden Sie eine Schlauchpumpe zum Austausch von Medien in der Kultur Kammer mit den neuen Medien mit 80 mM Kalium.
- Ein Ende des Schlauches liefert 10 mL eines Bestandes von 80 mM Kalium in Phenol-freiem DMEM gelöst, und das andere Ende des Schlauchs wird Medien aus der Kammer entfernen.
- Sie wollen mindestens einen 10-fach Austausch von Medien, um sicherzustellen, dass die Medien in die Kammer verließ die richtige Konzentration von Kalium hat.
- Nach Medien ausgetauscht wird, fügen Sie 3 ul der NucView 488 Substrat für die Medien in der Kammer. Pipette zu mischen. - Direkte Zugabe von 80 mM K + und NucView 488 Substrat zu Medien in der Kultur Kammer:
- Bereiten Sie eine 10x Stammlösung von 80 mM Kalium in Phenol-freiem DMEM aufgelöst.
- Add 3 ul der NucView 488 Substrat 50 uL 10x 80 mM Kalium. Pipette zu mischen. In den 500 ul Phenol-freiem DMEM in Kultur Kammer.
Hinweis: Diese Methode istbevorzugt, wenn Sie Interesse an der Aufrechterhaltung oder der Beurteilung Wachstum oder andere Faktoren, die abgesondert werden in der Original-Datenträger können, sind. Wir haben festgestellt, dass die NucView 488 Substrat stabil ist in der Zellkultur für Experimente dauerhaft bis zu 36 h.
- Medien Austausch by langsam und lokale Perfusion:
8. Live-Cell Imaging
- Klicken Sie auf den roten Kanal zu transfizierten Zellen anzuzeigen.
- Wählen und speichern Sie etwa ein Dutzend Bilder, wo gibt es mehrere transfizierten Zellen, und speichern Sie diese "XY-Punkte". Je nach der Menge des Arbeitsspeichers, können Sie die Anzahl der Bühne Punkte, die Sie in der Lage sein zu erwerben ist begrenzt.
- Haben die Lupe nehmen Bilder (in Hellfeld-, Rot-Kanal und grünen Kanal) auf diese gespeicherten Etappe Punkte alle 6 Minuten.
- Jede grüne Färbung, die sichtbar ist während der frühen Stadien der Experimente zeigt wahrscheinlich Zellen, die bereits Gegenstand Apoptose aufgrund der Regel der Transfektion und / oder Umweltbelastungen. Apoptosis aufgrund der experimentellen Behandlungen werden zu einem späteren Zeitpunkt in das Experiment nachgewiesen werden.
9. Statistische Analyse
Für jedes Experiment, programmieren wir das Mikroskop, um mehrere XY-Punkte zu erwerben, um eine große Datenmenge effizient zu sammeln. Jedes Experiment ist in doppelter oder dreifacher Ausführung durchgeführt und die Daten werden aus verschiedenen Experimenten an verschiedenen Tagen durchgeführt zusammengestellt. Aus jedem Datensatz, analysieren wir bis zu 15 Felder anzeigen und vergleichen das Verhältnis von Caspase-negative Zellen Caspase-positive Zellen (Gesamtzahl der Zellen im Sichtfeld / Gesamtzahl der Caspase-positive Zellen).
- Die aufgezeichneten Messwerte von jedem Datensatz werden in einem größeren Sample-Set zusammengefasst und sind dann miteinander über eine ANOVA-Tabelle (p = 0,05). Wir zeigen die Standardfehler des Mittelwerts (SEM) von jedem Versuch, und vergleichen Sie die Differenz der Mittelwerte durch Ausführen eines Tukey bedeutet Vergleichstest (p = 0,05), um festzustellen, which Behandlungen unterscheiden sich deutlich voneinander.
10. Repräsentative Ergebnisse
Wir haben ein Experiment zu zeigen, wie die NucView 488 Substrat kann eine erhöhte Rate von Apoptose von N19-OLG-Zellkulturen nach einer Behandlung mit einer hohen extrazellulären Kaliumkonzentration zeigen beschrieben. Die N19-Zellen wurden mit RFP transfiziert und wurden entweder mit 3 ul NucView 488 Substrat (Kontrolle) oder 3 ul NucView 488 Substrat und 80 mM behandelt [K +] (Behandlung). Die Zellen wurden überwacht und die Bilder wurden über einen 12-Stunden-Kurs, der ausreichend für Studien mit neurologischen Beleidigungen (Abbildung 1A) erworben wird. In Kontrollbedingungen, haben wir nicht beobachten, erhebliche Mengen von Apoptose im Vergleich zu den 80 mM [K +] behandelten Kulturen (Hash-Kasten), die ca. 45% Zelltod nach 12 h (Abbildung 1B) zeigte. Der Hintergrund grünes Signal zu beobachtend in der Kontrollgruppe Bedingungen zeigt die Zellen, die Apoptose sind ohne die Zugabe von extrazellulärem Kalium. Praktisch keine der Zellen in der Kontrollgruppe Experiment weisen Apoptose durch den 12 h Zeitpunkt, obwohl in anderen Situationen die Experimente erforderlich sein, um mehr ausgeführt werden. Die Bilder wurden mit einem 10x-Objektiv. Bar = 100 um.
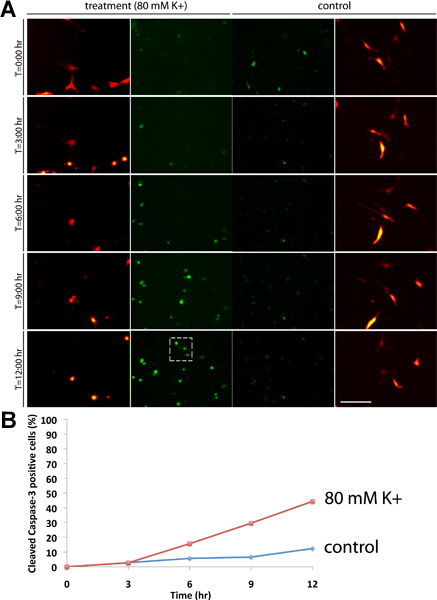

Abbildung 1. (A) A 12 h Zeitverlauf Experiment N19 OLG Kulturen 48 h nach der Transfektion Ausdruck RFP-MBP (roter Kanal) zusammen mit 3 ul der NucView 488 Substrat (grüner Kanal). Die Kulturen wurden entweder mit einer Endkonzentration von 80 mM behandelt [K +] (linkes Bild) oder keine Behandlung als Kontrolle (rechte Bilder). Die Bilder wurden bei 6 min Intervallen erfasst und deutliche Aktivierung von Caspase gespalten-3 (grün) kann beobachten,d in Kulturen mit 80 mM behandelt [K +] innerhalb der Zellkerne (Hash-Box) im Vergleich zur Kontrollgruppe zu experimentieren. (B) Anteil der gespaltenen Caspase-3-Zellen (berechnet durch Division der Gesamtzahl der Zellen in das Blickfeld von die Gesamtzahl der Caspase-positive Zellen). Im Vergleich zu Bedingungen zu kontrollieren, beobachten wir rund 45% Zelltod nach K +-Behandlung um 12 h.
SVideo 1. A 12 h Zeitverlauf Experiment N19-OLG Kulturen 48 h nach der Transfektion Ausdruck RFP-MBP (roter Kanal) mit 3 ul der NucView 488 Substrat (grüner Kanal), zusammen mit Hellfeld-Bilder und ein Drei-Wege- zusammengefügte Bild, nach Behandlung mit 80 mM [K +].
SVideo 2. A 12 h Zeitverlauf Experiment N19-OLG Kulturen 48 h nach der Transfektion Ausdruck RFP-MBP (roter Kanal) mit 3 ul der NucView 488 Substrat (grüner Kanal), zusammen mit Hellfeld-images und ein Drei-Wege-zusammengefügte Bild. Keine Behandlung war es, die Kulturen angelegt und N19-OLGs sehen die Migration durch das Mikroskop Bereich im Gegensatz zu Zellkulturen, die mit 80 mM behandelt werden [K +] (mit S-Video 1 zu vergleichen).
Diskussion
Obwohl dies nicht die einzige fluorogenen Produkt für die Apoptose-Erkennung gibt es mehrere signifikante Vorteile bei der Verwendung der NucView 488 Substrat. Einer der wichtigsten Vorteile ist die Fähigkeit, Apoptose in lebenden Zellen in Echtzeit zu verfolgen, während die meisten alternativen Produkten entweder Zelllyse benötigen oder haben schlechte Zellpermeabilität. Weitere Vorteile sind die hohe Empfindlichkeit für Caspase-3-Erkennung, hohe Zellpermeabilität, geringe Zytotoxizität und keine Interferenzen mit dem Fortschreiten der Apoptose. Der Untergrund hat auch geringe Hintergrundfluoreszenz, bis es gespalten und gelangt in den Zellkern, die Hintergrund-Fluoreszenz eliminiert. Die Caspase-3-Erkennungssequenz enthält 3 negative Ladungen und der DNA-bindenden Farbstoff hat eine positive Ladung 2. Die DEVD-NucView 488-Molekül hat also eine negative Ladung, welche die Aktivierung und Bindung des Farbstoffs verhindert, um DNA in Zellen, in denen Caspase ist nicht aktiv.
Maintaining Konsistenz zwischen den Experimenten ist erforderlich, um der Lage sein, sinnvolle Vergleiche zwischen den Wiederholungen zu ziehen. Einer der wichtigsten Parameter zu halten konsistent ist Zelldichte, als es die Rate der Transfektion beeinflusst. Die Realisierung hoher Transfektionsraten in verewigt N19-OLG Zellkulturen ist schwieriger als mit anderen gängigen Zelllinien wie HeLa-oder HEK293, und ist stark abhängig von Dichte, in unserer Erfahrung 12, 13. Unsere beste Transfektionseffizienz für diese Zellen mit Fugene HD (Roche) wurden erhalten und sind in der Regel etwa 15%, kann aber über 30% zu erreichen, je nach zu bauen. Sorgfältige Zellzählung wird in eine kohärente Transfektionsraten Hilfe. Es ist auch wichtig, um Zellen aus verschiedenen Behandlungen, um das gleiche Maß an Umwelt-Stress aussetzen, insbesondere bei der Messung Raten von Apoptose. Insbesondere sind die Länge der Zeit, über die die Zellen Transfektionsreagenzien, oder die Höhe der Belichtung ausgesetzt sind, wichtige ökologische VariablenAbles zu prüfen, und sollte konstant bleiben über Experimente. Für unsere Anwendungen haben wir festgestellt, dass die Sammlung einer großen Anzahl von Feldern-of-view bietet eine ausreichend große Stichprobe, um statistisch signifikante Vergleiche make [ebd.].
Offenlegungen
Die Autoren haben keine Interessenkonflikte offen zu legen.
Danksagungen
Dieses Labor wurde von der kanadischen Institutes of Health Research, dem Natural Sciences and Engineering Research Council in Kanada, und die Multiple Sclerosis Society of Kanada (MSSC) unterstützt. GSTS war der Empfänger einer Doctoral Studentship aus dem MSSC. Wir danken Dr. Joan Boggs (Hospital for Sick Children, Toronto) für viele hilfreiche Diskussionen und Kommentare zu diesem Manuskript. Wir sind dankbar, dass Biotium für ihre großzügige Geschenk von zusätzlichen NucView 488 Caspase-3.
Materialien
Tabelle der spezifischen Reagenzien und Geräte
| Name des Reagenz | Firma | Katalog-Nummer |
|---|---|---|
| NucView 488 Caspase-3 Assay Kit for Live Cells | Biotium | 30029 |
| FuGENE HD Transfektionsreagenz | Roche | 04709705001 |
| Dulbecco modifiziertes Eagle-Medium | Gibco | 31053-028 |
| 0,25% Trypsin | Gibco | 15050-065 |
| Fetal Bovine Serum | Gibco | 12483-020 |
| Penicillin / Streptomycin | Gibco | 15140122 |
| # 1,5-25 mm Deckglas | Warner Instruments | 64-0715 |
Chamlide CMB magnetische | Quorum Technologies | CM-B-40 |
| Cellstart Gewebekultur 10 cm Teller | VWR | 82050-576 |
| BD Falcon 6-Well-Platten | VWR | CA62406-161 |
Referenzen
- Antczak, C., Takagi, T., Ramirez, C. N., Radu, C., Djaballah, H. Live-cell imaging of caspase activation for high-content screening. J. Biomol. Screen. 14, 956-969 (2009).
- Cen, H., Mao, F., Aronchik, I., Fuentes, R. J., Firestone, G. L. DEVD-NucView488: a novel class of enzyme substrates for real-time detection of caspase-3 activity in live cells. FASEB. J. 22, 2243-2252 (2008).
- de Calignon, A., Fox, L. M., Pitstick, R., Carlson, G. A., Bacskai, B. J., Spires-Jones, T. L., Hyman, B. T. Caspase activation precedes and leads to tangles. Nature. 464, 1201-1204 (2010).
- Eldadah, B. A., Faden, A. I. Caspase pathways, neuronal apoptosis, and CNS injury. J. Neurotrauma. 17, 811-829 (2000).
- Foster, L. M., Phan, T., Verity, A. N., Bredesen, D., Campagnoni, A. T. Generation and analysis of normal and shiverer temperature-sensitive immortalized cell lines exhibiting phenotypic characteristics of oligodendrocytes at several stages of differentiation. Dev. Neurosci. 15, 100-109 (1993).
- Fulton, D., Paez, P. M., Fisher, R., Handley, V., Colwell, C. S., Campagnoni, A. T. Regulation of L-type Ca(++) currents and process morphology in white matter oligodendrocyte precursor cells by golli-myelin proteins. Glia. 58, 1292-1303 (2010).
- Hisahara, S., Okano, H., Miura, M. Caspase-mediated oligodendrocyte cell death in the pathogenesis of autoimmune demyelination. Neurosci. Res. 46, 387-397 (2003).
- Lau, A., Tymianski, M. Glutamate receptors, neurotoxicity and neurodegeneration. Pflugers. Arch. 460, 525-542 (2010).
- Lawrence, M. S., Ho, D. Y., Sun, G. H., Steinberg, G. K., Sapolsky, R. M. Overexpression of Bcl-2 with herpes simplex virus vectors protects CNS neurons against neurological insults in vitro and in vivo. J. Neurosci. 16, 486-496 (1996).
- Paez, P. M., Spreuer, V., Handley, V., Feng, J. M., Campagnoni, C., Campagnoni, A. T. Increased expression of golli myelin basic proteins enhances calcium influx into oligodendroglial cells. J. Neurosci. 27, 12690-12699 (2007).
- Sanchez Mejia, R. O., Friedlander, R. M. Caspases in Huntington's disease. Neuroscientist. 7, 480-489 (2001).
- Smith, G. S. T., De Avila, M., Paez, P., Spreuer, V., Wills, M. K. B., Jones, N., Boggs, J. M., Harauz, G. Proline substitutions and threonine pseudo-phosphorylation of the SH3-ligand of 18.5 kDa myelin basic protein decrease affinity for the Fyn-SH3-domain and alter process development and protein localization in oligodendrocytes. J. Neurosci. Res. , (2011).
- Smith, G. S. T., Paez, P. M., Spreuer, V., Campagnoni, C. W., Boggs, J. M., Campagnoni, A. T., Harauz, G. Classical 18.5-and 21.5-kDa isoforms of myelin basic protein inhibit calcium influx into oligodendroglial cells, in contrast to golli isoforms. J. Neurosci. Res. 89, 467-480 (2011).
- Springer, J. E., Azbill, R. D., Knapp, P. E. Activation of the caspase-3 apoptotic cascade in traumatic spinal cord injury. Nat. Med. 5, 943-946 (1999).
- Verity, A. N., Bredesen, D., Vonderscher, C., Handley, V. W., Campagnoni, A. T. Expression of myelin protein genes and other myelin components in an oligodendrocytic cell line conditionally immortalized with a temperature-sensitive retrovirus. J. Neurochem. 60, 577-587 (1993).
- Yu, S. P. Regulation and critical role of potassium homeostasis in apoptosis. Prog. Neurobiol. 70, 363-386 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten