Method Article
Surveillance clivées activité caspase-3 et l'apoptose des cellules immortalisées oligodendrocytaires utilisant imagerie des cellules vivantes et de Cleaveable fluorogénique-dye substrats suivants dépolarisation de la membrane de potassium induite par
Dans cet article
Résumé
Imagerie des cellules vivantes de l'apoptose médiée caspase-3 dans les cultures cellulaires immortalisée N19-oligodendrocyte utilisant le NucView 488 caspase-3 du substrat. Cette technique est applicable pour les essais de la mort cellulaire programmée en temps réel dans une variété de types de cellules et de tissus.
Résumé
Le système nerveux central peuvent éprouver un certain nombre de contraintes et les insultes neurologiques, qui peuvent avoir de nombreux effets indésirables qui aboutira à une réduction de la population neuronale et la fonction. Axones endommagés peuvent libérer des molécules excitatrices comme le potassium ou le glutamate dans la matrice extracellulaire, qui à son tour, peut produire d'autres insultes et les blessures aux cellules gliales de soutien, y compris astrocytes et oligodendrocytes 8, 16. Si l'insulte persiste, les cellules seront soumis à la mort cellulaire programmée (apoptose), qui est réglementée et activée par un certain nombre de bien établie cascades de transduction du signal 14. L'apoptose et une nécrose tissulaire peut survenir après une lésion cérébrale traumatique, ischémie cérébrale, et des convulsions. Un exemple classique de la régulation apoptotique est la famille de cystéine dépendante aspartate-dirigé protéases ou caspases. Protéases activées incluant les caspases ont également été impliqués dans la mort cellulaire en réponse à la neuro chroniquesmaladies dégénératives, y compris la maladie d'Alzheimer, de Huntington et la sclérose en plaques 4, 14, 3, 11, 7.
Dans ce protocole, nous décrivons l'utilisation de la NucView 488 caspase-3 substrat pour mesurer le taux d'apoptose caspase-3 dans la médiation immortalisé N19-oligodendrocytes cultures cellulaires (OLG) 15, 5, suite à une exposition à différents stress extracellulaires tels que des concentrations élevées de de potassium ou le glutamate. La lignée cellulaire immortalisée conditionnellement-N19-OLG (représentant l'ancêtre O2A) a été obtenu auprès du Dr. Anthony Campagnoni (UCLA Semel Institute for Neuroscience) 15, 5, et a déjà été utilisée pour étudier les mécanismes moléculaires de l'expression du gène de la myéline et transduction du signal conduisant OLG différenciation (par exemple, 6, 10). Nous avons trouvé cette lignée cellulaire pour être robuste à l'égard de transfection avec exogènes basique de la myéline des protéines (MBP) construit fusionnée à la GFP soit DP ou (rouge ou vert fluorescent protein) 13,12. Ici, les cultures de cellules N19-OLG ont été traités soit avec du chlorure de potassium 80 mM ou 100 mM glutamate de sodium pour imiter les fuites axonale dans la matrice extracellulaire pour induire l'apoptose 9. Nous avons utilisé un bi-fonctionnelle de la caspase-3 contenant un substrat DEVD (Asp-Glu-Val-Asp) caspase-3 sous-unités de reconnaissance et d'un colorant liaison à l'ADN 2. Le substrat pénètre rapidement dans le cytoplasme où elle est clivée par la caspase-3 intracellulaires. Le colorant, NucView 488 est libéré et entre dans le noyau de la cellule où il se lie d'ADN et une fluorescence verte à 488 nm, de signalisation apoptose. L'utilisation du NucView 488 caspase-3 substrat permet imagerie des cellules vivantes en temps réel 1, 10. Dans cette vidéo, nous avons également décrire la culture et la transfection de cellules immortalisées N19-OLG, ainsi que des techniques d'imagerie des cellules vivantes.
Protocole
1. La décongélation et la culture de cellules
- Obtenir des stocks de produits congelés immortalisé N19-oligodendrogliales cellules de long terme stocke l'azote liquide.
- Plongez flacon contenant des cellules à 37 ° C l'eau de bain jusqu'à la suspension cellulaire est complètement dégelée.
- Ajouter 7 ml de DMEM (Dulbecco Modified Eagle Medium) avec du glucose à haute complété 10% de FBS (sérum de veau fœtal) et 1% de pénicilline / streptomycine à une plaque de 10 cm de la culture.
- Ajouter la cellule en suspension goutte à goutte à la plaque, et agiter doucement et rock de la boîte de Pétri pour disperser les cellules uniformément.
- Cellules en culture à 34 ° C / 5% de CO 2 incubateur.
- Après 4 heures, les médias aspirer à partir de plaques de supprimer tout reste du DMSO (diméthylsulfoxyde) qui avait été utilisé comme un cryoprotecteur, et remplacer par du milieu frais (7 ml de DMEM haute-glucose milieux supplémentés avec 10% de FBS et 1% de pénicilline / streptomycine) .
2. Cellules repiquage
- A 70-80%confluent (4-7 jours de croissance), aspirer les médias à partir des cellules.
- Ajouter 1 mL de trypsine à 0,25% à l'assiette. Pipeter trypsine pour détacher les cellules (environ 5 minutes).
- Faire des dilutions appropriées aux conditions expérimentales et le passage une plaque à 10 cm supplémentaires pour de futures expériences à une densité cellulaire pas moins que les 0,1 x 10 6 cellules / ml.
Note: Vous devriez le passage de vos cellules au moins deux fois après la décongélation avant de les utiliser pour des expériences.
3. Comptage et Placage Cellules
- Pour cellules de la plaque d'imagerie des cellules vivantes, trypsiniser comme décrit précédemment.
- Retirez environ 30 ul de cellules et de compter en utilisant un hémocytomètre.
- Placer une lamelle de verre non couché dans une plaque à 6 puits. Ajouter des cellules à la même à une densité de 0,1 x 10 6 cellules / ml dans 2 ml de phénol DMEM sans grande glucose médias, supplémenté avec 10% de FBS et 1% de pénicilline / streptomycine, à 34 ° C / 5% de CO 2.
- Autorisercellules à croître durant la nuit (16-20 h) à 34 ° C / 5% de CO 2 avant la transfection.
4. La transfection
- Combinez 100 uL du milieu sans sérum, de 0,5-4 mg ADN plasmidique purifié, et 4 pl FuGENE HD (Roche). Vortex doucement pour mélanger.
- Vortex à nouveau brièvement et permettre à l'ADN de complexes pendant 5 min à température ambiante, puis ajouter le mélange de l'ADN FuGENE HD directement sur les cellules cultivées. Inclinez la plaque délicatement au mélange.
- Culture des cellules pour une période supplémentaire de 48 heures à 34 ° C / 5% de CO 2 avant le traitement ou l'expérimentation.
5. Cellules Préparation imagerie des cellules vivantes (LCI)
- Allumez le LCI Chamlide cellules vivantes boîte de contrôle d'instruments au moins 1 h avant de vous voulez commencer votre expérience. La boîte de contrôle régule également la température et l'humidité dans l'Chamlide LCI, et régule le débit de la pré-mélangé à 5% de CO 2.
Remarque: Il est conseillé deAllumez le boîtier de commande jusqu'à 3 h avant les expériences commencent à s'assurer que toute la scène atteint 34 ° C. Cette étape permettra de réduire la dérive focale, qui est causée par la dilatation thermique et de fluxulation de la scène métal comme il se réchauffe, lors de l'imagerie.
- Travailler dans un flux hotte, vaporiser la chambre de culture Chamlide magnétiques de type, et une pince à épiler, avec 70% d'éthanol et de les laisser sécher pendant 5 minutes.
- Retirer les cellules de l'incubateur et de confirmer qu'ils sont sains. Ils devraient apparaître adhérente et bien réparties sur la lamelle de verre avec de nombreux procédés membranaires. Les cellules qui sont stressés par la transfection sont pas adaptés à l'expérimentation, et aura un nombre réduit d'extensions processus, et ont souvent un noyau de forme irrégulière.
- Inclinez la plaque à 6 puits et enlever la lamelle avec des pincettes. Placer rapidement le côté pile lamelle jusqu'à dans la plaque de fond de la chambre de culture. Ne pas laisser la lamelle de sécher.
- Fixez le magnétique principalcorps de la chambre de culture et d'ajouter 500 ul des médias de l'original 6-même la plaque sur le dessus de la lamelle. Re-utilisation de ce média va diminuer la quantité de stress placé sur les cellules causés par les changements environnementaux, et peut également être utile pour évaluer les facteurs sécrétés extracellulaire.
- Placez le couvercle de verre sur la chambre de culture.
- Utilisez un Kimwipe pulvérisé avec de l'éthanol à 70% pour enlever toute matière résiduelle à partir du bas de la lamelle, qui nuirait à la microscopie.
- Placer la chambre de culture dans les 34 ° C / 5% de CO 2 incubateur pendant 30 min. Cette étape fera en sorte que la chambre se réchauffe à 34 ° C pour réduire le déplacement de la lamelle que le métal se réchauffe.
6. Réglages du microscope
Les images ont été acquises ici en utilisant un microscope inversé Leica DMIRE2 avec une lentille de relais personnalisés et des logements de roue filtre d'émission pour le chargement de la cartouche de roues multiples (Technologies Inc Quorum, Guelph, ON).
- Brightfield - Lampe fixé à 2,5 V et le temps d'exposition à 240 ms.
- Red Fluorescent Protein (RFP) - Gain fixé à 140 pour 200 ms.
- Green Fluorescent Protein (GFP) - Gain fixé à 140 pour 500 ms.
- Notre microscope est une lampe gradable plutôt que d'un disque rotatif pour contrôler la quantité de lumière disponible pour les cellules. Nous courons nos expériences avec la lumière à 90% de l'intensité maximale de la lampe.
7. Traitement des cellules avec inducteurs d'apoptose et de NucView 488 Caspase-3 substrat
- Il est important de préparer d'importants stocks d'inducteurs d'apoptose à l'avance et les congeler dans des aliquotes, de sorte que les concentrations seront compatibles entre les expériences.
- Le substrat est NucView 488 sensible à la lumière. Préparer des aliquotes de 15 uL de réduire les tubes de gel / dégel, et conserver à -20 ° C couvert de papier d'aluminium. Travailler avec l'éclairage ambiant de la pièce aussi bas que possible pour réduire l'exposition de la NucVIEW 488 substrat à la lumière, avant son utilisation.
- Récupérez la chambre de culture rapide de l'incubateur afin que les cellules ne sont pas exposés à une réduction de la température. Placer la chambre de culture sur la chambre de l'environnement du microscope, et utiliser des colliers pour maintenir la chambre de culture de se déplacer. A ce stade, vous devriez également tamiser les lumières ambiante.
- Allumez le 5% prémélangé CO 2 en cuve avec régulateur double.
- Utilisation de l'objectif 10x, mise au point de trouver des cellules sur le moniteur de l'ordinateur en utilisant la microscopie à champ lumineux. Remarque: vous voulez utiliser la plus grande ouverture numérique de l'objectif avec le grossissement désiré de réduire le temps d'exposition.
- Livrer des inducteurs de l'apoptose dans les cellules (dans notre cas, le potassium mM 80 ou 100 mM glutamate), l'une des méthodes suivantes peuvent être utilisées. Nous allons utiliser la livraison de 80 mM de potassium comme un exemple, en utilisant du KCl dissous sous forme de concentré 10x dans nos milieux de culture typique.
- Media Exchange bperfusion lente et locales y:
- Utiliser une pompe péristaltique pour échanger des médias dans la chambre de culture avec les nouveaux médias contenant 80 mM de potassium.
- Une extrémité du tube se livrer 10 mL d'un stock de 80 mM de potassium dissous dans du phénol DMEM sans, et l'autre extrémité du tuyau va supprimer les médias de la chambre.
- Tu veux au moins un échange de 10x des médias pour assurer que les médias restent dans la chambre a la bonne concentration de potassium.
- Après les médias sont échangées, ajouter 3 488 ul de substrat NucView aux médias dans la chambre. Pipette pour mélanger. - Outre directe de 80 mM de K + et 488 NucView substrat aux médias en chambre de culture:
- Préparer une solution mère 10x de 80 mM de potassium dissous dans du phénol DMEM sans.
- Ajouter 3 ul de substrat à 488 NucView 50 uL de 10x 80 de potassium mM. Pipette pour mélanger. Ajouter à 500 ul de phénol DMEM sans en chambre de culture.
Remarque: cette méthode estpréférée si vous êtes intéressé à maintenir ou à évaluer la croissance ou d'autres facteurs sécrétés qui peuvent être présents dans le support d'origine. Nous avons constaté que les 488 NucView substrat est stable en culture de cellules pour des expériences durables aussi longtemps que 36 h.
- Media Exchange bperfusion lente et locales y:
8. Imagerie des cellules vivantes
- Cliquez sur le canal rouge pour afficher les cellules transfectées.
- Sélectionnez et enregistrez autour d'une douzaine de cadres où il ya plusieurs cellules transfectées, et sauver ces «points XY". Selon la quantité de mémoire d'ordinateur, vous pouvez être limité au nombre de points d'étape que vous pourrez acquérir.
- Demandez aux capturer des images de microscope (en champ lumineux, le canal rouge, et le canal vert) lors de ces étapes enregistré des points de toutes les 6 minutes.
- Toute coloration verte qui est visible durant les premiers stades de l'expérimentation indique probablement les cellules qui sont déjà en cours de l'apoptose, en raison souvent à la transfection et / ou un stress environnemental. ApoptTSO dues aux traitements expérimentaux seront détectés à une date jalon plus tard dans l'expérience.
9. Analyse statistique
Pour chaque expérience, nous programmons le microscope pour acquérir des points XY multiples de rassembler un vaste ensemble de données de manière efficace. Chaque expérience est réalisée en double ou en triple, et les données sont compilées à partir des expériences distinctes effectuées à des jours différents. A partir de chaque ensemble de données, nous analysons jusqu'à 15 champs de vue et de comparer le ratio de la caspase-cellules négatives à la caspase-cellules positives (nombre total de cellules dans le champ de vue / nombre total de cellules positives pour la caspase-).
- Les mesures enregistrées par chaque ensemble de données sont regroupées dans un ensemble plus large échantillon, et sont ensuite comparés les uns aux autres en utilisant un tableau ANOVA (p = 0,05). Nous montrons l'erreur-type de la moyenne (SEM) de chaque expérience, puis de comparer la différence de moyens en effectuant un test de Tukey moyens de comparaison (p = 0,05) pour déterminer WHich traitements sont significativement différents les uns des autres.
10. Les résultats représentatifs
Nous avons décrit une expérience visant à illustrer comment le NucView 488 substrat peut indiquer une augmentation du taux d'apoptose des N19-OLG cultures de cellules suivant un traitement avec une concentration en potassium extracellulaire élevé. Le N19-cellules ont été transfectées avec DP, et ont été soit traités avec 3 pi NucView 488 substrat (contrôle), ou 3 488 uL NucView substrat et 80 mM de [K +] (le traitement). Les cellules ont été surveillés et les images ont été acquises sur un cours de 12 h de temps, ce qui est suffisant pour des études impliquant des insultes neurologiques (figure 1A). Dans des conditions de contrôle, nous n'avons pas observé d'importantes quantités de l'apoptose par rapport au 80 mm [K +] cultures traitées (boîte hachés), qui a montré environ 45% de mort cellulaire après 12 h (figure 1B). Le signal de fond vert d'observerD dans les conditions de contrôle indique les cellules qui sont en apoptose, sans l'ajout de potassium extracellulaire. Pratiquement aucune des cellules de l'apoptose présentent contrôle d'expérience par le point 12 de temps h, bien que dans d'autres situations les expériences peuvent être nécessaires pour fonctionner plus longtemps. Les images ont été acquises en utilisant un objectif 10x. Barre = 100 um.
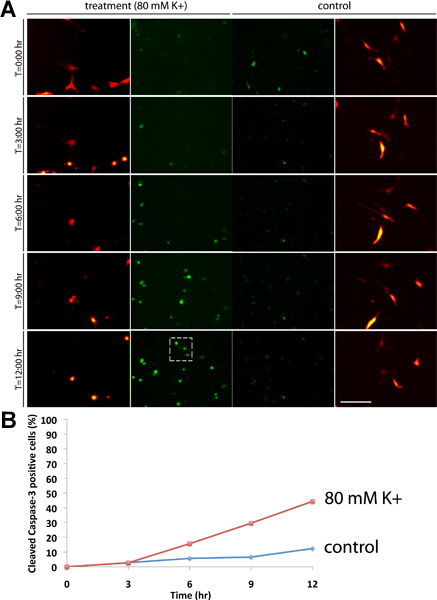

Figure 1. (A) A 12 h expérimentation bien sûr le temps des cultures N19 OLG 48 h post-transfection exprimant RFP-MBP (canal rouge), avec 3 488 ul de substrat NucView (canal vert). Les cultures ont été traitées soit avec une concentration finale de 80 mM de [K +] (panneaux de gauche), ou aucun traitement comme une commande (panneaux de droite). Les images ont été acquises à intervalles de 6 minutes, et l'activation significative de clivage caspase-3 (signal vert) peuvent être d'observerD dans les cultures traitées avec 80 mM de [K +] dans les noyaux des cellules (boîte hachés) par rapport à l'expérience de contrôle. (B) Pourcentage de la caspase-3 clivée cellules (calculé en divisant le nombre total de cellules dans le champ de vision en le nombre total de cellules positives pour la caspase-). En comparaison avec le contrôle des conditions, nous avons observé autour de la mort cellulaire de 45% suivants K +-traitement par 12 h.
SVidéo 1. Une expérience de 12 h cours du temps de N19-OLG cultures 48 h post-transfection exprimant RFP-MBP (canal rouge) avec 3 488 ul de substrat NucView (canal vert), avec champ lumineux des images et un moyen de trois image fusionnée, après un traitement avec 80 mM de [K +].
SVidéo 2. Une expérience de 12 h cours du temps de N19-OLG cultures 48 h post-transfection exprimant RFP-MBP (canal rouge) avec 3 488 ul de substrat NucView (canal vert), avec champ lumineux IMAGes et une image à trois voies ont fusionné. Aucun traitement n'a été appliqué à des cultures et N19-OLGs peut être vu migrer à travers le champ de microscope en contraste avec les cultures de cellules traitées avec 80 mM de [K +] (à comparer avec SVidéo 1).
Discussion
Même si ce n'est pas le seul produit disponible pour la détection fluorogénique apoptose, il ya plusieurs avantages significatifs à l'utilisation du substrat NucView 488. Un des principaux avantages est la possibilité de suivre l'apoptose dans les cellules vivantes en temps réel, alors que la plupart des produits de remplacement, soit exiger une lyse cellulaire ou la perméabilité des cellules pauvres. Les autres avantages comprennent une grande sensibilité pour la caspase-3 de reconnaissance, de la perméabilité cellulaire élevée, une faible cytotoxicité, et aucune interférence avec la progression de l'apoptose. Le substrat a également fluorescence de fond doux jusqu'à ce qu'il est clivé et pénètre dans le noyau, ce qui élimine la fluorescence de fond. La séquence de reconnaissance de caspase-3 contient trois charges négatives et le colorant de liaison d'ADN a une charge positive 2. Le DEVD-488 NucView molécule a donc une charge nette négative, ce qui empêche l'activation et la fixation de la teinture à l'ADN dans les cellules où la caspase n'est pas actif.
Mala cohérence entre les expériences intaining est nécessaire pour être en mesure d'établir des comparaisons significatives entre les répétitions. Un des principaux paramètres de garder constant est la densité cellulaire, car il influe sur le taux de transfection. Obtenir des taux de transfection élevé dans immortalisé N19-OLG cultures cellulaires est plus difficile que d'autres lignées cellulaires courantes telles que HeLa ou HEK 293, et est fortement dépendante de la densité, dans notre expérience de 12, 13. Nos meilleures efficacités de transfection de ces cellules ont été obtenus avec Fugene HD (Roche) et sont normalement d'environ 15%, mais peut atteindre plus de 30%, selon le construire. Le comptage des cellules permet de suivre l'aide à obtenir des taux de transfection cohérente. Il est également important d'exposer les cellules à partir des traitements différents pour le même degré de stress de l'environnement, en particulier lorsque l'on mesure les taux d'apoptose. Plus précisément, la longueur du temps pendant lequel les cellules sont exposées à des réactifs de transfection, ou le montant de l'exposition lumineuse, sont importantes sur l'environnement variablevariables à considérer, et devrait rester constante à travers des expériences. Pour nos applications, nous avons constaté que la collecte d'un grand nombre de champs de vue offre un échantillon de taille suffisamment grande pour faire des comparaisons statistiquement significative [ibid].
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêt à divulguer.
Remerciements
Ce laboratoire a été financée par les Instituts canadiens de recherche en santé, en sciences naturelles et en génie du Canada et la Société canadienne de la sclérose plaques (SCSP). GSTS a été le récipiendaire du doctorat une bourse d'études de la SCSP. Nous sommes reconnaissants envers le Dr Joan Boggs (Hospital for Sick Children, Toronto) pour de nombreuses discussions utiles et des commentaires sur ce manuscrit. Nous sommes reconnaissants à Biotium pour leur généreux don de 488 supplémentaires NucView caspase-3.
matériels
Table des réactifs spécifiques et des équipements
| Nom de réactif | Société | Numéro de catalogue |
|---|---|---|
| NucView 488 Kit Caspase-3 Assay pour les cellules vivantes | Biotium | 30029 |
| Réactifs de transfection FuGENE HD | Roche | 04709705001 |
| Dulbecco Modified Eagle Médium | Gibco | 31053-028 |
| Trypsine à 0,25% | Gibco | 15050-065 |
| Sérum de veau fœtal | Gibco | 12483-020 |
| Pénicilline / streptomycine | Gibco | 15140122 |
| # 1.5 à 25 mm en verre lamelle | Warner Instruments | 64-0715 |
Chamlide CMB magnétiques | Quorum Technologies | CM-B-40 |
| Culture de tissus Cellstart boîtes de 10 cm | VWR | 82050-576 |
| BD Falcon de 6 puits boîtes de culture tissulaire | VWR | CA62406-161 |
Références
- Antczak, C., Takagi, T., Ramirez, C. N., Radu, C., Djaballah, H. Live-cell imaging of caspase activation for high-content screening. J. Biomol. Screen. 14, 956-969 (2009).
- Cen, H., Mao, F., Aronchik, I., Fuentes, R. J., Firestone, G. L. DEVD-NucView488: a novel class of enzyme substrates for real-time detection of caspase-3 activity in live cells. FASEB. J. 22, 2243-2252 (2008).
- de Calignon, A., Fox, L. M., Pitstick, R., Carlson, G. A., Bacskai, B. J., Spires-Jones, T. L., Hyman, B. T. Caspase activation precedes and leads to tangles. Nature. 464, 1201-1204 (2010).
- Eldadah, B. A., Faden, A. I. Caspase pathways, neuronal apoptosis, and CNS injury. J. Neurotrauma. 17, 811-829 (2000).
- Foster, L. M., Phan, T., Verity, A. N., Bredesen, D., Campagnoni, A. T. Generation and analysis of normal and shiverer temperature-sensitive immortalized cell lines exhibiting phenotypic characteristics of oligodendrocytes at several stages of differentiation. Dev. Neurosci. 15, 100-109 (1993).
- Fulton, D., Paez, P. M., Fisher, R., Handley, V., Colwell, C. S., Campagnoni, A. T. Regulation of L-type Ca(++) currents and process morphology in white matter oligodendrocyte precursor cells by golli-myelin proteins. Glia. 58, 1292-1303 (2010).
- Hisahara, S., Okano, H., Miura, M. Caspase-mediated oligodendrocyte cell death in the pathogenesis of autoimmune demyelination. Neurosci. Res. 46, 387-397 (2003).
- Lau, A., Tymianski, M. Glutamate receptors, neurotoxicity and neurodegeneration. Pflugers. Arch. 460, 525-542 (2010).
- Lawrence, M. S., Ho, D. Y., Sun, G. H., Steinberg, G. K., Sapolsky, R. M. Overexpression of Bcl-2 with herpes simplex virus vectors protects CNS neurons against neurological insults in vitro and in vivo. J. Neurosci. 16, 486-496 (1996).
- Paez, P. M., Spreuer, V., Handley, V., Feng, J. M., Campagnoni, C., Campagnoni, A. T. Increased expression of golli myelin basic proteins enhances calcium influx into oligodendroglial cells. J. Neurosci. 27, 12690-12699 (2007).
- Sanchez Mejia, R. O., Friedlander, R. M. Caspases in Huntington's disease. Neuroscientist. 7, 480-489 (2001).
- Smith, G. S. T., De Avila, M., Paez, P., Spreuer, V., Wills, M. K. B., Jones, N., Boggs, J. M., Harauz, G. Proline substitutions and threonine pseudo-phosphorylation of the SH3-ligand of 18.5 kDa myelin basic protein decrease affinity for the Fyn-SH3-domain and alter process development and protein localization in oligodendrocytes. J. Neurosci. Res. , (2011).
- Smith, G. S. T., Paez, P. M., Spreuer, V., Campagnoni, C. W., Boggs, J. M., Campagnoni, A. T., Harauz, G. Classical 18.5-and 21.5-kDa isoforms of myelin basic protein inhibit calcium influx into oligodendroglial cells, in contrast to golli isoforms. J. Neurosci. Res. 89, 467-480 (2011).
- Springer, J. E., Azbill, R. D., Knapp, P. E. Activation of the caspase-3 apoptotic cascade in traumatic spinal cord injury. Nat. Med. 5, 943-946 (1999).
- Verity, A. N., Bredesen, D., Vonderscher, C., Handley, V. W., Campagnoni, A. T. Expression of myelin protein genes and other myelin components in an oligodendrocytic cell line conditionally immortalized with a temperature-sensitive retrovirus. J. Neurochem. 60, 577-587 (1993).
- Yu, S. P. Regulation and critical role of potassium homeostasis in apoptosis. Prog. Neurobiol. 70, 363-386 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon