Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von Basalzellen und Submuköse Gland Duct Zellen aus Maus Trachea
In diesem Artikel
Zusammenfassung
Hier zeigen wir unser Protokoll zur Isolierung von basalen und submuköse Drüsen Gangzellen von Maus Luftröhre. Darüber hinaus zeigt das Verfahren zum Einspritzen von Stammzellen in die dorsale Maus Fettkörper ein erstellen In vivo Modell der submukösen Drüsen Regeneration.
Zusammenfassung
Die große Atemwege sind in direktem Kontakt mit der Umwelt und daher anfälliger für Verletzungen von Toxinen und Krankheitserregern, dass wir den Atem in 1. Die großen Atemwege erfordern daher eine effiziente Reparatur-Mechanismus, um unseren Körper zu schützen. Diese Reparatur-Prozess tritt aus Stammzellen in den Atemwegen und Isolierung dieser Stammzellen aus den Atemwegen ist wichtig für das Verständnis der Mechanismen der Reparatur und Regeneration. Es ist auch für das Verständnis abnorme Reparatur, die Atemwegserkrankungen 2 führen kann wichtig. Das Ziel dieses Verfahrens ist es, ein neues Stammzellpopulation von den Maus trachealen submucosalem Drüsenkanäle isolieren und diese Zellen in vitro und in vivo Modellsystem zu platzieren, um die Mechanismen der Reparatur und Regeneration der submucosalen Drüsen 3 zu identifizieren. Diese Produktion zeigt Methoden, die zur Isolierung und Test der Kanal-und basalen Stammzellen aus dem großen Atemwege 3 werden kann. Dies wird uns erlaubenzu Erkrankungen der Atemwege, wie zystischer Fibrose, Asthma und chronisch obstruktiver Lungenerkrankung studieren. Derzeit gibt es keine Verfahren zur Isolierung von submucosalem Drüse Gangzellen und keine in vivo-Modellen, um die Regeneration des submucosalen Drüsen studieren.
Protokoll
Outline of Steps
Ein. Dissection der Luftröhre
2. Reinigung Luftröhre und Schneiden
3. Enzymverdau und Verarbeitung zu Einzelzellsuspension
4. Färbung für FACS und Sortierung
5. Verarbeitung sortierten Zellen in vivo und in vitro-Modelle
Ein. Dissektion der Trachea
- Euthanize die Maus mit einer intraperitonealen Injektion von 0,1 cc von Pentobarbital mg/0.2.
- Schneiden Sie die Bauchdecke, und bewegen Sie den Darm zur Seite, um die Bauchaorta aussetzen und dann sezieren.
- Öffnen Sie die Brust durch einen Schnitt durch die Membran und vorderen Brustwand auf beiden Seiten, um das Herz und die Lunge aussetzen. Weiter Zerschneiden in den Hals Entfernen der Fett-und Speicheldrüsen, die Luftröhre aussetzen.
- Entfernen Sie den Thymus und schneiden die Lunge aus seinen Verbindungen unten und hinten. Separaß die Trachea vom Oesophagus eine Zange durch Einfügen zwischen ihnen dann schneiden die Luftröhre an seinem oberen zumeist oberhalb seiner Verbindung mit dem Kehlkopf. Dann halten die Luftröhre mit einer Pinzette und sezieren von ihrer Befestigung und weiter unten, um ihn mit dem Herz und der Lunge en-Block zu entfernen. Schneiden Sie das Herz und die Lunge in der Nähe des Nabels, die meisten der rechten und linken Hauptbronchus gehören.
- Zeigen die Luftröhre in einer kleinen Petrischale mit Auffangmediums auf Eis.
2. Reinigung Luftröhre und Cutting It
- Unter dem Binokular, benutze sehr feinen Spitze Zange (Nr. 5) und Vannas Tübingen Schere (FST 15003-08 finescience.com), um die Luftröhre von allen anderen Geweben an ihn zu reinigen. Dazu gehören: Lymphknoten, Recurrens, Fett, Schilddrüse und restlichen Lungengefäße. Der obere Teil der Luftröhre bedarf besonderer Aufmerksamkeit, um die großen Kehlkopfknorpel ohne den größten Haufen SMG entfernenDas ist zwischen dem Ringknorpel und der ersten trachealen knorpeligen Ring (C1) 4 eingereicht.
- Schneiden die Trachea in den oberen Teil und dem unteren Teil zwischen C4 und C5 und dann aufgeschnitten beide Teile durch das Lumen der Luftröhre.
3. Enzym Verdauung und Verarbeitung in Single Cell Suspension (SCS)
- Inkubieren der untere Teil der Luftröhre in 1 ml 16 U Dispase in ein Eppendorf-Röhrchen bei Raumtemperatur (RT) für 30 min, wie zuvor 5 beschrieben. Dann fügen Sie 0,5 mg / ml DNase I in DMEM für weitere 20 min bei RT.
- Entfernen Sie die verdaut Luftröhre in die frische Auffangmediums in einer sterilen Petrischale und isolieren das Oberflächenepithel unter dem Binokular. Mit einer Pipette das Medium, welches das Epithel abgezogen, um eine 50 ml konischen Röhrchen übertragen.
- Spin down das abisolierte Epithel bei 1.000 xg bei 4 ° C. Entfernen Sie den Überstand und 0,1% Trypsin / EDTA und Inkubation unter Schütteln the Rohr in einer 37 ° C Schüttelinkubator (200 UpM) für 30 min. Nach der Inkubation mit einem 1.000 ul Spitze, und Abpipettieren aufzubrechen Klumpen und bilden eine einzige Zellsuspension.
- Den oberen Luftröhre in einer konischen Röhrchen mit 1 ml 0,15% Pronase. Dann bei 4 ° C für 4 Stunden inkubiert.
- Vorsichtig das Röhrchen vortexen und dann die Luftröhre in frischen Auffangmediums und bestätigen unter dem Binokular, dass es vollständige Ablösung der Oberfläche Epithel (SE).
- Mince die Luftröhre mit einer feinen Schere zu öffnen, die SMG Fächer und dann inkubieren für eine weitere Stunde in Pronase bei RT mit langsamen Schütteln.
- Spin-Down der Luftröhrengewebe, entfernen Sie die Pronase, mit 0,1% Trypsin / EDTA und Inkubation bei 37 ° C für 30 min unter Schütteln wie oben.
- Passage die verdauten Zellen, Klumpen und alle verbleibenden Stücke von Drüsen durch 20G, 23G und 26G Nadeln mit einer 10 ml Spritze. Wiederholen Sie die Passage mehrmals mit jeder Nadel Größe vorRücktritt. Jetzt sollten die meisten Zellen in einem SCS sein.
- Filtern Sie die Suspension durch eine 40 uM Sieb waschen dann das Sieb und Spin-Down der Zellen. Dann rekonstituieren die Zellen in einem geeigneten Volumen des Mediums, zu zählen und die Zellen gehen sofort in FACS Färben und Sortieren. Lassen Zellen in 4 ° C oder auf Eis für mehrere Stunden, da wir fanden, dass dies die Lebensfähigkeit beeinträchtigt und eine erhebliche Verringerung der bildenden Kugel Effizienz.
4. Färbung für FACS und Sortierung
- Nehmen Sie genügend Zellen für die Herstellung der ungefärbten und Single gebeizt Entschädigung Rohre werden dann färben den Rest der Zellen mit primären Antikörper, Ziege TROP2 und Ratte ITGA6, für 15 min bei RT. Dann mit PBS waschen oder Auffangmediums, Remover den Überstand sehr vorsichtig und brechen das Zellpellet.
- Stain mit dem entsprechenden sekundären Antikörper, im Dunkeln bei RT inkubieren 10 min, waschen und Überstand und dann brechen die Pellets.
- Auf den FACSARIA, bereinigt Ihre Spannung und Ausgleich, Tor aus den Trümmern, sehr kleine Zellen, Dubletten und tote Zellen. Dann sollten die meisten Zellen aus der SE sein TROP2 positiv, während 20-50% der SMG Zellen TROP2 + 6 sein wird.
- Ihre eingestellt Sortier-Gatter zum TROP2 + +-Zellen aus ITGA6 SE (Basalzellen) und für TROP2 +-Zellen (+ /-ITGA6 positive Zellen) aus SMG (Kanal-Zellen).
5. Verarbeitung sortierten Zellen für: In-vitro-Kultur und in vivo Modell
5.1 In vitro bildenden Kugel 5-9 Kultur
- Mix 100 ul von "Growth Factor reduziert Matrigel" mit 100 ul Vollmedium 10,11 (siehe Tabelle 1), die bis zu 50.000 sortierten Zellen dann setzen Sie diese Mischung in der oberen Kammer eines 24-Loch-trans-well. Dann legen Sie 400 ul Vollmedium in der unteren Kammer und bei 37 ° C inkubieren Ändern Medium in der unteren Kammer jeden zweiten Tag und zusätzliche 100 ul Matrigeljede Woche oder früher, wenn es dünn wird.
5.2 In-vivo-Modell
- Rekonstituieren der sortierte Zellpellet in Vollmedium gemischt 1:1 mit Matrigel in einer Konzentration von 5.000-10.000 Zellen pro 50 pl.
- Anesthetize die Empfänger C57/BL6-Mäusen. Verabreichen Carprofen (5 mg / kg) subcutaenously als Analgetikum. Sterilisieren und rasieren ihre Rücken dann eine zentrale Längsachse Hautschnitt in den oberen Rücken. Der Schnitt sollte groß genug sein, um den Fettkörper Injektionsstelle sowie der Bläschenzubereitung, das nach der Injektion bildet identifizieren. Verwenden der stumpfen Seite der Schere um Taschen zwischen der Haut und der Rückseite des Brustwand beidseitig um Zugang zu maximieren und Visualisierung verbreitern.
- Identifizieren Sie die medialen Rand des Schulterblattes, indem Sie die Maus Vorderbein und nach hinten, um das Schulterblatt bewegenden sehen. Nehmen Sie 50 ul der Zellsuspension in einem 300 ul BD Insulin Spritze aufgezogen und in der Fettpolster unmittelbar medial des Schulterblattes und lateraldie Wirbel. Sie sollten in der Lage sein, um eine Blase sonst sind Sie zu tief zu sehen. Wiederholen Sie das gleiche auf der anderen Seite dann Clip oder Stich in die Haut Einschnitt. Prüfen Mäusen und geben Carprofen (5 mg / kg, sc) einmal täglich während 48 Stunden.
- Nach 3 Wochen einschläfern Mäuse mit pentobarbatol (0,1 mg/0.2 cc, IP), öffnen Sie die Haut wie oben und sezieren die ganze Fettpolster von beiden Seiten mit einer Sicherheitsmarge zu vermeiden, fehlt jegliches Gewebe-Struktur, die gebildet und hätte verlängert sich um. Fix in PFA und einbetten in Paraffin 12. Extreme Vorsicht ist beim Trimmen und Schneiden der Block nicht zu umgehen oder zu übersehen, eine Struktur eingesetzt werden. Die beste Vorgehensweise ist bis 40 um trimmen einmal, dann schneiden Sie ein 4 um Scheibe, legen Sie sie auf einen Objektträger aus Glas und untersuchen sie unter dem Mikroskop, um zu bestätigen, ob es irgendwelche "epithelialen Strukturen" in diesem Teil des Blocks sind oder nicht. Wenn es nichts zu sehen, dann noch einmal trimmen und wiederholen Sie diesen Schritt.
6. Repräsentative Ergebnisse
Stripping der Maus Luftröhren wird in einem denudierten Luftröhre, die durch Lichtmikroskopie sichtbar ist, wie in 1A gezeigt, führen. 1B zeigt die Ansicht einer Hellfeld Luftröhre nach epithelialen Strippen mit submucosalen Drüsen wobei aus den Geweben und ähnelt Weintrauben freigegeben.
Pronase entfernt das ITGA6 Epitop und deshalb die TROP2 Gangzellen nicht in ITGA6 + und abgetrennt werden - Populationen. Jedoch verdaut Dispase, welche die ITGA6 Epitop bewahrt, alle Oberflächenepithel und die Gangzellen auch bei sehr kurzen Inkubationszeiten, und kann daher nicht verwendet werden, um Kanal von Basalzellen 3 trennen. Durchflusszytometrie der einzelnen Zellsuspensionen sollte zeigen Vorwärtsstreuung und seitlichen Streudiagramme, die in 2A dargestellt werden. Gute Trennung des Kanals Zellen aus dem Rest, wenn die trachealen Zellen mit dem TROP2 Antikörper sollte in der Durchflusszytometrie werden für Leuchtstofflampen activated cell sorti gesehenng (FACS), wie in 2B zu sehen. Kügelchen sollten in der Matrigel nach ca. 1 Woche in Kultur sichtbar und sind im Aussehen dicht wie in Abbildung 3 dargestellt. Die Effizienz dieses Prozesses ist die Größenordnung von 1-2% und Einzelzellen wird immer noch in der Matrigel Gegenwart und wahrscheinlich stellen Zellen aus den submukösen Drüsenkanäle, die nicht über die Fähigkeit zur Selbsterneuerung. Injektion von Stammzellen Kanals in die Maus Fettpolster führt zur Bildung von submukosalem Drüse-ähnliche Strukturen, Abbildung 4 dargestellt sind. Diese werden in den Blöcken auch ohne H & E-Färbung gesehen. Dies sind kugelförmig und besitzen eine mittlere Lumen. Viele Querschnitte müssen durch die Fettpolster werden, um nicht diese epithelialen Strukturen verpassen.
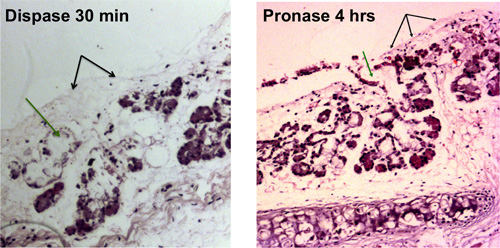
Abbildung 1. Enzymatische Verdauung von Trachealepithels. Entfernung von Oberflächen-Epithelzellen mit blac angezeigtk Pfeile, die Entfernung von Zellen in den submucosalen Drüsenkanäle ist mit grünem Pfeile dargestellt. Denudierten Luftröhren, die durch Lichtmikroskopie sichtbar sind, werden nach 30 min Dispase Verdauung und nach 4 h Pronase Verdauung gezeigt.

2A. I. Durchflusszytometrie der einzelnen Zellsuspensionen zeigt repräsentative Vorwärtsstreuung und seitlichen Streudiagramme von Maus Luftröhre nach Oberflächenepithelzellen Strippen. ii. Vertreter FACS Plots für TROP2 Ausdruck im Kanal Zellen aus Maus Luftröhre.
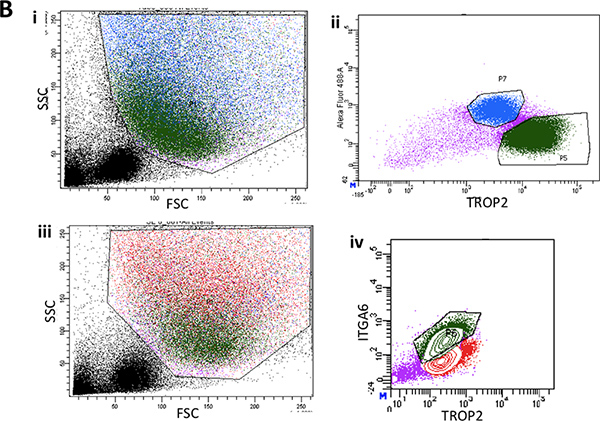
2B. I. Durchflusszytometrie der einzelnen Zellsuspensionen aus abgestreift Oberflächenepithel der unteren zwei Drittel der Maus Trachea zeigt repräsentative Vorwärtsstreuung und seitlichen Streudiagramme. ii. Typische FACS Grundstück ITGA6 Ausdruck in surface Epithel. iii. Ein anderer Vertreter FACS Grundstück von vorn und zur Seite Streuung von Oberflächenepithel zeigt wieder Gating der basalen Zell-Population in grün. iv. Typische ITGA6 und TROP2 Ausdruck Zellpopulation in grün.
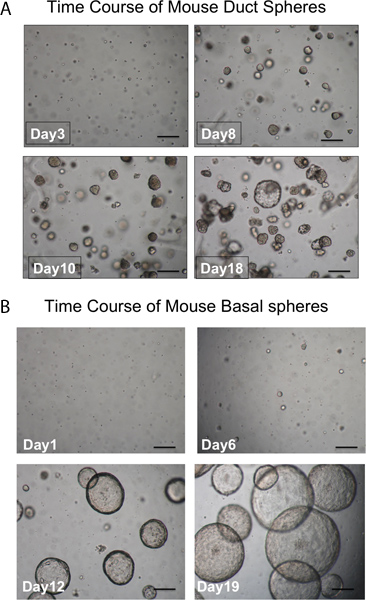
Abbildung 3. Zeitlicher Verlauf der Entwicklung der Sphären. A. Duct Sphären. Spheres sichtbar sein soll in der Matrigel nach ca. 1 Woche in Kultur und fast alle sind im Aussehen dichter. Einzelne Zellen, die nicht zu Kugeln sind ebenfalls zu sehen. (Maßstab = 50 um). B. Basal Kugeln sind größer und luminalen in Erscheinung. Einzelne Zellen, die nicht zu Kugeln sind ebenfalls zu sehen. (Maßstab = 50 um).
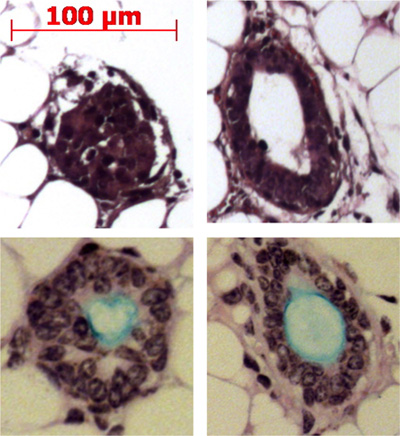
Abbildung 4. Injektion von Stammzellen Kanals in die Maus Fettpolster führt zur Bildung von submukosalem Drüse Strukturen. Vertretungsstrukturenwerden in der Fettpolster gezeigt und einige gezeigt Herstellung Mucin (hellblau) mit dem Alcianblau Periodic Acid Schiff Fleck.
Diskussion
Diese Technik zum Kanal und basalen Zellen aus den Atemwegen zu isolieren, ist für ein besseres Verständnis der Atemwege Reparatur und Regeneration und Atemwegserkrankungen wichtig. Die hier beschriebenen Techniken sind ein paar wichtige Schritte. Die erste ist die optimierte enzymatische Verdauung Zeitraum. Die zweite ist die Schaffung eines einheitlichen Zellsuspension durch serielle Passage mit progressiv höhere Gage Nadeln Zelle Scherung zu verhindern, sondern brechen Zellklumpen. Die dritte ist die FACS-Analyse,...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir möchten die Grundzüge der Stem Cell Research Center FACS anerkennen und vor allem danke Jessica Scholes und Felicia Codrea für ihre Hilfe bei der Zellsortierung. Die Arbeit wurde durch CIRM RN2-00904-1, K08 HL074229, American Thoracic Society / COPD Foundation ATS-06-065, Das Concern Foundation, The UCLA Jonsson Comprehensive Cancer Center Thoracic Oncology Program / Lung Cancer SPORE, der University of California Cancer finanziert Forschung Coordinating Committee und das Gwynne Hazen Kirsche Memorial Laboratories (BG).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalognummer | |
| Vollmedium 10: DMEM-F-12, 50/50, 1X) | Mediatech | 15-090-CV | |
| Hepes (15 mM) | Invitrogen | 15630 | |
| Natriumbicarbonat (3,6 mm oder 0,03%) | Invitrogen | 25080 | |
| L-Glutamin (4 mM) | Mediatech | 25-005-Cl | |
| Penicillin (100 E / ml) | Mediatech | 30-001-CI | |
| Streptomycin (100 ug / m) | Mediatech | 30-001-CI | |
| Amphotericin B (0,25 g / ml) | Lonza | 17-836R | |
| InSulin (10 ug / ml) | Sigma | I6634 | |
| Transferrin (5 ug / ml) | Sigma | T1147 | |
| Cholera-Toxin (0,1 ug / ml) | Sigma | C8052 | |
| Epidermal Growth Factor (25 ng / ml) | BD | 354001 | |
| Rinderhypophysenextrakt (30 ug / ml) | Invitrogen | 13028-014 | |
| Fötalem Rinderserum (5%) | Fischer | SH3008803HI | |
| Retinsäure (0,05 pM) | Sigma | R2625 | |
| Growth Factor Reduced Matrigel | BD | 354230 |
Tabelle 1. Füllen Media-Komponenten.
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Pronase | Roche | 10165921001 | Gebrauchte bei 0,15%: -O / n bei 4 ° C Verdauung insgesamt trachealen Zellen (ALI Kultur) zu isolieren -4 Hr Verdauung 4 ° C bis zu isolieren SMG |
| Dispase | BD Biosciences | 354235 | Gebrauchte bei 16 Einheiten: 30 min bei RT |
| DNase I | Sigma | DN25 | Verwendet bei 0,5 mg / ml: 20-30 min bei RT |
Tabelle 2. Enzyme für die enzymatische Verdauung der Luftröhre eingesetzt.
Referenzen
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten