JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 기관에서 자연적으로 흐르는 것과 셀 및 Submucosal 글 랜드 덕트 세포의 분리
요약
여기 마우스 tracheas의 기초 및 submucosal 글 랜드 덕트 세포의 분리에 대한 프로토콜을 보여줍니다. 우리는 또한을 만들 등쪽 마우스 지방 패드에 줄기 세포를 주입하는 방법을 보여줍니다 생체 내 모델입니다.
초록
대형 항공은 1 우리가 숨 독소와 전염성 대리인의 부상 때문에 민감 환경과의 접촉에 직접하고. 대형 항공 따라서 효율적인 복구 메커니즘이 우리 몸을 보호하기 위해 필요합니다. 이 복구 과정은기도의 줄기 세포에서 발생기도에서 이러한 줄기 세포를 분리하는 것은 수리와 중생의 메커니즘을 이해하는 것이 중요합니다. 이기도 질환이 될 수 있습니다 이상 수리를 이해하는 것도 중요하다. 이 방법의 목적은 마우스 tracheal submucosal 글 랜드 덕트에서 새로운 줄기 세포 인구를 분리하고 submucosal 선들은 3 수리와 중생의 메커니즘을 식별하는 체외 및 생체 모델 시스템에서 이러한 셀을 배치하는 것입니다. 이 생산은 큰기도 3에서 덕트 및 기초 줄기 세포를 분리하고 분석하는 데 사용할 수있는 방법을 보여줍니다.이 우리에게 수이러한 낭성 섬유증, 천식, 만성 폐 질환으로 방해하는기도가 질병을 공부합니다. 현재 submucosal 선 덕트 세포의 분리에 대한 방법은 없습니다 및 submucosal 분비의 재생을 연구하는 생체 모델에 더 있습니다.
프로토콜
단계의 개요
1. 기관의 해부
2. 호흡 관을 청소하고 절단
3. 하나의 세포 현탁액에 효소 소화 및 처리
4. FACS에 얼룩 및 정렬
5. 생체 및 체외 모델에 대한 분류 세포를 처리
1. 기관의 해부
- pentobarbital 0.1 mg/0.2 CC의 intraperitoneal 주사와 마우스를 안락사시켜야.
- 복부 벽을 열고 잘라 내고 복부 대동맥을 노출 한 다음 해부하기 위해 옆에 창자를 이동합니다.
- 심장과 폐를 노출 양쪽 횡격막과 흉부 앞쪽에 벽을 통해 절단하여 상자를 엽니 다. 기관을 폭로하기 위해 지방과 침샘을 제거 목에까지 절단 계속합니다.
- thymus를 제거하고 아래의 뒤의 연결 해제 폐를 잘라. Separ그들 사이 집게를 삽입하여 식도에서기도를 먹었다는 후두와의 연결을 위의 상단 대부분의 기관을 잘라. 그런 다음 집게로 기관을 보유하고 첨부 파일에서 해부하고 마음과 폐 전용 블록으로 제거 할 아래로 계속 진행합니다. 오른쪽과 왼쪽 주요 기관지의 대부분을 포함 할 수있는 hilum에 가까운 심장과 폐를 멀리 자른다.
- 얼음 매체를 수집하는 포함하는 작은 배양 접시에있는 호흡 관을 삽입합니다.
2. 기도를 청소하고 절단
- 해부 현미경에서 그것에 연결된 모든 다른 조직에서 기관을 청소하는 것은 매우 훌륭한 점 포셉 (5 호)와 Vannas 튀빙겐 가위 (FST 15003-08 finescience.com)을 사용합니다. 이 자료에는 림프절, 재발 후두 신경, 지방, 갑상선 및 남은 폐 혈관합니다. 기관의 위쪽 부분은 SMG의 가장 큰 뭉치를 손상시키지 않고 큰 후두 연골을 제거하기 위해 특별한주의가 필요합니다그는 반지 연골의 연골 및 제 tracheal 연골 성의 링 (C1) 4 사이에 붙어있다.
- 상부와 C4 & C5 사이의 하단 부분에 호흡 관을 잘라 다음 기관의 내강을 통해 두 부분을 잘라 냈어.
3. 단일 세포 현탁액 (SCS)에 효소 소화 및 처리
- 30 분 같은 이전 5 설명을위한 실내 온도 (RT)에서 Eppendorf 튜브 16 U의 dispase 1 ML에있는 기관의 하단을 품다. 그런 다음 RT에서 추가 20 분에 0.5 밀리그램 / DMEM에 ML DNase I을 추가합니다.
- 멸균 페트리 접시에 신선한 수집 매체로 소화 tracheas를 제거하고, 해부 현미경으로 표면 상피를 제거. 50 ML 원뿔 튜브로 제거 상피를 포함하는 매체를 전송하는 피펫을 사용합니다.
- 4 ° C.에서 1,000 XG에서 제거 상피를 스핀 다운 표면에 뜨는을 제거하고 일을 흔들어 동안 0.1 % 트립신 / EDTA (에틸렌 다이아 민 테트라 초산)과 품다를 추가37에 전자 튜브 ° C 30 분에 보육 (200 RPM)를 흔들어. 부화 후, 1000 μl 팁을 사용하여 clumps을 해제하고 단일 세포 현탁액을 형성하기 위해 아래로 피펫합니다.
- 0.15 %의 pronase 1 ML을 포함하는 원추 관 상부기도를 놓습니다. 그런 다음 4 시간에 대해 4 ° C에서 알을 품다.
- 관 부드럽게 소용돌이하고 신선한 수집 매체로 기관을 배치하고 표면 상피 (SE)의 완전한 분리가되는 해부 현미경으로 확인합니다.
- SMG 구획을 연 다음 천천히 흔들림을 RT에서 pronase에 하나 더 시간 동안 배양하기 위해 고급 가위로기도를 이기다.
- tracheal 조직을 스핀 다운, pronase를 제거 위와 같이 흔들림과 30 분에 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 및 품다 37 ° C에서 0.1 %를 추가합니다.
- 10 ML의 주사기를 사용하여 20G, 23G 및 26G 바늘을 통과 소화 세포, clumps과 땀샘의 남은 덩어리. 전에 각 바늘 크기 passaging를 여러 번 반복물러나. 지금, 대부분의 세포는 SCS에 있어야합니다.
- 40 μM의 스트레이너를 통해 정지를 필터링하면 다음 여과기을 씻고 세포를 스핀 다운. 그런 매체의 적절한 볼륨에서 reconstitute 세포는 세포 수를 계산하고 얼룩 및 정렬 FACS 즉시 진행합니다. 우리가이 생존에 영향을 미치는 심각하게 효율성을 형성 영역을 감소 것을 발견하기 때문에 4 ° C 또는 몇 시간 동안 얼음에 세포를 방치하지 마십시오.
4. FACS에 얼룩 및 정렬
- 그리고 RT에서 15 분 동안 차 항체, 염소 Trop2와 쥐 ITGA6있는 세포의 나머지 부분을 얼룩 흠없는 및 단일 스테인드 보상 튜브를 준비하기위한 충분한 세포를보세요. 그런 다음 PBS로 씻거나 매체를 수집, 제거 표면에 뜨는을 매우 신중하게하고 세포 펠렛을 깰.
- 10 분 동안 RT에서 어둠 속에서 길러 적절한 보조 항체와 얼룩, 씻고 표면에 뜨는 제거한 다음 펠렛을 깰.
- FACS에ARIA, 파편, 아주 작은 세포, 세포 doublets와 죽은 세포 밖으로 전압 및 보상, 게이트를 조정 한 후. SMG 세포의 20~50%이 TROP2 + 6 질 것 그런 다음, SE에서 가장 전지는 TROP2 긍정적해야합니다.
- 귀하의 정렬 Trop2에 대한 게이트 + ITGA6 SMG (덕트 세포)에서 SE에서 + 세포 (기저 세포)와 Trop2에 대한 + 세포 (+ /-ITGA6 긍정적 인 세포).을 설정
5. 에 대한 정렬 셀을 처리 : 생체 모델에서 체외 문화에
5-9 문화를 형성 체외 영역에서 5.1
- 100 μl 혼합 한 다음 24도 횡단도의 상부 챔버에이 혼합물을 넣어 50,000 정렬 셀까지 포함 된 완벽한 중간 10,11 (표 1 참조)의 100 μl와 함께 "성장 인자는 Matrigel을 감소." 그런 다음 37 하부 챔버에서 완전 매체 400 μl를 넣고 배양 ° C. 매일 하부 챔버에서 미디어를 변경하고 Matrigel의 추가 100 μl를 추가매주하거나 얇은 될 경우 이전.
생체 모델에 5.2
- Reconstitute 50 μl 당 5,000-10,000 세포의 농도에 matrigel과 1시 1분 혼합 완전한 중간에 정렬 세포 펠릿.
- 받는 사람 C57/BL6 쥐를 마취. 진통제로 subcutaenously Carprofen을 (5 밀리그램 / kg) 관리 할 수 있습니다. 살균과 뒤를 면도는 상단 뒤쪽에 중심 길이 방향 피부 절개를합니다. 절개는 지방 패드 분사 사이트뿐만 아니라 주입 한 후 형성 물집을 식별 할 수있을만큼 충분히 주어져야합니다. 액세스 및 시각화를 극대화 할 양쪽 가슴 벽의 피부와 다시 사이 파우치를 좀 더 넓혀야 가위의 무딘면을 사용합니다.
- 견갑골의 이동을 볼 위 뒤로 마우스 forelimb을 눌러 견갑골의 내측 경계를 식별합니다. 300 μl BD의 인슐린 주사기로 세포 현탁액의 50 μl를 타고 그냥 견갑골에 안쪽하고 측면 지방 패드에 주사척추. 당신이 너무 깊어 그렇지 않으면 물집을 볼 수 있습니다. 반대편 후 클립이나 바늘 피부 절개를에서 동일하게 반복합니다. 마우스를 확인하고 48 시간을 위해 하루에 한 번씩 Carprofen을 (5 밀리그램 / kg, SC) 제공합니다.
- 3 주 후에도, pentobarbatol (0.1 mg/0.2 CC, IP)로 쥐를 안락사시켜야 위의 피부를 열고 형성하고 주변에 확장 한 수있는 조직 구조를 누락 방지 할 수있는 여유가 양쪽에서 전체 지방 패드를 해부. 파라핀 12 PFA 및 소스에서 수정합니다. 익스트림주의 트리밍과 구조를 무시하거나 간과하지 블록을 절단하는 동안 고용해야합니다. 가장 좋은 방법은 한 번 한 후 4 μm 슬라이스를 잘라 유리 슬라이드에 배치하고 블록 여부를이 부분에서 "상피 구조"가있을 경우 확인 현미경을 검사 40 μm를 잘라하는 것입니다. 본 아무것도없는 경우, 한 번 잘라이 단계를 반복합니다.
6. 대표 결과
취소 선마우스 tracheas의 pping은 그림 1A와 같이 가벼운 현미경으로 볼 수있는 denuded 기관 될 것입니다. 그림 1B는 포도의 조직과 유사한 뭉치에서 풀려나 submucosal 분비와 상피 벗겨 이후 기관의 brightfield보기를 보여줍니다.
Pronase는 ITGA6 에피토프를 제거하고 TROP2 덕트 세포 ITGA6 +과로 분리 할 수없는 이유입니다 - 인구. 그러나, ITGA6 에피토프를 보존 dispase은, 표면 상피, 심지어 매우 짧은 부화 시간과 덕트 세포, 따라서 세 기저 세포에서 덕트를 분리하는 데 사용할 수 없습니다를 모두 소화. 단일 세포 현탁액의 유동 세포 계측법은 그림 2A에 표현 분산과 측면 분산 형 플롯을 앞으로 표시합니다. tracheal 세포가 형광 활성 세포 sorti에 대한 유동 세포 계측법에 Trop2 항체를 볼 수 있어야 할 경우 나머지 덕트 세포의 좋은 분리NG는 (FACS)와 같은 그림 2B에 표시. 분야는 문화에 약 1 주 후 matrigel에 볼 수 있으며 그림 3과 같이 외관에 고밀도 아르해야합니다. 이 프로세스의 효율성은 여전히 matrigel에 존재하고 가능성이 자기 갱신 능력을 가지고하지 않는 submucosal 글 랜드 덕트의 세포를 잘 표현할 수 1-2% 및 단일 세포의 순서입니다. 그림 4 표시됩니다 submucosal 선 같은 구조의 형성에서 마우스 지방 패드 결과에 덕트 줄기 세포의 주입. 이도 H & E 염색하지 않고 블록에 볼 수 있습니다. 다음은 구형이며, 중앙 루멘을 보유하고 있습니다. 대부분의 크로스 섹션이 상피 구조를 놓치지되지 않도록 지방 패드 통해해야합니다.
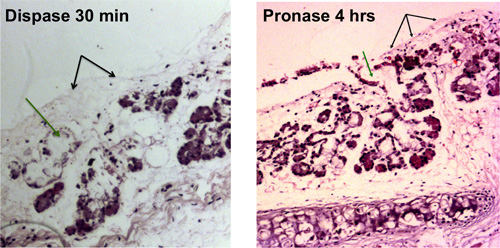
그림 1. tracheal 상피의 효소 소화. 표면 상피 세포의 제거는 blac으로 표시됩니다K 화살표, submucosal 글 랜드 덕트의 세포의 제거는 녹색 화살표로 표시됩니다. 빛 현미경으로 볼 수 있습니다 Denuded tracheas는 dispase 소화 30 분 후에 pronase는 소화의 4 시간 후에 표시됩니다.

그림 2A. 전. 상피 표면이 벗겨 후 마우스 tracheas에서 대표 앞으로 분산 및 사이드 분산 형 플롯을 보여주는 단일 세포 현탁액의 유동 세포 계측법. II. 마우스 tracheas에서 덕트 셀에 TROP2 표현 대표 FACS 플롯.
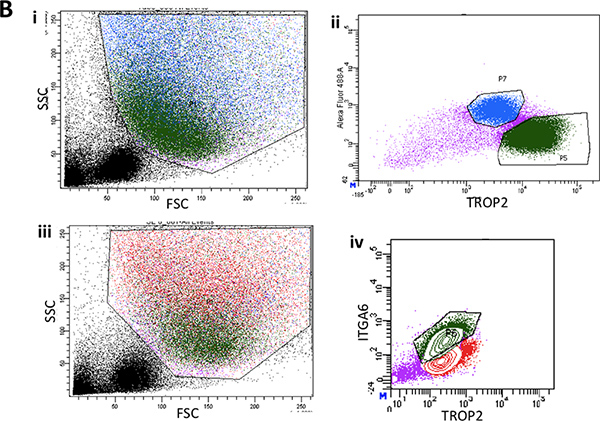
그림 2B. 전. 대표 앞으로 분산 및 사이드 분산 형 플롯을 보여주는 마우스 기관의 낮은 삼분의이의 제거 표면 상피에서 단일 세포 현탁액의 유동 세포 계측법. II. 스와의 ITGA6 표현의 일반적인 FACS의 음모상피를 rface. III. 녹색 기저 세포 인구의 게이팅을 다시 보여주는 표면 상피에서 순방향 및 측면 분산의 또 다른 대표 FACS의 줄거리. IV. 일반 ITGA6 및 TROP2이 녹색으로 세포 인구를 표현.
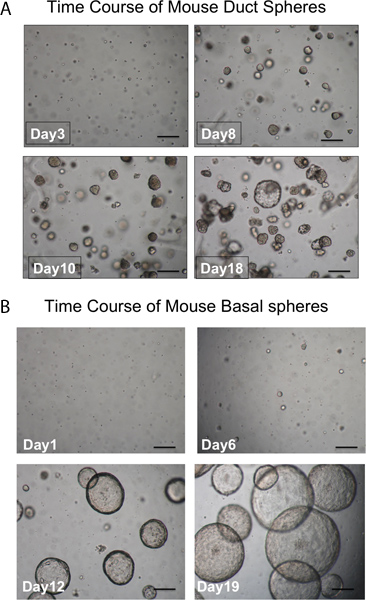
그림 3. 분야의 개발 시간 코스입니다. A. 덕트 영역. 분야는 문화에 대한 일주 후 matrigel에 표시됩니다 거의 모든 외관에 조밀 있습니다. 분야를 형성하지 않습니다 단일 세포도 볼 수 있습니다. (스케일 바 = 50 μm). B. 자연적으로 흐르는 것과 분야는 모양이 크고 luminal 있습니다. 분야를 형성하지 않습니다 단일 세포도 볼 수 있습니다. (스케일 바 = 50 μm).
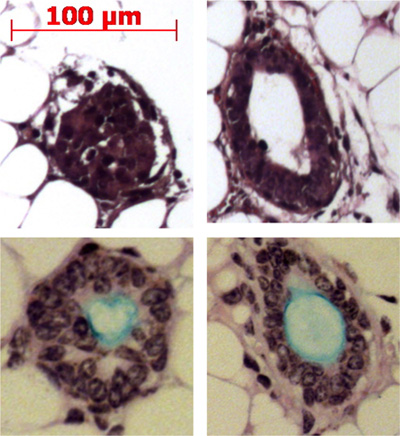
그림 4. submucosal 선 같은 구조의 형성에서 마우스 지방 패드 결과에 덕트 줄기 세포의 주입. 대표 구조지방 패드에 표시되어 있으며 일부는 Alcian 파란 정기 산성 스키 프는 얼룩과 점액 (하늘색)를 생산 표시됩니다.
토론
기도의 덕트와 기저 세포를 분리하는이 기술은기도 수리 및 재생과기도 질환에 대한 우리의 이해를 개선하는 것이 중요합니다. 여기에 설명 된 기술은 몇 가지 중요한 단계가 포함되어 있습니다. 첫 번째는 최적화 된 효소 소화 기간입니다. 두 번째는 세포 전단을 방지하기 위해하지만, 셀 clumps을 깨고 점점 더 게이지 바늘로 passaging 시리얼을 통해 단일 세포 현탁액의 창조입니다. 세 번째는 ...
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는 광범위한 줄기 세포 연구 센터 FACS을 인정하고 특히 셀 정렬과의 도움을 제시카 스콜스와 시아 Codrea 감사드립니다. 작품은 CIRM RN2 - 00904-1, K08 HL074229, 미국 흉부 학회 / COPD 재단 ATS-06-065, 걱정 재단, UCLA Jonsson 종합 암 센터 흉부 종양학 프로그램 / 폐 암 포자, 캘리포니아 암의 대학 자금을 지원 한 연구 조정위원회와 Gwynne 헤이 즌 벚꽃 기념 연구소 (BG).
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| 중간 열을 완료 : DMEM-F-12, 50 / 50, 1X) | Mediatech | 15-090 - CV | |
| Hepes (15 ㎜) | Invitrogen | 15,630 | |
| 나트륨 중탄산염 (3.6mM 또는 0.03 %) | Invitrogen | 25,080 | |
| L-글루타민 (4 ㎜) | Mediatech | 25-005-CL | |
| 페니실린 (100 U / ML) | Mediatech | 30-001 - CI | |
| 스트렙토 마이신 (100 μg / m) | Mediatech | 30-001 - CI | |
| Amphotericin B (0.25 μg / ML) | Lonza | 17 836R | |
| 에sulin (10 μg / ML) | 시그마 | I6634 | |
| 트랜스페린 (5 μg / ML) | 시그마 | T1147 | |
| 콜레라 독소 (0.1 μg / ML) | 시그마 | C8052 | |
| 표피 성장 인자 (25 NG / ML) | BD | 354001 | |
| 소 뇌하수체 추출 (30 μg / ML) | Invitrogen | 13028-014 | |
| 태아 소 혈청 (5 %) | 어부 | SH3008803HI | |
| Retinoic 산 (0.05 μM) | 시그마 | R2625 | |
| 성장 인자는 Matrigel을 감소 | BD | 354230 |
표 1. 미디어 구성 요소를 완료합니다.
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 |
| Pronase | 로슈 | 10165921001 | 0.15 %에서 사용 : 4 번 - O / N ° C의 소화 총 tracheal 세포를 (ALI 문화 용) 분리 할 수 -4 시간에 소화 4 ° C SMG 격리하기 |
| Dispase | BD Biosciences | 354235 | 16 단위에서 사용 : RT시 30 분 |
| DNase I | 시그마 | DN25 | 0.5 MG / ML에서 사용 : RT에서 20-30 분 |
표 2. 효소는 기관의 효소 소화에 사용됩니다.
참고문헌
- Bartlett, J. A., Fischer, A. J., McCray, P. B. Innate immune functions of the airway epithelium. Contrib. Microbiol. 15, 147-163 (2008).
- Finkbeiner, W. E. Physiology and pathology of tracheobronchial glands. Respir. Physiol. 118, 77-83 (1999).
- Hegab, A. E. A Novel Stem/Progenitor Cell Population from Murine Tracheal Submucosal Gland Ducts with Multipotent Regenerative Potential. Stem Cells. , (2011).
- Jeffery, P. K. Morphologic features of airway surface epithelial cells and glands. Am. Rev. Respir. Dis. 128, S14-S20 (1983).
- Rock, J. R. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proc. Natl. Acad. Sci. U.S.A. 106, 12771-12775 (2009).
- Goldstein, A. S. Trop2 identifies a subpopulation of murine and human prostate basal cells with stem cell characteristics. Proc. Natl. Acad. Sci. U.S.A. 105, 20882-20887 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- McQualter, J. L., Yuen, K., Williams, B., Bertoncello, I. Evidence of an epithelial stem/progenitor cell hierarchy in the adult mouse lung. Proc. Natl. Acad. Sci. U.S.A. 107, 1414-1419 (2010).
- Inayama, Y. In vitro and in vivo growth and differentiation of clones of tracheal basal cells. Am. J. Pathol. 134, 539-549 (1989).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. Am. J. Physiol. Lung. Cell. Mol. Physiol. 283, L1315-L1321 (2002).
- Wu, X., Peters-Hall, J. R., Bose, S., Pena, M. T., Rose, M. C. Human Bronchial Epithelial Cells Differentiate to 3D Glandular Acini on Basement Membrane Matrix. Am. J. Respir. Cell Mol. Biol. , (2010).
- Ooi, A. T. Presence of a putative tumor-initiating progenitor cell population predicts poor prognosis in smokers with non-small cell lung cancer. Cancer Res. 70, 6639-6648 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유