Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein fluoreszierendes Screening Assay zur Identifizierung von Modulatoren der GIRK Kanäle
In diesem Artikel
Zusammenfassung
Ein Echtzeit-Screening-Verfahren zur Identifizierung von Medikamenten, die mit G-Protein-gated Einwärtsgleichrichter K interagieren + (GIRK) Kanälen beschrieben. Der Test basiert Membranpotential Fluoreszenzfarbstoffe zu GIRK Kanal-Aktivität zu messen. Diese Technik eignet sich sowohl für den Einsatz auf einer Reihe von Zelllinien.
Zusammenfassung
G-Protein-gesteuerten K + Einwärtsgleichrichter (GIRK) Kanäle fungieren als zelluläre Mediatoren einer Vielzahl von Hormonen und Neurotransmittern und im Gehirn, Herz, Skelettmuskel und endokrines Gewebe 1,2 ausgedrückt. GIRK Kanäle aktiviert werden nach der Bindung von Liganden (Neurotransmitter, Hormone, Arzneimittel, etc.), um die Plasma-Membran-gebundenen G-Protein-gekoppelte Rezeptoren (GPCRs). Diese Bindung bewirkt, dass die Stimulation des G-Proteine (G i und G o), die anschließend zu binden und aktivieren Sie die GIRK Kanal. Nach dem Öffnen der GIRK Kanal erlaubt die Bewegung von K + aus der Zelle verursacht das Ruhemembranpotential zu mehr negativ. Als Folge davon sinkt GIRK Kanal-Aktivierung in Neuronen spontane Aktionspotential Bildung und hemmt die Freisetzung von exzitatorischen Neurotransmittern. Im Herzen, hemmt die Aktivierung des GIRK Kanal Schrittmacher-Aktivität dadurch eine Verlangsamung der Herzfrequenz. 3. Allerdings bleibt die Pharmakologie dieser Kanäle weitgehend unerforscht. Obwohl eine Reihe von Medikamenten, einschließlich Antiarrhythmika, Antipsychotika und Antidepressiva die GIRK Kanal blockieren, ist diese Hemmung nicht selektiv und bei relativ hohen Wirkstoffkonzentrationen 3.
Hier beschreiben wir eine Echtzeit-Screening-Test zur Identifizierung neuer Modulatoren von GIRK Kanäle. In diesem Assay werden neuronalen AtT20-Zellen, die GIRK Kanäle mit Membranpotential Fluoreszenzfarbstoffe, wie Bis-(1,3-dibutylbarbituric Säure) geladen Trimethin Oxonol [Dibac 4 (3)] oder HLB 021-152 (1 ). Die Farbstoffmoleküle werden stark fluoreszierende folgende Aufnahme in die Zellen (Abbildung 1). Behandlungder Zellen mit GPCR-Liganden stimuliert die GIRK Kanäle zu öffnen. Das resultierende K +-Ausstrom aus der Zelle bewirkt, dass das Membranpotential zu werden negativ und das Fluoreszenzsignal zu verringern (Abbildung 1). So können Medikamente, die K +-Ausstrom modulieren durch den Kanal GIRK untersucht mit Hilfe eines Fluoreszenz-Plattenlesegerät werden. Im Gegensatz zu anderen Ionenkanal-Screening-Assays, wie Atomabsorptionsspektrometrie 4 oder Radiotracer Analyse 5 stellt die GIRK Kanal Fluoreszenz-Assay einen schnellen, in Echtzeit und kostengünstige Screening-Verfahren.
Protokoll
1. Herstellung von Zellen
- Wachsen Hypophyse AtT20-Zellen in Dulbeccos modifiziertem Eagle-Medium (DMEM) mit 10% Pferdeserum und aufrechtzuerhalten Kulturen bei 37 ° C in einer befeuchteten Atmosphäre von 5% CO 2 ergänzt.
- Pflegen Sie die Kultur durch Subkultivierung der Zellen alle 5 bis 7 Tage mit einem Standard-Verfahren Trypsinierung.
- Die Vertiefungen von schwarzen, klaren unten, 96-well Platten mit 50 ul von Poly-L-Lysin. Die Vertiefungen für 30 Minuten in den Inkubator zu trocknen.
- Tafel die Zellen in den Platten mit 96 Vertiefungen, enthaltend 200 ul Medium bei einer Dichte von 30.000 Zellen pro Vertiefung und Lagerung der Zellen in dem Inkubator für 3-4 Tage.
- Verwenden eine Aspiration Setup, bestehend aus einem verschlossenen 4-Liter-Flasche mit einer Vakuumquelle an einem Ende und einem 200 ul Pipettenspitze an dem anderen Ende, langsam absaugen Kulturmedium aus der Zellmonolayer.
- Waschen Sie die Zellen mit 200 ul normalen Pufferlösung (132 mM NaCl, 5 mM KCl, 1 mM CaCl 2, 1 mM MgCl 2, 5 mM Dextrose, 5 mM HEPES, pH 7,4 mit NaOH).
- Geben Sie 200 ul Puffer Lösung, die das Membranpotential-sensitiven Farbstoffs (MPD) DIBAC 4 (3) oder HLB 021-152 (5 pM) in jede Vertiefung und inkubieren Sie die Zellen für 40 min bei 37 ° C
2. Vorbereitung der Testverbindungen und Cell Treatment
- Bereiten Sie eine serielle Verdünnung der Testverbindungen (Standard = 10 mM in DMSO) aus einer Verbindung Bibliothek (in 96-Well-Format) mit einer Versette (ThermoFisher) automatisierte Liquid-Handling-System.
- Entfernen Sie die 96-Well Platte, welche die AtT20 Zellen aus dem Inkubator und damit die Platte an die Raumtemperatur anpassen. Absaugen der alte Puffer und durch frisches Pufferlösung, die die MPD an die Zellen.
- Mit der Liquid-Handling-System anwenden verschiedenen Konzentrationen (10 nM bis 10 pM) der Testverbindungen (2 bis 20 ul) und Control-Lösungen (0,1% DMSO) (in Pufferlösung containing der MPD) an die 96-Well-Platte mit den Zellen.
- Inkubieren der Zellen für 5 min mit Testverbindungen vor der Fluoreszenz-Messungen.
3. Die Aktivierung von GIRK Kanäle, Neonlicht Messung und Analyse
- Legen Sie die 96-Well-Platte in eine Biotek Synergy2 fluoreszierenden Platte Leser und erhalten Sie die fluoreszierenden Hintergrund Signal an Anregungs-und Emissionswellenlänge von 520 und 560 nm auf.
- Anwenden der GPCR-Liganden (Somatostatin = 200 nM oder Carbachol = 10 pM) oder Kontroll-Lösung (Puffer allein) (20 mL) in die Vertiefungen (Gesamtvolumen = 220 mL), um die Kanäle mit den GIRK Synergy2 Injektor zu aktivieren. Daten sammeln Punkte bei 10 s Intervallen über einen 300 s Abtastperiode bei Anregungs-und Emissionswellenlänge von 520 und 560 nm auf.
- Besorgen Sie den zeitlichen Verlauf und Spitze-Amplitude des fluoreszierenden Änderung über Biotek Gen5 Software und exportieren Sie die Daten nach Excel zur weiteren Analyse.
- Berechnen Sie die Z'-Faktor, um die Zuverlässigkeit des Tests zu bestimmen. Platten für Z'-Faktor Bestimmung verwendet wurde, enthielt zwei Reihen von jeweils positiv (GPCR-Liganden) und negativen (Puffer allein) Kontrollen. Die Z'-Faktor ist definiert als: Z '= 1 - (P + 3σ 3σ N) / | μ P - μ N |, wobei μ μ P & N sind das Mittel der positive und negative Steuersignale und &sgr; P & · N sind die Standardabweichungen der positive und negative Steuersignale, bzw. 6. Z'-Faktoren im Bereich von 0,5 bis 1,0 zeigen, dass die Qualität des Assays ausgezeichnete 6 ist. Platten mit Z'-Faktoren unter 0,5 werden aus der Analyse ausgeschlossen.
- Verbindungen, die die Fluoreszenz-Signal modulieren, werden in Gegenwart von Ba 2 + oder tertiapin-Q erneut getestet, um Einwärtsgleichrichter K +-Kanal Spezifität zu bestätigen.
4. Repräsentativer Ergebnisse
Ein Beispiel des Fluoreszenzsignals unter Verwendung des GIRK Kanal Assay wird in 2 gezeigt. Die Zugabe des GPCR-Liganden Somatostatin (200 nM), um den AtT20-Zellen verursachte eine schnelle, zeitabhängige Abnahme der HLB 021-152 Fluoreszenzsignal (2). Im Gegensatz dazu erzeugte Zugabe von Kontrolllösung eine kleine schnelle Anstieg in der Fluoreszenz, die mit der Zeit auf die Grundlinie zurück (Abb. 2). Vergleich der Spitzenwert Fluoreszenzwerte in 96-Well-Platten mit Steuerung und Somatostatin-Lösungen injiziert hat eine Z'-Faktoren im Bereich von 0,5 bis 0,7. Für weitere Quantifizierung wurde die Kontrolle Datensatz aus der Somatostatin-Rekord subtrahiert und der resultierende Somatostatin-und Kleinschreibung Signal analysiert (Abbildung 2).
Der Test stellt ein Verfahren zur schnellen Identifizierung Medikamente, die GIRK Kanäle modulieren. Zum Beispiel Medikamente, die Hemmung der GIRK channel sollte GPCR-Liganden-vermittelte Abnahme der Fluoreszenz, indem verhindert wird K +-Ausstrom aus den Zellen zu reduzieren. Wie in 3, der Behandlung der Zellen mit tertiapin-Q, ein Toxin gezeigt, dass Blöcke GIRK Kanäle 7, die eine Hemmung der Somatostatin-vermittelte Fluoreszenz Änderung hergestellt. Propafenon, ein Antiarrhythmikum, dass die Blöcke GIRK Kanäle im Herzen 8, inhibierte auch den fluoreszierenden Änderung (Abbildung 4). Der Assay kann auch nützlich sein zur Identifizierung von Aktivatoren der GIRK Kanal. Die Anwendung dieser Ethanol (100 & 200 mM), verursacht ein Aktivator des Kanals GIRK 2,3, keine signifikante Veränderung des Fluoreszenzsignals im Vergleich zur Lösung (p> 0,5) zu steuern.
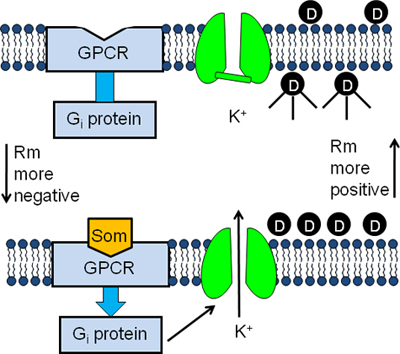
Abbildung 1. Experimentelle Gestaltung des GIRK Kanal Fluoreszenz-Assay. AtT20-Zellen werden in einem Puffer mit einer Membran inkubierte Potential Fluoreszenzfarbstoff (D). Die Farbstoffmoleküle geben Sie in die Zellen und werden nach der Bindung an intrazelluläre Proteine (oben) fluoreszierend. Die Bindung von Somatostatin (SOM) in seine GPCR stimuliert die inhibitorische Protein G (G i) bewirkt die Aktivierung des GIRK Kanal (unten). Die anschließende Efflux von K + aus der Zellen bewirkt, dass das Membranpotential weiter in den negativen und die Farbstoffmoleküle, um die Zellen zu verlassen. Als Ergebnis können die Fluoreszenzsignal abnimmt (unten).
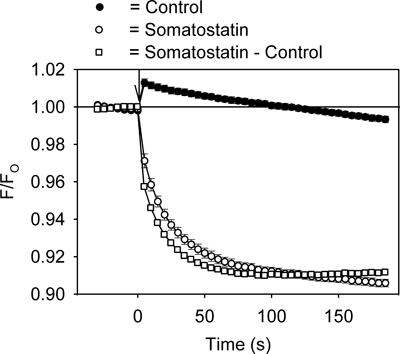
Abbildung 2. Vertreter HLB 021-152 Fluoreszenzsignal im Laufe der Zeit in den AtT20 Zellen während der Zugabe von Somatostatin-oder Kontroll-Lösung gemessen. Das Verhältnis der Fluoreszenzintensität (F / F O) wurde durch Teilen des Signals in Gegenwart (F) von Somatostatin (oder Kontroll-Lösung) von der Grundlinie Signal vor (F O) gemessen wird, berechnet addition von Somatostatin (oder Control-Lösung). Jeder Punkt stellt den Mittelwert ± SE in 5-6 Vertiefungen erhalten. Somatostatin oder Kontrolle wurde zum Zeitpunkt Null (↓) zugegeben. Die Zugabe des Kontrolllösung führte zu einer geringen vorübergehender Anstieg des Fluoreszenzsignals. Dies resultiert aus einer Temperaturänderung durch Injektion der Lösung verursacht.

3. Behandlung der Zellen mit AtT20 tertiapin-Q (500 nM) hemmt die Somatostatin-vermittelte Abnahme der Fluoreszenz-Signal durch Bindung an und blockiert die GIRK Kanäle. Jeder Punkt stellt den Mittelwert ± SE in 4-6 Brunnen erhalten. Somatostatin wurde zum Zeitpunkt Null (↓) zugegeben.
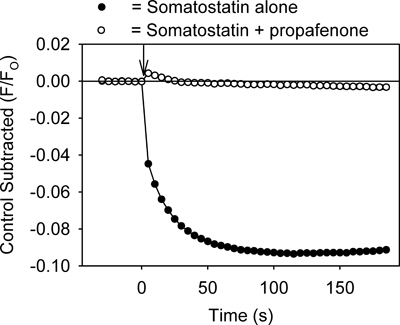
Abbildung 4. Die Behandlung der Zellen mit AtT20 Propafenon (20 uM) hemmt auch die Somatostatin-vermittelten Abnahme derdas Fluoreszenzsignal. Jeder Punkt stellt den Mittelwert ± SE in 5-6 Vertiefungen erhalten. Somatostatin wurde zum Zeitpunkt Null (↓) zugegeben.
Diskussion
Während Membranpotential Fluoreszenzfarbstoffe verwendet wurden, um Medikamente, die Ionenkanäle modulieren 9,10 zu identifizieren, ist dies der erste Bericht über ihre Anwendung für die neuronale GIRK Channel Drug Discovery. Die GIRK Kanal Fluoreszenz-Assay hier vorgestellten bietet eine schnelle, zuverlässige und Echtzeit-Methode für das Screening von Liganden-gesteuerte K +-Kanäle. Der Assay kann zur Verwendung mit einer Vielzahl von Zellen, einschließlich immortalisierten Zelllinien (HE...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde vom US Public Health Service Award NS-071530 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| DMEM | CellGro | 10-013 | |
| Pferdeserum | Invitrogen | 16050-114 | |
| 96-Well-Platten | Corning | 3603 | |
| Poly-L-Lysin | Sigma-Aldrich | P4707 | |
| Somatostatin | Sigma-Aldrich | S9129 | |
| Carbachol | Sigma-Aldrich | C4382 | |
| HLB 021-152 | AnaSpec | 89300 | |
| Versette automatisierten Liquid Handler | ThermoFisher | 650-01 | |
| Synergy2 fluoreszierenden Platte Leser | Biotek | ||
| Gen5 Analyse software | Biotek |
Tabelle 1. Tabelle der spezifischen Reagenzien und Geräte.
Referenzen
- Hibino, H. Inward rectifying potassium channels: their structure, function and physiological roles. Physiol. Rev. 90, 291-366 (2010).
- Lusscher, C., Slesinger, P. A. Emerging roles for G protein-gated inwardly rectifying potassium (GIRK) channels in health and disease. Nat. Rev. Neurosci. 11, 301-315 (2010).
- Kobayashi, T., Ikeda, K. G protein-activated inwardly rectifying potassium channels as potential therapeutic targets. Cur. Pharm. Des. 12, 4513-4523 (2006).
- Terstappen, G. C. Functional analysis of native and recombinant ion channels using a high-capacity nonradioactive rubidium efflux assay. Anal. Biochem. 272, 149-155 (1999).
- Cheng, C. S. A high-throughput HERG potassium channel function assay: an old assay with a new look. Drug Dev. Ind. Pharm. 28, 177-191 (2002).
- Zhang, J. -. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screen. 4, 67-73 (1999).
- Jin, W., Lu, Z. A novel high-affinity inhibitor for inward-rectifier K+ channels. Biochem. 37, 13291-13299 (1998).
- Inomata, N. Anti-arrhythmic agents act differently on the activation phase of the Ach-response in guinea pig atrial myocytes. Br. J. Pharmacol. 108, 111-116 (1993).
- Tang, W. Development and evaluation of high throughput functional assay methods for HERG potassium channel. J. Biomol. Screen. 6, 325-331 (2001).
- Wolff, C., Fuks, B., Chatelain, P. Comparative study of membrane potential-sensitive fluorescent probes and their use in ion channel screening assays. J. Biomol. Screen. 8, 533-513 (2003).
- Niswender, C. M., Johnson, K. A., Luo, Q., Avala, J. E., Kim, C., Conn, P. J., Weaver, C. D. A novel assay of Gi/o-linked G protein-coupled receptor coupling to potassium channels provides new insights into the pharmacology of group III metabotropic glutamate receptors. Mol. Pharm. 73, 1213-1224 (2008).
- Bridal, T. R., Marquilis, M., Wang, X., Donio, M., Sorota, S. Comparison of human Ether-á-go-go related gene screening assays based on IonWorks Quattro and thallium flux. Assay Drug Dev. Technol. 8, 755-765 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten