Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de cribado para la identificación de moduladores fluorescente de canales GIRK
En este artículo
Resumen
Un tiempo real procedimiento de detección para identificar los medicamentos que interactúan con la proteína G-gated K hacia el interior del rectificador + (GIRK) canales se describe. El ensayo utiliza la membrana potencial sensibles tintes fluorescentes para medir la actividad GIRK canal. Esta técnica es adaptable para su uso en un número de líneas celulares.
Resumen
G cerradas en proteínas internas del rectificador de K + (GIRK) los canales funcionan como mediadores celulares de una amplia variedad de hormonas y los neurotransmisores y se expresan en el cerebro, corazón, músculo esquelético y 1,2 tejido endocrino. GIRK canales se activan tras la unión de ligandos (neurotransmisores, hormonas, medicamentos, etc) para su plasma unida a la membrana, acoplados a proteínas G receptores (GPCR). Esta unión hace que la estimulación de las proteínas G (G i y o G) que posteriormente se unen y activan el canal GIRK. Una vez abierto el canal GIRK permite el movimiento de K + fuera de la célula causando la membrana en reposo potencial de ser más negativo. Como consecuencia, la activación GIRK canal en las neuronas disminuye la formación espontánea potencial de acción e inhibe la liberación de neurotransmisores excitatorios. En el corazón, la activación del canal GIRK inhibe la actividad de marcapasos por lo tanto reducir la frecuencia cardíaca. 3. Sin embargo, la farmacología de estos canales sigue siendo en gran parte inexplorado. A pesar de una serie de fármacos, incluyendo agentes antiarrítmicos, antipsicóticos y antidepresivos bloquear el canal GIRK, esta inhibición no es selectiva y se presenta en concentraciones relativamente altas de drogas 3.
A continuación, describimos un ensayo de cribado en tiempo real para la identificación de nuevos moduladores de canales GIRK. En este ensayo, las células neuronales AtT20, expresando canales GIRK, se cargan con el potencial de membrana sensibles tintes fluorescentes tales como bis-(1,3-dibutylbarbituric ácido) trimethine oxonol [DiBAC 4 (3)] o HLB 021-152 (Figura 1 ). Las moléculas de colorante convertido absorción siguiente fuertemente fluorescente en las células (Figura 1). Tratamientode las células con ligandos GPCR estimula los canales GIRK para abrir. El resultante salida de K + fuera de la célula hace que el potencial de membrana a ser más negativo y la señal fluorescente a disminuir (Figura 1). Así, los fármacos que modulan la salida de K + a través del canal GIRK puede ensayarse utilizando un lector de placa fluorescente. A diferencia de otros ensayos de detección de iones de canal, como la espectrometría de absorción atómica 4 o 5 radiotrazador de análisis, el ensayo GIRK canal de fluorescencia proporciona un procedimiento de detección rápida, en tiempo real y de bajo costo.
Protocolo
1. Preparación de las células
- Crece pituitarias AtT20 células en medio de Eagle modificado de Dulbecco (DMEM) suplementado con suero de caballo al 10% y mantener cultivos a 37 ° C en una atmósfera humidificada de 5% de CO 2.
- Mantener el cultivo por las células subcultivo cada 5 a 7 días utilizando un procedimiento estándar tripsinización.
- Cubra los pocillos de fondo negro, claro, placas de 96 pocillos con 50 l de ácido poli-L-lisina. Permita que los pozos se sequen durante 30 minutos en la incubadora.
- Placa de las células en las placas de 96 pocillos que contienen 200 l de medios a una densidad de 30.000 células por pocillo y almacenar las células en la incubadora durante 3-4 días.
- Utilizar una configuración aspiración, que consiste en un frasco tapado 4 litros conectado a un vacío en un extremo y una punta de pipeta 200 l en el otro extremo, para aspirar lentamente el medio de cultivo de la monocapa celular.
- Se lavan las células con 200 l de solución tampón normal (132 mM de NaCl, 5 mM de KCl, 1 mM CaCl 2, 1 mM de MgCl 2, 5 mM de dextrosa, HEPES 5 mM, pH 7,4 con NaOH).
- Añadir 200 l de solución tampón que contiene el potencial de membrana sensible al colorante (MPD) DiBAC 4 (3) o HLB 021-152 (5 M) a cada pocillo y se incuba a las células durante 40 min a 37 ° C.
2. Preparación de compuestos de ensayo y de tratamiento de la célula
- Preparar una serie de dilución de los compuestos de ensayo (stock = 10 mM en DMSO) a partir de una biblioteca compuesto (en formato de 96 pocillos), utilizando un Versette (ThermoFisher) sistema automatizado de tratamiento de líquidos.
- Retirar la placa de 96 pocillos, que contiene las células AtT20, de la incubadora y permitir que la placa para volver a la temperatura ambiente. Aspirar fuera del tampón de edad y aplicar la solución tampón fresco que contiene el MPD a las células.
- Usando el sistema de tratamiento de líquidos se aplican diversas concentraciones (10 nM a 10 mM) de los compuestos de ensayo (2 a 20 l) y soluciones de control (0,1% DMSO) (en solución tampón containing del MPD) a la placa de 96 pocillos que contenía las células.
- Se incuban las células durante 5 min con compuestos de ensayo antes de las mediciones fluorescentes.
3. La activación de los canales GIRK, fluorescente Medición y Análisis
- Insertar la placa 96-bien en un lector de placa Biotek Synergy2 fluorescente y obtener la señal de fondo fluorescente en longitudes de onda de excitación y emisión de 520 nm y 560, respectivamente.
- Aplicar los ligandos GPCR (somatostatina = 200 nM o carbacol = 10 uM) o la solución de control (tampón solo) (20 l) a los pocillos (volumen total = 220 l) para activar los canales GIRK utilizando el sistema Synergy2 inyector. Recoge los puntos de datos en intervalos de 10 s durante un período de muestreo de 300 s en longitudes de onda de excitación y emisión de 520 nm y 560, respectivamente.
- Obtener el transcurso del tiempo y la amplitud pico del cambio fluorescente mediante Biotek Gen5 software y exportar los datos a Excel para su posterior análisis.
- Calcular la Z 'factor para determinar la fiabilidad del ensayo. Las placas utilizadas para la determinación de Z 'factor contenido 2 filas cada uno de los positivos (ligando GPCR) y controles negativos (tampón solo). El factor de Z 'se define como: Z = 1 - (P + 3σ 3σ N) / | μ P - N μ |, donde μ μ P & N son los medios del control positivo y las señales de control negativo, y • P & N σ son las desviaciones estándar del control positivo y las señales de control negativo, respectivamente 6. Z 'factores en el rango de 0,5 a 1,0 indican que la calidad del ensayo es excelente 6. Placas con Z 'factores por debajo de 0,5 se excluyen del análisis.
- Los compuestos que modulan la señal fluorescente se vuelven a probar en presencia de Ba 2 + o tertiapin-Q para confirmar hacia adentro K + rectificador especificidad canal.
4. RResultados epresentante
Un ejemplo de la señal de fluorescencia medida usando el ensayo de canal GIRK se muestra en la Figura 2. La adición de la somatostatina ligando GPCR (200 nM) a las células AtT20 causado una rápida, dependiente del tiempo disminución en el HLB 021-152 señal fluorescente (Figura 2). En contraste, la adición de solución de control producido un pequeño aumento en la fluorescencia instantánea que con el tiempo volvió a la línea de base (Figura 2). La comparación de los valores de pico fluorescentes en placas de 96 pocillos inyectados con soluciones de control y somatostatina dio unos factores Z 'en el intervalo de 0,5 a 0,7. Para la cuantificación adicional, el registro de control se restó de la somatostatina y el registro resultante somatostatina sensible señal analizados (Figura 2).
El ensayo proporciona un método para identificar rápidamente los fármacos que modulan canales GIRK. Por ejemplo, los fármacos que inhiben el cha GIRKnnel debería reducir GPCR mediadas ligando-disminuye en la fluorescencia mediante la prevención de salida de K + de las células. Como se muestra en la Figura 3, el tratamiento de las células con tertiapin-Q, una toxina que bloquea los canales GIRK 7, produjo una inhibición de la somatostatina cambio mediada fluorescente. Propafenona, un fármaco anti-arrítmico que bloquea los canales GIRK en el corazón 8, también inhibe el cambio de fluorescencia (Figura 4). El ensayo también puede ser útil para la identificación de los activadores del canal GIRK. Sin embargo, la aplicación de etanol (100 y 200 mM), un activador del canal GIRK 2,3, causó ningún cambio significativo en la señal fluorescente cuando se compara con la solución de control (p> 0,5).
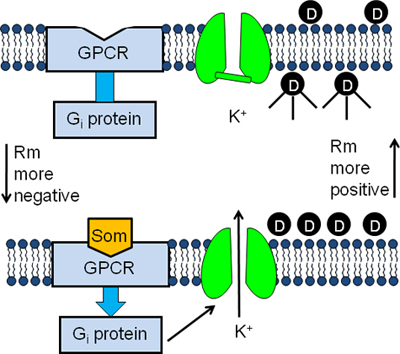
Figura 1. Diseño experimental del ensayo GIRK canal fluorescente. AtT20 células se incubaron en tampón que contiene una membranae potencial sensible tinte fluorescente (D). Las moléculas de colorante entrar en las células y se vuelven fluorescentes al unirse a las proteínas intracelulares (panel superior). La unión de la somatostatina (SOM) a su GPCR estimula la proteína inhibidora G (G i) causando la activación del canal GIRK (panel inferior). El flujo de salida posterior de K + fuera de las células hace que el potencial de membrana a ser más negativo y las moléculas de colorante para salir de las células. Como resultado de las disminuciones señal fluorescente (panel inferior).
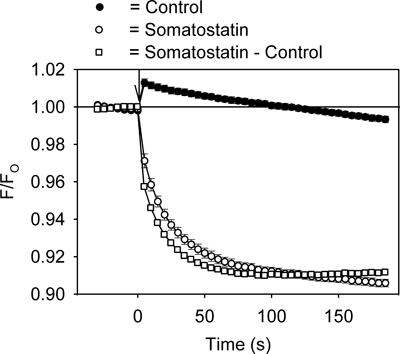
Figura 2. Representante HLB 021-152 señal fluorescente medido a través del tiempo en las células AtT20 durante la adición de la somatostatina o solución de control. La relación de la intensidad fluorescente (F / F O) se calculó dividiendo la señal en la presencia (F) de la somatostatina (o solución de control) por la señal de referencia medido antes (F O) anunciocondición de la somatostatina (o solución de control). Cada punto representa la media ± SE obtenido en 5-6 pocillos. La somatostatina o solución de control se añadió en el momento cero (↓). La adición de la solución de control causó un pequeño aumento transitorio de la señal fluorescente. Esto dio como resultado de un cambio de temperatura causado por la inyección de la solución.

Figura 3. Tratamiento de las células AtT20 con tertiapin-Q (500 nM) inhibe la disminución somatostatina mediada en la señal fluorescente mediante la unión a los canales y bloqueo GIRK. Cada punto representa la media ± error estándar obtenido en los pozos de 4-6. La somatostatina se añadió en el momento cero (↓).
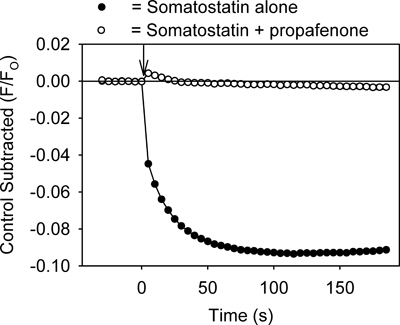
Figura 4. Tratamiento de las células AtT20 con propafenona (20 mM) también inhibe la disminución somatostatina mediada enla señal fluorescente. Cada punto representa la media ± SE obtenido en 5-6 pocillos. La somatostatina se añadió en el momento cero (↓).
Discusión
Si bien el potencial de membrana sensibles tintes fluorescentes se han utilizado para identificar los fármacos que modulan los canales iónicos 9,10, este es el primer informe de su aplicación para las neuronas de drogas GIRK Discovery Channel. El ensayo GIRK canal de fluorescencia que aquí se presenta ofrece un método rápido, fiable y en tiempo real para la detección de ligandos canales de K +. El ensayo puede ser modificado para su uso con una amplia gama de células inmortalizadas, incluye...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por EE.UU. Premio de Servicio Público de Salud NS-071530.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| DMEM | CellGro | 10-013 | |
| El suero de caballo | Invitrogen | 16050-114 | |
| Placas de 96 pocillos | Corning | 3603 | |
| Poli-l-lisina | Sigma-Aldrich | P4707 | |
| La somatostatina | Sigma-Aldrich | S9129 | |
| Carbacol | Sigma-Aldrich | C4382 | |
| HLB 021-152 | AnaSpec | 89300 | |
| Versette controlador de líquido automatizado | ThermoFisher | 650-01 | |
| Synergy2 lector de placas fluorescentes | Biotek | ||
| Gen5 análisis de software | Biotek |
Tabla 1. Tabla de reactivos y equipos específicos.
Referencias
- Hibino, H. Inward rectifying potassium channels: their structure, function and physiological roles. Physiol. Rev. 90, 291-366 (2010).
- Lusscher, C., Slesinger, P. A. Emerging roles for G protein-gated inwardly rectifying potassium (GIRK) channels in health and disease. Nat. Rev. Neurosci. 11, 301-315 (2010).
- Kobayashi, T., Ikeda, K. G protein-activated inwardly rectifying potassium channels as potential therapeutic targets. Cur. Pharm. Des. 12, 4513-4523 (2006).
- Terstappen, G. C. Functional analysis of native and recombinant ion channels using a high-capacity nonradioactive rubidium efflux assay. Anal. Biochem. 272, 149-155 (1999).
- Cheng, C. S. A high-throughput HERG potassium channel function assay: an old assay with a new look. Drug Dev. Ind. Pharm. 28, 177-191 (2002).
- Zhang, J. -. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screen. 4, 67-73 (1999).
- Jin, W., Lu, Z. A novel high-affinity inhibitor for inward-rectifier K+ channels. Biochem. 37, 13291-13299 (1998).
- Inomata, N. Anti-arrhythmic agents act differently on the activation phase of the Ach-response in guinea pig atrial myocytes. Br. J. Pharmacol. 108, 111-116 (1993).
- Tang, W. Development and evaluation of high throughput functional assay methods for HERG potassium channel. J. Biomol. Screen. 6, 325-331 (2001).
- Wolff, C., Fuks, B., Chatelain, P. Comparative study of membrane potential-sensitive fluorescent probes and their use in ion channel screening assays. J. Biomol. Screen. 8, 533-513 (2003).
- Niswender, C. M., Johnson, K. A., Luo, Q., Avala, J. E., Kim, C., Conn, P. J., Weaver, C. D. A novel assay of Gi/o-linked G protein-coupled receptor coupling to potassium channels provides new insights into the pharmacology of group III metabotropic glutamate receptors. Mol. Pharm. 73, 1213-1224 (2008).
- Bridal, T. R., Marquilis, M., Wang, X., Donio, M., Sorota, S. Comparison of human Ether-á-go-go related gene screening assays based on IonWorks Quattro and thallium flux. Assay Drug Dev. Technol. 8, 755-765 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados