È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un test di screening a fluorescenza per l'identificazione di modulatori Canali GIRK
In questo articolo
Riepilogo
A real-time procedura di screening per identificare i farmaci che interagiscono con la proteina G-gated verso l'interno raddrizzatore K + (GIRK) canali viene descritto. Il test utilizza coloranti fluorescenti potenziale di membrana sensibili per misurare l'attività dei canali GIRK. Questa tecnica è adattabile per l'uso su un certo numero di linee cellulari.
Abstract
Proteina G-dipendenti verso l'interno del raddrizzatore K + (GIRK) canali di agire come mediatori cellulari di una vasta gamma di ormoni e neurotrasmettitori e sono espressi nel cervello, cuore, muscolo scheletrico e del tessuto endocrino 1,2. GIRK canali si attivano in seguito il legame di ligandi (ormoni, neurotrasmettitori, farmaci, ecc) per la loro membrana plasmatica-bound, accoppiati a proteine G recettori (GPCR). Tale legame determina la stimolazione delle proteine G (G e G o i) che legano e successivamente attivare il canale GIRK. Una volta aperto il canale GIRK consente il movimento di K + fuori dalla cellula causando la membrana riposo potenziale di diventare più negativo. Di conseguenza, canale attivazione GIRK in neuroni diminuisce formazione spontanea potenziale di azione e inibisce il rilascio di neurotrasmettitori eccitatori. Nel cuore, l'attivazione del canale GIRK inibisce l'attività del pacemaker così rallentando la frequenza cardiaca. 3. Tuttavia, la farmacologia di questi canali rimane in gran parte inesplorato. Sebbene un certo numero di farmaci anti-aritmici tra cui agenti, i farmaci antipsicotici e antidepressivi bloccare il canale GIRK, questa inibizione non è selettiva e si verifica a concentrazioni relativamente elevate di droga 3.
Qui, noi descriviamo un tempo reale saggio di screening per identificare modulatori di nuovi canali GIRK. In questo saggio, cellule neuronali AtT20, che esprimono canali GIRK, vengono caricati con membrana coloranti fluorescenti sensibili potenziale come bis-(1,3-dibutylbarbituric acido) trimethine oxonol [DiBAC 4 (3)] o HLB 021-152 (Figura 1 ). Le molecole di colorante fluorescente diventano fortemente seguente captazione nelle cellule (Figura 1). Trattamentodelle cellule con leganti GPCR stimola i canali GIRK per aprire. La risultante K + efflusso fuori dalla cellula causa del potenziale di membrana a diventare più negativo e il segnale fluorescente per diminuire (Figura 1). Pertanto, i farmaci che modulano K + efflusso attraverso il canale GIRK può essere saggiata usando un lettore di piastra fluorescente. A differenza di altri saggi di screening dei canali ionici, quali spettrometria di assorbimento atomico o 4 radiotracciante analisi 5, il saggio GIRK canale fluorescente fornisce una procedura di screening rapido, in tempo reale e poco costoso.
Protocollo
1. Preparazione delle cellule
- Grow pituitari AtT20 cellule in terreno Dulbecco modificato Eagle (DMEM) supplementato con siero di cavallo 10% e mantenere colture a 37 ° C in atmosfera umidificata al 5% CO 2.
- Mantenere la cultura Trapianto delle cellule ogni 5 a 7 giorni utilizzando una procedura standard tripsinizzazione.
- Coat i pozzi di nero, fondo chiaro, piastre a 96 pozzetti con 50 pl di poli-L-lisina. Lasciare asciugare i pozzetti per 30 minuti in incubatrice.
- Piastra le cellule nelle piastre a 96 pozzetti contenenti 200 pl mezzi a densità di 30.000 cellule per pozzetto e conservare le cellule in incubatore per 3-4 giorni.
- Utilizzare una configurazione aspirazione, costituito da un tappo 4 barattolo l collegato ad un vuoto su una estremità e una punta di pipetta 200 pl all'altra estremità, per aspirare lentamente il terreno di coltura del monostrato cellulare.
- Lavare le cellule con 200 pl di soluzione tampone normale (132 mM NaCl, 5 mM KCl, 1 mM CaCl 2, 1 mM MgCl 2, destrosio 5 mM, HEPES 5 mM, pH 7,4 con NaOH).
- Aggiungere 200 pl di soluzione tampone contenente il potenziale-colorante sensibile membrana (MPD) DiBAC 4 (3) o HLB 021-152 (5 pM) a ciascun pozzetto ed incubare le cellule per 40 min a 37 ° C.
2. Preparazione dei composti in esame e il trattamento con cellule
- Preparare una diluizione seriale di composti di prova (fotografia = 10 mM in DMSO) da una libreria composto (in formato a 96 pozzetti) utilizzando un (ThermoFisher) Versette sistema automatizzato di gestione dei liquidi.
- Rimuovere la piastra a 96 pozzetti, contenente le cellule AtT20, dall'incubatore e permettono la piastra di ritornare a temperatura ambiente. Aspirare il buffer sconto vecchio e applicare la soluzione tampone fresco contenente il MPD alle cellule.
- Utilizzando il sistema di manipolazione di liquido applica varie concentrazioni (10 nM a 10 pM) dei composti di prova da 2 a 20 pl) e soluzioni di controllo (0,1% DMSO) (in soluzione tampone containing il MPD) alla piastra a 96 pozzetti contenenti le cellule.
- Incubare le cellule per 5 min con composti di prova prima delle misurazioni fluorescenti.
3. Attivazione di canali GIRK, misurazione e analisi fluorescente
- Inserire la piastra a 96 pozzetti in un lettore di piastre Synergy2 Biotek fluorescente e ottenere il segnale fluorescente di fondo a lunghezze d'onda di eccitazione e di emissione di 520 e 560 nm, rispettivamente.
- Applicare i ligandi GPCR (somatostatina = 200 nM o carbacolo = 10 pM) o la soluzione di controllo (solo tampone) (20 pl) ad ogni pozzetto (volume totale = 220 mL) per attivare i canali GIRK utilizzando il sistema Synergy2 iniettore. Raccogliere punti dati a intervalli di 10 s 300 s per un periodo di campionamento a lunghezze d'onda di eccitazione e di emissione di 520 e 560 nm, rispettivamente.
- Ottenere il decorso e l'ampiezza di picco del cambiamento fluorescente utilizzando Biotek Gen5 software ed esportare i dati in Excel per ulteriori analisi.
- Calcolare il Z'-fattore per determinare l'affidabilità del saggio. Lastre utilizzate per la determinazione Z'-factor contenuta 2 righe ciascuno di positivo (ligando GPCR) e negativi (solo tampone) controlli. Il Z'-fattore è definito come: Z '= 1 - (3σ P + 3σ N) / | P μ - N μ |, dove μ P & μ N sono mezzi di controllo positivo e segnali di controllo negativi, e σ P & N σ sono le deviazioni standard del controllo positivo e segnali di controllo negativo, rispettivamente 6. Z'fattori nell'intervallo da 0.5 a 1.0 indicare che la qualità del saggio è eccellente 6. Piastre con Z'-fattori inferiori a 0,5 sono esclusi dall'analisi.
- Composti che modulano il segnale fluorescente sono riesaminati in presenza di Ba 2 + o tertiapin-Q per confermare attivo raddrizzatore K + specificità canale.
4. RRisultati epresentative
Un esempio del segnale di fluorescenza misurata usando il saggio canale GIRK è mostrato in Figura 2. L'aggiunta della somatostatina ligando GPCR (200 nM) per le cellule AtT20 causato una rapida, dipendente dal tempo diminuzione del segnale fluorescente 021-152 HLB (Figura 2). Al contrario, l'aggiunta di soluzione di controllo prodotto un piccolo aumento istantaneo della fluorescenza che con il tempo restituito al basale (Figura 2). Confronto tra i valori di picco fluorescenti in piastre da 96 pozzetti iniettati con controllo e soluzioni somatostatina dato un Z'fattori nell'intervallo da 0,5 a 0,7. Per ulteriore quantificazione, il record di controllo è stato sottratto dal record somatostatina e la risultante somatostatina sensibile segnale analizzato (Figura 2).
Il saggio fornisce un metodo per identificare rapidamente farmaci che modulano i canali GIRK. Ad esempio, i farmaci che inibiscono la cha GIRKnnel dovrebbe ridurre GPCR ligando-mediate diminuzioni della fluorescenza impedendo K + efflusso dalle cellule. Come mostrato in Figura 3, il trattamento delle cellule con tertiapin-Q, una tossina che blocca i canali GIRK 7, prodotto una inibizione del cambio somatostatina-mediata fluorescente. Propafenone, un farmaco antiaritmico che blocca i canali GIRK nel cuore 8, anche inibito il cambiamento fluorescente (Figura 4). Il dosaggio può anche essere utile per identificare attivatori del canale GIRK. Tuttavia, l'applicazione di etanolo (100 e 200 mM), un attivatore del canale GIRK 2,3, causato alcun cambiamento significativo nel segnale fluorescente rispetto ai controlli soluzione (p> 0,5).
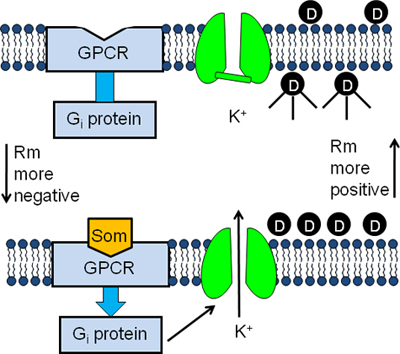
Figura 1. Disegno sperimentale del test GIRK canale fluorescente. AtT20 cellule sono incubate in tampone contenente un Membrane potenziale sensibile colorante fluorescente (D). Le molecole di colorante entrare nelle cellule e diventano fluorescenti sul legame alle proteine intracellulari (pannello superiore). Il legame di somatostatina (Som) alla sua GPCR stimola la proteina G inibitoria (G i) provocando l'attivazione del canale GIRK (pannello inferiore). L'efflusso successiva K + dalle cellule provoca il potenziale di membrana a diventare più negative e le molecole di colorante per uscire le cellule. Come risultato diminuisce segnale fluorescente (pannello inferiore).
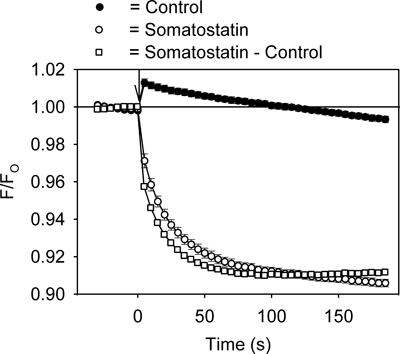
Figura 2. Rappresentante HLB 021-152 segnale fluorescente misurato nel tempo nei AtT20 cellule durante l'aggiunta di somatostatina o soluzione di controllo. Il rapporto tra l'intensità della fluorescenza (F / F O) è stata calcolata dividendo il segnale in presenza (F) di somatostatina (o soluzione di controllo) dal segnale basale misurata prima (F O) annunciodizione della somatostatina (o soluzione di controllo). Ogni punto rappresenta la media ± SE ottenuta in 5-6 pozzetti. La somatostatina o soluzione di controllo è stata aggiunta al tempo zero (↓). Aggiunta della soluzione di controllo ha provocato un piccolo aumento transitorio del segnale fluorescente. Questo risultato di una variazione di temperatura causato dalla iniezione della soluzione.

Figura 3. Trattamento delle cellule con AtT20 tertiapin-Q (500 nM) inibisce la somatostatina-mediata diminuzione del segnale fluorescente legandosi e bloccando i canali GIRK. Ogni punto rappresenta la media ± SE ottenuta in 4-6 pozzetti. La somatostatina è stato aggiunto al tempo zero (↓).
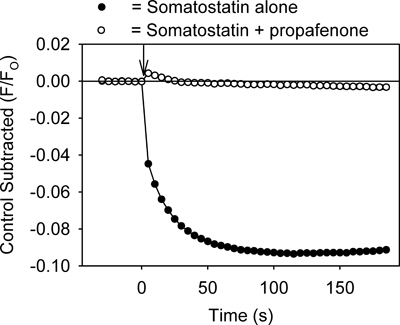
Figura 4. Trattamento delle cellule con AtT20 propafenone (20 pM) inibisce anche la somatostatina-mediata diminuzioneil segnale fluorescente. Ogni punto rappresenta la media ± SE ottenuta in 5-6 pozzetti. La somatostatina è stato aggiunto al tempo zero (↓).
Discussione
Mentre il potenziale di membrana coloranti fluorescenti sensibili sono stati utilizzati per identificare i farmaci che modulano i canali ionici 9,10, questo è il primo rapporto della loro applicazione per la scoperta di farmaci neuronale GIRK canale. Il saggio GIRK canale fluorescente qui presentato fornisce un metodo rapido, affidabile e in tempo reale per lo screening del ligando-dipendenti canali del K +. Il dosaggio può essere modificato per l'utilizzo con un'ampia gamma di cellule, c...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da premio statunitense Public Health Service NS-071530.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| DMEM | Cellgro | 10-013 | |
| Siero di cavallo | Invitrogen | 16050-114 | |
| 96-pozzetti | Corning | 3603 | |
| Poly-L-lisina | Sigma-Aldrich | P4707 | |
| Somatostatina | Sigma-Aldrich | S9129 | |
| Carbacolo | Sigma-Aldrich | C4382 | |
| HLB 021-152 | AnaSpec | 89300 | |
| Versette gestore automatizzata dei liquidi | ThermoFisher | 650-01 | |
| Synergy2 lettore di piastre a fluorescenza | Biotek | ||
| Gen5 analisi software | Biotek |
Tabella 1. Tabella di reagenti e attrezzature specifiche.
Riferimenti
- Hibino, H. Inward rectifying potassium channels: their structure, function and physiological roles. Physiol. Rev. 90, 291-366 (2010).
- Lusscher, C., Slesinger, P. A. Emerging roles for G protein-gated inwardly rectifying potassium (GIRK) channels in health and disease. Nat. Rev. Neurosci. 11, 301-315 (2010).
- Kobayashi, T., Ikeda, K. G protein-activated inwardly rectifying potassium channels as potential therapeutic targets. Cur. Pharm. Des. 12, 4513-4523 (2006).
- Terstappen, G. C. Functional analysis of native and recombinant ion channels using a high-capacity nonradioactive rubidium efflux assay. Anal. Biochem. 272, 149-155 (1999).
- Cheng, C. S. A high-throughput HERG potassium channel function assay: an old assay with a new look. Drug Dev. Ind. Pharm. 28, 177-191 (2002).
- Zhang, J. -. H., Chung, T. D. Y., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screen. 4, 67-73 (1999).
- Jin, W., Lu, Z. A novel high-affinity inhibitor for inward-rectifier K+ channels. Biochem. 37, 13291-13299 (1998).
- Inomata, N. Anti-arrhythmic agents act differently on the activation phase of the Ach-response in guinea pig atrial myocytes. Br. J. Pharmacol. 108, 111-116 (1993).
- Tang, W. Development and evaluation of high throughput functional assay methods for HERG potassium channel. J. Biomol. Screen. 6, 325-331 (2001).
- Wolff, C., Fuks, B., Chatelain, P. Comparative study of membrane potential-sensitive fluorescent probes and their use in ion channel screening assays. J. Biomol. Screen. 8, 533-513 (2003).
- Niswender, C. M., Johnson, K. A., Luo, Q., Avala, J. E., Kim, C., Conn, P. J., Weaver, C. D. A novel assay of Gi/o-linked G protein-coupled receptor coupling to potassium channels provides new insights into the pharmacology of group III metabotropic glutamate receptors. Mol. Pharm. 73, 1213-1224 (2008).
- Bridal, T. R., Marquilis, M., Wang, X., Donio, M., Sorota, S. Comparison of human Ether-á-go-go related gene screening assays based on IonWorks Quattro and thallium flux. Assay Drug Dev. Technol. 8, 755-765 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon