Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Verwendung von Mikroumgebung Microarrays (MEArrays)
In diesem Artikel
Zusammenfassung
Eine kombinatorische funktionelle Screening-Methode für Einblicke in die Auswirkungen der molekularen Zusammensetzung der Mikroumgebung auf zelluläre Funktionen beschrieben. Das Verfahren nutzt bestehende Biochip-basierten Technologien, um Arrays von definierten kombinatorischen Mikroumgebungen, dass Zelladhäsion und funktionelle Analyse unterstützt generieren.
Zusammenfassung
Die Wechselwirkungen zwischen Zellen und ihrer Umgebung Mikroumgebung funktionelle Konsequenzen für zelluläres Verhalten. Auf der einzigen Zelle Ebene können unterschiedliche Mikroumgebungen verhängen Differenzierung, Migration und Proliferation Phänotypen, und auf der Gewebe-Ebene die Mikroumgebung verarbeitet so komplex wie Morphogenese und Tumorentstehung 1. Nicht nur, dass die Zell-und Molekularbiologie Inhalt Mikroumgebungen Auswirkungen die Zellen innerhalb, aber so tun die Elastizität 2 und Geometrie 3 des Gewebes. Definiert als die Summe der Zell-Zell-,-ECM und löslichen Faktor Wechselwirkungen neben physikalischen Eigenschaften ist der Mikroumgebung komplex. Die Phänotypen von Zellen innerhalb eines Gewebes sind teilweise auf Grund ihrer genomischen Inhalt und teilweise auf die Wechselwirkungen mit der kombinatorischen microenviroment. Eine große Herausforderung ist es, bestimmte Kombinationen von Mikroumgebung Komponenten mit charakteristischen Verhaltensweisen zu verknüpfen. ent "> Hier präsentieren wir die Mikroumgebung Mikroarray (MEArray)-Plattform für zellbasierte funktionelles Screening von Wechselwirkungen mit kombinatorischen Mikroumgebungen 4. Das Verfahren erlaubt die gleichzeitige Steuerung der molekularen Zusammensetzung und der Elastizitätsmodul und kombiniert die Verwendung von allgemein verfügbar Microarray und Mikrostrukturierung Technologien. MEArray Bildschirme benötigen so wenige wie 10.000 Zellen pro Array, welches funktionelle Studien von seltenen Zelltypen wie adulte Progenitorzellen erleichtert. Eine Begrenzung der Technik ist, dass ganze Gewebe Mikroumgebungen nicht vollständig auf MEArrays rekapituliert werden. jedoch Vergleich Antworten in der gleichen Zelltyp zu zahlreichen verwandten Mikroumgebungen beispielsweise paarweise Kombinationen von ECM-Proteinen, die eine gegebene Gewebes zu charakterisieren, werden Erkenntnisse, wie Mikroumgebungsbedingungen Komponenten hervorzurufen gewebespezifischen funktionellen Phänotypen bereitzustellen.
MEArrays gedruckt unter Verwendung einer Vielzahl von rekombinantem gro werdenwth Faktoren, Cytokine und gereinigtes ECM Proteine, und Kombinationen davon. Die Plattform wird nur durch die Verfügbarkeit von spezifischen Reagenzien begrenzt. MEArrays zugänglich sind Zeitraffer Analyse, aber am häufigsten für Endpunkt-Analysen von Zellfunktionen, die messbar sind mit fluoreszierenden Sonden verwendet. Zum Beispiel werden DNA-Synthese, Apoptose, Akquisition von differenzierten Zustände oder Produktion spezifischer Genprodukte häufigsten gemessen. Kurz gesagt, ist der grundlegende Ablauf eines MEArray Experiment Folien mit Druck Substrate beschichtet vorzubereiten und die Master-Platte von Proteinen, die gedruckt werden sollen, vorbereitet. Dann werden die Arrays mit einem Mikroarray-Roboter gedruckt werden Zellen erlaubt zu befestigen, in Kultur zu wachsen, und werden dann chemisch bei Erreichen der experimentellen Endpunkt fixiert. Fluoreszierenden oder kolorimetrische Assays, mit traditionellen Mikroskopen oder Microarrayscannern abgebildet wird, werden verwendet, um relevante molekularen und zellulären Phänotypen (Abbildung 1) offenbaren.
Protokoll
Ein. Printing Substrata Vorbereitung
Die Entscheidung, Polydimethylsiloxan (PDMS)-beschichteten oder Polyacrylamid (PA)-beschichteten Folien verwenden, hängt von den wichtigsten Parameter des experimentellen Designs. Der Elastizitätsmodul der beiden Polymere kann abgestimmt, um die Steifigkeit der verschiedenen Geweben durch Veränderung des Base / Heilung Verhältnis von PDMS und das Acrylamid / Bisacrylamid-Verhältnis von PA imitieren. PDMS kann steifer Geweben in dem Bereich von 1-10MPa (Knorpel, Hornhaut und Arterienwände) zu imitieren, und PA können weicheren Gewebe im Bereich von 100 Pa-100kPa (z. B. Brust-, Hirn-, Leber und Prostata) 5 imitieren. PDMS ist kostengünstig, leicht herzustellen, und die Geometrie der gedruckten Merkmale werden als identisch mit dem Kopf der Druckstifte. Somit wird die Größe und Form der Funktionen präzise gesteuert werden kann unter Verwendung von Stiften mit unterschiedlichen Geometrien Spitze. PDMS ist hydrophober als PA, welche bewirkt, dass einige Herausforderungen bei der Zellenhandhabungseinheit und immunosTaining Schritte, und möglicherweise nicht mit einigen Zelllinien. Da PA ist ein Hydrogel und ein natives, nicht-Fouling-Oberfläche, werden die Zellen nur auf Stellen, wo gibt es Proteine, die Unterstützung der Zelladhäsion befestigen. Die Geometrie der gedruckten Features auf PA Gele nicht exakt folgen die Geometrie des Nadelkopfes; üblicherweise sie Kreise durch Diffusion, unabhängig von der Geometrie, die pinhead verwendet werden. Printing Kontaktzeit und Bolzendurchmesser Parameter kann empirisch für eine optimale Funktion Größe auf PA-Gelen bestimmt werden.
Polydimethylsiloxan (PDMS)
- In einem Einweg-Plastikbecher kombinieren Sylgard 184 Siliconelastomergrundstoff mit dem Härter im Verhältnis 10:1, kräftig mischen sich mit einem Holz-oder Kunststoff-Zungenspatel dann degas in einer Raumtemperatur Vakuumglocke für 30 min.
- Mitte eine Mikroskop-Objektträger-Standard auf das Vakuum betätigten Spannfutter einer Lackschleuder, dann Sprühregen 0,5 ml des gemischten Elastomers Polymers auf der Mitte der Gleitfläche. Spin bei6.000 rpm für 60 sec.
- Heilen die PDMS-beschichteten Folien in einem 70 ° C Ofen oder auf einem digitalen Heißplatte (staubgeschützt) für 4 Stunden bis über Nacht.
- Ausgehärtete Dias kann sofort verwendet werden, oder über mehrere Monate gespeichert in einer Diashow-Box, die in einem Kunststoff-Plastikbeutel verschlossen ist und in einer Schublade. Die PDMS zieht Staub so muss es auch aus Raumluftzirkulation geschützt werden.
- Hinweis: Nitril oder andere Nicht-Latex-Handschuhe getragen werden, wenn die Arbeit mit dem PDMS-Elastomer-Kit werden. Der unbeabsichtigte Kontakt mit Latex-Handschuhen hemmt PDMS Polymerisation.
Polyacrylamid (PA)
- NaOH Ätzen: Objektträger auf Heizblock bei 80 ° C. 1 ml 0,1 N NaOH auf jeder Folie, achten Sie darauf, die gesamte Folie bedecken. Lassen die NaOH verdampfen (ein weißer Film sollte auf der Gleitfläche zu bilden). Da die PA-Gel kann nur fest an auf NaOH geätzten Oberflächen, wird das PA-Gel während der Austrocknung Schritt, wenn die gesamte Folie Surf lösenace nicht durch NaOH abgedeckt. Wenn die Gleitfläche nicht abgedeckt wurde vollständig durch Zugabe von 1 ml 0,1 N NaOH wiederholt. Folien können dann bei Raumtemperatur (RT) für mehrere Tage gelagert werden. Hinweis: Eine Alternative zu NaOH Ätzen ist Ozon-oder Plasma-Reinigung der Dias.
- 3-Aminopropyltriethoxysilan (APES) Beschichtung: In einem Abzug Objektträger in einer 15 ml Gericht, und 300 ul APES auf jeder NaOH geätzten Folie. Lassen Sie die APES reagieren mit den NaOH Objektträger für 5 min. Bei Überschreiten dieser Zeit wird zu Schwierigkeiten beim Auswaschen umgesetzten APES Reagenz. Auswaschen APES gründlich mit entionisiertem Wasser zwei bis dreimal auf beiden Seiten der Folien. Wenn die Wäsche nicht vollständig ist, wird durch Glutaraldehyd APES oxidiert werden, um einen braunen Niederschlag auf Objektträger in Schritt 1.8 bilden.
- Glutaraldehyd Oxidation: Saugen Sie alle Lösungen aus den Gleitflächen. In jedem 15-cm-Spiegel, 25 ml 0,5% Glutaraldehyd in PBS. Reagieren für 30 min in einem dunklen Raum. Nach 30 min absaugen alle Glutaraldehyd und verwenden nicht-lint ArbeitsmarktAtory Tücher (z. B. Kimwipes) sorgfältig zu trocknen Dias. Folien können dann bei RT gelagert werden bis zu einem Tag.
- Gel Zubereitung: Nach der Vorbereitung PA Mischungen einschließlich Acrylamid, Bisacrylamid und ddH 2 O in nach der folgenden Tabelle, entgasen für 30 min, und dann legen PA Mischungen auf Eis zu verlangsamen Polymerisation. Fügen APS und TEMED und gut mischen Recht, bevor sie die Gele. Pipet PA Mischungen auf den Gleitflächen und Ort 24 mm x 50 mm, Nummer 1 Deckgläser auf der PA. Vermeiden Sie Drücken Deckglas und Objektträger aus Glas zusammen und verhindern Blasenbildung. Für Gele> 40.000 Pa verwenden 100 ul, für andere Gele 350 ul verwenden.
| Ausgewähltes Modul (Pa) | Acrylamid% | Bisacrylamid% | Acrylamid aus 40% Aktien (ml) | Bis-Acrylamid von 2% Lager (ml) | VE-Wasser (ml) | APS (ul) | TEMED (ul) |
| 480 ± 160 | 3 | 0,06 | 0,75 | 0,3 | 8,95 | 100 | 10 |
| 4470 ± 1190 | 5 | 0,15 | 1,25 | 0,75 | 8 | 100 | 10 |
| 40.400 ± 2390 | 8 | 0,48 | 2 | 2,4 | 5,6 | 100 | 10 |
Adaptiert von 6,7.
- Lassen Sie das PA-Gel für 2 Stunden polymerisieren, und entfernen Sie dann Deckgläser unter deionisiertem Wasser.
- Waschen PA-Gel Folien in großen Coplan Gläser über Nacht in Wasser (~ 8 h), um nicht umgesetztes Acrylamide entfernen.
- Dry Folien in einer 37 ° C-Ofen für 2-4 Stunden oder bis PA Gel vollständig aushärtet.
- PA-Gel-Folien können bei 4 ° C einen Monat lang in einem verschlossenen schiebeschachtel gespeichert werden.
2. Protein Master Plate Vorbereitung
- Alle Proteine Schulterd in Aktien von 10X-Lösungen in den Puffern des Anbieters empfohlen aliquotiert und bei -80 ° C. Meist ECM-Proteine sind löslich in entionisiertes Wasser, sondern der pH-Wert müssen möglicherweise mit Tropfen Essigsäure eingestellt werden. Meist Wachstumsfaktoren, Zytokine und rekombinanten Rezeptor extrazellulären Domänen werden in PBS mit BSA vorbereitet, aber Herstellers Bedingungen variieren. Filter the protein Aliquots durch einen 0,45 um 4-mm Nylon Spritzenfilter (Nalgene) vor der Lagerung.
- Entwerfen Sie ein Master-Platte in Übereinstimmung mit den gewünschten Protein-Kombinationen und Verdünnungen. Adhärenten Zellen Regel verlassen sich auf das Vorhandensein von mindestens einem kompatiblen ECM, um die Zelladhäsion vermitteln, aber Antikörper gegen Zelloberflächen-Epitope können auch vermitteln Befestigung manchmal. Es ist eine gute Idee, freie FITC Farbstoff oder ein Fluorophor-konjugierten Proteins mit mindestens einem gut anlegen, so dass Arrays können leicht orientiert werden später.
- Bereiten Sie die Master-Platte durch Verdünnen der Protein-Kombinationen mit Druck Puffer von 100 mM zusammenTris-acetate/20% glycerol/0.05% Triton-100X pH 5,2. Typischerweise jede Vertiefung einer 384-Well-Platte enthält nicht mehr als 10 ul.
- Notieren Sie den Inhalt jeder Vertiefung in jedem Master-Platte in einem tabulatorgetrennte Datenbank-Datei und stellt jedem Master-Platte mit einer eindeutigen Identifikationsnummer. Eine sechsstellige Datum des Designers Initialen folgen oft dient (MMDDYYinitial). Da die Well-Volumina klein sind, können Protein-Aliquots effizient genutzt werden, um eine große Anzahl von replicate Trennstufen erzeugen. Es wird empfohlen, dass Master-Platten gespeichert sind bei -80 ° C und jeder Master-Platte sollte nicht mehr als zwei Gefrier-Auftau-Zyklen durchlaufen.
3. MEArray Printing
- MEArrays kann mit den meisten herkömmlichen Microarray Druck Robotern gedruckt werden. Quill Nadel-Drucker, die entweder aus Silikon oder aus Edelstahl Pins verwenden funktionieren gut, aber Protein Viskosität kann problematisch sein. Kapillar-Drucker sind ideal Microarray Druck Roboter für diese Anwendung, wie sie funktionierenNun mit viskosen Proteinlösungen.
- Um eine gute statistische Power innerhalb eines Arrays zu erreichen, wird von 10 bis 12 replicate spots jeder Mikroumgebung empfohlen. Eine solche Konstruktion wird Vergleich der Aktivität in einer Mikroumgebung relativ zu einer anderen im selben Array mit einfachen T-Teststatistiken ermöglichen. Dunnette-Test kann verwendet werden, um die Aktivität in einer Kontrollgruppe Umfeld mit anderen Mikroumgebungen vergleichen. Diese Konstruktion funktioniert am besten, wenn eine funktionelle Phänotyp hat mit der Steuerung Mikroumgebung, bevor Sie die MEArray Experimenten zugeordnet worden.
- Die Luftfeuchtigkeit sollte etwa 50% gehalten werden. Feuchtigkeitsregelungssystem ist wichtig, da ein niedriger Luftfeuchte die Lösung im Inneren der Zapfen bzw. in den Vertiefungen der Masterplatte Bewirken ineffizient Abscheidung auf den Substraten Druck trocknen kann. Feuchtigkeit kann effektiv durch Drapieren den Roboter mit nicht-porösen Plastikplanen und sowohl mit einem Luftbefeuchter und ein de-Luftbefeuchter auf 50% Luftfeuchtigkeit zu halten gesteuert werden. Abgekühlt Druck plattens können usef seinul für die Erhaltung einiger Proteine, aber Vorsicht geboten, um die Bildung von Kondenswasser auf den Folien zu vermeiden.
- Jedes gedruckte Array sollte mit Gefrierfach-proof Dia-Etiketten mit einer Seriennummer, die der Master-Platte die Kennung durch eine dreistellige Zahl (MMDDYYinitial-nnn), gefolgt besteht kodiert beschriftet werden. Wie jedes Array wird verwendet oder verbreitet werden, sollten die Angaben ihrer experimentellen Behandlungen in einer Datenbank verwaltet werden. Verfolgen Sie das Datum für Druck und die Zahl der Frost-Tau-Zyklen der Master-Platten helfen, die optimalen Bedingungen für die Aufrechterhaltung Reproduzierbarkeit zu identifizieren.
- Gedruckt MEArrays sollten in verschlossenen Diakästen bei -20 ° C werden für nicht mehr als einen Monat gelagert. Reproduzierbarkeit deutlich sinkt danach.
4. Kultivierung von Säugerzellen auf MEArrays for Functional Analysis
- Bringen Kultur Kammern: Um die Lautstärke der Medien und die Zahl der Zellen erforderliche Kultur auf die MEArrays zu begrenzen, ist ein Kunststoff-Kammer fitted zu umgeben die gedruckte Array. Für viele Arrays kann eine einzelne Kammer von einer 2-Kammer-Objektträger (Nunc), die eine Fläche von 4,2 cm 2 enthält, verwendet werden. Entfernen Sie die Kammern des hergestellten Kammerobjektträgers und schneiden die Kammern in der Mitte mit einer Rasierklinge. Verwenden eine 3-ml-Spritze, um eine dünne Wulst Aquariensilikon (DAP) mit der Kante einer Kammer und Druck auf die Oberfläche eines MEArray anzuwenden. Vermeiden Sie es, die aufgebrachte Aquariensilikon Kammer auf die Array-Funktionen.
- Sperren und Spülen: MEArrays müssen gut gespült, um nicht umgesetzte Monomere, die für Zellen toxisch sein kann zu entfernen. Wenn PDMS-beschichteten Folien wurden verwendet, dann werden die Bereiche zwischen den gedruckten Features müssen zuerst mit einem nicht-Fouling-Beschichtung, um die Zelladhäsion zu verhindern blockiert; inkubieren die Arrays in 1% Pluronic F108 (BASF) in Wasser oder 2% BSA in Wasser 15 min unter Vakuum. PA-Gel Folien erfordern keinen Blockierungsschritt. In allen Fällen, spülen Arrays mit Zellkulturmedien dreimal für fünf Minuten (Medien Wahl hängtauf die Zellen verwendet, aber die Verwendung von Antibiotika ist unabhängig von Medien oder Zellen) empfohlen. PA Gele zusätzliche 30 min Inkubation in den Medien, um das Gel zu rehydrieren.
- Zellhaftung: Vier bis fünf Arrays können hineinpassen einer einzigen 15 cm sterile Petrischale. Decken Sie die Petrischale mit einem Deckel zu halten die Arrays steril. Die Hälfte des endgültigen Datenträger zum MEArray durch Zugabe der Zellen in Medien mit einer Endkonzentration von 10.000 bis 1.000.000 Zellen / ml. Zellen werden mit den gedruckten Features mit unterschiedlichen Geschwindigkeiten abhängig von der Zusammensetzung des gedruckten Mikroumgebung zu befestigen. Überprüfen Sie für eine gleichmäßige Befestigung durch Betrachten der Arrays durch eine invertierte Stage-Mikroskop in 15 bis 20 Minuten-Intervallen. Durch vorsichtiges Schütteln der MEArrays hin und her, können Zellen Anbringen in einer gemusterten Weise aus den schwimmenden, ungebundene Zellen unterschieden werden.
- Entfernen von ungebundenen Zellen: Ein PA-beschichteten MEArrays, die ungebundenen Zellen abgesaugt und das Medium kann mit einem geeigneten Volumen ersetzt. Auf PDMS-beschichtete MEArrays können die Medien niemals völlig aus dem Brunnen entfernt werden, weil die Zellen austrocknen und sterben fast sofort. Somit auf PDMS-beschichteten MEArrays müssen die ungebundenen Zellen durch einen Prozess der sukzessiven Austausch der Hälfte des Volumens der Medien entfernt werden, bis alle ungebundenen Zellen entfernt werden, wie durch mikroskopische Untersuchung bestimmt. Die de-benetzende Wirkung PDMS ist weniger ausgeprägt, wenn serumhaltigen Medien im Vergleich zu definierten Medien verwendet wird, und wenn BSA werden die unbedruckten Bereiche gegenüber Pluronics F108 blockieren.
- Zellen können auf MEArrays innen 15 cm Petrischalen für viele Tage mit normalen Medien Veränderungen platziert kultiviert werden. Medienwechsel auf PDMS Folien müssen mit aufeinanderfolgenden Änderungen der Hälfte der Datenträger erfolgen.
- Gemeinsames Fixiermittel, wie Paraformaldehyd und Methanol / Aceton, sind kompatibel mit MEArray Systeme. Wenn Färben von Zellen auf PA-beschichteten MEArrays können Fixative hinzugefügt und weggespült genauso wie sie in einem herkömmlichen Färbung sein.Wenn jedoch Färben von Zellen auf PDMS-beschichteten MEArrays, muss die Oberfläche bleiben auch während der Fixierung nass. Saugen Sie die Hälfte der Medien und ersetzen mit einem Fixiermittel. Wiederholen Sie den Vorgang einige Male, bis das Bohrloch mit einer Mehrheit von Fixativ gefüllt ist. Nach der Fixierung wird das Fixiermittel schrittweise in der gleichen Weise mit Blocking-Puffer, die für den nächsten Schritt der Analyse ist ersetzt.
- Immunfärbung wird häufig verwendet, um zelluläre Funktionen zu analysieren. Färbung Routinen variieren, aber bei der Arbeit auf den PDMS MEArrays, muss man jedes Waschen und Absaugen wie oben ausgeführt, ändert sich allmählich die Lösungen und niemals zu, dass die Oberfläche de-nass. Entnetzung verursachen Artefakte in Färbung.
- Die Kammern können mit Hilfe einer Rasierklinge entfernt werden. Deckgläser können auf der gefärbten MEArrays mit Fluoromount-G (Southern Biotech) montiert werden. Der Nachweis kann mit den meisten Multifluoreszenzen Microarrayscannern oder konfokalen Mikroskopen mit motorischem durchgeführt werdengefliesten Bildaufnahme-Modi.
5. Repräsentative Ergebnisse
Ein Beispiel für gemusterten Proteinablagerung auf eine gedruckte PDMS-coasted MEArray Verwendung eines eckigen spitzen Stiften auf einer Silicium Pinole Stift Mikroarray-Roboter Druck ist in Abbildung 2 gezeigt. Abscheidung von verschiedenen Proteinen, die gedruckt werden können durch Immunfluoreszenz unter Verwendung von Antikörpern (2A) verifiziert werden. Verdünnungen der Proteinlösungen in der Master-Platte reflektierend sind der Menge (Fluoreszenzintensität), die auf der Druckform Substrate Oberfläche (2B) abgeschieden wird. Zellen sollten mit den gedruckten Features in naheliegender Weise strukturiert (2C) zu befestigen.
Ein Beispiel eines MEArray Experiment zeigt, dass inverse Verdünnungen von zwei spezifischen Proteinen Mikroumgebung Keratin Expressionsprofile in einem Protein hervorgerufen konzentrationsabhängigen Weise in einem menschlichen multipotenten Brustepithelzellen progenitor Zelllinie (D920-Zellen), ist in Abbildung 3 dargestellt. Bubble Plots sind nützlich für die Bestimmung, ob bestimmte Phänotypen auf Zellen replizieren Merkmale einer Verdünnungsreihe auferlegt werden. Zum Beispiel, wenn ein bestimmtes Molekül in einer Mikroumgebung bewirkt eine deutliche Phänotyp, sobald die instruktive Komponente wurde genug in einem Hintergrund einer neutralen ECM der Phänotyp zu ändern oder verschwinden verdünnt. Immunfluoreszenz-Nachweis von Keratin 8 und Keratin 14 Intermediärfilament Proteine wurde mit einem Axon 4200A (Molecular Devices) Microarrayscanner durchgeführt. Zwölf replicate Verdünnungsreihen wurden auf jeder MEArray gedruckt, und das Protokoll 2-Verhältnis von Keratin 8 bis Keratin 14 mittlere Fluoreszenzintensität als Blase Grundstück wurde graphisch dargestellt, um eine realistische Vorstellung von Variation und Reproduzierbarkeit des Signals geben. Die gezeigte Daten aus einem MEArray die behoben nachdem Zellen hatte befestigt und ungebundene Zellen wurden entfernt (3A) gewaschen wurde, und nach 24 h culture (3B). Für diese relativ kleinen Analyse wurde eine Einweg-ANOVA verwendet, um die Varianz von der mittleren Signal zu jedem Zeitpunkt zu bestimmen, und gruppiert zweiseitiger T-Tests wurden verwendet, um zu bestimmen, ob die verschiedenen Verdünnungen von Kollagen Typ I und rekombinantes humanes P- Cadherin verursacht Veränderungen im Keratin Ausdruck. Es gab keine Abweichungen von dem Mittelwert zwischen den Zellen auf die Funktionen nur nach der Befestigung, jedoch gab es signifikante Unterschiede im Keratin Ausdruck zwischen den Zellen nach 24 Stunden der Exposition gegenüber den verschiedenen Mikroumgebungen. T-Tests überprüft, dass hohe Kollagen Typ I Konzentrationen ausgelöste höhere Keratin 8-Expression, während hohe P-Cadherin Konzentrationen löste eine starke Keratin 14 Signal nach 24 Stunden. Dieses Ergebnis stimmte mit früheren Berichten, dass P-Cadherin-haltigen Mikroumgebungen K14-exprimierenden myoepithelialen Phänotyp auf bi-potent Mamma Vorläuferzellen 4 auferlegen wird.
Ein Beispiel für eine gesamte scanned MEArray auf einem 40.000 Pa PA-Gel gedruckt wird in Abbildung 4 dargestellt.

Abbildung 1. Ein Ablaufdiagramm des Verfahrens MEArray. Zuerst werden die Substrate entweder mit Druck PDMS oder PA hergestellt. Zweitens sind die Master-Platten hergestellt und kommentierte in einer Datenbank. Drittens werden die gedruckten und codierten MEArrays mit Seriennummern. Viertens Kulturkammern gebunden sind, sind Oberflächen-Blöcke und / oder Spülen, dann Zellen erlaubt zu befestigen und ungebundene Zellen werden weggewaschen. Fünftens können Zellen mit färbenden oder Bio-Assay nach einer Inkubationszeit auf experimentellen Design basierend behandelt werden. Schließlich können Bilder MEArray erhalten und analysiert werden, mit geeigneten Scanner und Software.
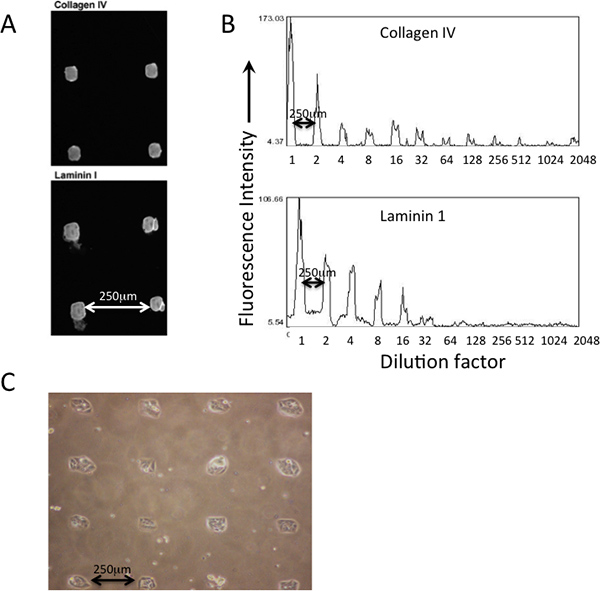
Abbildung 2. Deposition und die relative Häufigkeit der gedruckten Proteine können mit Immunfärbung vor Zellhaftung überprüft werden. A) Antikörper, die Typ IV-Kollagen erkannt und Laminin-111 wurden verwendet, um ihre Präsenz in gedruckter Merkmale eines MEArray überprüfen. B) Verwendung einer durchschnittlichen Pixelintensität Analyse-Funktion in NIH ImageJ Software, die relative Häufigkeit der beiden Proteine über eine Reihe von Verdünnungen, beginnend mit einer 200 ug / ml Proteinlösung, kann qualitativ beurteilt werden. C) Phase Aufnahme von D920-Zellen an quadratischen Funktionen eines gedruckten PDMS-beschichtete MEArray.
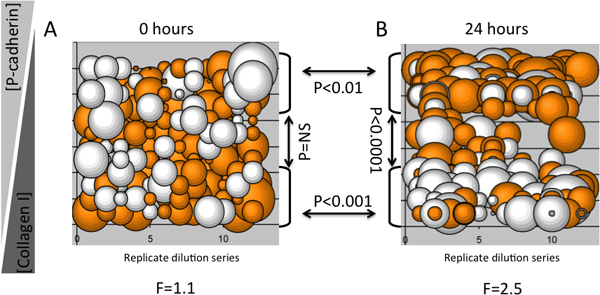
Abbildung 3. Ein Beispiel für eine Analyse unter Verwendung MEArray Veränderungen im Keratin Expression in einer multipotenten Vorläuferzellen Zelllinie als Funktionen der Zeit und Mikroumgebung. Jede Blase steht Verhältnisse von Keratin 8 und Keratin 14 Protein-Spiegel von 10 bis 15 Zellen an einem featur in einem MEArray. Expression wurde mit Immunfluoreszenz Sonden bestimmt. A) zeigt die Verhältnisse im Keratin-Zellen nur nach der Befestigung, und B) zeigt die Verhältnisse Keratin nach 24 h auf einem Array, die parallel plattiert wurde. Die maximale Konzentration beider Proteine betrug 200 pg / ml und verwässert 2-fach. Der Durchmesser einer Blase stellt die Größe des Baumstammes 2-Verhältnis von Keratin 8 und Keratin 14 mittlere Intensität, und die orange und weiß Farbcodierung zeigt Werte> 0 und <0 sind. F-Werte für Einweg-ANOVA und P-Werte von T-Tests, und Klammern mit Pfeilen Identifizieren der Populationen Vergleich gezeigt.

Abbildung 4. Ein Beispiel eines MEArray Scan erfassten Verwendung eines gefliesten Akquisitionsmodus auf einem Laser-Scanning-Konfokalmikroskop. HCC1569 Zellen dürfen wir die DNA analogen EdU für 4 h vor der Fixierung zu integrieren.DAPI (blau) und Edu (rot) dargestellt.
Diskussion
Die MEArray hier vorgestellte Methode ermöglicht funktionelle Analysen von Zell-und kombinatorischen Mikroumgebung Interaktionen 4. MEArray Analyse kombiniert Verwendung von basischen Mikrostrukturierung Technologien, Zellbiologie, und Microarray-Druck Roboter und Analyse-Geräte, die in vielen Multiuser-Labore sind. MEArray Bildschirme sind kompatibel mit den meisten adhärente Zelltypen, wenn serumfreie Medien Formulierungen müssen möglicherweise in einigen Fällen eingestellt werden zu BSA oder <1% S...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
ML wird von der NIA (R00AG033176 und R01AG040081) und Laboratory Directed Forschung und Entwicklung, US Department of Energy contract # DE-AC02-05CH11231 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalognummer | Kommentare (optional) |
| Glasplättchen 25 mm x 75 mm | VWR | 48311-600 | |
| Deckgläschen (Nr.1) 24 mm x 50 mm | VWR | 48393-241 | |
| Färbekasten (oder Coplan jar) | VWR | 25461-003 | |
| Petrischalen (15 cm) | BD Falcon | 351058 | |
| NaOH (1,0 N) | Sigma-Aldrich | S2567 | |
| APES (> 98% (3-Aminopropyl) triethoxysilan) | Sigma-Aldrich | A3648 | |
| Glutaraldehyd | Sigma-Aldrich | G7651 | 50% in Wasser |
| APS (> 98% Ammoniumpersulfat) | Sigma-Aldrich | A3678 | Bereiten Sie 10% funktionierende Lösung mit ddH 2 O |
| TEMED (N, N, N ', N'-Tetramethylethylendiamin) | Sigma-Aldrich | T9281 | |
| Acrylamid (40%) | Sigma-Aldrich | A4058 | |
| Bis-Acrylamid (2% w / v) | Fisher BioReagents | BP1404-250 | |
| 0,45 um Spritzenfilter 4-mm Nylon- | Nalgene | 176-0045 | |
| FITC | Sigma-Aldrich | F4274 | |
| PDMS (Polydimethylsiloxan) | Dow Corning | 3097358-1004 | Sylgard 184 Elastomer-Kit über Ellsworth Adhesives |
| 2-Kammer-Objektträgern | NUNC | 177380 | |
| Pluronic F108 | BASF | 30089186 | |
| Aquarium Dichtstoff | Dow Corning | DAP 00688 | |
| Fluormount-G | Southern Biotech | 0100-01 | |
| Einweg-Plastikbecher | |||
| Mundspatel | |||
| Nitril-Handschuhe | |||
| Plastic Objektträger-Boxen | |||
| Spin Coater | WS-400B-6NPP/LITE | Laurell Technologies Corporation | |
| Ofen | |||
| Digitale Kochplatte | |||
| 384-Well-Platten | Eine Marke geeignet für die Mikroarray-Roboter | ||
| Microarray-Druck-Roboter | |||
| Inverted Phase und Fluoreszenz-Mikroskop | |||
| Axon Microarrayscannern | Molecular Devices | Mehrere Konfigurationen existieren |
Referenzen
- Bissell, M. J., Labarge, M. A. Context, tissue plasticity, and cancer: are tumor stem cells also regulated by the microenvironment. Cancer Cell. 7, 17-23 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Dev. Cell. 6, 483-495 (2004).
- LaBarge, M. A. Human mammary progenitor cell fate decsions are products of interactions with combinatorial microenvironments. Integrative Biology. 1, 70-79 (2009).
- Kim, H. N. Patterning Methods for Polymers in Cell and Tissue Engineering. Annals of biomedical engineering. , (2012).
- Boudou, T., Ohayon, J., Picart, C., Pettigrew, R. I., Tracqui, P. Nonlinear elastic properties of polyacrylamide gels: implications for quantification of cellular forces. Biorheology. 46, 191-205 (2009).
- Tse, J. R., Engler, A. J. Preparation of hydrogel substrates with tunable mechanical properties. Current protocols in cell biology. Chapter 10, Unit 10 (2010).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat. Methods. 2, 119-125 (2005).
- Soen, Y., Mori, A., Palmer, T. D., Brown, P. O. Exploring the regulation of human neural precursor cell differentiation using arrays of signaling microenvironments. Mol. Syst. Biol. 2, 37 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten