Method Article
Neo-Islet Formation in Leber der diabetischen Mäuse von Helper-abhängigen Adenovirus-Vektor-vermittelten Gentransfer
In diesem Artikel
Zusammenfassung
Wir beschreiben hepatische neo-Inselzellen Formation in STZ (Streptozotocin)-induzierte diabetische Mäuse durch Gentransfer von Neurogenin3 (Ngn3) und Betacellulin (BTC) Verwendung von Helfer-abhängigen Adenovirus-Vektor (HDAd) und der Umkehrung von Hyperglykämie. Unsere Methode nutzt die Vorteile von Helfer-abhängigen Adenovirus-Vektoren mit ihren hocheffizienten in vivo Transduktion und der lang anhaltende Genexpression.
Zusammenfassung
Typ 1-Diabetes wird durch T-Zellen vermittelten autoimmune Zerstörung von Insulin-produzierenden Zellen in der Bauchspeicheldrüse. Bisher Insulinersatzbehandlung ist immer noch die große Therapie, da Inseltransplantation wurde von Donor Verfügbarkeit und durch die Notwendigkeit für Langzeitimmunsuppression beschränkt. Induced Inselneogenese durch Gentransfer von Neuogenin3 (Ngn3), der Insel Linienhalter Definition spezifischer Transkriptionsfaktor und Betacellulin (BTC) hat eine kleine Insel Wachstumsfaktor das Potenzial, Typ 1 Diabetes zu heilen.
Adenovirusvektoren (Anzeigen) sind hocheffiziente Gentransfervektor, allerdings muss frühen Generation Anzeigen mehrere Nachteile zur Verwendung in vivo. Helper-abhängige Anzeigen (HDAds) sind die am weitesten fortgeschrittenen Anzeigen, die entwickelt, um das Sicherheitsprofil von frühen Generation von Anzeigen zu verbessern und Transgenexpression 1 verlängert wurden. Es fehlt ihnen an chronischen Toxizität, weil sie viralen kodierenden Sequenzen 2-5 fehlt und behalten nur Ad cis elements notwendig Vektor Replikation und Verpackung. Dies ermöglicht Klonieren von bis zu 36 kb Gene.
In diesem Protokoll beschreiben wir die Methode HDAd-Ngn3 und HDAd-Btc erzeugen und diese Vektoren in STZ-induzierte diabetische Mäuse liefern. Unsere Ergebnisse zeigen, dass Co-Injektion von HDAd-Ngn3 und HDAd-Btc induziert 'neo Inseln' in der Leber und kehrt Hyperglykämie bei diabetischen Mäusen.
Protokoll
Ein. Klonen der therapeutischen Gene in HDAd Shuttle Vector
- Klon Maus Ngn3 und Btc cDNAs in die pLPBL1 Plasmidvektor, eine ubiquitäre Elongationsfaktor-1-Promotor (BOS) und eine Poly-A-Signal enthält. Nach der Fertigstellung überprüfen Vektoren durch Sequenzanalyse und dann subklonieren diese Expressionskassetten in pΔ28 HDAd Shuttle-Plasmid 6.
- Ausgewählte HDAd Shuttle-Vektoren durch die PmeI Plasmidrückgrat freizugeben, zu reinigen DNAs durch Phenol / Chloroform / Isoamylalkohol-Extraktion durch Ethanolfällung und auflösen mit Transfektions-grade Wasser.
2. Helper-abhängigen Adenovirus-Vektor Produktion
HDAd Vektorproduktion umfasst mehrere Schritte, die sorgfältig für optimale Ergebnisse befolgt werden müssen.
2,1 Transfektion
- Zwei Tage vor der Transfektion Keim 116 Zellen 7 in 6-cm-Schale auf 70-80% konfluent auf dem Tag der Transfektion zu erreichen.
- Drei Stunden vor der Transfektion, entfernen Sie mittel-und 5 ml frisches Wachstumsmedium [MEM mit 10% FBS und 1% PSG (Penicillin, Streptomycin und Glutamin), Invitrogen ergänzt].
- Transfizieren 116 Zellen mit 10 ug DNA aus Schritt 1.2), mit der ProFectionR Mammalian Transfection Kit von Promega nach Herstellerangaben.
- Am nächsten Tag die Zellen werden mit 1 ml Wachstumsmedium 2 mal. Hinzufügen Helfervirus (HV) bei 500 Vektorpartikel (vp) / Zelle bis 0,1 ml PBS mit Calcium und Magnesium (PBS + +) und Überlagerung mit den Zellen. Schütteln Sie die Speisen gleichmäßig zu verteilen das HV alle 10 min.
- Nach 60 min, 1,5 ml Erhaltungsmedium (MEM, 5% FBS, 1% PSG).
- Hinzufügen 1 ml Erhaltungsmedium den nächsten Tag.
- Beachten Zellen für CPE (zytopathischen Effekt - Zellen werden gerundet und abgenommen). Mehr als 80% der Zellen sollte CPE 2 Tage nach der Infektion zeigen.
- Collect rohen Zelllysat (CVL, Zellen und Medium), eindd 10% Volumen von 40% Saccharose und bei -80 ° C. Die CVL als Passage 0 beschriftet - (CVL-P0).
2,2 Vector Verstärkung
- Einfrieren (-80 ° C, 3-5 min) / Tau (37 ° C, 1-2 min) 3 mal.
- Overlay 0,5 ml CVL ergänzt mit HV bei 200 vp / Zelle konfluenten 116-Zellen in 6-cm-Spiegel, und rocken das Gericht schonend alle 5 min. Nach 30 min, 1 ml Wartung Medium.
- 1 ml Erhaltungsmedium nächsten Tag. 2 Tage später sollten die meisten der Zellen zeigen CPE.
- Sammeln Sie die CVL und bei -80 ° C (CVL-P1) wie für Schritt 2.1.8 beschrieben).
- Wiederholen Sie den Vorgang für 3 mal die CVL P2-P4 zu bekommen.
- Auszug DNA (DNeasy Blood & Tissue Kit, Qiagen) von 0,2 ml CVL sammelte bei P1-P4 und analysieren den Vektor Verstärkung durch qPCR mit HV-und HDAd-spezifischen Primern (Tabelle 1). Verwenden des Durchgangs in dem exponentiell amplifiziert HDAd relativ zu HV (P3 in Fig. 2) für die subsequent Verfahren.
- Co-Infektion 90% konfluent 116 Zellen in 15cm Schüssel mit 0,5 ml CVL und HV bei 200 vp / Zelle. Rock the dish schonend alle 5 min. Nach 30 min, 10 ml Wartung Medium.
- 5 ml der Wartung nach 24 Stunden.
- Collect Zellen durch Zentrifugation bei 1500 × g für 5 min genau 48 Stunden nach der Infektion.
- Resuspendieren Zellen in 1 ml PBS + + 4% Saccharose enthaltenden (P5) und Einfrieren bei -80 ° C.
2,3 Großräumige HDAd Produktion
- Zu 116 Zellen in Suspension zur Infektion der Zellkultur herzustellen, übertragen konfluenten 116 Zellen in 8 x 15-cm-Schale in 3 L Spinnerflasche und fügen Suspension Wachstumsmedium (Joklik modifiziertem MEM mit 5% FBS, 0,1 mg / ml Hygromycin und 1% PSG) bis zur endgültigen 1 L, und inkubieren in einem CO 2-Inkubator mit Spinnen bei 60 rpm 8.
- Hinzufügen 0,5 l frischem Medium täglich für 2 Tage (insgesamt 2 L).
- Zählen von Zellen am dritten Tag. Cells sind gebrauchsfertig, wenn Erreichen to Gesamt-Zellzahl von 1x10 9.
- Frost / Tau-P5 3 mal.
- Sammeln von Zellen aus 3 L Spinnerflasche durch Zentrifugation bei 1000 × g für 5 min. Sparen Sie 100 ml des Überstands zu resuspendieren der Zellen.
- Übertragen Zellen in einen 250-ml Spinnerflasche. Hinzufügen P5 und HV bei 200 vp / Zelle, Zellen und Inkubation für 1 h bei 37 ° C bei 60 Umdrehungen pro Minute.
- Transfer Zellen und mittel-bis 3 L Spinnerflasche, fügen 2 L Aussetzung Wachstumsmedium. Übertragen 1 ml Zellsuspension in eine Vertiefung in einer 12-Well-Platte, um die Zellen für CPE zu beobachten.
- Inkubieren Zellen in Spinnerflasche für 2 Tage in einem CO 2-Inkubator bei 60 Umdrehungen pro Minute.
- Sammle Zellen durch Zentrifugation und mit 15 ml 100 mM Tris-HCl (pH 8,0) und bei -80 ° C (P6) bis zur Reinigung wieder auszusetzen.
2,4 Vector Reinigung
- 1,0 ml 5% Natriumdesoxycholat auf die P6. Vorsichtig mischen und inkubieren für 30 Minuten bei Raumtemperatur.
- Fügen Sie 400 ul 2 M MgCl 2, 300 μl RNase A (10 mg / ml) und 300 ul DNase I (10 mg / ml) und Inkubation bei 37 ° C für 1 Stunde.
- Zentrifuge bei 6.000 xg für 10 min bei Raumtemperatur zu sammeln Überstand.
- Sterilisieren NVT 65 Ultrazentrifuge Röhrchen (Beckman) unter UV-Licht 1 Stunde lang in Gewebekultur Haube.
- Hinzufügen 2,8 ml niedriger Dichte CsCl-Lösung (1,25 g / ml), 2,8 ml Unterlage aus hochdichtem CsCl Dichte Lösung (1.41g/ml) und dann Überlagerung 5-6 ml des Überstandes, um das Rohr auf den Hals zu füllen. Verwenden 100 mM Tris-HCl (pH 8,0), um das Rohr ggf. ausfüllen.
- Zentrifuge bei 10 ° C für 30 min bei 50.000 rpm bei 10 ° C mit Beckman LE-80K mit NVT-65 Rotor.
- Wischen Sie den Bereich mit 70% Ethanol für Punktion und sammeln die untere opaleszierende Bande mit einem 3-ml-Spritze mit 22-G-Nadel an Seite Punktion (Abb. 3a) ausgestattet. Manchmal ist eine sehr schwache Helfer Band kann unter der prominenteren vector Band gesehen werden. Versuchen Sie, so viel von th erhaltene Vektorbande wie möglich, ohne dass die Helfer Band. Es ist akzeptabel, bei diesem Schritt auch wenn einige der Helfer-Band angesaugt wird, wie es bei der anschließenden Zentrifugation über Nacht, die folgendermaßen getrennt werden.
- Legen Sie die gesammelten Bands in eine neue sterilisiert Ultrazentrifuge Röhren. Füllen Sie die Rohre an den Hals durch Überlagerung 1,35 g / ml CsCl Density-Lösung.
- Zentrifuge bei 10 ° C bei 50.000 rpm über Nacht. Sammeln Sie die opaleszierende Bande (Abbildung 3b).
- Übertragen Sie das Band in einem Dialyse-Kassette (Slide-a-Lyzer, 10.000 MWCO, Thermo-wissenschaftlichen).
- Dialysieren gegen 3 l 10 mM autoklavierten Tis-HCl, pH 7,2, enthaltend 2 mM MgCl 2 und 4% Saccharose bei 4 ° C über Nacht.
- Entfernen Sie die HDAd Vektor von Dialyse-Kassette. Aliquot 20 ul für physikalische Titer und 50 ul für die DNA-Charakterisierung. (Hinweis: Für Ngn3 Vektor, wiederholen "P6" dreimal, um eine ausreichende Vektor zu erhalten, da die Ausbeute an HDAd-Ngn3 ist schlecht im Vergleich zu HDAd-Btc oder HDAd leer.)
2,5 Charakterisierung von HDAd Vektoren
- Bestimmen die physikalischen Titer (vp / ml) unter Verwendung von optischer Dichte (OD). Fügen Sie 20 ul Vektors oder 20 ul Dialysepuffer bis 380 ul TE-Puffer mit 0,1% SDS und Inkubation bei 56 ° C für 20 min. Messung der OD bei 260 nm auf. Die physikalische Titer = OD260 x 1,1 x 10 12 x 20 (vp / ml).
- Analysieren HV Kontamination durch qPCR. Verwenden 50 ul Aliquots auf DNA unter Verwendung DNeasy Gewebe / Blut-DNA-Extraktionskit (Qiagen) extrahiert. Verdünnen Sie die DNA 1000-fach und nehmen 5 ul für die qPCR-Analyse mit Helfer-und Vektor-spezifischen Primern (Tabelle 1). Der Helfer Kontamination sollte weniger als 1%, wie in 4A gezeigt.
- Verwenden Southern-Blot-Vektor-Struktur zu analysieren. Southern Blot-Analyse durchzuführen 10 unter Verwendung einer Sonde für die invertierte terminale Wiederholungssequenz (ITR). Die repräsentatives Ergebnis ist in 4B gezeigt.
- Bestimmen in vitro Wirksamkeit. Infect bekanntZahl von 116 Zellen in einer 12-Well-Platte mit HDAd vector bei 1000 vp / Zelle in vierfacher Ausfertigung. Ernten Sie die Zellen nach 48 Stunden und extrahieren RNA die Expression von Ngn3 und Btc mRNAs durch qRT-PCR (Tabelle 1) zu bestimmen. Repräsentative Ergebnisse sind in 5 gezeigt.
3. Behandlung des diabetischen Mäusen durch HDAd-Ngn3 and-Btc
3,1 Induktion von Diabetes bei Mäusen und Injektion von Vektoren HDAd
- Vorbereitung der STZ: Bereiten 0,1 M Citratpuffer, und pH-Wert auf 4,3-4,5. Filtern dies durch eine 0,22 mm Spritzenfilter. Mit sterilem Wasser verdünnen dies 0,01 M Na-Citrat pH 4,2-4,5. Aufzulösen geeignete Menge STZ (Sigma) in dieser Lösung, um eine Endkonzentration von 12,5 mg / ml zu erreichen. Bei dieser Konzentration gibt es keinen Niederschlag. Bewahren Sie diese STZ-Lösung bei 4 ° C bis verwendet. Bringen der Temperatur des Einspritzen Lösung auf Raumtemperatur unmittelbar vor der Injektion. Der STZ-Lösung Schulterd werden frisch zubereitet jeden Tag injiziert und innerhalb von 5-10 min aufgelöst.
- Inject dieses STZ-Lösung intraperitoneal (10 ul / g bis eine Dosis von 125 ug / g Körpergewicht zu erreichen), am Abend zwischen 07.05 Uhr (bevor die Lichter ausgeschaltet sind, in der Maus-Anlage ausgeschaltet und die Mäuse starten Fütterung aktiv), an zwei aufeinanderfolgenden Tagen 9.
3.2 Monitoring Mäusen Glukose und Injektion von HDAd Vektoren.
- Schnelle Mäuse für 6 Stunden und messen Körpergewicht und Blutzucker wöchentlich bis Mäuse haben Hyperglykämie (≥ 250mg/dl). Verwenden Sie einen One Touch glucometer für Blut durch tail snip gesammelt. Sobald Blutzuckerspiegel ≥ 250 mg / dl, überprüfen Sie das Blutzucker wieder in 48 Stunden nach einem 6 Stunden schnell zu anhaltenden Hyperglykämie und Blutzucker im Zielbereich für die Behandlung zu gewährleisten: 250-500 mg / dl.
- Saures Mäusen mit anhaltender Hyperglykämie durch eine einzelne intravenöse Injektion von Vektoren über HDAd Schwanzvene. Die gesamte vector Dosis 6x10 11 vpfür alle Behandlungsgruppen (in 0,25 ml): 5x10 11 vp Ngn3 1 x10 11 vp Btc für die Kombination Gruppe; 5x10 11 vp Ngn3 + 1x10 11 vp für Ngn3 Gruppe und 1x10 11 vp Btc + 5x10 11 vp leeren Vektor für BTC-Gruppe und 6x10 11 vp leeren Vektor für die Kontrollgruppe.
- Injektion in die Schwanzvene. Legen Mäuse in Tailveiner restrainer (TV-150, Braintree Scientific Inc.), und warmes Wasser verwenden, um die Schwanzvenen erweitern, reinigen Sie den Schwanz mit 70% Alkohol. Halten tail unterhalb der Injektionsstelle zwischen Daumen und Zeigefinger der Hand, verwenden Sie eine andere Hand zur Injektion. Vor der Injektion stellen Sie sicher, es gibt keine Blasen in der Spritze (mit 30 1/2 G Nadel und 1 ml Spritze). Setzen Sie die Nadel und spritzen den Vektor langsam. Wenn die Nadel in die Vene, kann ein Flash von Blut in der Nabe der Nadel zu sehen und auch kein Widerstand während der Injektion. Nach dem Entfernen der Nadel, halten Sie die Injektionsstelle mit Gaze, um die Blutung vor der Rückkehr Mäusen t zu stoppeno Käfig.
Wenn die Nadel nicht in der Vene ist signifikanten Widerstand der Injektion und ein wenig subkutane Quaddel entsteht. Zu dieser Zeit entfernen Sie die Nadel und versuchen Sie es erneut an einem anderen Standort.
3.3 Analyse der Auswirkungen der HDAd-Ngn3 + HDAd-Btc Behandlung.
- Monitor 6 hr Nüchternblutzucker und Körpergewicht wöchentlich nach Vektor-Behandlung.
- Blut aus der Vena saphena oder Schwanzvene im Bein alle 2 Wochen zum Testen Insulin (Maus Insulin ELISA-Kit, Mercodia) und der Leberenzyme (AST und ALT Unendlichkeit Reagenzien, Thermo Scientific) mit kommerziellen Kits.
- Die Maus in einem nicht begrenzten 50 ml Falcon-Röhrchen mit Löchern in dem geschlossenen Ende gemacht.
- Die Maus Kopf ist an dem geschlossenen Ende des Rohres und Beine und den Schwanz an der offenen Seite der Röhre. Um Blut aus dem linken Bein sammeln, das linke Bein erstrecken Rohraußenseite und schonend klemmen die Haut des Oberschenkels zwischen dem Daumen und dem Zeigefinger, um das Bein zu immobilisieren.
- Verwendeneinen Rasierer, um das Haar vor dem Schienbein / Unterschenkel-Bereich zu entfernen, um die Saphenusvene, die sich auf der lateralen Seite des unteren Schenkels freizulegen. Reinigen Sie die rasierte Haut mit 70% Alkohol und trocknen lassen.
- Punktion der V. saphena mit einer 25-Gauge-Nadel, sammeln das Blut mit Microvette CB300 Rohr (Sarstedt) und setzen die Rohre auf dem Eis.
- Drücken Sie die Einstichstelle mit Gaze, um die Blutung vor der Rückkehr die Mäuse zu den Käfigen zu stoppen.
- Zentrifugieren bei 3.000 xg für 5 min, nehmen Sie den Überstand und bei -20 ° C für weitere Analysen.
3,4 Führen Glukosetoleranztest (GTT) 6 Wochen nach der Behandlung.
- Gelöst D-Glucose (Sigma) in destilliertem Wasser bis zu 15% Glucose (15 g / 100 ml) und die Glucose Sterilfilter machen.
- Schnelle Mäuse für 6 Stunden. Verwenden Sie warmes Pad, um die Mäuse zu wärmen und sammeln das Blut (0 min Zeitpunkt). Dann injizieren 1,5 g / kg D-Glucose ip (10 ul / g von 15% Glukose).
- ColLect Blut bei 15, 30, 60, 120 min.
- Messen Sie die Glukose und Insulin in all diesen Proben.
3,5 Tissue-Analyse, um die Expression der Vektoren zu beurteilen und bewerten die Induktion von Inselneogenese.
In all diesen Schritten werden die Steuerelemente, die erforderlich ist, um zuverlässig die Ergebnisse zu interpretieren sind, umfassen: (1) Leervektor behandelten diabetischen Mäusen (2) nicht-diabetischen Mäusen und (3) nicht-diabetische Bauchspeicheldrüse dient als positive Kontrolle für die Expression des islet spezifische Hormone und Transkriptionsfaktoren.
- Ernte Leber und Bauchspeicheldrüse nach 3 und 6 Wochen nach der Behandlung. Teilen Sie sich in 2 Teile, der erste für Snap Einfrieren in flüssigem Stickstoff und Lagerung bei -80 ° C für RNA-und Protein-Extraktion und die zweite mit 10% Formalin Nacht fix für die Immunhistochemie Analyse.
- Auszug RNA durch ein Standardprotokoll und analysieren Ausdruck Insel bestimmte Hormone und Transkriptionsfaktoren, zusammen mit Ngn3 und Btc um Bestätigungm vector Ausdruck, in der Leber durch qRT-PCR unter Verwendung spezifischer Primer 9, 10.
- Extrahieren Insulin und C-Peptid aus der Leber durch Säure-Ethanol-Extraktionsverfahren und Quantifizierung von einem kommerziellen ELISA-Kits (hochempfindliche Insulin Assay Mercodia, C-Peptid-ELISA-Kit, Wako).
- Führen Immunfärbung auf islet spezifische Hormone (Insulin, Glucagon, PP, SST) zusammen mit Inselzellen spezifische Transkriptionsfaktoren in Paraffin eingebetteten Schnitten 9, 10. Die Expression und Ngn3 Btc kann auch durch Immunfärbung bestätigt werden.
4. Repräsentative Ergebnisse
Wir klonierten Ngn3 und Btc cDNA in pΔ28 Vektoren durch allgegenwärtige Promotors eIF2a (BOS) angetrieben und erzeugt HDAd-Ngn3 und HDAd-Btc. Wie in 2 gezeigt, verringerten relativen HV Kontamination signifikant (was mehr Vektor Amplifikation und weniger Helfer Verstärkung) bei Passage 3. Daher verwendeten wir P3 für nachfolgende Vektorproduktion. Nach dem erstenCsCl diskontinuierlichen Gradienten und Ultrazentrifugation gesammelt wir den niedrigsten Vektorbande und dann gesammelt das opaleszierende Bande entsprechend HDAd Vektors in der zweiten Ultrazentrifugation (Abbildung 3). Das gereinigte HDAd vector hatten weniger als 1% der HV Kontamination (4A) durch qPCR und hatte keinen Helfer Verschmutzung sichtbar Southern Blot (4B), was auf eine ausreichende Qualität für Vektor-Infusion in Mäusen. Weitere Analysen enthalten Transgenexpression durch Infektion von 116-Zellen. Die mRNA-Expressionsniveaus von Ngn3 und Btc lagen im Vektor infizierten Zellen von über 10.000-fach im Vergleich mit denjenigen in nicht infizierten Zellen (Abb. 5).
HDAd-Ngn3 and-Btc wurden dann auf STZ-induzierten diabetischen Mäusen über die Schwanzvene Injektion mit leeren Vektor injiziert und HDAd-Btc injiziert diabetischen Mäusen dient als negative Kontrolle verabreicht. Hyperglykämie wurde umgekehrt und Glukose-stimulierte InsulinsekretionBei Mäusen wurde sowohl mit HDAd-Ngn3 und HDAd-Btc aber nicht in Mäusen, die mit einzelnen Genvektor oder Kontrolle Leervektor (Abbildung 6) behandelt wurden wiederhergestellt. Die HDAd-Ngn3 Btc Behandlung induzierte Inselneogenese und dies wurde durch Testen insgesamt Insulin und C-Peptid-Gehalt (Abb. 6E) mit nicht-diabetischen, diabetische Leervektor behandelten Mäusen als Kontrollen dienten quantifiziert. Das Vorhandensein von c-Peptid und Insulin in äquimolaren Verhältnissen bestätigt, dass das Insulin in der Leber erkannt Tat wird in der Leber synthetisiert. RT-qPCR bestätigt, dass die Leber von HDAd-Ngn3 Btc behandelten Mäusen alle Insel-spezifische Hormone und Transkriptionsfaktoren 9 ausgedrückt. Immunhistochemie zeigten Insulin positiven Zellen in der Leber von Mäusen mit HDAd-Ngn3 und HDAd-Btc behandelt, aber keine Insulin positive Zellen wurden in Mäusen mit Steuervektor (Abbildung 7) behandelt wurden. Wir haben auch bestätigt, dass es keine restliche Inseln in der Bauchspeicheldrüse des Ngn3 Btc treated Mäusen im Gegensatz zu den zahlreichen Inseln in nicht-diabetischen Pankreas verglichen. Vektor (Ngn3 und BTC) zusammen mit Inselzellen spezifische Abstammungslinie Transkriptionsfaktor (Pdx-1 und Nkx6.1) Expression wurde auch durch Immunfärbung der Leber (Abbildung 7) beurteilt.
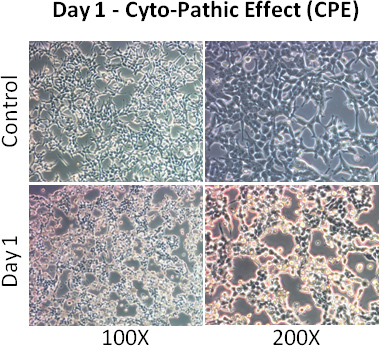
Abbildung 1. Flussdiagramm der Gen-Therapie des diabetischen Mäusen mit Helfer-abhängigen Virus-System. Zunächst Ngn3 und BTC, in einer Kassette von einem allgegenwärtigen BOS-Promotor angetrieben, in HDAd Shuttle (pΔ28) kloniert. HDAd wird durch mehrere Schritte, einschließlich Transfektion, serielle Passagen Amplifikation und großem Maßstab Infektion durch Vektor anschließende Reinigung hergestellt. Nach der Charakterisierung der Qualität werden HDAds intravenös in STZ-induzierte diabetische Mäuse über die Schwanzvene injiziert. Die Wirkungen der Behandlung durch Messung Glucose, Körpergewicht, GTT und durch Analysen der Genexpression beurteiltin der Leber.
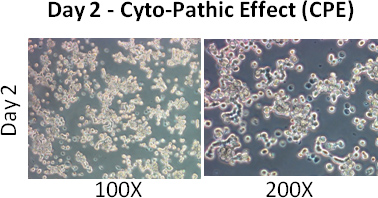
Abbildung 2. Bestimmung HDAd vector Verstärkung. DNA wird aus Passage P0 bis P4 unter Verwendung von DNA-Extraktionskits (Qiagen) extrahiert. DNA wird verdünnt 1000-fach und 5 ul DNA für Echtzeit-PCR (qPCR) verwendet wird. Helper-und Vektor-spezifische Primer verwendet werden. Standardkurven werden durch serielle Verdünnungen (10 -5 bis 1 ng / ml) von HDAd Shuttlevektor-Plasmid und HV-Plasmid (obere Bilder) erzeugt. Verwendung der Standardkurven und die Ct-Werte für den Vektor und Helfervirus Kopienzahl wird berechnet und das Verhältnis von HDAd / HV wird als Prozentsatz der Gesamt-Virus (+ Helfer HDAd) aufgetragen. Daher relativen Vektor Verstärkung wird wie folgt berechnet: [vector Kopienzahl / (Vektor + Helfervirus Nummer des Exemplars)]. In dem gezeigten Beispiel (unten) HDAd vector Verstärkung bei P4 Plateau, während die relative HDAd / HV bei P3 steigt. Daher P3 ist für den nachfolgenden Schritt ausgewählt.
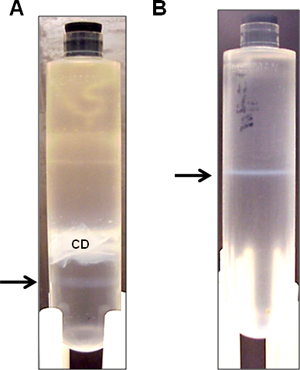
Abbildung 3. Vertreter HDAd vector Bands nach diskontinuierlichen CsCl Dichte Ultrazentrifugation. HDAd Vektor von einem 3L Spinnerkultur über sequentielle CsCl Dichtegradientenzentrifugation gereinigt. (A) nach dem ersten Dichte-Ultrazentrifugation, ist eine einzelne opaleszierende Vektorbande sichtbar (Pfeil) unterhalb opaken Zelltrümmer (CD). Der opaleszierende Bande (Pfeil) für den zweiten Dichte-Zentrifugation gesammelt. (B) Nach der zweiten Dichtegradienten-Ultrazentrifugation, wird das opaleszierende Bande (Pfeil) für die Dialyse gesammelt.
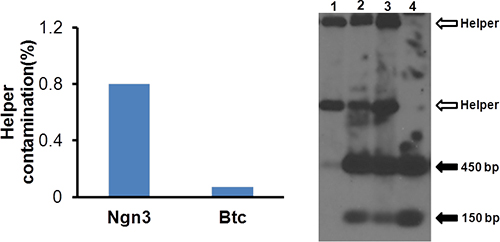
Abbildung 4. Analyse der Helfervirus Kontamination. DNA wird aus 50 ul gereinigten Virus extrahiert und Helferzellen ist eine Kontaminationssessed wie in 2. Die Abbildung zeigt helper Kontamination HDAd-Ngn3 und HDAd-Btc weniger als 1%.
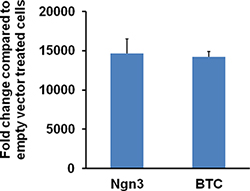
Abbildung 5. Analyse der Struktur der HDAd Vektor. Southern Blot wie vorstehend (Oka K, et al.) Beschrieben durchgeführt. Spur 1: DNA aus Helfervirus; Spur 2: DNA von P3; Spur 3: DNA aus P4; Bahn 4: gereinigtes vectopr. Offene Pfeile zeigen die Helfervirus abgeleitet Bands und die gefüllten Pfeile zeigen die ITR Bands aus dem HDAd Vektor abgeleitet.
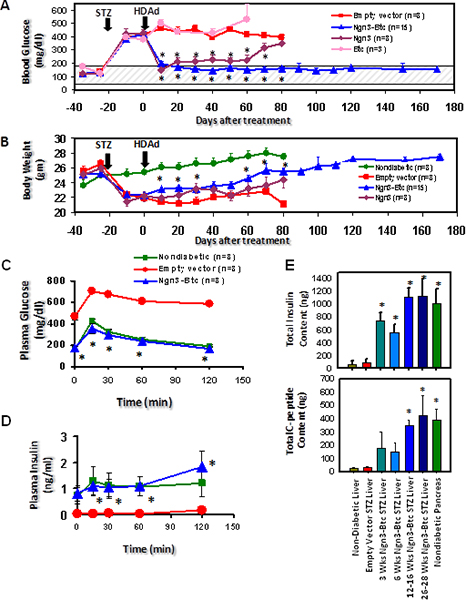
Abbildung 6. Expression Niveau Ngn3 oder BTC in 116 Zellen mit HDAd-Ngn3 oder HDAd-Btc Vektor infiziert. 116 Zellen in einer 12-Well-Platten sind mit HDAd-Ngn3 oder HDAd-Btc oder Leervektor bei 1000 vp / Zelle für 2 Tage infiziert. Cells werden geerntet und Gesamt-RNA extrahiert mit Trizol Reagenz. qRT-PCR erfolgt mit Ngn3 oder BTC-spezifischen Primern. Die relative Ngn3 oder BTC-mRNA-Expression von mehr als 10.000-fach erhöhte in Zellen mit HDAd-Ngn3 oder HDAd-Btc infiziert. Die Figur ist aus Dev.Cell 2009 Mar nachgedruckt; 16 (3): 358-73; Yechoor et. al., mit Genehmigung von Elsevier.
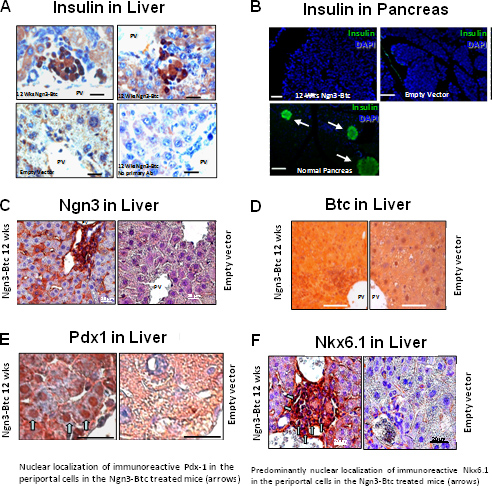
Abbildung 7. Gentransfer von HDAd-Ngn3 und HDAd-Btc in STZ-induzierte diabetische Mäuse führt zu Umkehrung von Diabetes und Induktion von Inselneogenese in der Leber. (A) Plasma Glucose und (B) Körpergewicht von STZ-induzierte diabetische Mäuse mit HDAd-Ngn3 und HDAd-Btc behandelt. (C) Plasma Glukose und Insulin während einer IP-GTT 6 Wochen nach der Behandlung. (D) Repräsentative Insulin Färbung in der Leber 12 Wochen nach der Behandlung. * P <0,05 (vs Leervektor-Gruppe). Die Figur ist aus Dev nachgedruckt. Cell 2009 Mar; 16 (3): 358-73; Yechoor et al, mit Genehmigung von Elsevier..
| Name | Vorwärtsprimer | Reverse-Primer | |
| Helfer | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| Vektor | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| Btc | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
Tabelle 1. Primersequenzen.
Diskussion
HDAds wurden entwickelt, um die Schwächen der ersten Generation Ads zu überwinden und für gentherapeutische Anwendung nutzbar zu machen. Allerdings bleiben technische Herausforderungen. Zum Beispiel erfordert HDAd HV für HDAd Verpackungs-und Vektor-Verstärkung ist nicht so effizient wie frühe Generation Ads. HV ist eine der ersten Generation Ad und jede Verunreinigung der HV Kompromiss die Wirksamkeit der HDAd. Daher sind hocheffiziente Transfektion und optimale Bedingungen für jede serielle Passage kritisch. Ein anderer kritischer Parameter für Vektorproduktion ist, welche Passage (P1-P4) sollte für nachfolgende Passage 5, die direkt als Inokulum für Suspensionskulturen verwendet werden. Unserer Erfahrung, werden die besten Ergebnisse durch den Durchgang durch die HDAd vector Anteil drastisch in der folgenden Passage (P3 in Abbildung 2) erhöht erhalten. Die Ausbeute an HDAd Vektoren hängt Transgen-Kassetten. Während vector Produktion, werden beide Transgene geäußert, da beide Gene unter sichubiquitäre Promotor. Ngn3 ist ein Transkriptionsfaktor und Btc ist ein Wachstumsfaktor, wonach die HDAd exprimierenden Vektor Transkriptionsfaktor, beeinflussen Zellstammbaums hemmt Vektor Amplifikation während diejenige exprimieren Wachstumshormon hilft in Vektor-Replikation und Verpackung können suggeriert.
Mit Diabetes vorausgesetzt epidemische Ausmaße, sind neue Ansätze zur b-Zellmasse Wiederherstellung benötigt. In diesem Bericht wir Methoden, die Vorteile der HDAd Vektoren nutzen, um Gentransfer von Insel-definierenden Linie Transkriptionsfaktor, zusammen mit der für Ngn3 islet Wachstumsfaktor bewirken beschreiben, Betacellulin Inselneogenese in periportalen Regionen der Leber zu induzieren. Um die Wirksamkeit der dies zu bewerten, ist es wichtig zu Mäusen, die mit stabilen Hyperglykämie wählen und sicherzustellen, dass geeignete Kontrollen immer enthalten sind. Aus diesem Gentransfer Experimenten behandelt Leervektor diabetischen Mäusen sollte immer genutzt werden. Darüber hinaus verwenden HDAd-Ngn3 und HDAd-Btc individuell behandelten diabetischen mice dient dazu, den individuellen Beitrag dieser beiden Gene in Inselneogenese testen. Da unsere Daten zeigen, dass Ngn3 alleine ausreicht, um Inselneogenese induzieren, aber die Zugabe des Wachstumsfaktors, BTC, dient dazu, die Reaktion, die zu robusten Induktion Inselneogenese vermehren. Es ist auch wichtig, um zu testen, daß der Vektor Expression tatsächlich in das Zielgewebe, die Leber und auch erreicht, um zu demonstrieren, dass das Insulin im Plasma behandelten Mäusen getestet wird, die nicht aus Rest-Inseln in der Bauchspeicheldrüse, durch den Nachweis der Abwesenheit von pankreatischen Inseln in den diabetischen Mäusen.
Zusammengefasst liegt der Vorteil des HDAd-Vektor-System für den Gentransfer in seiner hohen Klonierungskapazität, effiziente Transduktion und langanhaltende Genexpression in der Leber mit minimalen chronische Toxizität sowie seine Art nicht Integration von Vektor-Genom in den Wirt Chromosom. Die primären Einschränkungen sind die komplexen Schritte in seiner Generation und beteiligt ihrein vivo-Anwendung ist in erster Linie auf die Leber mit den beliebtesten Ad Serotyp 5 begrenzt. Inselneogenese können induziert vollständig wiederherzustellen Plasmainsulinspiegel und Glukosetoleranz bei diabetischen Mäusen durch Induzieren Inselneogenese in der Leber durch Gentransfer von Insel-definierenden Linie Transkriptionsfaktor, zusammen mit der für Ngn3 islet Wachstumsfaktor, Betacellulin werden. In diesem Bericht zeigen wir die optimale Protokoll zu hochwertigen HDAd-Ngn3 und HDAd-Btc erzeugen, und zeigen Techniken zu induzieren und zu beurteilen Inselneogenese in der Leber der diabetischen Mäuse Hyperglykämie umzukehren.
Fußnote: Die virale Vektoren und die Zelllinien hier beschriebenen sind von der Vector Produktion Core Laboratory, Diabetes Research Center, Baylor College of Medicine ( http://www.bcm.edu/mcb/index.cfm?pmid=7731 ). Einige kommerzielle Kits sind auch zur Erzeugung HDAd Viren (zB Microbix biosyst verfügbarems Inc.).
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der NIH unterstützt: R03 DK089061-01 (VKY); NIH: K08 DK068391 (VKY), die Diabetes und Endokrinologie Research Center-(DERC - P30DK079638) am Baylor College of Medicine, ein Pilot & Feasibility Zuschuss aus Die DERC (VKY); Juvenile Diabetes Research Foundation: JDRF Award # 5-2006-134 (VKY).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Mammalian Transfection Kit ProFectionR | Promega | E1200 | |
| DNeasy Blood & Tissue Kit (50) | Qiagen | 69504 | |
| Perfecta SYBR Green SuperMix, ROX | Quanta Biosciences | 95055-500 | |
| Natriumdesoxycholat | Sigma | D6750-25G | |
| MEM Pulver | Invitrogen | 61100087 | |
| Penicillin Streptomycin | Sigma | 15140122 | |
| FBS | Atlanta Biologicals | S11150 | |
| L-Glutamin | Invitrogen | 25030-081 | |
| Hygromycin B | Sigma | H0654-1G | |
| MEM EAGLE Joklik | Sigma | M0518-10L | |
| Rnase | Roche | 10109169001 | |
| DNase I, Klasse II | Roche | 10104159001 | |
| Streptozocin | Sigma | s0130 | |
| Glass Spinnerflaschen | Corning | 4500-3L | |
| Glass Spinnerflaschen | Corning | 4500-250 | |
| Schieben A-analysator casset | PIERCE CH | PI66380 | |
| Rohr OptiSeal Poly allomer, 11,2 ml | Beckman Coulter | 362181 | |
| Cäsiumchlorid 1 kg | JT4042-2 | VWR | |
| Beckman LE-80K | Beckman Coulter | Optimale LE-80K Ultrazentrifuge | |
| Filtern | VWR | 28143-338 | |
| Zentrifugenröhrchen 500 ml | Corning | 431123 | |
| tailveiner restrainer | Braintree Scientific, Inc | tv-150 | |
| Insulin, Maus ELISA | Mercodia | 10-1247-01 | |
| Microvette CB300 | Sarstedt | 16.443.100 | |
| D-Glucose | Sigma | G8270 | |
| Maus-C-Peptid-ELISA-Kit | Wako Pure Chemical Industries, Ltd | # 631-07231 | |
| Meerschweinchen Anti-Insulin-Antikörper | Abcam | ab7842 | |
| Ziege-Anti-Pdx1 Antikörper | Geschenk von Dr. Christopher Wright | ||
| Maus anti Ngn3 Antikörper | Beta Cell Biology Consortium, Univ. of Pennsylvania | AB2013 | |
| Maus anti Nkx6.1 Antikörper | Beta Cell Biology Consortium, Univ. der Pennsylvania | F64A6B4 | |
| Anti-Betacellulin Antikörper | Cell Sciences | PAAQ1 | |
| ALT (SGPT) Color Reagent SET. | Teco Diagnostics | A526 - 120 | |
| AST / (SGOT), Farbe Endpoint Reagent Set | Teco Diagnostics | A561-120 |
Tabelle 2. Spezifische Reagenzien und Ausrüstung.
Referenzen
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten