Method Article
Neo-Islet formation dans le foie des souris diabétiques par Helper-dépendante Transfert de gènes à médiation adénovirale Vecteur
Dans cet article
Résumé
Nous décrivons hépatique néo-îlots formation en STZ (streptozotocine)-induite des souris diabétiques par transfert de gène de Neurogenin3 (Ngn3) et bêtacelluline (Btc) à l'aide d'aide en fonction de vecteur adénoviral (HDAd) et la reprise de l'hyperglycémie. Notre méthode prend avantages de helper-vecteurs adénoviraux dépendants de leur très efficace dans la transduction in vivo et l'expression du gène de longue durée.
Résumé
Diabète de type 1 est causé par des lymphocytes T destruction auto-immune des cellules productrices d'insuline dans le pancréas. Jusqu'à présent remplacement de l'insuline est encore le traitement majeur, car la transplantation d'îlots a été limitée par la disponibilité des bailleurs de fonds et par la nécessité d'immunosuppression à long terme. Induite îlot néogenèse par transfert de gène de Neuogenin3 (Ngn3), l'îlot lignée définir facteur de transcription spécifique et bêtacelluline (BTC), un facteur de croissance îlot a le potentiel de guérir diabète de type 1.
Les vecteurs adénoviraux (Ads) sont très efficaces vecteur de transfert de gène, mais Annonces de première génération présentent plusieurs inconvénients pour une utilisation in vivo. Helper-dépendants Annonces (HDAds) sont les annonces les plus avancées qui ont été développées pour améliorer le profil de sécurité de première génération de pub et de prolonger l'expression du transgène 1. Ils manquent de toxicité chronique parce qu'ils n'ont pas les séquences codantes virales 2-5 et ne conserver que l'annonce cis elNTS nécessaires à la replication du vecteur et de l'emballage. Cela permet le clonage des gènes jusqu'à 36 ko.
Dans ce protocole, nous décrivons la méthode de production HDAd-Ngn3 et HDAd-Btc et de livrer ces vecteurs dans des souris diabétiques STZ-induits. Nos résultats montrent que la co-injection de HDAd-Ngn3 et «îlots» néo-HDAd Btc induit dans le foie et renverse l'hyperglycémie chez des souris diabétiques.
Protocole
1. Cloner les gènes thérapeutiques dans le vecteur navette HDAd
- Clone souris Ngn3 et BTC ADNc dans le vecteur plasmidique contenant pLPBL1 un allongement ubiquitaire facteur-1 de promoteur (BOS) et un signal poly A. À la fin, vérifiez vecteurs par analyse de la séquence, puis sous-cloner ces cassettes d'expression dans pΔ28 navette HDAd plasmide 6.
- Vecteurs navettes HDAd digérer par Pmel pour libérer le squelette du plasmide, ADN purifier par extraction à l'alcool phénol / chloroforme / isoamyl suivie d'une précipitation à l'éthanol et reconstituer la transfection de qualité de l'eau.
2. Helper-dépendante de la production vecteur adénoviral
Production de vecteurs HDAd implique plusieurs étapes qui doivent être suivies pour des résultats optimaux.
2.1 Transfection
- Deux jours avant la transfection, de semences 116 cellules 7 dans 6-cm-vaisselle pour atteindre 70-80% de confluence le jour de la transfection.
- Trois heures avant la transfection, éliminer le milieu et ajouter 5 ml de milieu de croissance frais [MEM supplémenté avec 10% de FBS et le PSG 1% (pénicilline, streptomycine et glutamine), Invitrogen].
- Transfecter 116 cellules avec 10 ug d'ADN à partir de l'étape 1.2), en utilisant le kit de transfection ProFectionR mammifères de Promega selon les instructions du fabricant.
- Le lendemain, laver les cellules avec 1 ml de milieu de croissance 2 fois. Ajouter virus auxiliaire (HV) à 500 particules de vecteur (VP) / cellule de 0,1 ml de PBS contenant du calcium et du magnésium (PBS + +) et la superposition des cellules. Secouez délicatement les plats afin de répartir uniformément la HV toutes les 10 min.
- Après 60 minutes, ajouter 1,5 ml de milieu d'entretien (MEM, 5% de FBS, le PSG 1%).
- Ajouter un autre 1 ml de milieu d'entretien le lendemain.
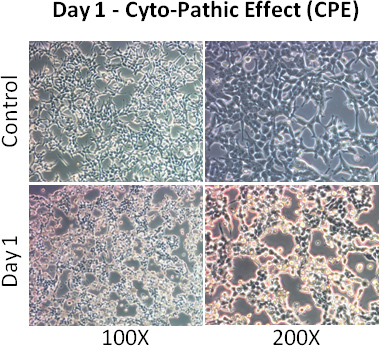
- Respecter les cellules pour les CPE (effet cytopathique - cellules s'arrondissent et détaché). Plus de 80% des cellules doit montrer CPE 2 jours après l'infection.
- Recueillir lysat cellulaire brut (CVL, cellules et le milieu), unele volume jj 10% de sucrose à 40% et conserver à -80 ° C. Le CVL est étiqueté comme passage 0 - (CVL-P0).
2.2 Vecteur d'amplification
- Gel (-80 ° C, 3-5 min) / dégel (37 ° C, 1-2 min) 3 fois.
- Superposition 0,5 ml CVL complétée par HV à 200 pv / cellule pour 116 cellules confluentes en 6-cm-vaisselle, et secouez le plat doucement toutes les 5 min. Après 30 minutes, ajouter 1 ml milieu d'entretien.
- Ajouter 1 ml d'entretien courant moyen suivant. 2 jours plus tard, la plupart des cellules doit montrer CPE.
- Recueillir le CVL et conserver à -80 ° C (CVL-P1) tel que décrit pour l'étape 2.1.8).
- Répétez la procédure pour 3 fois pour obtenir le CVL P2-P4.
- Extraire l'ADN (sang DNeasy Tissue Kit &, Qiagen) à partir de 0,2 ml de CVL collectés en P1 à P4, et d'analyser l'amplification vecteur par PCR quantitative en utilisant des amorces HT et HDAd spécifique (tableau 1). Utilisez le passage dans lequel HDAd exponentielle amplifiée par rapport à HV (P3 de la figure 2) pour la subsequent procédure.
- Co-infection 90% 116 cellules confluentes dans un plat de 15cm avec 0,5 ml CVL et HV à 200 pv / cellule. Basculez le plat doucement toutes les 5 min. Après 30 minutes, ajouter 10 ml de milieu d'entretien.
- Ajouter 5 ml de milieu d'entretien après 24 heures.
- Recueillir les cellules par centrifugation à 1500 xg pendant 5 min exactement 48 heures après l'infection.
- Remettre en suspension les cellules dans 1 ml de PBS + + saccharose contenant 4% (P5) et congeler à -80 ° C.
2.3 La production à grande échelle HDAd
- Pour préparer 116 cellules de l'infection dans la culture de cellules en suspension, transférer 116 cellules confluentes en 8 x 15 cm, plat en 3 flacon spinner L et ajouter du milieu de croissance de suspension (Joklik modifié MEM supplémenté avec 5% de FBS, 0,1 mg / ml d'hygromycine et 1% PSG) en finale de 1 L et incuber dans un incubateur à CO 2 avec rotation à 60 tours par minute 8.
- Ajouter 0,5 L de milieu frais tous les jours pendant 2 jours (au total 2 L).
- Compter les cellules le troisième jour. Les cellules sont prêts à utiliser si t pour atteindreo le nombre total de cellules de 1x10 9.
- Gel / dégel P5 3 fois.
- Prélever des cellules du flacon spinner 3 L par centrifugation à 1000 xg pendant 5 min. Économisez 100 ml de surnageant de remettre en suspension les cellules.
- Transfert des cellules dans un flacon spinner de 250 ml. Ajouter P5 et HV à 200 pv / cellule pour les cellules et incuber pendant 1 heure à 37 ° C à 60 rpm.
- Cellules de transfert et moyennes flacon de 3 litres spinner, ajouter 2 L milieu de croissance suspension. Transférer 1 ml de suspension cellulaire dans un puits dans une plaque à 12 puits pour observer les cellules pour les CPE.
- Incuber les cellules en fiole centrifuge pendant 2 jours dans un incubateur à CO 2 à 60 tours par minute.
- Recueillir les cellules par centrifugation et remis en suspension avec 15 ml 100 mM Tris-HCl (pH 8,0) et conserver à -80 ° C (P6) jusqu'à ce que la purification.
2,4 purification Vecteur
- Ajouter 1,0 ml de désoxycholate de sodium à 5% à la P6. Mélanger doucement et incuber pendant 30 min à température ambiante.
- Ajouter 400 ul de 2 M MgCl 2, 300 μl de RNase A (10 mg / ml), et 300 ul de DNase I (10 mg / ml) et incuber à 37 ° C pendant 1 heure.
- Centrifuger à 6000 xg pendant 10 min à température ambiante pour ramasser le surnageant.
- Stériliser tubes NVT ultracentrifugation 65 (Beckman) sous lumière UV pendant 1 heure dans la hotte de culture tissulaire.
- Ajouter 2,8 ml d'une solution à faible densité de CsCl (1,25 g / ml), sous-couche de 2,8 ml à haute densité de la solution de densité de CsCl (1.41g/ml) puis superposition 5-6 ml de surnageant pour remplir le tube au goulot. Utiliser 100 mM Tris-HCl (pH 8,0) pour remplir le tube si nécessaire.
- Centrifuger à 10 ° C pendant 30 min à 50.000 tours par minute à 10 ° C avec Beckman LE-80K-65 en utilisant NVT rotor.
- Essuyez la zone avec de l'éthanol à 70% pour ponction à l'aiguille, et de recueillir la bande inférieure opalescente avec une seringue de 3 ml équipé d'aiguille 22-G par ponction côté (figure 3a). Parfois, un groupe d'aide très faible peut être vu ci-dessous la bande vecteur plus important. Essayez d'obtenir autant d'ebande de vecteur e que possible, sans que la bande assistant. Il est acceptable à cette étape, même si une partie de la bande d'aide est aspiré, comme il sera séparé à la centrifugation subséquente durant la nuit qui suit.
- Placez les bandes rassemblées dans un des nouveaux tubes stérilisés ultracentrifugation. Remplir les tubes à col en superposant 1,35 g / ml, solution de densité de CsCl.
- Centrifuger à 10 ° C à 50.000 tours par minute du jour au lendemain. Recueillir la bande opalescente (figure 3b).
- Transférer la bande dans une cassette de dialyse (Slide-a-Lyzer, 10.000 MWCO, Thermo-scientifique).
- Dialyser contre 3 L de autoclavé 10 mM Tis-HCl, pH 7,2 contenant 2 mM de MgCl 2 et 4% de saccharose à 4 ° C pendant la nuit.
- Retirer le vecteur HDAd de cassette de dialyse. Aliquote de 20 ul pour le titre physique et 50 pi de caractérisation de l'ADN. (Remarque: Pour Ngn3 vecteur, répétez "P6" trois fois pour obtenir le vecteur suffisant puisque le rendement de HDAd-Ngn3 est faible par rapport à HDAd-Btc ou HDAd vide.)
2.5 Caractérisation des vecteurs HDAd
- Déterminer le titre physique (vp / ml) en utilisant la densité optique (DO). Ajouter 20 ul vecteur ou 20 ul du tampon de dialyse à 380 pi de tampon TE contenant 0,1% de SDS et incuber à 56 ° C pendant 20 min. Mesurer la DO à 260 nm. Le titre physique = OD260 x 1,1 x 10 12 x 20 (vp / ml).
- Analyser la contamination HV par qPCR. Utilisez aliquote de 50 ul d'extraire l'ADN à partir de tissus DNeasy / kit d'extraction de l'ADN du sang (Qiagen). Diluer l'ADN de 1000 fois et prendre 5 ul pour analyse qPCR utilisant d'aide et le vecteur des amorces spécifiques (tableau 1). La contamination d'aide doit être inférieure à 1%, comme le montre la figure 4A.
- Utilisez Southern blot pour analyser la structure de vecteur. Effectuer une analyse par transfert de Southern 10 à l'aide d'une sonde pour la répétition terminale inversée (ITR). Le résultat représentatif est illustré à la figure 4B.
- Déterminer l'efficacité in vitro. Infect connunombre de 116 cellules dans une plaque à 12 puits avec le vecteur HDAd à 1000 vp / cellule en quatre exemplaires. Récolter les cellules après 48 heures et extraire l'ARN pour déterminer l'expression des ARNm Ngn3 et Btc par qRT-PCR (Tableau 1). Les résultats représentatifs sont présentés dans la figure 5.
3. Traitement des souris diabétiques par HDAd-Ngn3 et-Btc
3,1 induction du diabète chez la souris et l'injection de vecteurs HDAd
- Préparation de STZ: Préparer un tampon citrate 0,1 M, et ajuster le pH à 4.3 au 4.5. Filtrer cette seringue à travers un filtre de 0,22 mm. Utilisation de l'eau stérile diluer à 0,01 M citrate de Na pH 4.2 à 4.5. Dissoudre quantité appropriée de STZ (Sigma) dans cette solution pour obtenir une concentration finale de 12,5 mg / ml. A cette concentration il n'y a pas de précipitation. Conserver cette solution STZ à 4 ° C jusqu'à utilisation. Amener la température de la solution d'injection à la température ambiante immédiatement avant l'injection. La solution shoul STZd être préparées chaque jour et injecté dans les 5-10 min d'être dissoute.
- Injecter la solution par voie intrapéritonéale STZ (10 ul / g pour obtenir une dose de 125 mg de poids corporel / g), dans la soirée entre 5-7 pm (avant que les lumières sont éteintes dans l'établissement de la souris et les souris commencent à se nourrir activement), sur deux jours consécutifs 9.
3.2 Suivi des souris glucose et l'injection de vecteurs HDAd.
- Souris rapides pour 6 heures et le poids corporel et la mesure de la glycémie par semaine jusqu'à souris ont une hyperglycémie (≥ 250mg/dl). Utilisez un glucomètre One Touch pour le sang collecté par snip queue. Une fois que la glycémie est ≥ 250 mg / dl, vérifiez à nouveau la glycémie de nouveau dans 48 heures après une heure 6 rapide pour assurer une hyperglycémie persistante et de la glycémie se situe dans la fourchette cible pour le traitement: 250-500 mg / dl.
- Traiter des souris présentant une hyperglycémie persistante par une injection intraveineuse unique de vecteurs HDAd via veine de la queue. La dose totale est vecteur 6x10 11 vppour tous les groupes de traitement (dans 0,25 ml): 5.10 11 vp Ngn3 1 x10 11 vp Btc pour le groupe combiné, 5x10 11 1x10 + vp Ngn3 11 vp pour Ngn3 groupe et 1x10 11 vp Btc + 5x10 11 vp vecteur vide pour le groupe et Btc 6x10 11 vp vecteur vide pour le groupe témoin.
- Injection dans la veine de la queue. Placez la souris dans Tailveiner dispositif de retenue (TV-150, Braintree Scientific Inc), et utiliser l'eau chaude pour dilater les veines de la queue, la queue nettoyer avec de l'alcool à 70%. Tenez la queue en dessous du site d'injection entre le pouce et l'index de la main, utilisez une autre main pour injection. Avant l'injection, s'assurer qu'il n'y ait pas de bulles dans la seringue (en utilisant 30 1/2 G aiguille et seringue de 1 ml). Insérez l'aiguille et injecter le vecteur lentement. Si l'aiguille est dans la veine, un éclair de sang peut être vu dans le moyeu de l'aiguille et aussi aucune résistance lors de l'injection. Après avoir retiré l'aiguille, tenez le site d'injection avec une compresse pour arrêter l'hémorragie avant de retourner souris to cage.
Si l'aiguille n'est pas dans la veine il ya une résistance significative à l'injection sous-cutanée et un peu papule se pose. A ce moment retirer l'aiguille et essayez à nouveau sur un site différent.
3.3 Analyse des effets de HDAd-Ngn3 + HDAd-Btc traitement.
- Monitor 6 h glycémie à jeun et le poids corporel par semaine après le traitement vectoriel.
- Recueillir le sang de la veine saphène ou veine de la queue à la jambe toutes les 2 semaines à l'insuline essai (souris insuline kit ELISA, Mercodia) et des enzymes hépatiques (AST et ALT Infinity réactifs, Thermo Scientific) à l'aide des kits commerciaux.
- Placez la souris dans un tube Falcon de 50 ml non plafonnés avec des trous pratiqués dans l'extrémité fermée.
- La tête de la souris est à l'extrémité fermée du tube et les jambes et la queue sur le côté ouvert du tube. À recueillir du sang à partir de la jambe gauche, étendre la jambe gauche à l'extérieur du tube et pincer légèrement la peau de la cuisse entre le pouce et l'index afin d'immobiliser la jambe.
- Utiliserun rasoir pour enlever les poils de la jambe / zone inférieure de la jambe, pour exposer la veine saphène, qui est présent sur le côté latéral de la jambe inférieure. Nettoyer la peau rasée avec de l'alcool à 70% et laisser sécher.
- Piquer la veine saphène interne avec une aiguille de calibre 25, Recueillir le sang avec Microvette cb300 tube (Sarstedt) et mettre les tubes sur la glace.
- Appuyez sur le point de ponction avec une compresse pour arrêter l'hémorragie avant de retourner les souris dans les cages.
- Centrifuger les tubes à 3000 xg pendant 5 min, prenez le surnageant et conserver à -20 ° C pour analyse ultérieure.
3.4 Effectuer un test de tolérance au glucose (GTT) à 6 semaines après le traitement.
- Dissous D-glucose (Sigma) dans de l'eau distillée pour fabriquer du glucose à 15% (15 g / 100 ml) et filtre stérile de glucose.
- Souris rapides pour 6 heures. Utiliser un tampon à chaud pour réchauffer les souris et recueillir le sang (0 point dans le temps min). Puis injecter 1,5 g / kg de D-glucose ip (10 ul / g de glucose 15%).
- Coltionner le sang à 15, 30, 60, 120 min.
- Mesurer le taux de glucose et d'insuline dans tous ces échantillons.
3.5 L'analyse des tissus pour évaluer l'expression des vecteurs et d'évaluer l'induction de l'îlot néogenèse.
Dans toutes ces étapes, les contrôles qui sont nécessaires pour interpréter de manière fiable les résultats suivants: (1) vecteur vide ont traité des souris diabétiques (2) non-diabétiques et les souris (3) non-diabétique du pancréas servant de contrôle positif pour l'expression de l'îlot hormones et facteurs de transcription spécifiques.
- Récolte du foie et du pancréas à 3 et 6 semaines après le traitement. Diviser en 2 morceaux, le premier pour congélation rapide dans l'azote liquide et le stockage à -80 ° C pour l'ARN et l'extraction des protéines, et la seconde à fixer avec formol à 10% du jour au lendemain pour l'analyse immunohistochimique.
- Extraire l'ARN par un protocole standard et analyser l'expression des îlots hormones et des facteurs de transcription, avec Ngn3 et Btc de confirmationvecteur d'expression m, dans le foie par qRT-PCR en utilisant des amorces spécifiques 9, 10.
- Extrait de l'insuline et de peptide C dans le foie par la méthode d'extraction de l'acide-éthanol et de quantifier par un kit commercial ELISA (dosage de l'insuline ultra sensible, Mercodia, C-peptide kit ELISA, Wako).
- Effectuer immunocoloration pour îlots hormones spécifiques (insuline, glucagon, PP, SST) avec des îlots facteurs de transcription spécifiques dans de la paraffine embarqués articles 9, 10. L'expression de Ngn3 et Btc peut également être confirmée par immunomarquage.
4. Les résultats représentatifs
Nous avons cloné et Ngn3 Btc ADNc dans des vecteurs pΔ28 conduits par promoteur ubiquitaire eIF2A (BOS) et a généré HDAd-Ngn3 et HDAd-Btc. Comme le montre la figure 2, par rapport contamination HV diminué de manière significative (ce qui implique l'amplification et l'amplification vecteur plus moins helper) au passage 3. Par conséquent, nous avons utilisé P3 pour la production de vecteurs ultérieure. Après la premièreGradient discontinu de CsCl et ultracentrifugation, nous avons recueilli la bande basse vecteur et ensuite recueilli la bande opalescente correspondant au vecteur HDAd dans l'ultracentrifugation seconde (figure 3). Le vecteur purifié HDAd a moins de 1% de contamination HV (figure 4A) par PCR quantitative et a pas de contamination visible auxiliaire sur Southern blot (figure 4B), ce qui indique une qualité suffisante pour perfusion vecteur dans des souris. Une analyse plus poussée compris l'expression du transgène par une infection de 116 cellules. Les niveaux d'expression d'ARNm de Ngn3 et Btc étaient plus élevés dans les cellules infectées par le vecteur par plus de 10.000 fois par rapport à ceux des cellules non infectées (figure 5).
HDAd-Ngn3 et-Btc ont ensuite été administré à la STZ induit des souris diabétiques par injection dans la veine de queue avec vecteur vide injecté et HDAd-Btc souris diabétiques par injection servant de témoin négatif. L'hyperglycémie a été renversé et stimulée par le glucose sécrétion d'insulinea été restaurée chez les souris traitées avec les deux HDAd-Ngn3 et HDAd-Btc mais pas chez les souris traitées avec le vecteur seul gène ou un vecteur contrôle vide (figure 6). Le HDAd-Ngn3-Btc traitement induit îlot néogenèse et cela a été quantifiée par dosage de la teneur totale en insuline et de peptide C (figure 6E) avec les non-diabétiques, diabétiques traités souris vecteur vide servant de témoins. La présence de C-peptide d'insuline et dans des rapports équimolaires confirme que l'insuline est détecté dans le foie est en effet en cours de synthèse dans le foie. RT-qPCR a confirmé que le foie de HDAd-Ngn3-Btc souris traitées ont exprimé toutes les hormones îlots spécifiques et facteurs de transcription 9. Immunohistochimie a montré cellules productrices d'insuline positifs dans le foie des souris traitées avec HDAd-Ngn3 et HDAd-Btc, mais pas de cellules productrices d'insuline positifs ont été observés chez les souris traitées avec le vecteur de commande (Figure 7). Nous avons également confirmé qu'il n'y avait pas îlots résiduels dans le pancréas de la treate Ngn3-Btcsouris d par rapport aux nombreux îlots de non-diabétique du pancréas. Vecteur (Ngn3 et Btc) avec îlot lignée facteur de transcription spécifique (PDX-1 et Nkx6.1) expression a également été évaluée par immunocoloration du foie (figure 7).
Organigramme Figure 1. D'une thérapie génique de souris diabétiques utilisant le système du virus helper-dépendante. Tout d'abord, Ngn3 et BTC, dans une cassette entraîné par un promoteur ubiquitaire BOS, sont clonés dans HDAd navette (pΔ28) vecteurs. HDAd est produite par plusieurs étapes, y compris la transfection, des passages successifs d'amplification, et une infection à grande échelle suivie d'une purification vecteur. Après avoir caractérisé la qualité, HDAds sont injectées par voie intraveineuse STZ-induites des souris diabétiques via veine de la queue. Les effets du traitement sont évalués par le glucose de mesure, le poids corporel, GTT et par des analyses d'expression géniquedans le foie.
Figure 2. Détermination vecteur d'amplification HDAd. L'ADN est extrait du passage P0 à P4 en utilisant des kits d'extraction d'ADN (Qiagen). ADN ADN est dilué 1000 fois et 5 pi est utilisé pour PCR en temps réel (qPCR). Amorces auxiliaires et spécifique du vecteur sont utilisés. Les courbes d'étalonnage sont générés par des dilutions en série (10 -5 à 1 ng / ml) de HDAd navette vecteurs plasmidiques et HV plasmidiques (panneaux supérieurs). En utilisant les courbes d'étalonnage et les valeurs CT pour le numéro de vecteur auxiliaire et copie virus est calculée et le rapport de HDAd / HV est tracée en pourcentage du virus total (helper + HDAd). Par conséquent, l'amplification vecteur relatif est calculé comme suit: [nombre de copies du vecteur / (vecteur + copie virus helper nombre)]. Dans l'exemple montré (panneau inférieur) d'amplification vecteur HDAd plateau à P4, tandis que le rapport HDAd / HV augmente à P3. Par conséquent, P3 est choisi pour l'étape ultérieure.
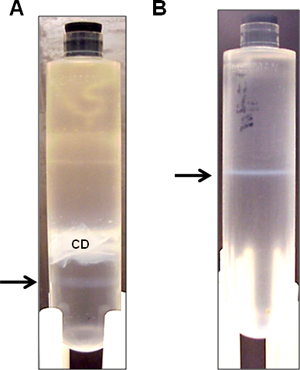
Figure 3. Bandes vecteur représentatif HDAd après ultracentrifugation de densité discontinu de CsCl. HDAd vecteur est purifié à partir d'une culture spinner 3L sur gradient de densité de CsCl séquentielle. (A) Après ultracentrifugation en gradient de densité d'abord, une bande unique vecteur opalescent est visible (flèche) ci-dessous les débris cellulaires opaque (CD). La bande opalescente (flèche) est perçue pour la centrifugation en gradient de densité seconde. (B) Après l'ultracentrifugation en gradient de densité seconde, la bande opalescente (flèche) est collectée pour la dialyse.
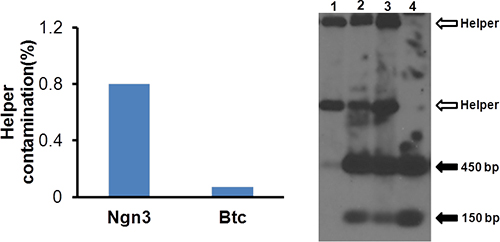
Figure 4. Analyse de la contamination par le virus helper. L'ADN est extrait à partir de virus purifié et 50 pl contamination helper est unssessed comme dans la figure 2. La figure montre la contamination de l'aide HDAd-Ngn3 et HDAd-Btc est inférieure à 1%.
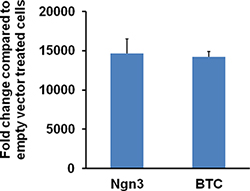
Figure 5. Blot analyse de la structure du vecteur HDAd. Southern est réalisée comme décrit précédemment (Oka K, et al.). Piste 1: l'ADN de virus auxiliaire; Voie 2: ADN de P3; Voie 3: ADN de P4; Voie 4: vectopr purifié. Flèches blanches indiquent les bandes de virus helper dérivés et les flèches pleines indiquent les bandes ITR dérivés du vecteur HDAd.
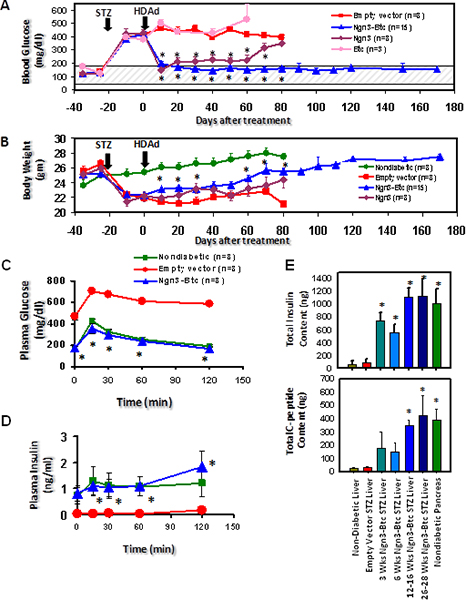
Figure 6. Niveau d'expression de Ngn3 ou Btc dans 116 cellules infectées avec le vecteur HDAd-Ngn3 ou HDAd-Btc. 116 cellules dans un plaques à 12 puits sont infectées avec le vecteur HDAd-Ngn3 ou HDAd-Btc ou vide à 1000 vp / cellule pendant 2 jours. Cells sont récoltées et l'ARN total est extrait en utilisant le réactif Trizol. qRT-PCR est réalisée en utilisant Ngn3 ou Btc amorces spécifiques. Le Ngn3 parent ou expression de l'ARNm Btc a augmenté de plus de 10.000 fois dans des cellules infectées par le HDAd-Ngn3 ou HDAd-Btc. Le chiffre est tiré à part de Dev.Cell mars 2009; 16 (3): 358-73; Yechoor et al. al., avec la permission d'Elsevier.
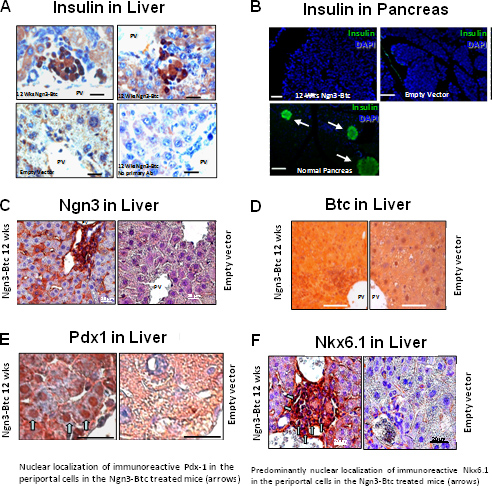
Figure 7. Transfert de gènes de HDAd-Ngn3 et HDAd-Btc dans des souris diabétiques STZ-induites conduit au renversement du diabète et de l'induction de l'îlot néogenèse dans le foie. (A) glucose dans le plasma et le poids corporel (B) des souris diabétiques par STZ traités avec induites HDAd-Ngn3 et HDAd-Btc. (C) Le glucose plasmatique et d'insuline au cours d'un IP-GTT à 6 semaines après le traitement. (D) représentant coloration insuline dans le foie 12 semaines après le traitement. * P <0,05 (vs groupe vecteur vide). Le chiffre est tiré à part de Dev. Cell mars 2009, 16 (3): 358-73; Yechoor et al, avec la permission d'Elsevier..
| nom | amorce sens | inverser primaire | |
| assistant | GACCATCAATCTTGACGACC | ATGTCGCTTTCCAGAACCC | |
| vecteur | TTGGGCGTAACCGAGTAAG | ACTTCCTACCCATAAGCTCC | |
| Ngn3 | AAGAGCGAGTTGGCACTCAG | TCTGAGTCAGTGCCCAGATG | |
| Btc | GCACAGGTACCACCCCTAGA | TGAACACCACCATGACCACT | |
Tableau 1. Séquences des amorces.
Discussion
HDAds ont été développées pour surmonter la faiblesse des annonces de première génération et à exploiter pour l'application de thérapie génique. Toutefois, des problèmes techniques subsistent. Par exemple, HDAd nécessite HT pour l'emballage HDAd et d'amplification vecteur n'est pas aussi efficace que les premières générations annonces. HV est une annonce de première génération et toute contamination de compromis HV l'efficacité de HDAd. Par conséquent, la transfection très efficace et des conditions optimales pour chaque passage en série sont essentiels. Un autre paramètre essentiel pour la production de vecteurs qui est de passage (P1 à P4) doit être utilisé pour le passage ultérieur 5 qui est directement utilisé comme inoculum pour les cellules en suspension. Pour notre expérience, les meilleurs résultats sont obtenus en utilisant le passage par lequel proportion vecteur HDAd est augmenté de façon spectaculaire dans le passage suivant (P3 de la figure 2). Le rendement des vecteurs HDAd dépend de cassettes transgène. Au cours de la production de vecteurs, les deux transgènes sont exprimés parce que les deux gènes sont souspromoteur ubiquitaire. Ngn3 est un facteur de transcription et de la CTB est un facteur de croissance, ce qui suggère que le facteur de transcription HDAd vecteur exprimant ce qui peut influer sur la lignée cellulaire inhibe l'amplification vecteur tandis que l'hormone de croissance contribue à exprimer la replication du vecteur et de l'emballage.
Avec le diabète prend des proportions épidémiques, de nouvelles approches pour restaurer la masse des cellules b sont nécessaires. Dans ce rapport, nous décrivons les méthodes pour exploiter les avantages de vecteurs HDAd pour effectuer le transfert de gènes de l'îlot lignée de définir le facteur de transcription, Ngn3 avec le facteur de croissance des îlots, bêtacelluline pour induire néogenèse des îlots dans les régions périportaux du foie. Pour évaluer l'efficacité de ce fait, il est important de choisir des souris présentant une hyperglycémie stable et s'assurer que les contrôles appropriés sont toujours inclus. Pour ces expériences de transfert de gènes, le vecteur vide ont traité des souris diabétiques doivent toujours être utilisés. En outre, en utilisant HDAd-Ngn3 et HDAd-Btc traitées individuellement diabétique kmCE sert à tester la contribution individuelle de ces deux gènes dans des îlots néogenèse. Comme nos données démontrent que Ngn3 seule est suffisante pour induire îlot néogenèse, mais l'ajout du facteur de croissance, la CTB, sert à augmenter la réponse conduisant à l'induction robuste de l'îlot néogenèse. Il est également important de vérifier que le vecteur d'expression est en effet réalisé dans le tissu cible, le foie et aussi de démontrer que l'insuline dosée dans le plasma des souris traitées ne vient pas des îlots résiduels dans le pancréas, en démontrant l'absence de pancréas îlots chez les souris diabétiques.
En résumé, l'avantage du système HDAd-vecteur de transfert de gènes réside dans sa capacité de clonage élevée, une transduction efficace et à long terme l'expression des gènes durable dans le foie avec une toxicité chronique minimale ainsi que la nature de la non-intégration du génome vecteur dans l'hôte chromosome. Les principales limites sont les étapes complexes qui interviennent dans sa production et saapplication in vivo est principalement limité au foie avec le sérotype le plus populaire Ad 5. Islet néogenèse peut être amené à restaurer entièrement l'insulinémie et la tolérance au glucose chez les souris diabétiques en induisant néogenèse des îlots dans le foie par transfert de gène du facteur de transcription îlot lignée définissant, Ngn3 avec le facteur de croissance des îlots, bêtacelluline. Dans ce rapport, nous montrons le protocole optimal pour produire de haute qualité HDAd-Ngn3 et HDAd-Btc, et la démonstration de techniques pour inciter et d'évaluer néogenèse des îlots dans le foie des souris diabétiques pour inverser l'hyperglycémie.
Note: Les vecteurs viraux et les lignées cellulaires décrites ici sont disponibles dans le Laboratoire de base Vecteur de production, recherche sur le diabète Center, Baylor College of Medicine ( http://www.bcm.edu/mcb/index.cfm?pmid=7731 ). Certains kits commerciaux sont également disponibles pour générer des virus (par exemple HDAd Microbix biosystems Inc.)
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par des subventions du NIH R03: DK089061-01 (VKY); NIH: K08 DK068391 (VKY), le diabète et d'endocrinologie Centre de recherche-(DERC - P30DK079638) au Baylor College of Medicine, une subvention de pilote et de faisabilité de l'DERC (VKY); Juvenile Diabetes Research Foundation: Prix FRDJ # 5-2006-134 (VKY).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| Kit de transfection de mammifères ProFectionR | Promega | E1200 | |
| DNeasy Blood Kit et de tissus (50) | Qiagen | 69504 | |
| Perfecta SYBR Green Supermix, ROX | Quanta Biosciences | 95055-500 | |
| Désoxycholate de sodium | Sigma | D6750-25G | |
| MEM poudre | Invitrogen | 61100087 | |
| La streptomycine Pénicilline | Sigma | 15140122 | |
| FBS | Atlanta Biologicals | S11150 | |
| L-glutamine | Invitrogen | 25030-081 | |
| Hygromycine B | Sigma | H0654-1G | |
| MEM EAGLE Joklik | Sigma | M0518-10L | |
| Rnase | Roche | 10109169001 | |
| DNase I, grade II | Roche | 10104159001 | |
| Streptozocine | Sigma | s0130 | |
| Verre spinner flacons | Corning | 4500-3L | |
| Verre spinner flacons | Corning | 4500-250 | |
| Faites glisser une casset-lyseur | PIERCE CH | PI66380 | |
| Tube OptiSeal poly allomer, 11,2 ml | Beckman Coulter | 362181 | |
| Chlorure de césium 1 kg | JT4042-2 | VWR | |
| Beckman LE-80K | Beckman Coulter | Optimal LE-80K ultracentrifugeuse | |
| Filtrer | VWR | 28143-338 | |
| Centrifuger le tube à 500 ml | Corning | 431123 | |
| tailveiner restrainer | Braintree scientifique, INC | tv-150 | |
| L'insuline, Souris ELISA | Mercodia | 10-1247-01 | |
| Microvette cb300 | Sarstedt | 16.443.100 | |
| D-glucose | Sigma | G8270 | |
| Souris C-peptide ELISA Kit | Wako Pure Chemical Industries, Ltd | # 631-07231 | |
| Guinée porc anticorps anti-insuline | Abcam | ab7842 | |
| de chèvre anti-anticorps Pdx1 | don du Dr. Christopher Wright | ||
| souris anti Ngn3 anticorps | Beta Cell Biology Consortium, Univ. de Pennsylvanie | AB2013 | |
| souris anti Nkx6.1 anticorps | Beta Cell Biology Consortium, Univ. de Pennsylvania | F64A6B4 | |
| bêtacelluline anticorps anti- | Cell Sciences | PAAQ1 | |
| ALT (SGPT) SET Couleur réactif. | Diagnostics Teco | A526 - 120 | |
| AST / (SGOT), jeu de réactifs Couleur Endpoint | Diagnostics Teco | A561-120 |
Tableau 2. Réactifs et équipements spécifiques.
Références
- Parks, R. J. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proc. Natl. Acad. Sci. U. S. A. 93, 13565-13570 (1996).
- Kim, I. H., Jozkowicz, A., Piedra, P. A., Oka, K., Chan, L. Lifetime correction of genetic deficiency in mice with a single injection of helper-dependent adenoviral vector. Proc. Natl. Acad. Sci. U.S.A. 98, 13282-13287 (2001).
- Belalcazar, L. M. Long-term stable expression of human apolipoprotein A-I mediated by helper-dependent adenovirus gene transfer inhibits atherosclerosis progression and remodels atherosclerotic plaques in a mouse model of familial hypercholesterolemia. Circulation. 107, 2726-2732 (2003).
- Oka, K. Long-term stable correction of low-density lipoprotein receptor-deficient mice with a helper-dependent adenoviral vector expressing the very low-density lipoprotein receptor. Circulation. 103, 1274-1281 (2001).
- Nomura, S. Low-density lipoprotein receptor gene therapy using helper-dependent adenovirus produces long-term protection against atherosclerosis in a mouse model of familial hypercholesterolemia. Gene Ther. 11, 1540-1548 (2004).
- Ng, P. A high-efficiency Cre/loxP-based system for construction of adenoviral vectors. Hum. Gene Ther. 10, 2667-2672 (1999).
- Palmer, D., Ng, P. Improved system for helper-dependent adenoviral vector production. Mol. Ther. 8, 846-852 (2003).
- Oka, K., Chan, L. Helper-Dependent Adenoviral Vectors. Current Protocols in Molecular Biology. , 16.24.1-16.24.23 (2005).
- Yechoor, V. Neurogenin3 is sufficient for transdetermination of hepatic progenitor cells into neo-islets in vivo but not transdifferentiation of hepatocytes. Dev. Cell. 16, 358-373 (2009).
- Yechoor, V. Gene Therapy with Neurogenin 3 and Betacellulin Reverses Major Metabolic Problems in Insulin-Deficient Diabetic Mice. Endocrinology. , (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon