Method Article
Tissue Engineering eines Menschen 3D
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Methoden, um menschliche 3D-Tumorgewebe als Testsysteme zu erstellen beschrieben. Diese Techniken basieren auf einer dezellularisierten Biologische Vaskularisierte Gerüst (BioVaSc), primäre menschliche Zellen und einer Tumor-Zellinie, die unter statischen als auch unter dynamischen Bedingungen in einer Strömungs Bioreaktor kultiviert werden können, basieren.
Zusammenfassung
Krebs ist eine der führenden Todesursachen weltweit. Aktuelle Therapiestrategien werden überwiegend in 2D-Kultur-Systeme, die physiologischen Bedingungen in vivo unzureichend widerspiegeln entwickelt. Biologische Zellen 3D-Matrices bieten ein Umfeld, in dem die Zellen können sich selbst organisieren, so dass die Untersuchung der Gewebeorganisation und der Zelldifferenzierung. Solche Gerüste können mit einem Gemisch aus verschiedenen Zelltypen, direkte 3D-Zell-Zell-Interaktionen zu studieren ausgesät werden. Um das 3D-Komplexität von Krebstumoren zu imitieren, hat unsere Gruppe ein 3D in vitro Tumortestsystem entwickelt.
Unsere 3D-Gewebetestsystem-Modelle der in vivo Situation von malignen peripheren Nervenscheidentumoren (MPNSTs), die wir mit unseren dezellularisiertes Schweine Jejunalsegment abgeleiteten biologischen vaskularisierten Gerüst (BioVaSc) gegründet. In unserem Modell reseeded wir eine modifizierte BioVaSc Matrix mit primären Fibroblasten, mikrovaskulären Endothelzellen (MVECs) und die S462-Tumorzelllinie. Für statische Kultur, wird die Gefäßstruktur des BioVaSc entfernt und die verbleibende Gerüst auf einer Seite offen (Dünndarmsubmukosa SIS-Muc) geschnitten. Die resultierende Matrix wird dann zwischen zwei Metallringen (Zell Kronen) befestigt.
Eine weitere Option ist es, die Zellkultur ausgesät SIS-Muc in einem Strömungsbioreaktorsystem, das die Zellen Scherbelastung aussetzt. Hier wird der Bioreaktor eine peristaltische Pumpe in einem selbstgebauten Inkubator verbunden. Ein Computer steuert die arterielle Sauerstoff-und Nährstoffzufuhr über Parameter wie Blutdruck, Temperatur und Volumenstrom. Dieser Aufbau ermöglicht eine dynamische Kultur entweder mit druckregulierten pulsierende oder Konstantstrom.
In dieser Studie konnten wir erfolgreich sowohl eine statische als auch dynamische 3D-Kultursystem für MPNSTs herzustellen. Die Fähigkeit, Krebstumore in einer natürlicheren 3D-Umgebung zu modellieren wird die Entdeckung, Erprobung und Validierung zu ermöglichenZukunft Pharmazeutika in einem Menschen-ähnliches Modell.
Einleitung
Neue Arzneimittel müssen in Bezug auf ihre Qualität, Sicherheit und Wirksamkeit vor der Zulassung überprüft werden. Bis heute sind Tierversuche die Standardmethode für Drogentests und Validierung. Jedoch aufgrund speziesspezifische Unterschiede, Tierversuche häufig nicht umfassend Bewertung der Wirkung der Verbindungen bei Menschen 1. Aus diesem Grund ist es wichtig, die menschliche Gewebemodelle, die für die in-vitro-Tests von neuen Arzneimitteln und Substanzen verwendet werden können, zu erzeugen.
Einer der Schwerpunkte unserer Gruppe ist die Schaffung von in-vitro-Testmodellen mit unseren biologischen vaskularisierten Gerüst (BioVaSc) 2,3. Die BioVaSc können als statische oder dynamische 3D-Matrixsystem verwendet werden. Für statische Kultur, ist die Schweine dezellularisiertes Jejunalsegment (Dünndarmsubmukosa SIS-Muc) in einem Metalleinsatz für die Zell Nachsaat platziert. Verschiedene Zellen, wie Krebszellen und Endothelzellen auf dem Gerüst gezüchtet werden.
Für dynamische Kultur, die BioVaSc einen Bioreaktor-System, das Fluss durch das Gefäßsystem oder über die Oberfläche des Gerüsts gilt angebracht. Strom Bioreaktoren implementieren biologische, mechanische oder elektrische Stimuli, die auf der Differenzierung oder Proliferation von Zellen 4 handeln. Für Bioreaktoren im Bereich des Tissue Engineering, ist das Grundkonzept, um die Bedingungen im menschlichen Körper simuliert. Wobei werden Zellen bereitgestellt eine natürliche Umgebung, in der sie miteinander und mit den sie umgebenden extrazellulären Matrix interagieren können. Zur Herstellung von in vitro-Testsystemen oder Transplantate, ist die Fähigkeit, die natürliche Umgebung der Zellen mit einem geeigneten Trägerstruktur und Bioreaktorsystem nachahmen kritisch 5. Daher müssen immer komplexer und technisch anspruchsvoller Geräte, um diese Aufgaben zu erfüllen, 6 entwickelt werden.Weiterhin ist es möglich, unsere Gerüst für die establ verwendenAuffüllung eines vaskularisierten Modell aufgrund der erhaltenen röhrenförmige Strukturen, die die zuführende Arterie, Vene, und das Verbindungs Kapillarbett enthalten. Alle Schweine-Zellen benötigen, um durch chemische, mechanische und enzymatische Dezellularisierung entfernt werden, und das Gerüst gamma-sterilisiert. Die wiederhergestellten Rohr vaskulären Strukturen können anschließend mit humanen mikrovaskulären Endothelzellen unter Verwendung eines Rückführ Perfusionsbioreaktorsystem 7, welche die biomechanischen und / oder biochemische Parameter, wie pH-Wert, Temperatur, Druck, Nährstoffversorgung und Entsorgung 6 nachahmt impft werden. Die Reendothelialisierung der rohrförmigen Strukturen schafft eine menschliche Blutgefäßäquivalent im kollagenen Gerüst 3,7. In dem folgenden Schritt, kann die Oberfläche der früheren Lumen (Mucosa) mit primären humanen Zellen besiedelt werden, um Co-Kulturen 3,7,8 herzustellen.
In dieser Studie wurde ein 3D-Tumortestsystem wird durch Co-Kultivieren einer Tumorzelllinie mit primären st eingestelltRomals Zellen unter statischen und dynamischen Bedingungen auf der SIS-Muc.
Protokoll
1. Dezellularisierung der BioVaSc
- Spülen Sie das Gefäßsystem des Schweine Jejunalsegment via Kanüle arteriellen Zugang und Darmlumen mit PBS -. Wiederholen, bis es ganz sauber ist.
- Bereiten Sie eine 200 mm Durchmesser Glasbehälter mit 4 Adaptern und verbinden sie über Silikonschläuche an den Schlauchpumpe (Ismatec). Die Drucksteuereinheit kann über einen Drucksensor, der in ein steriles Einweghaube (siehe Fig. 1) verbunden ist, überwacht werden.
- Füllen Vorratsflaschen mit Dezellularisierung (DZ) Lösung und überprüfen Sie die Schlauchsystem für mögliche Luftblasen.
- Schließen Sie die Darmlumen mit Kabelbindern an den Glas Anschlüsse für Lumenfluss. Pumpe 500 ml DZ Lösung in die roten arteriellen Zugang (1B) des Gefäßsystems. Unterbrechen Sie den Pumpvorgang alle 15 Minuten kurz manuell drücken Sie die gesamte Darmlumen.
- Während der decellularizati100 mm Hg, nach dem natürlichen Vorbild Blutdruck - auf Verfahren, sollte der Druck der Pufferlösung zwischen 80 sein.
- Waschen Sie die BioVaSc mit PBS - bis es frei ist von Zellreste ("ganz weiß").
- Füllen Sie den BioVaSc vollständig mit der DZ-Lösung und Inkubation in DZ Lösung tauchen über Nacht bei 4 ° C auf Schüttler.
- Wiederholen Sie Schritt 1.6.
- Legen Sie die BioVaSc in DNase-Lösung und Inkubation über Nacht bei 4 ° C auf Schüttler.
- DNase-Lösung entfernen und spülen mit Waschpuffer.
- γ-Sterilisation mit 25 kGy
2. Die verschiedenen Zelltypen
2.1 Isolation von primären humanen dermalen mikrovaskulären Endothelzellen (MVECs) und Fibroblasten
- Schneiden Hautbiopsie (vorzugsweise preputium) in Streifen von 2 - 3 mm Breite mit Skalpell und spülen Sie sie mit PBS 3x - Lösung.
- Decken Sie das Gewebe mit Dispase-Lösung, Inkubation es für 16-18 h bei 4 ° C.
- Separate Epidermis von der Dermis mit 2 Pinzetten und übertragen sowohl getrennt in Petrischalen mit PBS + gefüllt.
- Rinse Dermis Streifen 1x mit Versene.
- 10 ml Trypsin / EDTA-Lösung in die Dermis Streifen und bebrüten es im Brutschrank für 40 min.
- Stoppen Sie die Enzymreaktion sofort mit 1% FCS.
- Übertragen Hautstreifen in eine Petrischale mit VascuLife gefüllt und auskratzen jeden Streifen mit dem Skalpell 8x jeder Seite, mit ein wenig Druck.
- Übertragen des hergestellten Zellsuspension über eine Zellsieb in ein Zentrifugenröhrchen und spülen Zellsieb 3x mit VascuLife.
- Zentrifugieren bei 1.200 xg für 5 Minuten und Resuspendieren des Zellpellets mit VascuLife.
- Um die Fibroblasten zu isolieren, Streifen hacken Dermis in kleine Stücke mit dem Skalpell.
- 10 ml Kollagenase-Lösung zur Lederstücke.
- Inkubieren Sie es für 45 Minuten in den Inkubator, dann zentrifugiert und es vorsichtig supernatant.
- Waschen Pellet 1x mit DMEM + 10% FCS +% PenStrep, Zentrifuge und es vorsichtig Stand.
- Das Pellet in Kulturmedium und überträgt es auf einer T75 Kulturflasche, damit Zellen aus dem Gewebe zu wachsen.
2.2 Tumorzelllinie S462
Die Tumorzelllinie S462 (freundlicherweise von Dr. Nikola Holtkamp, Charité Universitätsmedizin Berlin zur Verfügung gestellt) wurde aus einer malignen peripheren Nervenscheidentumor eines weiblichen Patienten mit der erblichen Veranlagung Tumor-Syndrom Neurofibromatose Typ 1 9 erzeugt. S462 werden in DMEM mit 10% FCS kultiviert. Medium muss alle 2 geändert werden - 3 Werktagen. Einmal in der Woche müssen die Zellen aufgeteilt werden.
3. Tumor-Testsystem: Statische Kulturbedingungen im Vergleich mit Dynamic Kultur Im Bioreaktor-Systeme
- Schneiden Sie die Rohr SIS-Muc öffnen auf der einen Seite und befestigen Sie es zwischen zwei Metallringe (Zell Kronen, 10 mm Durchmesser, selbst constructed). Decken Sie die SIS-Muc in Zellkulturmedium über Nacht.
- Seed isolierte Zellen in definierten Zellzahlen (siehe unten) auf einer oder beiden Seiten des SIS (mono-oder Co-Kultur-Set-up).
- Samen 8.000 Zellen / cm 2 Primär MVECs in einem Gesamtvolumen von 100 &mgr; l auf der basolateralen Oberfläche der SIS (früher Serosa). 3 Stunden später die gut mit Medium füllen, um eine Kultur eingetaucht zu gewährleisten.
- Ermöglichen Endothelzellen für 3 Tage haften. Klappen Sie den statischen Kultursystem um 180 ° und übertragen sie auf eine 12-Well-Platte.
- Samen eine Mischung von primären Hautfibroblasten (8.000 Zellen / cm 2) und Tumorzellen (15.000 Zellen / cm 2) in einem Gesamtvolumen von 500 &mgr; l auf der apikalen Oberfläche des SIS (die Seite des ehemaligen Lumen).
- Lassen Zellen für 3 Stunden halten und füllen die gut mit Medium (Kultur eingetaucht, mittel: 50% Vasculife + 50% DMEM mit 10% FCS).
- Der Tumor-Testsystem wird unter statischen Bedingungen kultiviert eint 37 ° C, 5% CO 2 im Inkubator für weitere 14 Tage. Ändern Kulturmedium alle 2 - 3 Tage.
- Für die dynamische Kultur, fixieren Sie die SIS-Muc zwischen zwei Metallringe und Saatgut Primär MVECs wie in 3.2.1 beschrieben. Nach 3 Tagen entfernen Sie die SIS-Muc von den Metallringen und legen Sie die Membran in den Strömungsreaktor (siehe 2C und 2D). Anwenden der primären Hautfibroblasten und Tumorzellen mit einer Spritze und Kanüle auf die Matrix im Bioreaktor und damit die Zellen für 3 h halten vor dem Füllen des Bioreaktorsystems mit Kulturmedium.
- Am folgenden Tag dynamischen Kulturbedingungen mit konstanter Mediumstrom (3,8 ml / min, 37 ° C und 5% CO 2) eingeleitet werden. Die dynamische Kultur wird 14 Tage gehalten wird Kulturmedium nach 7 Tagen gewechselt.
- Der dynamische Test-Setup ist in einer selbstgebauten Inkubator, Medienfluss bietet durch eine Pumpe und die notwendige Temperatur und CO 2 kultiviert Inhalt.
4. Charakterisierungsmethoden für die Analyse
4.1 Fixierung und Paraffineinbettung der geimpften kollagene Matrix
- Für (Immun-) histologische Charakterisierungen entfernen Sie das Kulturmedium und fixieren das Gewebe mit 4% Paraformaldehyd für 2 Stunden.
- Entfernen Sie 4% Paraformaldehyd und übertragen Sie die SIS von der Metalleinsatz zu einer Einbettung von Gewebekassette. Gießen Sie das Gewebe verbleibenden Fixiermittel zu entfernen und zu entwässern für Paraffin-Infiltration.
- Vor dem Einbetten in einem Paraffinblock, schneiden Sie die SIS in 2 - 3 Scheiben und legen Sie sie in einem Paraffin-gefüllte Metallsockel Form, so dass die Schnittflächen nach unten zeigen. Fügen Sie die Gewebekassette auf der Form als Unterlage.
- Cut 5 um Scheiben und schweben sie auf einem 40 ° C warmen Wasserbad zum Richten, dann montieren Dias auf Glasobjektträger geeignet. Unbeschichtete Objektträger sind für H & E Flecken verwendet, Polylysin-beschichtete Objektträger für immunhistologische Färbung, um die Befestigung zu verbessern.Lassen Scheiben gründlich trocknen.
- Melt Paraffin, entfernen Sie sie mit Xylol und deinen Durst Scheiben für folgende Färbung.
4.2 Färbung
- Die rehydriert Scheiben mit Hämatoxylin / Eosin als standardisierte Übersichtsfärbung gefärbt werden.
- Für immunhistologische Färbung der fixierten und in Paraffin-Gewebeschnitten infiltriert muss eine Antigen-Retrieval, damit Antikörper zu erkennen und auf ihre spezifischen Epitope binden zu unterziehen. Daher entparaffiniert und rehydratisiert Träger werden in einem Dampfkochtopf mit beheizten Citratpuffer (pH 6,0) für 20 Minuten platziert.
- Objektträger Waschpuffer (0,5 M TBS-Puffer + 0,5% Tween) und Kreisscheiben mit einem PAP Stift um das erforderliche Volumen für Färbelösungen minimieren.
- Legen Sie die Folie in einer Feuchtekammer. Um einen bestimmten Meerrettich-Peroxidase vermittelten Visualisierung der Antigen-Antikörper-Bindung zu garantieren, muss die endogene Peroxidase mit 3% Wasserstoffperoxid gesättigt ist.
- Primäre antibOdy Verdünnungen werden auf die Scheiben aufgetragen, 1 h bei RT inkubiert und mit Waschpuffer sorgfältig abgewaschen.
- Zum Nachweis von spezifischen Antigen-Antikörper-Bindung der Ultra Vision Absicherung Detection System HRP DAB (Thermo Scientific) wird entsprechend der empfohlenen Protokoll verwendet.
- Die Zellkerne sind mit Hämatoxylin für 1 min gegengefärbt.
- Objektträger werden mit einem wässrigen Medium angeordnet, getrocknet und aufgenommen mit einer inversen Mikroskop.
Ergebnisse
Wie in Fig. 1B gezeigt ist, wir die dezellularisierte Schweine Jejunalsegment (ca. 2 m Länge und 20 mm Durchmesser) mit erhaltenen röhrenförmigen Strukturen des kapillaren Netzwerk. Nach der chemischen, enzymatischen und mechanischen Dezellularisierung, erhalten wir eine Kollagen I / III-Gerüst, die für 3D-Zellkultur verwendet werden können. Ein Feulgen-Test wurde durchgeführt, um die Reinheit (keine DNA-Resten) der Matrix (Daten nicht gezeigt) zeigen.
2A und 2B zeigen die statische Kultur der SIS-Muc von den Zell Kronen gesichert. Wir setzten die SIS-Muc in einer in-house entwickelt Bioreaktor (2C) für die dynamische Kultur. 2D stellt die simulierten dynamischen Strom durch die Kammer des Bioreaktors. Der Bioreaktor wird in einem selbstgebauten Inkubator System angeordnet und mit einer peristaltischen Pumpe verbunden ist. Dieser Aufbau ermöglicht eine dynamische Kultur entweder mit druckregulierten pulsierenden Fluss oder c onstant Fluss.
Figur 3 gibt einen Überblick über den statisch kultivierten S462 Tumorzelllinie in der 2D-Mono (3A) und in 3D Cokultur (3B-3D). 3B zeigt die dreifache Kultur von Tumorzellen und Fibroblasten S462 auf der apikalen Seite des SIS -Muc (ehemaliger Innenlumen Seite) und MVEC auf der basolateralen Seite (ehemaliger Serosaseite). Die Identifizierung der verschiedenen Zelltypen ist durch Färbung Zelltyp-spezifischen Markern, wie z. B. von Willebrand-Faktor zu MVEC (3C) Beschriftung möglich. Die p53-positiven Zellen S462 aus den p53-negativen primären Fibroblasten (Fig. 3D) und die 3D-Verteilung der Zellen können analysiert werden unterschieden werden. 4 zeigt Färbungen entspricht Fig. 3 der dynamisch kultivierten Triple Kultur.
0460/50460fig1.jpg "/>
Fig. 1 ist. Dezellularisierung Set-up. (A) Bioreaktor und Pumpen Set-up für die Dezellularisieren BioVaSc von einem PC überwacht. (B) Dezellularisierte BioVaSc in Glasbehälter. Das Lumen und die arterielle Einlass sind an den Adapter angeschlossen ist. .
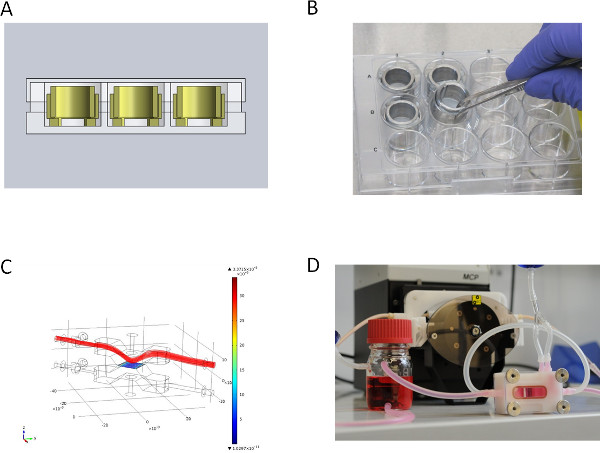
2. In Hinblick auf die verschiedenen Kultur-Set-ups. (A) CAD-Schnittansicht der statischen Kultursystem in Mikrotiter-Well-Platte, (B) Metalleinsätze für statische Kultur, (C) mittlere Strömungssimulation (Geschwindigkeitsfeld [m / s]) für die dynamische Kultur der obere Deckel des Strömungs Bioreaktor , (D) Durchfluss Bioreaktor für die dynamische Kultur in die Schlauchpumpe verbunden. Klicken Sie hier, um eine größere Abbildung anzuzeigen
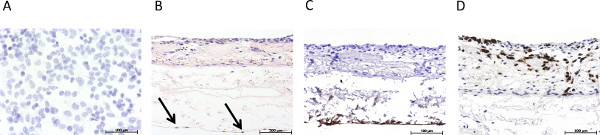
3. Übersicht über die immunhistologische Charakterisierung der statischen 3D-Tumormodell. (A) Hämatoxylin-Färbung der statisch kultivierten 2D-Monokultur S462 Zellen auf einem Permanox Rutsche, (B) H & E-Färbung der statisch kultivierten 3D-Dreifach-Kultur, markieren Pfeile Endothelzellen, (C) immunhistologische Färbung für von-Willebrand-Faktor, (D ) immunhistologischen Färbung für p53. Klicken Sie hier, um eine größere Abbildung anzuzeigen
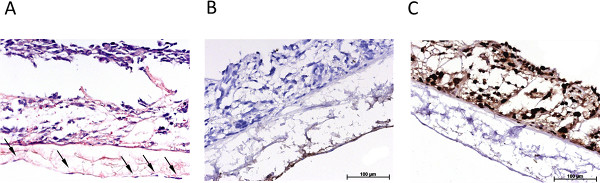
Abbildung 4. Übersicht über die immunhistologische Charakterisierung der dynamischen 3D-Tumormodell. (A) H & E-Färbung der dynamisch kultivierten 3D-Dreifach-Kultur, Pfeile markieren Endothelzellen, (B) immunhistologische Färbung für von-Willebrand-Faktor, (C) immunhistologischen Färbung für p53. Klicken Sie hier, um eine größere Abbildung anzuzeigen
Diskussion
Beim Vergleich von 2D-und 3D-Kultursysteme in der Tumorforschung, 3D-Systemen, obwohl die teurer Ansatz, haben sich die Bedingungen in den biologischen Mikroumgebungen besser zu imitieren. Es konnte gezeigt werden, dass einige Tumorzellen wachsen in einem 3D-Kultur sehr viel langsamer als in einem gemeinsamen 2D-Kultur 12, die in Übereinstimmung mit der Situation in einer realen Tumor ist. Bissell und Mitarbeiter zeigten in ihrer Arbeit, dass das Verhalten von krebserregenden Brustzellen spiegelt die Situation in vivo, einschließlich der Zellmorphologie und-Meldung, genauer, wenn ein 3D-Kultur in einer Matrix bietet Zell-ECM-Interaktionen. Außerdem wies sie die Bedeutung der extrazellulären Umgebung in 3D durch den Nachweis, dass Änderungen in den Umweltwechsel führte zur Reversion der malignen Zellen mit einem normalen Phänotyp. Außerdem und vor allem sind diese Ergebnisse auch in in vivo Tiermodellen 10,11 bestätigt werden.
NHALT "> Der direkte Vergleich der in vivo-Tierversuchen und in vitro Gewebemodellen zeigt Vor-und Nachteile beider Systeme. Ein Vorteil der in-vitro-Modellen ist die Erlaubnis von einem viel besseren Echtzeit-oder Fest Bildgebung durch Mikroskopie. Eine Einschränkung ist, dass sie imitieren statische oder Kurzzeit-Bedingungen, während in vivo-Systemen oft die Fortschritte. Der derzeitige Mangel an Gefäßsystem und normalen Transport von kleinen Molekülen, Host-Immunantworten und andere Zell-Zell-Interaktionen sind weitere Nachteile der In-vitro-Modelle 12. Daher 3D In-vitro-Systeme, wie in dieser Studie vorge bieten eine vielversprechende Ergänzung zu Tierversuchen. Sie bieten eine bessere Vergleichbarkeit für den menschlichen Organismus und somit die Minimierung der experimentellen Fehlinterpretationen. Biomimetic in vivo Modellsystemen wird damit an Relevanz zu untersuchen, wie Krebs und Metastasierung ist abhängig auf Mikroumgebungsbedingungen, die tumorig regulierenenesis 11.Unsere Studie zeigt, dass die 3D-Umgebung durch die SIS-Muc vorgesehen führt zu einer tumorartigen Gewebebildung von Zellen, die nicht in den gängigen 2D-Zellkultur zu beobachten ist (siehe Abbildung 3A). Darüber hinaus ist die Verwendung von primären Zellen aus Tumorbiopsien abgeleitet ein sehr wichtiger Schritt in Richtung personalisierte Medizin, einer Disziplin, die bei der Ermittlung der besten Behandlung je nach individuellen Bedürfnissen des Patienten zum Ziel hat. Die Einbeziehung primären Patienten-spezifischen Tumorzellen aus Biopsiematerial isoliert werden In-vitro-Prüfung von Therapiestrategien zu ermöglichen. Solche Testsysteme machen es möglich, verschiedene Medikamente und Kombinationen davon, in einer Zeit-und kostensparende Hochdurchsatz-Screening zu untersuchen. Darüber hinaus ist die Integration von Tumor-assoziierten Stromazellen wie in dieser Studie gezeigt, wichtig für den personalisierten Ansatz, da Einflüsse Mikroumgebung eines Tumors Tumorprogression 13 und könnte als geei beweisenle therapeutisches Ziel.
Alternativ zu einer personalisierten Ansatz können unsere Tumor-Modell geändert werden, um als eine verallgemeinerte Tumortestsystem durch den Einbau von etablierten Zelllinien tumorigen zu dienen. Dies ist eine vielversprechende Anpassung der Grundlagenforschung Zwecke. Sowohl für Drogentests nähert sich das Vorhandensein einer Gefäßstruktur ist erforderlich, um die Verteilung und Aufnahme von therapeutischen Substanzen testen. Das SIS-Muc-Matrix ermöglicht die basolateralen Impfen mit primären MVEC für barriereAufnahmeStudien wird die Nachsaat der erhaltenen Gefäßstrukturen des BioVaSc weiteren Verbesserung der Untersuchung von Drug Delivery.
Um Gewebemodelle zu erstellen, kann ein 3D-biologisch abbaubare Matrix als Rahmen für eine Co-Kultur von verschiedenen Zelltypen, 14 verwendet werden. Die Verwendung eines solchen 3D-Matrices wird oft durch das Fehlen eines funktionellen Gefäß beschränkt. Dieses Problem kann durch die Verwendung des BioVaSc, die erhaltenen Blutgefäß str bietet gelöst werdenuctures, die mit Endothelzellen reseeded werden kann. Weiterhin stellt die BioVaSc extrazellulären Komponenten, die die Adhäsion der Zellen zu gewährleisten und die Gewebedifferenzierung. Es ermöglicht auch die Langzeit-Gewebe-spezifische Funktion der 3D-Gewebe bioartifizielles 7,8,15. Voraussetzung für das Engineering von funktionellen Gefäßersatz ist die Nachahmung der menschlichen physiologischen und biomechanischen Bedingungen. Daher Bioreaktorsysteme, die diese Anforderungen in vitro umsetzen können, sind von großem Interesse für die Erstellung der biologischen Tumormodellen.
Die Kombination der BioVaSc ist die Bioreaktortechnologie und Co-Kultivierung verschiedener Zelltypen eine sehr vielversprechende Methode zur vaskularisierten Tumor-Gewebe, das für die Untersuchung der Tumorprogression wie Angiogenese und Metastasierung relevante Mechanismen erlauben erzeugen. Wir sehen, wie Tumormodellen als vielversprechender Ansatz zur Ergänzung von Tierstudien, die eine gleichwertigedas menschliche Tumorphysiologie.
Offenlegungen
Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Jan Hansmann (Fraunhofer IGB, Stuttgart) für seine technische Unterstützung danken zu Bioreaktoren und den Bioreaktor Inkubator entwickeln.
Materialien
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Collagenase solution | SERVA | 17454 | (500 U/ml) |
| Dispase solution | Gibco | 17105-041 | (2.0 U/ml) |
| DMEM, high-glucose | PAA | G0001,3010 | |
| DNase | ROCHE | 10104159001 | 200 mg solved in 500 ml PBS+ + 1% PenStrep |
| DZ solution | Roth | 3484.2 | 34 g Sodium Desoxychelate, in 1 L Ultra-pure water |
| FCS | LONZA | DE14-801F | |
| IHC-Kit DCS SuperVision 2 HRP | DCS | PD000KIT | |
| medical pressure transducer | MEMSCAP | SP844 | |
| monoclonal mouse anti-human Von Willebrand Factor | DAKO Cytomation | M0616 | Clone F8/86 0.12 μg/ml |
| mouse monoclonal anti-human p53 | DAKO Cytomation | IS616 | Clone DO-7 ready-to-use |
| peristaltic pump | Ismatec | ||
| sterile disposable dome | MEMSCAP | 844-28 | |
| Trypsin / EDTA solution | PAA | L11-003 | 0,05% |
| VascuLife (VEGF-Mv) | Lifeline | LL-0003 | |
| Versene | Gibco | 15040-033 |
Referenzen
- Schenke-Layland, K., Nerem, R. M. In vitro human tissue models--moving towards personalized regenerative medicine. Adv. Drug Deliv. Rev. 63, 195-196 (2011).
- Pusch, J., Votteler, M., et al. The physiological performance of a three-dimensional model that mimics the microenvironment of the small intestine. Biomaterials. 32, 7469-7478 (2011).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models: a new approach for the refinement of biomedical research. J. Biotechnol. 148, 56-63 (2010).
- Lanza, R., Langer, R., Vacanti, J. . Principles of tissue engineering. , (2007).
- Barron, V., Lyons, E., Stenson-Cox, C., McHugh, P. E., Pandit, A. Bioreactors for cardiovascular cell and tissue growth: a review. Ann. Biomed. Eng. 31, 1017-1030 (2003).
- Martin, I., Wendt, D., Heberer, M. The role of bioreactors in tissue engineering. Trends Biotechnol. 22, 80-86 (2004).
- Mertsching, H., Walles, T., Hofmann, M., Schanz, J., Knapp, W. H. Engineering of a vascularized scaffold for artificial tissue and organ generation. Biomaterials. 26, 6610-6617 (2005).
- Linke, K., Schanz, J., Hansmann, J., Walles, T., Brunner, H., Mertsching, H. Engineered liver-like tissue on a capillarized matrix for applied research. Tissue Eng. 13, 2699-2707 (2007).
- Holtkamp, N., Atallah, I., et al. MMP-13 and p53 in the progression of malignant peripheral nerve sheath tumors. Neoplasia. 9, 671-677 (2007).
- Weaver, V. M., Petersen, O. W., et al. Reversion of the malignant phenotype of human breast cells in three-dimensional culture and in vivo by integrin blocking antibodies. J. Cell Biol. 137, 231-245 (1997).
- Hutmacher, D. W., Horch, R. E., et al. Translating tissue engineering technology platforms into cancer research. J. Cell. Mol. Med. 13, 1417-1427 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130, 601-610 (2007).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Yang, S. -. T., Zhang, X., Wen, Y. Microbioreactors for high-throughput cytotoxicity assays. Curr. Opin. Drug Discov. Devel. 11, 111-127 (2008).
- Schultheiss, D., Gabouev, A. I., et al. Biological vascularized matrix for bladder tissue engineering: matrix preparation, reseeding technique and short-term implantation in a porcine model. J. Urol. 173, 276-280 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten