Method Article
Тканевая инженерия человеческого 3D
В этой статье
Резюме
Методы для создания 3D-ткани опухоли человека в качестве тест-систем, описаны. Эти технологии основаны на decellularized биологическом васкуляризированных строительные леса (BioVaSc), первичных человеческих клеток и клеточной линии опухоли, которые можно культивировать в статических, так и динамических условиях в биореакторе потока.
Аннотация
Рак является одной из ведущих причин смерти во всем мире. Текущие терапевтические стратегии преимущественно разработан в системах культуры 2D, которые неадекватно отражают физиологические условия в естественных условиях. Биологические 3D матрицы обеспечивают клеткам среду, в которой клетки могут самоорганизовываться, позволяя изучение организации тканей и дифференцировки клеток. Такие каркасы могут быть затравку в виде смеси различных типов клеток для изучения Direct 3D клетка-клетка-взаимодействия. Чтобы имитировать 3D сложность раковых опухолей, наша группа разработала 3D в пробирке системы тестирования опухоли.
Наши 3D модели тест ткани системные ситуация в естественных условиях злокачественных периферических нервных оболочки опухолей (MPNSTs), которые мы установили с нашим decellularized свиного тощей кишки сегмента происходит биологическая васкуляризированной лесов (BioVaSc). В нашей модели мы пересевали модифицированную BioVaSc матрицу с первичными фибробласты, эндотелиальные клетки микрососудов (mvECs) и S462 линия клеток опухоли. Для статического культуры, сосудистая структура BioVaSc удаляют и оставшиеся леса разрезают открыта с одной стороны (Подслизистая основа тонкой кишки SIS-MUC). Полученную матрицу затем фиксируют между двумя металлическими кольцами (клеточные крон).
Другой вариант заключается в культуре клеток посеяны SIS-Мук в системе биореактора потока, который предоставляет клетки напряжению сдвига. Здесь, биореактор подключен к перистальтического насоса в самостоятельно построенного инкубаторе. Компьютер регулирует артериальное кислорода и питательных веществ через такие параметры, как кровяное давление, температура и расход. Эта установка позволяет динамически культуры либо с регулируемым давлением пульсирующей или постоянным потоком.
В этом исследовании, мы могли успешно установить как статический и динамический 3D систему культуры для MPNSTs. Возможность моделирования раковых опухолей в более естественном среде 3D позволит открытие, тестирование и валидациюбудущие фармацевтические препараты в подобных человеческим модели.
Введение
Новые лекарственные препараты должны быть проверены в отношении их качества, безопасности и эффективности до допуска на рынок. На сегодняшний день, эксперименты на животных являются стандартным методом тестирования и проверки наркотиков. Однако из-за различий видоспецифичных, эксперименты на животных часто не всесторонне оценить эффект соединений в организме человека 1. По этой причине очень важно, чтобы генерировать модели ткани человека, которые могут быть использованы для испытаний в пробирке новых лекарственных средств и веществ.
Одним из направлений нашей группы является создание в пробирке тест-моделях с нашей биологической васкуляризированной эшафот (BioVaSc) 2,3. BioVaSc может быть использован в качестве статического или динамического 3D матричной системы. Для статического культуры, decellularized свиной тощей кишки сегмент (Подслизистая основа тонкой кишки SIS-Muc) помещается в металлической вставкой для сотового повторного заполнения. Различные клетки, такие как рак и эндотелиальных клеток можно культивировать на строительных лесов.
Для динамического культуры, BioVaSc присоединен к системе биореактора, который применяется поток по всей сосудистой сети или через поверхности строительных лесов. Текущие биореакторы реализовать биологические, механические или электрические раздражители, которые действуют на дифференциации или пролиферации клеток 4. Для биореакторов в области тканевой инженерии, основная концепция заключается в имитации условий в организме человека. Отличающийся тем, что клетки при условии естественную среду, в которой они могут взаимодействовать друг с другом и окружающими их внеклеточного матрикса. Для производства в пробирке тест-систем или трансплантации, способность имитировать естественную среду клеток с соответствующей структуры носителя и системы биореактора имеет решающее значение 5. Таким образом, более сложные и технически требовательные устройства должны быть разработаны в целях выполнения этих задач 6.Кроме того, можно использовать наш эшафот для Establishment из васкуляризированной модели из-за сохранившихся трубчатых структур, которые включают в питающей артерии вены, и соединительный капиллярное русло. Все свиньи клетки должны быть удалены с помощью химического, механического и ферментативного decellularization, и эшафот гамма-стерилизации. Восстановленные трубчатые сосудистых структур могут быть впоследствии пересевают с человеческими микрососудистых эндотелиальных клеток с использованием рециркуляции проточном биореакторе 7, который имитирует биомеханические и / или биохимические параметры, такие как рН, температура, давление, питательных веществ и удаления отходов 6. Повторное эндотелизации из трубчатых структур создает человеческий эквивалент кровеносных сосудов внутри коллагеновой лесов 3,7. На следующем этапе, поверхность бывших просвета (слизистой) могут быть затравку первичных человеческих клеток, чтобы установить совместно культур 3,7,8.
В этом исследовании 3D система тест опухоль создана сокультивирования линию опухолевых клеток с первичной улРомал клетки в статических и динамических условиях на SIS-Мюнхен.
протокол
1. Decellularization из BioVaSc
- Промойте сосудистую систему свиньи тощей кишки сегмента через канюлированного артериальной доступа и просвет кишечника с PBS -. Повторяйте до тех пор, пока она полностью чистым.
- Подготовьте 200 мм Диаметр стекла бак с 4 адаптерами и соединить их с помощью кремниевых труб для перистальтического насоса (Ismatec). Давление блок управления может контролироваться с помощью датчика давления, который соединен с стерильных одноразовых куполом (см. рисунок 1).
- Заполните бутыли с decellularization (DZ) решения и проверить систему труб для возможных воздушных пузырьков.
- Подключите просвет кишечника с помощью кабельных стяжек в стеклянных разъемами для просвета потока. Насос 500 мл раствора DZ в красную артериальной доступа (рис. 1В) сосудистой системы. Прерывание процесса перекачивания каждые 15 мин в ближайшее время вручную выдавить весь просвет кишечника.
- Во время decellularizatiна процесс, давление буферного раствора должна быть в пределах 80 - 100 мм ртутного столба, по образцу естественного артериального давления.
- Вымойте BioVaSc с PBS - пока он не свободен от клеточных остатков ("полностью белые").
- Заполните BioVaSc полностью раствором DZ и инкубировать это погрузиться в растворе DZ течение ночи при 4 ° С на качалке.
- Повторите шаг 1.6.
- Поместите BioVaSc в ДНКазы раствора и инкубируют в течение ночи при 4 ° С на ротационном шейкере.
- Удалить ДНКазную решение и промыть моющим буфером.
- γ-стерилизация с 25 кГр
2. Различные типы Сотовые
2,1 Выделение первичных человеческих кожный микрососудистой эндотелиальных клеток (mvECs) и фибробластов
- Вырезать биопсию кожи (желательно preputium) на полосы 2 - 3 мм в ширину с скальпелем и промыть их 3x с PBS - решения.
- Накройте ткань раствором диспаза и инкубировать его для 16 - 18 часов при 4 ° С.
- Отдельные эпидермис от дермы с 2 пинцета и передать как отдельно в чашки Петри, наполненных PBS +.
- Промыть дермы полоски 1x с версеном.
- Добавьте 10 мл трипсина / EDTA решение полос дермы и инкубировать ее в инкубаторе в течение 40 мин.
- Остановить ферментативную реакцию сразу с 1% FCS.
- Трансфер полоски кожи, чтобы чашку Петри, наполненную VascuLife и выцарапать каждую полоску с скальпелем 8x каждой стороны, добавив небольшое давление.
- Передача полученного клеточной суспензии через ячейки сетчатого фильтра в центрифужную пробирку и промыть клеточный фильтр 3 раза с VascuLife.
- Центрифуга трубки при 1200 х г в течение 5 мин и ресуспендируют осадок клеток с VascuLife.
- Для выделения фибробласты, нарезать дермы полоски на мелкие кусочки с помощью скальпеля.
- Добавьте 10 мл раствора коллагеназы в дермы куски.
- Выдержите его в течение 45 мин в инкубаторе, затем центрифуги его и осторожно удалите суpernatant.
- Вымойте гранул 1x с DMEM + 10% FCS +% PenStrep, центрифуги его и осторожно удалите супернатант.
- Ресуспендируют гранул в культуральной среде и перенести его на T75 колбу культуры, чтобы позволить клеткам расти из ткани.
2.2 линии опухолевых клеток S462
Опухолевых клеток линии S462 (любезно предоставлены доктором Никола Хольткамп, Шарите университета медицины Берлина) был создан один из злокачественной периферических нервов оболочки опухоли пациентки с наследственной типа синдром предрасположенность опухоли нейрофиброматозом 1 9. S462 культивируют в среде DMEM с добавлением 10% FCS. Средний должен быть изменен каждые 2 - 3 дня. Раз в неделю клетки должны быть разделены.
3. Опухоль Тестовая система: Статические условия культивирования сравнению с динамическим культуры в биореакторе систем
- Вырезать трубчатый SIS-Muc открыть с одной стороны и закрепить их между двумя металлическими кольцами (сотовые коронок, диаметром 10 мм, само сonstructed). Накройте SIS-Мюнхен в среде культуры клеток в течение ночи.
- Семенной изолированы клетки в определенных количества клеток (см. ниже) на одной или обеих сторонах SIS (моно-или совместное культивирование набор).
- Seed 8000 клеток / см 2 первичных mvECs в общем объеме 100 мкл на базолатеральной поверхности SIS (бывший серозной). 3 часа спустя заполнить колодец со средой, чтобы обеспечить подводная культуру.
- Разрешить эндотелиальные клетки придерживаться течение 3 дней. Переверните статическая система культуры на 180 ° и перенести его на 12-луночный планшет.
- Seed смесь первичных фибробластов дермы (8000 клеток / см 2) и опухолевых клеток (15000 клеток / см 2) в пределах общего объема 500 мкл на апикальной поверхности SIS (сторона бывших просвета).
- Разрешить клетки придерживаться в течение 3 часов и заполнить хорошо со средней (погружается культуры, среды: 50% Vasculife + 50% DMEM с добавлением 10% FCS).
- Система тестирования опухоли культивируют в статических условиях ат 37 ° С, 5% СО 2 в инкубаторе для дополнительных 14 дней. Изменение культуральной среды каждые 2 - 3 дня.
- Для динамической культуры, исправить SIS-MUC между двумя металлическими кольцами и семян первичные mvECs, как описано в разделе 3.2.1. После 3 дней удалить SIS-MUC из металлических колец и вставить мембрану в проточный реактор (см. рис 2С и 2D). Применение основной дермальные фибробласты и клетки опухоли с помощью шприца и канюли на матрице в биореакторе, и позволяют клеткам прилипать в течение 3 ч перед заполнением систему биореактора с культуральной среде.
- На следующий день динамических условиях культивирования с постоянным потоком среды (3,8 мл / мин, 37 ° С и 5% СО 2) может быть инициирован. Динамический Культуру выдерживают в течение 14 дней, культуральная среда изменяется после 7 дней.
- Динамическая испытательная установка культивируют в самостоятельно построенного инкубатора, который обеспечивает поток средств массовой информации через насос и нужной температуры и CO 2 Содержание.
4. Методы Характеристика для анализа
4.1 Крепление и парафина-вложение сеяной коллагеновой матрицы
- Для (иммуно-гистологических характеристик) удаления культуральной среды и зафиксировать ткани 4% параформальдегидом в течение 2 часов.
- Удалить 4% параформальдегида и передать SIS от металлической вставкой в ткани встраивания кассеты. Полейте ткани, чтобы удалить остатки фиксатором и обезвоживают для парафина инфильтрации.
- Перед вложением в парафиновый блок, вырезать SIS в 2 - 3 дольки и поместить их в парафиновой заполненные металлическим основным форму таким образом, чтобы сократить поверхности лицом вниз. Добавить кассету ткани на верхней части формы в качестве подложки.
- Отрежьте 5 мкм ломтиками и плавать их на бане водяной 40 ° C для выпрямления, а затем смонтировать слайды на подходящих стеклах. Без покрытия горки используются для H & E пятен, Полилизиновые покрытием горки для иммуногистологического окрашивания улучшить вложение.Пусть ломтики полностью высохнуть.
- Растопите парафин, удалить его с помощью ксилола и увлажняет ломтики для следующих окрашивание.
4.2 Окрашивание
- Разведенной водой ломтики могут быть окрашивали гематоксилин / эозином как стандартизированный окрашивания обзора.
- Для иммуногистохимическому окрашивания, фиксированной и парафиновые-проникли Срезы ткани должны пройти извлечение антигена, чтобы антитела к распознавать и связывать их конкретных эпитопов. Таким образом, парафина и регидратированных горки помещают в пароварке с подогревом цитратном буфере (рН 6,0) в течение 20 мин.
- Передача слайды в промывочного буфера (0,5 М TBS буфера + 0,5% Твин) и кусочками круг с PAP пера, чтобы минимизировать необходимый объем для окрашивания решений.
- Поместите слайд в камере влажности. Чтобы обеспечить определенную пероксидаза хрена-опосредованной визуализации антиген-антитело-связывающий, эндогенный пероксидаза должен быть насыщен 3% перекиси водорода.
- Первичная АнтибODY разведения применяются к ломтиками, инкубировали в течение 1 часа при комнатной температуре и тщательно смывается с промывочным буфером.
- Для обнаружения специфических антиген-антитело привязок Ультра видения Quanto Система обнаружения HRP DAB (Thermo Scientific) используют в соответствии с рекомендуемым протоколом.
- Ядра гематоксилином в течение 1 мин.
- Слайды установлены с водной средой, сушат и отображаемого использованием обратной микроскопа.
Результаты
Как показано на рисунке 1b, мы decellularized на свинину тощей кишки сегмент (около 2 м в длину и 20 мм в диаметре) с сохранившимися трубчатых структур капиллярной сети. После химической, ферментативной и механической decellularization, мы получили каркас коллаген I / III, который может быть использован для 3D культуры клеток. Тест Фельгену было проведено с целью продемонстрировать чистоту (никаких следов ДНК) матрицы (данные не показаны).
2А и 2В показывают статическую культуру SIS-Мюнхен залог клеточных крон. Мы исправили SIS-Мюнхен в собственной разработки биореактора (рис. 2С) для динамического культуры. Рисунок 2D иллюстрирует имитацию динамический поток через камеру биореактора. Биореактор помещают в самостоятельно построенного системы инкубатора и подключены с использованием перистальтического насоса. Эта установка позволяет динамичной культуры либо давления регулируется поток пульсирующей или с onstant поток.
Рисунок 3 дает обзор статически культурного S462 линии опухолевых клеток в 2D монокультуры (рис. 3А) и в 3D сокультивирования (рис. 3В-3D). 3В показывает тройную культуру опухолевых клеток S462 и первичных фибробластов на апикальной стороне SIS -Muc (бывший внутренняя сторона люмен) и mvEC на базолатеральной стороне (бывший стороны серозной). Идентификация различных типов клеток можно путем окрашивания специфические маркеры типа клеток, например, фактора фон Виллебранда, чтобы маркировать mvEC (фиг.3С). Р53-позитивных клеток S462 можно отличить от р53-негативных первичных фибробластов (фиг. 3D), и распределение 3D клеток могут быть проанализированы. Фиг.4 показывает окрашивание эквивалент на фиг.3 в динамически культивируемых тройной культуры.
0460/50460fig1.jpg "/>
Рисунок 1. Decellularization настройки. (А) биореакторов и насос установка для decellularizing на BioVaSc, контролируемых ПК. (В) Decellularized BioVaSc в стеклянный резервуар. Просвет и артериальной впускной соединены с адаптерами. .
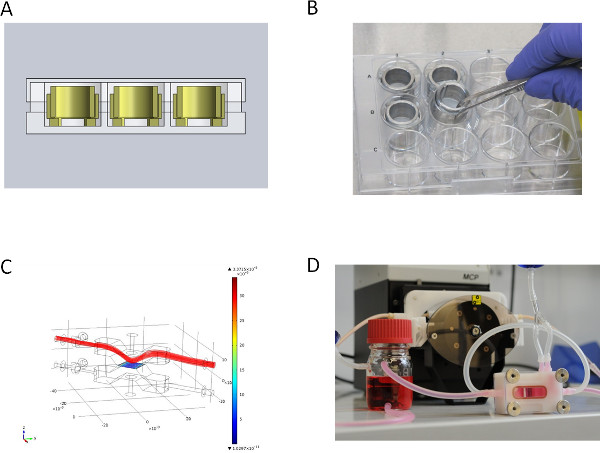
Рисунок 2. За зрения различных культур наборов. (A) CAD разрез статического системе культуры в микротитровальных луночный планшет, (B) металлические вставки для статического культуры, (C) моделирование потока среды (поле скорость [м / с]) для динамического культуры верхней крышке биореактора потока , (D) поток биореактор для динамичной культуры, подключенного к перистальтического насоса. Нажмите здесь, чтобы увеличить рисунок
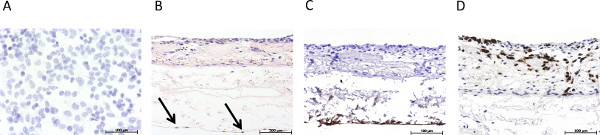
Рисунок 3. Обзор иммуногистологического характеристике статического 3D-модели опухоли. (A) гематоксилин пятно статически культивированных 2D моно культуры S462 клеток на предметном стекле Permanox, (B) H & E пятно статически культивированных 3D тройной культуры, Стрелками эндотелиальные клетки, (C) иммуногистологического окрашивание на фактор фон Виллебранда, (D ) иммуногистологического окрашивание p53. Нажмите здесь, чтобы увеличить рисунок
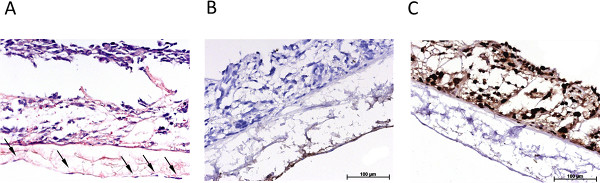
Рисунок 4. Обзор иммуногистологического характеристики динамического 3D-модели опухоли. (А) Н & E пятно динамично культурной 3D тройной культуры, Стрелками эндотелиальные клетки, (B) иммуногистологического окрашивание на фактор Виллебранда, (С) иммуногистологического окрашивание p53. Нажмите здесь, чтобы увеличить рисунок
Обсуждение
При сравнении 2D и 3D систем культуры в исследованиях опухоли, 3D-систем, несмотря на то, дороже подход, доказали, чтобы имитировать условия в биологических микросреды лучше. Было показано, что некоторые опухолевые клетки растут в 3D культуры гораздо медленнее, чем в обычном 2D культуре 12, который в соответствии с ситуацией в реальной опухоли. Бисселл и его коллеги показали, в своей работе, что поведение канцерогенных клеток молочной железы отражает ситуацию в естественных условиях, в том числе морфологии и клеточной сигнализации, точнее, когда 3D культура в матрице предлагает клеток ECM взаимодействия. Кроме того, они подчеркнули важность внеклеточной среде в 3D, продемонстрировав, что изменения в окружающей среде взаимодействий привело к возвращению злокачественных клеток к нормальному фенотипу. Кроме того, и самое главное, эти результаты могут быть также подтверждены в в естественных условиях животных моделях 10,11.
ontent "> прямое сравнение в естественных условиях экспериментов на животных и в пробирке моделей тканей показывает преимущества и недостатки в обеих системах. Одно из преимуществ модели в пробирке является разрешение гораздо лучше реальном времени или постоянной визуализации с помощью микроскопа. ограничением является то, они имитируют статический или краткосрочные условия, тогда как естественных условиях системы в часто прогрессировать. Нынешнее отсутствие сосудистой и нормальной перевозки малых молекул, иммунной реакции и другие межклеточные взаимодействия дальнейшие недостатки моделей в пробирке 12. Таким образом, 3D в системах пробирке, представленные в данном исследовании предлагают многообещающий дополнение к экспериментам на животных. Они обеспечивают лучшую сопоставимость для человеческого организма и, следовательно, минимизировать экспериментальные кривотолков. Biomimetic в системах естественных условиях модели будет, следовательно, стать более актуальными для изучения того, как рак и распространение метастазов зависит на микроокружения условиях, которые регулируют tumorigenesis 11.Наше исследование показывает, что 3D окружающей среды обеспечивается SIS-MUC приводит к более опухоли, как формирование тканей клеток, чего не наблюдается в общей 2D культуре клеток (см. рисунок 3А). Кроме того, использование первичных клеток, полученных из опухолевых биопсии является очень важным шагом на пути к персонализированной медицины, дисциплина, которая направлена на выявление лучшее лечение в зависимости от индивидуальных потребностей пациента. Включение первичные пациент-специфических опухолевых клеток, выделенных из материала биопсии позволит в пробирке тестирования терапевтических стратегий. Такие тест-системы позволит исследовать различные препараты и их комбинации в то время-и экономии высокопроизводительного скрининга. Кроме того, интеграция опухолеассоциированных стромальных клеток, как показано в этом исследовании является важным для индивидуального подхода, так как прогрессирование опухоли влияет микроокружение опухоли в 13 и может оказаться как suitabле терапевтической мишенью.
В качестве альтернативы для персонализированного подхода, наша модель опухоли могут быть изменены, чтобы служить в качестве обобщенной системы тестового опухоли путем введения установленных онкогенных линий клеток. Это перспективная приспособление для основных исследовательских целей. Для обоих подходов тестирования на наркотики наличие сосудистой структуры требуется, чтобы проверить распределение и поглощение терапевтических веществ. SIS-Muc матрица позволяет базолатеральную посев с первичным mvEC для поглощения барьер исследований, пересев из сохранившихся сосудистых структур BioVaSc будет способствовать дальнейшему улучшению изучение доставки лекарств.
Для того чтобы создать модели ткани, 3D биоразлагаемый матрица может быть использована в качестве основы для совместного культивирования клеток различных типов 14. Использование таких 3D матриц часто ограничивается отсутствием функционального васкуляризации. Эта проблема может быть решена путем использования BioVaSc, который предлагает сохраненный кровеносных сосудов улuctures, которые могут быть пересевают с эндотелиальными клетками. Кроме того, BioVaSc обеспечивает внеклеточных компонентов, которые обеспечивают адгезию клеток и облегчения тканевой дифференцировки. Она также позволяет долгое время тканеспецифическую функцию биоискусственных 3D тканей 7,8,15. Предпосылкой для инженерных функциональных сосудистых заменителей является Имитация человеческого физиологических и биомеханических условиях. Таким образом, системы биореакторов, которые могут реализовать эти требования в пробирке, имеют исключительный интерес для создания биологических моделей опухолей.
Сочетание BioVaSc, технология биореактор и со-культивирования различных типов клеток является очень перспективным методом для создания васкуляризированной ткани опухоли, что позволит изучение механизмов, имеющих значение для прогрессирования рака, таких как ангиогенез и метастазирование. Мы видим такие модели опухолевых качестве перспективного подхода к дополняя исследования на животных, предоставляя эквивалентк физиологии человека опухоли.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить янв Hansmann (Fraunhofer IGB, Штутгарт) за техническую поддержку в разработке биореакторы и биореактора инкубатор.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue number | Comments (optional) |
| Collagenase solution | SERVA | 17454 | (500 U/ml) |
| Dispase solution | Gibco | 17105-041 | (2.0 U/ml) |
| DMEM, high-glucose | PAA | G0001,3010 | |
| DNase | ROCHE | 10104159001 | 200 mg solved in 500 ml PBS+ + 1% PenStrep |
| DZ solution | Roth | 3484.2 | 34 g Sodium Desoxychelate, in 1 L Ultra-pure water |
| FCS | LONZA | DE14-801F | |
| IHC-Kit DCS SuperVision 2 HRP | DCS | PD000KIT | |
| medical pressure transducer | MEMSCAP | SP844 | |
| monoclonal mouse anti-human Von Willebrand Factor | DAKO Cytomation | M0616 | Clone F8/86 0.12 μg/ml |
| mouse monoclonal anti-human p53 | DAKO Cytomation | IS616 | Clone DO-7 ready-to-use |
| peristaltic pump | Ismatec | ||
| sterile disposable dome | MEMSCAP | 844-28 | |
| Trypsin / EDTA solution | PAA | L11-003 | 0,05% |
| VascuLife (VEGF-Mv) | Lifeline | LL-0003 | |
| Versene | Gibco | 15040-033 |
Ссылки
- Schenke-Layland, K., Nerem, R. M. In vitro human tissue models--moving towards personalized regenerative medicine. Adv. Drug Deliv. Rev. 63, 195-196 (2011).
- Pusch, J., Votteler, M., et al. The physiological performance of a three-dimensional model that mimics the microenvironment of the small intestine. Biomaterials. 32, 7469-7478 (2011).
- Schanz, J., Pusch, J., Hansmann, J., Walles, H. Vascularised human tissue models: a new approach for the refinement of biomedical research. J. Biotechnol. 148, 56-63 (2010).
- Lanza, R., Langer, R., Vacanti, J. . Principles of tissue engineering. , (2007).
- Barron, V., Lyons, E., Stenson-Cox, C., McHugh, P. E., Pandit, A. Bioreactors for cardiovascular cell and tissue growth: a review. Ann. Biomed. Eng. 31, 1017-1030 (2003).
- Martin, I., Wendt, D., Heberer, M. The role of bioreactors in tissue engineering. Trends Biotechnol. 22, 80-86 (2004).
- Mertsching, H., Walles, T., Hofmann, M., Schanz, J., Knapp, W. H. Engineering of a vascularized scaffold for artificial tissue and organ generation. Biomaterials. 26, 6610-6617 (2005).
- Linke, K., Schanz, J., Hansmann, J., Walles, T., Brunner, H., Mertsching, H. Engineered liver-like tissue on a capillarized matrix for applied research. Tissue Eng. 13, 2699-2707 (2007).
- Holtkamp, N., Atallah, I., et al. MMP-13 and p53 in the progression of malignant peripheral nerve sheath tumors. Neoplasia. 9, 671-677 (2007).
- Weaver, V. M., Petersen, O. W., et al. Reversion of the malignant phenotype of human breast cells in three-dimensional culture and in vivo by integrin blocking antibodies. J. Cell Biol. 137, 231-245 (1997).
- Hutmacher, D. W., Horch, R. E., et al. Translating tissue engineering technology platforms into cancer research. J. Cell. Mol. Med. 13, 1417-1427 (2009).
- Yamada, K. M., Cukierman, E. Modeling tissue morphogenesis and cancer in 3D. Cell. 130, 601-610 (2007).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Yang, S. -. T., Zhang, X., Wen, Y. Microbioreactors for high-throughput cytotoxicity assays. Curr. Opin. Drug Discov. Devel. 11, 111-127 (2008).
- Schultheiss, D., Gabouev, A. I., et al. Biological vascularized matrix for bladder tissue engineering: matrix preparation, reseeding technique and short-term implantation in a porcine model. J. Urol. 173, 276-280 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены