Method Article
Dissection und seitlicher Anbau von Zebrafisch-Embryonen: Analyse der Rückenmarksentwicklung
In diesem Artikel
Zusammenfassung
Entwicklungsprozesse wie Proliferation, Strukturieren, Differenzierung und Axon Führung leicht im Zebrafisch Rückenmark modelliert werden. In diesem Artikel beschreiben wir ein Verfahren zur Montage Zebrafisch-Embryonen, die Visualisierung dieser Ereignisse optimiert.
Zusammenfassung
Der Zebrafisch Rückenmark ist eine effektive Untersuchungsmodell für Systemforschung Nerven aus mehreren Gründen. Erstens kann genetische, transgene und Gen-Knockdown Ansätze genutzt werden, um die molekularen Mechanismen, die der Entwicklung des Nervensystems zu untersuchen. Zweitens großen Fängen der entwicklungs synchronisiert Embryonen bieten großen Versuchsprobengrößen. Drittens, die optische Klarheit des Zebrafischembryos erlaubt Forschern Vorläufer, glialen und neuronalen Populationen zu visualisieren. Obwohl Zebrafischembryonen transparent sind, können Probendicke wirksam mikroskopische Visualisierung behindern. Ein Grund dafür ist die Entwicklung von Tandem-Rückenmark und darüberliegenden Gewebe Somiten. Ein weiterer Grund ist die große Dotterkugel, die noch in Zeiten der frühen Neurogenese vorliegt. In diesem Artikel zeigen wir, Mikrodissektion und die Entfernung der Dotter in festen Embryonen, die mikroskopische Visualisierung ermöglicht es, während das umliegende Gewebe Somiten. Wir ALSo zeigen, semipermanente Befestigung von Zebrafischembryonen. Dies ermöglicht eine Beobachtung der Entwicklung des Nervensystems in den dorso-ventralen und anterior-posterioren Achsen, da sie die Dreidimensionalität des Gewebes bewahrt.
Einleitung
Visualisierung des Rückenmarks im Zebrafisch ist durch eine Anzahl von Faktoren gehemmt. Aufgrund der Dicke der darüberliegenden Somiten und der inneren Lage des Rückenmarks ist eine beträchtlich lange Arbeitsabstand für Hochzellauflösung erforderlich. Der Dotterkugel (die noch während der frühen Stadien der Neurogenese vorhanden ist) erhöht weiter die erforderlichen Arbeitsabstand und ist leicht durch Druck von einem Deckglas beschädigt. Außerdem Trümmer von beschädigten Eigelb verbietet klare Visualisierung von Geweben. Obwohl Querschnitte in den dorso-ventralen (DV) Achse möglich sind, sie nicht leicht eine gleichzeitige Visualisierung in der anterior-posterior (AP) Achse 1.
Um diese Hindernisse zu überwinden, werden Embryonen präpariert und auf Objektträger aufgebracht. Dieses Verfahren bietet mehrere Vorteile. Erstens liegen Zebrafischembryonen leicht mit der lateralen Seite nach oben, die AP-Achse Visualisierung erleichtert. Zweitens die Entfernung des Eigelbs ball verringert die erforderlichen Arbeitsabstand und begrenzt Schutt. Drittens erlaubt sowohl für Fluoreszenz-und Hellfeldmikroskopie das Montageverfahren zu. Viertens sind montiert Embryonen Monate stabil bei 4 ° C, wodurch längere Probe Visualisierung. Schließlich, daß vorderen Segmente auftritt Fortschreiten der Entwicklung sind reifer als Zahnbereich. Um sicherzustellen, dass inszeniert abgestimmt Rücken hemisegments zwischen Embryonen verglichen wird, wird überlagert Somitengewebe als Richtlinie. Zum Beispiel liegt über der zehnte hintersten Somiten den zehnten Rücken hemisegment, die entwicklungs Äquivalent in der Stufe abgestimmt Embryonen ist. Dieses Montageverfahren von intakten Embryonen ermöglicht die einfache Identifizierung von Somiten.
Wir verwenden Genetik und Gen-Knock-down-Technologien, um die Mechanismen der Axon-Führung in der Entwicklung des Rückenmarks zu studieren. Insbesondere haben wir festgestellt, dass robo2, robo3 und DCC für Commissural Primär Asce erforderlichNding (COPA) Axon-Wegfindung. Mit der hier beschriebenen Montageverfahren, waren wir in der Lage, ventralen Wachstum, Mittellinienüberfahrt, commissure Breite, Rücken-und Vorder Wachstum 2,3 zu untersuchen. Dieses Montageverfahren kann auch auf DV-oder AP-Musterbildung des Rückenmarks eingesetzt werden. Wir haben dieses Verfahren verwendet, um unterschiedlichen Rollen von Wnt nachgeschalteten Effektoren in DV Strukturierung des Rückenmarks zu bestimmen. Mit dieser Montage, waren wir in der Lage, DV-Auflösung von Markern auf Einzelzellebene zu erhalten, und zu bestimmen, Minute Musterverschiebungen als Folge der veränderten Wnt-Signalempfang 4,5. Dieses Montageverfahren ermöglicht auch mitotische Indexberechnung durch anti-phosphohistone 3 oder BrdU-Markierung (Vorläufer Proliferation) 5 Differenzierung.
Protokoll
1. Montage Embryonen (nach Abschluss der gewählte Visualisierungstechnik, wie Immunzytochemie, in situ Hybridisierung, etc.)
- Platzieren Embryonen in einer 35 mm Petrischale mit Puffer der Wahl (1A) gefüllt. Die Wahl der Puffer in der Kennzeichnung Verfahren. Typischerweise PBS-basierten Puffer sind geeignet.
- Unter einem Binokular und mit einer Pinzette, sichern Sie den Kopf mit einer Zange und ziehen Sie das Eigelb weg mit dem anderen Paar (Abbildung 1B). Alternativ können Sie auch ein Insektenstift in einer Insektenstifthalter vorsichtig wegziehen das Eigelb.
- Mit dem Embryo Poker (Angelschnur (0,41 mm Durchmesser) geklebt, um entweder eine Kapillare oder eine Pasteur-Pipette) bewegen die Embryonen auf einen Teil der Petrischale, die nicht über eine Menge von Schutt Eigelb (1C-D).
- Mit einem Glas Pasteur Pipette absaugen die Embryonen in so wenig Flüssigkeit wie möglich und gständig pipettieren sie auf einen Objektträger (1E).
- Sanft Docht entfernt überschüssige Flüssigkeit mit einem Labortuch. Kontakt mit Embryonen vermeiden.
- Einen Tropfen Eindeckmedium auf Embryonen. Für Fluoreszenzmarkierungen, verwenden Sie ein Antifade Reagenz der Wahl. Für kolorimetrische Signale kann 70% Glycerin als Befestigungsmedium verwendet werden.
- Mit dem Embryo Poker, orientieren die Embryonen auf ihren Seiten in Reihen (1F).
- In einem "dab" Vaseline oder Hochvakuumfett auf jeder Ecke einem Deckglas (1G). Dies verhindert eine Beschädigung des Embryos vor übermäßiger Kompression.
- Deckglas (Vaseline Seite nach unten) auf der Oberseite der Embryonen (1H).
- Klopfen Sie leicht das Deckglas an jeder Ecke, bis die Montage Medien (70% Glycerin oder anti-fade Montage Reagenz) wird das Deckglas (1H) zu berühren.
- Falls erforderlich, mehr Montage Medien durch Pipettieren direkt neben dem coverslip, mit einer Pipette in einem Bereich von 20 bis 200 ml. Es wird unter Docht.
- Mit einem Labortuch, ganz sauber auf der Deckglas. Seien Sie sicher, um Druck auf das Deckglas nicht zu, da diese Embryonen schädigen. Dieser Bereich muss trocken sein und haben keine Vaseline oder Montage Medien auf sie.
- Verwenden Sie Nagellack um den Rand des Deckglases (1I) abzudichten.
Ergebnisse
Bei der Aufklärung der Mechanismen, die verschiedenen Entwicklungsereignisse wie Zellmusterungs, Differenzierung und Axon Führung unterliegen, ist es wichtig, in der Lage, Zellen, die im Rahmen ihrer Gewebe zu visualisieren. Dorsoventraler Strukturierung Mängel in der Regel als eine ventrale oder dorsale Verschiebung der Expressionsdomäne von Transkriptionsfaktoren in der pax, nkx oder dbx Familien 4 vorhanden. Manchmal können Veränderungen subtil sein, das nur wenige Zelldurchmesser 4. Querschnittsanalyse ermöglicht diese Art der Analyse. Jedoch können Reagenzien mit schwächeren Signalen oder Querschnitte, die nicht senkrecht zu der Achse AP Interpretation beschränken. Ferner Querschnittsanalyse nicht ohne zu berücksichtigen, ob Änderungen bestehen in der AP-Achse, und ist auf die Verfügbarkeit eines Kryostaten. Diese Einschränkung wird durch Seitenansichten des Rückenmarks umgangen. Wie in 2B zu sehen ist, ist nkx6.1 mRNA detwa in der ventralen Hälfte des Rückenmarks bei 24 Stunden nach der Befruchtung (hpf) istributed, in der Vorläuferdomäne. Vorläuferzellen unterscheidbar von Post mitotischen Zellen aufgrund des Vorhandenseins der Bodenplatte, die im medialen Teil des Rückenmarks zu finden ist. Mit DIC Optik angesehen werden einzelne Zellen deutlich unterscheidbar, und eine definierte Grenzfläche zwischen exprimierenden und nicht exprimierenden Zellen, ist offensichtlich.
Austrittsvorläuferzellzyklus wird durch Veränderungen in der Genexpression begleitet. Zum Beispiel werden alle post-mitotischen Neuronen auszudrücken HuC / D, die mit Immunzytochemie 1,5 nachweisbar ist. mRNA-Sonden für die Insel, gata und VSX Familien beschriften spezifische post-mitotischen Neuronen konsequente Position und Anzahl in jeder Rückenmark hemisegment 6. Zusätzlich werden Axon Führung Rezeptoren, wie sie in der Robo-Familie in begrenzten Populationen von postmitotischen Neuronen (2C) 2,7,8. Seitlicher Anbau von Embryonen erlaubt eine genaue Zählungen der post-mitotischen Neuronen. Ebenso können Vorläuferzellen sich zu teilen, die weiterhin mit Anti-Phospho-Histon-3 Immunzytochemie sowie BrdU-Markierung quantifiziert werden. Weiterhin kann Zelltod mit TUNEL Kennzeichnung 4-6 bewertet.
Bei 24 hpf können Axone der folgenden postmitotischen Neuronen mit verschiedenen Methoden sichtbar gemacht werden, und unterscheiden sich in der Einzelzellebene: Seitliche Rücken Aufsteigend (Dola), Commissural Primär Aufsteigend (COPA), Commissural Sekundär Aufsteigend (CoSA), ventrale Längs Absteigend (Steppe), Kolmer-Agdur (KA), Commissural gegabelten / Längs (CoB / L), Umlauf Aufsteigend (CiA), Umlauf absteigend (CID) und unipolar Commissural absteigend (UCoD), Rohon-Bart (RB), Motoneuronen ( M) 9. Axone verlaufen von dieser Neuronen im dorsalen, ventralen, vorderen und hinteren Richtungen. Sie Niederlassung, über die Mittellinie, und beenden Sie sowohl die Rückenund ventralen Rückenmark. In Verbindung mit der konfokalen Laser-Scanning-Mikroskopie sind diese vielfältigen zellulären Verhaltensweisen deutlich in seitlich angebrachten Embryonen mit Hilfe der Immunzytochemie und genetisch kodierte Fluoreszenzproteine wie GFP 2. In 2D wurde ZNP-1 Immunzytochemie verwendet werden, um die Entwicklung Motoneuronen zu beschriften. Motoneuronen verlassen das Rückenmark ventral um die umliegende Muskulatur innervieren entwickeln.
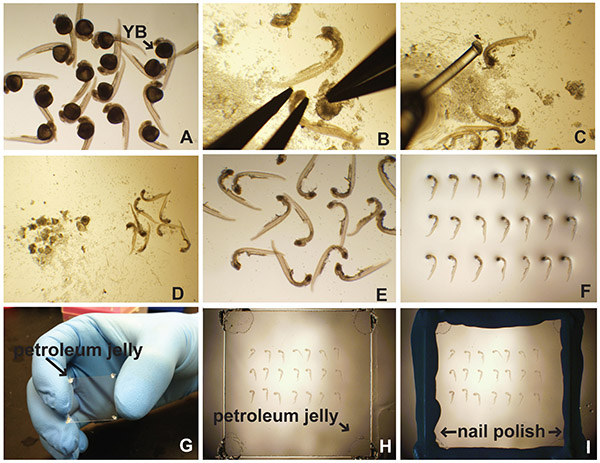
Fig. 1 ist. Präparation und Montage seitlich von Zebrafischembryos. (A) Nach der Verarbeitung für Immunfluoreszenz in situ-Hybridisierung, etc., sind Embryonen in einer 35 mm Petrischale mit PBT gefüllten (PBS mit 0,5% Triton X-100) oder PTW (PBS mit platziert 0,1% Tween-20). Das EigelbBall (YB) ist offensichtlich. (B) Das Eigelb wird durch die Sicherung der Kopf des Embryos, gefolgt von sorgfältig seziert und entfernt. (C) Ein Embryo Poker (Angelschnur an einer Pasteur-Pipette aufgeklebt) auf separaten Embryonen und Eigelb Schutt (D) verwendet. Gereinigt Embryonen werden auf einen Mikroskop-Objektträger (E) pipettiert und ausgerichtet (F). (G) Vaselin an den Ecken des Deckglases aufgebracht. (H) Das Deckglas wird sanft auf der Embryonen in Montagemedium platziert. (I) Nagellack verwendet, um die Kanten des Deckglases zu versiegeln. Klicken Sie hier für eine größere Ansicht .

< strong> Abbildung 2. Analyse von Genexpressionsmustern und Axon Pathfinding in seitlich angebrachten Zebrafischembryonen. (A) Zeichnung eines Zebrafischembryos bei 24 hpf. In BD, sind etwa vier hemisegments über dem Dottersack-Erweiterung visualisiert (boxed-Bereich). (B) nkx6.1 wird im ventralen Rückenmark, einschließlich der Bodenplatte (FP) ausgedrückt. (C) robo3 in postmitotischen Neuronen (PMN) ausgedrückt. Die Bodenplatte und Vorläuferzone ist nicht ersichtlich, in diesem mehr seitliche Brennebene. In B, C, das Rückenmark durch eine Klammer auf der linken Seite des Bildes begrenzt. (D) Die konfokale Mikroskopie wurde an Bild ZNP-1-Immunfluoreszenz, der Motor Axone verlassen das Rückenmark ventral-Etiketten eingesetzt. In allen Abbildungen ist anterior der linken und dorsalen liegt. A 40X großen Arbeitsabstand, Eintauchen in Wasser (NA 0,8) Objektiv verwendet wurde (3,3 mm).oad/50703/50703fig2highres.jpg "target =" _blank "> Klicken Sie hier für eine größere Ansicht.
Diskussion
Seitlicher Anbau von festen Zebrafischembryonen Hilfen Visualisierung von Rückenmark-Entwicklung. Durch die Entfernung des Dotterkugel, wird der für außergewöhnliche mikroskopische Bildgebung erforderlich Arbeitsabstand reduziert. Unsere repräsentative Ergebnisse wurden mit der 24 hpf Stufe begrenzt, jedoch kann diese Technik schon HPF 18 verwendet werden, obwohl früher Embryonen sind schwieriger aufgrund der Größe des Embryos und der Zerbrechlichkeit des Gewebes zu sezieren. Diese Technik ist auch anwendbar auf Embryonen, die älter als 24 HPF. Durch die optische Klarheit des embryonalen Zebrafisch, der Fähigkeit, zukunfts genetischen Screens durchführen, Reverse Genetik und transgene Ansätze unterstützt, kann mehrere Entwicklungsprozesse untersucht werden. Dies beinhaltet Mitoseindices der neuronalen Vorläuferzellen mit Markierungen wie BrdU-und Anti-Phospho-Histon-März 4-06 und Strukturierung durch Expression von neuronalen und glialen Vorläufer Marker in der pax, nkx, dbx, und olig families 1,4-6. Reagenzien, Gliazellen und neuronale Bestimmung (wie gliafibrilläres-Protein (GFAP) und HuC / D) berichten 1,4,5,10 verwendet werden können. Neuronale Differenzierung Subtyp kann durch Expression von Insel, VSX, engrailed und gata 1,4-6 Gene analysiert werden. Und schließlich ist die Analyse der Axon Führung durch Antikörper, wie anti-acetyliertes Tubulin, 3A10 und ZNP-1 2,11,12 möglich. Obwohl andere Wirbeltiermodellsysteme (Maus und Küken) werden verwendet, um das Rückenmark Entwicklung zu studieren, nur der Zebrafisch erlaubt den gleichzeitigen Empfang von allen Entwicklungs Achsen in der intakten Embryo.
Die offensichtliche Einschränkung dieses Ansatzes ist, dass die Embryonen festgelegt sind, die die Live-Darstellung ausschließt. Tatsächlich Entfernen (oder Beschädigung) der Dotter führt zu einem schnellen Tod des Embryos, ist es somit nicht möglich, den Arbeitsabstand in lebenden Embryos unter Verwendung dieser Technik zu reduzieren. Allerdings hoher Vergrößerung Rücken Cord Bildgebung in lebenden Embryonen möglich ist. Um das Eigelb bei Live-Bildgebung zu erhalten, können Embryonen in Depression Dias, die einen größeren Abstand zwischen der Probe und dem Deckglas bieten platziert werden. Alternativ können mehrere 22 mm x 22 mm Deckgläsern auf beiden Schlitten in einer 3 x 1 in Objektträger geklebt werden. Die Deckgläser dienen als "Brücke" für die darüberliegenden Deckglas. Wenn Embryonen sind älter als 18 hpf ist Tricaine verwendet, um Embryonen zu betäuben, um die Bewegung zu verhindern. Während ein Arbeitsabstand von 0,288 mm für deyolked Embryonen bei 24 hpf erforderlich, wenn mit lebenden Embryonen in Agarose eingebettet, mit intakten Eidotter, eine Mikroskoplinse mit einem Arbeitsabstand von 3,3 mm ausreichend. Alternativ kann Explantatkulturen deyolked aus Embryonen gewonnen mittels eines Plasmagerinnsel Immobilisierungstechnik 13 visualisiert werden. Verschiedene Populationen von Zellen durch die Verwendung von genetisch kodierte fluoreszierende Proteine wie GFP, mCherry oder der photo beachtenWandel Kaede Farbstoff (um nur einige zu nennen). Ferner kann fluoreszenzmarkierten Zellen in chimären Embryonen auch mit diesem Ansatz 14 gesehen werden.
Eine konsequente Montagetechnik, die für Monate stabil ist, ist ein wichtiges Werkzeug für Zell-und Entwicklungsbiologen. Diese einfache Technik ist reproduzierbar, was eine einfache Vergleich zwischen verschiedenen experimentellen Studien. Ferner wird die Ausrichtung der Embryonen in Reihen leicht ermöglicht Identifizierung spezifischer Embryonen für eine spätere Analyse.
Offenlegungen
Keine konkurrierenden finanziellen Interessen bestehen entweder Autor.
Danksagungen
Skidmore Fakultät Entwicklungszuschuss finanziert die Erstellung und Veröffentlichung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
Petri dishes 35 mm x 10 mm | VWR | 25373-041 | |
| Dumont Forceps #3 | Fisher Scientific | NC9839169 | |
| Cover glass | Fisher Scientific | 12-541-B22X22-1.5 | |
| Slides | Fisher Scientific | 12-550-343 | |
| SlowFade Gold | Fisher Scientific | S36936 | |
| ProLong Gold | Life Technologies | P36934 | |
| Petroleum Jelly | any grocery store |
| |
| Loop Holders | VWR | 80094-482 | |
| Insect Pins | Fine Science Tools | 26002-10 | |
| Nickel Plated Pin Holders | Fine Science Tools | 26016-12
| |
Olympus Stereomicroscope | Olympus | SZ61 |
Referenzen
- Gribble, S. L., Nikolaus, O. B., Dorsky, R. I. Regulation and function of Dbx genes in the zebrafish spinal. Dev. Dyn. 236 (12), 3472-3483 (2007).
- Bonner, J., et al. Midline crossing is not required for subsequent pathfinding decisions in commissural neurons. Neural Dev. 7 (1), 18 (2012).
- Ross, A. B. J. Activation of Wnt signaling using Lithium Chloride: Inquiry-Based Undergraduate Laboratory Exercises. Zebrafish. , (2012).
- Bonner, J., et al. Proliferation and patterning are mediated independently in the dorsal spinal cord downstream of canonical Wnt signaling. Dev. Biol. 313 (1), 398-407 (2008).
- Gribble, S. L., et al. Tcf3 inhibits spinal cord neurogenesis by regulating sox4a expression. Development. 136 (5), 781-789 (2009).
- England, S., et al. Roles of Hedgehog pathway components and retinoic acid signalling in specifying zebrafish ventral spinal cord neurons. Development. 138 (23), 5121-5134 (2011).
- Challa, A. K., Beattie, C. E., Seeger, M. A. Identification and characterization of roundabout orthologs in zebrafish. Mech Dev. (1-2), 101-101 (2001).
- Lee, J. S., Ray, R., Chien, C. B. Cloning and expression of three zebrafish roundabout homologs suggest roles in axon guidance and cell. 221 (2), 216-230 (2001).
- Downes, G. B., Waterbury, J. A., Granato, M. Rapid in vivo labeling of identified zebrafish neurons. Genesis. 34 (3), 196-202 (2002).
- Kim, H., et al. Notch-regulated oligodendrocyte specification from radial glia in the spinal cord of zebrafish embryos. Dev. Dyn. 237 (8), 2081-2089 (2008).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- de Soysa, T. Y., et al. Macondo crude oil from the Deepwater Horizon oil spill disrupts specific developmental processes during zebrafish embryogenesis. BMC Biol. 10 (40), (2012).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228 (3), 464-474 (2003).
- Deschene, E. R., Barresi, M. J. Tissue Targeted Embryonic Chimeras: Zebrafish Gastrula Cell Transplantation. J. Vis. Exp. (31), (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten