Method Article
Вскрытие и боковая навеска из эмбрионов данио рерио: Анализ спинномозговой развития шнура
В этой статье
Резюме
С развитием процессы, такие как пролиферация, структурирование, дифференциации и аксонов может быть легко смоделированы в данио спинного мозга. В этой статье мы опишем монтажный порядок эмбрионов рыбок данио, которая оптимизирует визуализацию этих событий.
Аннотация
Данио спинного мозга является эффективным следственная модель для исследования нервной системы по нескольким причинам. Во-первых, генетический, трансгенные и Нокдаун гена подходы могут быть использованы для изучения молекулярных механизмов, лежащих в основе развития нервной системы. Во-вторых, крупные кладки умственно синхронизированных эмбрионов обеспечить большие экспериментальные размеры выборки. В-третьих, оптическая прозрачность из рыбок данио эмбриона позволяет исследователям визуализировать прародителя, глиальных и популяции нейронов. Хотя эмбрионы рыбок данио прозрачны, толщина образца может препятствовать эффективной микроскопический визуализации. Одной из причин этого является разработка тандем спинного мозга и вышележащих сомитов ткани. Другой причиной является большая желток мяч, который по-прежнему присутствует в периоды раннего нейрогенеза. В этой статье мы покажем, микродиссекции и удаление желтка в основной эмбрионов, что позволяет микроскопический визуализацию при сохранении окружающей сомитов ткани. Мы ALSо демонстрируют полупостоянные монтаж эмбрионов рыбок данио. Это позволяет наблюдать развитие нервной системы в спинно-вентральной и передне-задней оси, как он сохраняет трехмерность ткани.
Введение
Визуализация спинного мозга у данио ингибируется от ряда факторов. Из-за толщины вышележащих сомитов и внутренней расположения спинного мозга, значительно длиннее расстояние требуется для высокой клеточной разрешении. Желток мяч (который по-прежнему присутствует на ранних стадиях нейрогенеза) еще больше увеличивает рабочее расстояние, необходимое, и легко повреждается давлением со стороны покровного стекла. Кроме того, мусор из поврежденного желтка запрещает четкую визуализацию тканей. Хотя сечения в спинно-вентральной (DV) оси возможны, они не всегда допускают одновременной визуализации в передне-задней (AP) оси 1.
Для преодоления этих препятствий, эмбрионы расчленены и установлен на слайдах. Эта процедура обеспечивает несколько преимуществ. Во-первых, эмбрионы рыбок данио легко лечь с боковой стороной вверх, что облегчает AP оси визуализации. Во-вторых, удаление желтка балл уменьшается необходимое рабочее расстояние, и ограничивает мусора. В-третьих, эта монтажная процедура позволяет люминесцентными лампами и микроскопии по методу светлого. В-четвертых, установлены эмбрионы являются стабильными в течение нескольких месяцев при 4 ° С, что позволяет длительное образец визуализации. Наконец, прогрессирование развития происходит в том, что передних сегментах являются более зрелыми, чем задних сегментах. Для того, чтобы гарантировать, что в постановке подобранные спинного hemisegments сравниваются между эмбрионов, перекрывающих сомит ткани используется в качестве ориентира. Например, десятым самым задней сомит перекрывает десятую спинного hemisegment, который является развитием эквивалент в эмбрионов на стадии соответствием. Это монтажа процедура интактных эмбрионов позволяет легко идентифицировать сомитах.
Мы используем генетики и генной нокдаун технологии для изучения механизмов аксонов в развивающихся спинного мозга. В частности, мы определили, что Robo2, Robo3 и ДКК необходимы для комиссуральных первичной ASCEнахождении (Кубок) Аксон поиска пути. Используя монтажный процедуру, описанную здесь, мы смогли изучить вентральной рост, средней линии пересечения, ширина спайки, спинной и переднюю 2,3 роста. Это монтажа процедура также может быть применен к DV или AP паттерна спинного мозга. Мы использовали эту процедуру, чтобы определить, разрозненные роли вниз по течению Wnt эффекторов в DV паттерна спинного мозга. Используя эту установку, мы смогли получить разрешение DV маркеров на уровне одной клетки, и определить мельчайшие структурирование сдвиги в результате измененного Wnt приема сигнала 4,5. Это монтажа процедура также позволяет расчета индекса митотический через анти-phosphohistone 3 или BrdU маркировки (пролиферация предшественников) дифференцирования 5.
протокол
1. Монтаж эмбрионов (после завершения Выбранный визуализации техники, таких как иммунопреципитация, в гибридизация и т.д.)
- Наведите эмбрионов в чашке 35 мм Петри заполнены буфера выбора (рис. 1А). Выбор буфера на основе процедуры маркировки. Обычно буферы на основе PBS являются подходящими.
- Под микроскопом рассекает, и с помощью щипцов, закрепите голову одной парой щипцов, потянув желток прочь с другой паре (рис. 1В). Кроме того, использование насекомых штифт в держатель насекомых контактный мягко тронуться с места желток.
- Использование покер эмбриона (лески (диаметр 0,41 мм) наносится либо капиллярной трубки или пипетки Пастера) двигаться эмбрионов к части чашки Петри, который не имеет много желтка мусора (рис. 1C-D).
- Использование стекла пипетки Пастера, аспирация эмбрионов в качестве небольшим количеством жидкости, насколько это возможно, и гвидимому пипетки их на слайд (рис. 1E).
- Аккуратно фитиль от избытка жидкости с использованием лабораторного салфетка. Избегать контакта с эмбрионами.
- Добавьте одну каплю монтажа средних и эмбрионов. Для флуоресцентных меток, использовать antifade реагента выбора. Для колориметрических сигналов, 70% глицерина может быть использован в качестве монтажной среды.
- Использование покер эмбриона, ориентироваться эмбрионов на боку в строках (рис. 1F).
- Добавьте одну "каплю" вазелина или высокой вакуумной смазки на каждом углу покровным (рис. 1G). Это предотвращает повреждение эмбриона от чрезмерного сжатия.
- Поместите покровное (вазелин стороной вниз) на вершине эмбрионов (рис. 1H).
- Аккуратно нажмите покровное на каждом углу, пока монтажной СМИ (70% глицерина или анти-Fade монтажа реагент) соприкасается покровное (Рисунок 1H).
- При необходимости добавьте больше монтажное СМИ с помощью пипетки прямо рядом с соуerslip, с помощью пипетки в диапазоне 20-200 мл. Это будет фитиль под.
- Использование лабораторию протрите, полностью очистить зону вокруг покровного стекла. Будьте уверены, чтобы не оказывать давление на покровного стекла, так как это может привести к повреждению эмбрионов. Эта область должна быть сухой и не иметь никакого вазелин или монтажные СМИ на нем.
- Использование лака для ногтей для герметизации вокруг края покровного стекла (рис. 1i).
Результаты
Когда выяснения механизмов, лежащих в основе различных событий, таких как в развитии клеточного паттерна, дифференциации и аксонов, важно иметь возможность визуализировать клетки в контексте их ткани. Дорсовентральных паттерна дефекты обычно присутствующие в брюшной или спинной сдвига в области экспрессии транскрипционных факторов в чел, NKX или DBX семей 4. Время от времени, изменения могут быть тонкими, состоящий всего несколько диаметров клеток 4. Поперечного сечения анализ позволяет этот тип анализа. Тем не менее, реагенты с более слабых сигналов, или сечений, которые не перпендикулярны оси AP может ограничить интерпретацию. Кроме того, в поперечном сечении анализ не легко учитывать сохраняются ли изменения в АР оси, и зависит от наличия криостата. Это ограничение обойти, боковым видом на спинном мозге. Как видно на рисунке 2B, Nkx6.1 мРНК д.istributed в примерно вентральной половины спинного мозга на 24 ч после оплодотворения (HPF), в домене предшественников. Клетки-предшественники отличаются от сообщение митотических клеток из-за наличия плиты пола, который находится в медиальной части спинного мозга. Просмотров с ОПК оптики, отдельные клетки ясно различимы, и определение границы между выражения и nonexpressing клетки очевидна.
Выход клеток-предшественников цикл сопровождается изменениями в экспрессии генов. Например, все постмитотических нейроны выразить HUC / D, который обнаруживается с иммуноцитохимии 1,5. мРНК зонды для островке, Гата, и VSX семей обозначать конкретные постмитотические нейроны последовательной позиции и числа в пределах каждого спинного мозга hemisegment 6. Кроме того, аксонов рецепторы, такие как те, в семье робо выражаются в ограниченных популяциях постмитотических нейронов (рис. 2С) 2,7,8. Боковой монтаж эмбрионов позволяет точные подсчеты постмитотических нейронов. Аналогичным образом, предшественники, которые продолжают делить может быть определена количественно с анти-фосфо-гистон 3 иммуноцитохимии, а также BrdU маркировки. Кроме того, гибель клеток можно оценить с TUNEL маркировки 4-6.
В 24 часов после оплодотворения, аксоны следующих постмитотических нейронов могут быть визуализированы с различными методами, и различимы на одном уровне клетки: Спинной Боковая возрастания (Дола), спаечный Первичная возрастания (Кубок), спаечный Вторичный возрастания (Cosa), брюшной Продольная убывания (пастбище), Кольмер-Agdur (КА), спаечный бифурцирующего / Продольные (ССБ / л), Окружная возрастанию (ЦРУ), Окружная убыванию (CID), и однополярный комиссуральных убыванию (UCoD), Rohon-Борода (РБ), мотонейроны ( M) 9. Аксоны проходят от этих нейронов в спинном, брюшной, передней и направлениях задних. Они филиал, пересечь среднюю линию, и выйти как на спиннойи вентральной спинного мозга. В сочетании с конфокальной лазерной сканирующей микроскопии, эти разнообразные клеточные поведения очевидны в поперечном направлении, установленных эмбрионов, используя иммуноцитохимии и генетически закодированные флуоресцентные белки, такие как GFP 2. На рисунке 2D, ZNP-1 иммуноцитохимия был использован для обозначения развивающихся двигательные нейроны. Мотонейронов выхода из спинного мозга вентрально к иннервируют окружающие развивающийся мускулатуру.
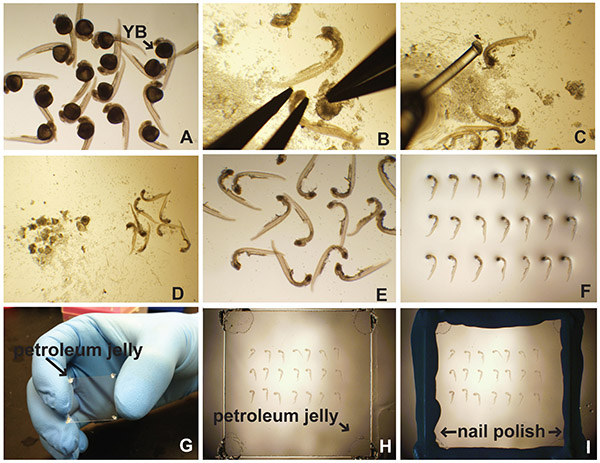
Рисунок 1. Вскрытие и бокового крепления из эмбрионов данио рерио. (А) после обработки на иммунофлуоресценции, в гибридизация и т.д., эмбрионы помещают в чашку Петри 35 мм, заполненной PBT (PBS с 0,5% Triton X-100) или PTW (PBS с 0,1% Tween-20). Желтокмяч (YB) очевидна. (В) Желток удаляют закрепляют головку эмбриона с последующим тщательным вскрытия. (С) эмбрион покер (леска приклеены к пипетки Пастера) используется для разделения эмбрионов и желтка мусора (D). Очищенные эмбрионы пипеткой на предметное стекло микроскопа (E) и выровнены (F). (G) Вазелин применяется к углам покровного стекла. (H) покровное осторожно помещают сверху эмбрионов по монтажу среды. (Я) Лак для ногтей используется для герметизации края покровного стекла. Нажмите здесь, чтобы увеличить изображение .

< сильный> Рисунок 2. Анализ генов паттернов экспрессии и аксона Pathfinding в поперечном направлении установлен эмбрионов рыбок данио. (А) Нанесение данио эмбриона на 24 часов после оплодотворения. В BD, примерно четыре hemisegments над расширением желточного мешка визуализируются (коробочную область). (B) Nkx6.1 выражается в брюшной спинного мозга, в том числе плиты перекрытия (FP). (C) Robo3 выражается в постмитотических нейронов (ПМН). Зона плиты перекрытия и прародитель не видно в этом более боковой фокальной плоскости. В B, C, спинной мозг ограничен кронштейне с левой стороны изображения. (D) конфокальной микроскопии изображение ZNP-1 иммунофлюоресценции, который маркирует моторные аксоны, выходящие из спинного мозга вентрально. Во всех изображений, передняя находится слева и спинной вверх. 40X длиннее расстояние деятельности, погружение в воду (NA 0.8) объектив был использован (3.3 мм).oad/50703/50703fig2highres.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Боковой монтаж основного эмбрионов данио вспомогательной визуализации развития спинного мозга. Через удаления желтка мяч, рабочее расстояние, необходимое для исключительного микроскопических изображений снижается. Наши репрезентативные результаты были ограничены до стадии 24 HPF, однако, этот метод может быть использован в начале 18 часов после оплодотворения, хотя ранее эмбрионы более трудно анализировать из-за размера эмбриона и хрупкости ткани. Этот метод также применим к эмбрионов старше 24 часов после оплодотворения. При содействии оптической ясности эмбрионального рыбок данио, способности выполнять вперед генетические экраны, обратной генетики, и трансгенных подходов, несколько процессов развития могут быть исследованы. Это включает в себя митотических индексов нейронных клеток-предшественников с маркерами, как BrdU и анти-фосфо-гистона 3 4-6 и структурирование через выражение нейронных и глиальных маркеров предшественников в чел, NKX, DBX и Olig Familieс 1,4-6. Реагенты, которые сообщают глиальных и нейронов определение (например, глиальных белков фибриллярные кислоты (GFAP) и HUC / D) 1,4,5,10 может быть использован. Дифференцировку нейронов подтип могут быть проанализированы с помощью выражения островок, VSX, engrailed и генов-Гата 1,4-6. И, наконец, анализ аксонов можно через антител, таких как анти-ацетилированного тубулина, 3A10, и ZnP-1 2,11,12. Хотя другие позвоночных модельных систем (мыши и цыпленок) используются для изучения развития спинного мозга, только рыбок данио позволяет одновременно просматривать всех осей развития в неповрежденной эмбриона.
Очевидным ограничением этого подхода является то, что эмбрионы фиксируются, что исключает живого изображения. В самом деле, удаление (или повреждения) результатов желтка в быстром эмбриональной смерти, таким образом, это не возможно, чтобы уменьшить рабочее расстояние в живых эмбрионов с помощью этой техники. Тем не менее, с большим увеличением спинного сой томография в живых эмбрионов можно. Для того чтобы сохранить желток в течение живого изображения, эмбрионы могут быть помещены в депрессии слайдов, которые обеспечивают большее пространство между образцом и покровное. Кроме того, несколько 22 мм х 22 мм покровные можно приклеить на любой слайд в 3 х 1 в предметное стекло. Покровные стекла служить «мостом» для вышележащих покровное. Если эмбрионы старше 18 оплодотворения, Tricaine используется для обезболивания эмбрионов, чтобы предотвратить движение. В то время как рабочее расстояние 0,288 мм требуется для deyolked эмбрионов на 24 часов после оплодотворения, при работе с живых эмбрионов, внедренных в агарозы, с неповрежденными желтков, микроскопический объектив с рабочим расстоянием 3,3 мм достаточно. Кроме того, эксплантов культуры, полученные из эмбрионов deyolked могут быть визуализированы с помощью метода иммобилизации плазма сгустка 13. Различные популяции клеток можно наблюдать с использованием генетически кодируемых флуоресцирующих белков, таких как GFP, mCherry, или фотопроводимостиконвертируемых краситель Kaede (назвать несколько). Кроме того, флуоресцентно меченые клетки в пределах химерных эмбрионов можно также рассматривать с таким подходом 14.
Последовательное монтажа техника, которая является стабильной в течение нескольких месяцев является важным инструментом для развития и клеточных биологов. Этот простой метод является воспроизводимым, что позволяет легко сравнивать различные экспериментальных испытаний. Кроме того, выравнивание эмбрионов в строках легко позволяет идентифицировать конкретные эмбрионов для последующего анализа.
Раскрытие информации
Нет конкурирующие между собой финансовые интересы не существуют для любой автора.
Благодарности
Skidmore факультет Грант развития финансировал подготовку и публикацию этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
Petri dishes 35 mm x 10 mm | VWR | 25373-041 | |
| Dumont Forceps #3 | Fisher Scientific | NC9839169 | |
| Cover glass | Fisher Scientific | 12-541-B22X22-1.5 | |
| Slides | Fisher Scientific | 12-550-343 | |
| SlowFade Gold | Fisher Scientific | S36936 | |
| ProLong Gold | Life Technologies | P36934 | |
| Petroleum Jelly | any grocery store |
| |
| Loop Holders | VWR | 80094-482 | |
| Insect Pins | Fine Science Tools | 26002-10 | |
| Nickel Plated Pin Holders | Fine Science Tools | 26016-12
| |
Olympus Stereomicroscope | Olympus | SZ61 |
Ссылки
- Gribble, S. L., Nikolaus, O. B., Dorsky, R. I. Regulation and function of Dbx genes in the zebrafish spinal. Dev. Dyn. 236 (12), 3472-3483 (2007).
- Bonner, J., et al. Midline crossing is not required for subsequent pathfinding decisions in commissural neurons. Neural Dev. 7 (1), 18 (2012).
- Ross, A. B. J. Activation of Wnt signaling using Lithium Chloride: Inquiry-Based Undergraduate Laboratory Exercises. Zebrafish. , (2012).
- Bonner, J., et al. Proliferation and patterning are mediated independently in the dorsal spinal cord downstream of canonical Wnt signaling. Dev. Biol. 313 (1), 398-407 (2008).
- Gribble, S. L., et al. Tcf3 inhibits spinal cord neurogenesis by regulating sox4a expression. Development. 136 (5), 781-789 (2009).
- England, S., et al. Roles of Hedgehog pathway components and retinoic acid signalling in specifying zebrafish ventral spinal cord neurons. Development. 138 (23), 5121-5134 (2011).
- Challa, A. K., Beattie, C. E., Seeger, M. A. Identification and characterization of roundabout orthologs in zebrafish. Mech Dev. (1-2), 101-101 (2001).
- Lee, J. S., Ray, R., Chien, C. B. Cloning and expression of three zebrafish roundabout homologs suggest roles in axon guidance and cell. 221 (2), 216-230 (2001).
- Downes, G. B., Waterbury, J. A., Granato, M. Rapid in vivo labeling of identified zebrafish neurons. Genesis. 34 (3), 196-202 (2002).
- Kim, H., et al. Notch-regulated oligodendrocyte specification from radial glia in the spinal cord of zebrafish embryos. Dev. Dyn. 237 (8), 2081-2089 (2008).
- Sylvain, N. J., Brewster, D. L., Ali, D. W. Zebrafish embryos exposed to alcohol undergo abnormal development of motor neurons and muscle fibers. Neurotoxicol. Teratol. 32 (4), 472-480 (2010).
- de Soysa, T. Y., et al. Macondo crude oil from the Deepwater Horizon oil spill disrupts specific developmental processes during zebrafish embryogenesis. BMC Biol. 10 (40), (2012).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228 (3), 464-474 (2003).
- Deschene, E. R., Barresi, M. J. Tissue Targeted Embryonic Chimeras: Zebrafish Gastrula Cell Transplantation. J. Vis. Exp. (31), (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены