Method Article
Verwendung von
In diesem Artikel
Zusammenfassung
Um Krankheitserreger Verbreitung entgegenzuwirken, Wirtszellen neu zu organisieren, um Bakterien ihre Zellskelett compartmentalize und induzieren Autophagie. Verwendung Shigella Infektion von Gewebekulturzellen, Wirt und Pathogen Determinanten dieses Verfahren zugrunde liegen, werden identifiziert und charakterisiert. Mit Zebrafisch-Modelle von Shigella-Infektion, sind die Rolle der entdeckten Moleküle und Mechanismen in vivo untersucht.
Zusammenfassung
Shigella flexneri ist ein intrazelluläres Pathogen, das von Phagosomen entkommen können, um das Zytosol zu erreichen, und polymerisieren die Host-Aktin-Zytoskelett, seine Beweglichkeit und Verbreitung zu fördern. Neue Arbeit hat gezeigt, dass Proteine in Aktin-basierte Motilität beteiligt sind auch die Autophagie, eine intrazelluläre Abbauprozess von entscheidender Bedeutung für die Zell autonome Immunität verbunden. Auffallend ist, können Wirtszellen Aktin-basierte Motilität von S. verhindern flexneri durch Abschottung Bakterien in Septin Käfige "und Targeting sie Autophagie. Diese Beobachtungen zeigen, dass ein vollständigeres Verständnis der Septine, eine Familie von filamentösen GTP-bindende Proteine, werden neue Einsichten in den Prozess der Autophagie bereitzustellen. Dieser Bericht beschreibt Protokolle Autophagie-Zytoskelett Interaktionen von S. verursacht überwachen flexneri in vitro unter Verwendung von Gewebekulturzellen und in vivo mit Zebrafisch-Larven. Diese Protokolle ermöglichen Untersuchung der intrazellulären mechanisms, die Verbreitung von Bakterien auf molekularer, zellulärer und ganzen Organismus-Ebene steuern.
Einleitung
Shigella flexneri, ein Gram-negatives Bakterium invasive enteropathogenen, kann von Phagosomen in das Cytosol zu entkommen, und polymerisieren die Host-Aktin-Zytoskelett zu zytosolischen Immunantwort zu entgehen und zu fördern intra-und interzelluläre Bewegung 1,2. Trotz des Verständnisses von Aktin-basierte Motilität in vitro 3,4 haben die Mechanismen beschränken bakterielle Verbreitung in vivo nicht vollständig definiert wurde. Dies ist wichtig für ein besseres Verständnis der angeborenen Immunität und Wirtsabwehr.
Septine, eine hoch konservierte Familie von Proteinen unter Metazoen sind Guanosintriphosphat (GTP) bindende Proteine, die in hetero-oligomeren Komplexen zusammen und bilden unpolaren Filamente, die mit zellulären Membranen und Zytoskelett 5,6 verknüpfen. Neuere Arbeiten haben entdeckt, dass infizierte Wirtszellen können Shigella aktinvermittelten Bewegung durch Abschottung Bakterien gezielt zu verhindern autophagy innerhalb Septin Käfige ", enthüllt die ersten zellulären Mechanismus, der Aktin-basierte Motilität 7,8 entgegenwirkt. Eine große offene Feld der Untersuchung liegt nun in Septin Biologie und Infektion. Septin Montage, durch eine Vielzahl von Krankheitserregern hervorgerufen (zB Listeria monocytogenes 7,9,10, Mycobacterium marinum 7,8, Candida albicans 11), kann als ein zentrales Thema in der Wirtsabwehr 5,12 entstehen.
Autophagie, eine hoch konservierte intrazelluläre Abbauprozess wird als eine Schlüsselkomponente der Zell-autonome Immunität wegen seiner Fähigkeit, cytosolische Bakterien zum Lysosom 13,14 liefern angesehen. Allerdings ist die Rolle von bakteriellen Autophagie in vivo zu beschränken oder zu fördern bakteriellen Replikations bleibt schlecht verstanden 15,16. Der Zebrafisch (Danio rerio) als ein wirbel Modell für die Untersuchung von Infektionen auf, da sie optisch zugänglich ist,bei den Larvenstadien, wenn das angeborene Immunsystem ist bereits funktionelle 17,18. Neuere Arbeiten haben die Anfälligkeit des Zebrafisch-Larven S. gekennzeichnet flexneri, ein Paradigma für bakterielle Autophagie 15 und hat die Shigella -zebrafish Infektionsmodell verwendet, um die Manipulation der Autophagie für antibakterielle Therapie in vivo 19 studieren.
Dieser Bericht bietet neue Tools und Tests zu studieren S. flexneri Wechselwirkungen mit Autophagie und dem Zytoskelett. In einem ersten Schritt, Protokolle zu überwachen Autophagozytose-Zytoskelett Interaktionen mit Shigella-Infektion des humanen epithelialen Zellinie HeLa beschrieben. Um die Rolle der Autophagie-Zytoskelett Interaktionen auf der Shigella Infektionsprozess in vitro zu beurteilen, Methoden Autophagozytose und Zytoskelett-Komponenten (mit siRNA oder pharmakologische Reagenzien) zu manipulieren sind. Neue Arbeit hat gezeigt, dass durch die Verwendung Shigella-Infektion of Zebrafisch-Larven können ähnliche Tests angewendet werden, um die Zellbiologie der Infektion in vivo zu untersuchen. Protokolle zu erstellen und zu infizieren Zebrafisch-Larven detailliert sind, und die Antwort der Gastgeber für Shigella-Infektion in vivo zu beurteilen, Protokolle, um festzustellen Host Überleben und bakterielle Belastung der infizierten Larven vorhanden sind. Methoden, um die Rekrutierung von septin und Autophagie Marker Shigella überwachen (entweder mit festen oder Wohnzebrafisch-Larven) und Methoden, um die Rolle dieser Prozesse in vivo zu testen [mit Morpholino-Oligonukleotide (in 1-4 Zell-Stadium Embryos injiziert) oder pharmakologische Reagenzien ( direkt mit dem Zebrafisch Badewasser zugesetzt)] werden ebenfalls diskutiert. Dieses Arbeitsprogramm wird voraussichtlich Einblick in die für die Kontrolle der Infektion durch cytosolische Wirtsreaktionen erforderlich Mechanismen aus.
Protokoll
1. Überwachung Autophagie und des Zytoskeletts in vitro unter Verwendung von Gewebekulturzellen
- Bereiten S. flexneri
- Platte S. flexneri M90T (Wildtyp) von -80 ° C Glycerin Lager auf einen Kongo-Rot tryptischen Casein Soja (TCS)-Agar-Platte. Inkubieren über Nacht bei 37 ° C aufweist. Die gleiche Platte kann für verschiedene Experimente verwendet werden.
- Abholung einer Einzelkolonie und wachsen in 8 ml TCS Medien in einem Schüttler über Nacht bei 37 ° C aufweist.
HINWEIS: Kongo-Rot zeigt an, dass die Bindung Virulenzplasmid wurde beibehalten. - Um Bakterien, die für exponentielles Wachstum Subkultur, zu impfen frisch TCS mit der Bakterienkultur über Nacht bei 1/80 Verdünnung und wachsen in einem Schüttler bei 37 ° C bis zu einer OD 600 = 0,3-0,6.
- Drehen Sie das bakterielle Subkultur bei 1.000 xg für 5 min. Waschen des Pellets mit MEM und Zentrifuge bei 1000 g für 5 min. Rekonstitution des Pellets in MEM, um OD 600 = 0,3-0,6.
- Bereiten HeLa Cells für Infektions
- HeLa-Zellen wachsen in "Vollmedium", dh., MEM plus L-Alanyl-L-Glutamin mit 1 mM Natriumpyruvat, 0,1 mM nicht-essentieller Aminosäurelösung und 10% fötalem Kälberserum ergänzt.
- Platte 1-1,5 × 10 5 Zellen in 6-Well-Platten 24 bis 48 h vor dem Experiment beginnt. Platte auf Deckgläschen in 6-Well-Platten für die Mikroskopie, oder die Platte auf 35 mm Glasboden Gerichte für Live Imaging vorzubereiten.
HINWEIS: (. ZB Aktin Schwänze, septin Käfige) Um Autophagie folgen (zB ATG8 / LC3 + ve Autophagosomen) und Zytoskelett Dynamik in Echtzeit während der Infektion mit Shigella Live-Bildgebung können Gewebekulturzellen transient mit GFP werden, RFP- oder GFP-markierten Konstrukte (siehe Diskussion).
- Infektion
- Infizieren Zellen mit 100: 1 Multiplizität der Infektion (MOI) von Shigella (OD 600 = 0,3-0,6) in MEM verdünnt; direkt an HeLa-Zellen in 6-w vernickelt hinzufügenell Platten 24 - 48 h vor der Infektion in 2 ml MEM (Serum verhungert) (wie in Abschnitt 1.2 beschrieben).
- Um bakterielle Adhärenz zu maximieren, um Zellen, Bakterien und Zellen Zentrifuge bei 700 × g für 10 min bei Raumtemperatur zu hosten. Nach Zentrifugation Inkubation 30 min bei 37 ° C, 5% CO 2 und erlauben die Infektion fortschreiten.
- Waschen infizierten Zellen zweimal mit frischem MEM und Inkubation mit Gentamicin enthaltenden Vollmedium für 1-4 h je nach Experiment (50 ug / ml, um extrazelluläre Bakterien zu eliminieren).
- Befestigung und Kennzeichnung infizierten HeLa-Zellen für die Mikroskopie
- Mit 1x PBS waschen infizierten Zellen zweimal, und fixieren für 15min in 4% Paraformaldehyd in PBS 1x bei Raumtemperatur. Um Para entfernen, waschen Zellen 2x mit PBS 1x.
- Inkubieren fixierten Zellen in 50 mM Ammoniumchlorid 10 min bei Raumtemperatur. Einmal mit 1x PBS waschen und permeabilisieren Zellen für 4 min mit 0,1% Octylphenol Ethylenoxidkondensat bei Raum temperatur.
HINWEIS: Alternativen zu Ethylenoxid-Kondensat zur Permeabilisierung Octylphenol, wie Saponin oder Methanol, kann für unterschiedliche Konservierung von Zellstrukturen 20 aufgebracht werden. - Waschen Sie die Zellen in 1x PBS und Inkubation in Feuchtkammer mit primären Antikörpern gegen Autophagie kritischen Komponenten (zB p62 / SQSTM1) oder die septin Zytoskelett (SEPT2, SEPT6, SEPT7, SEPT9 und SEPT11 in HeLa-Zellen exprimiert) für 30 min (bei Raumtemperatur) über Nacht (bei 4 ° C).
- Waschen Sie die Zellen zweimal mit 1x PBS und Inkubation in Feuchtkammer mit Sekundärantikörper, und beschriften filamentösen Aktin (F-Aktin) mit Phalloidin, für 30 min (bei Raumtemperatur) über Nacht (bei 4 ° C). Zur Färbung von Wirtszellkerne hinzufügen 4 ", 6-Diamidino-2-phenylindol (DAPI).
- Waschen Sie die Zellen in 1x PBS und montieren Sie die Deckgläser auf Objektträger mit Montage Medium.
- Mikroskopische Imaging von infizierten HeLa-Zellen
- Um das Bild der infreflektierte Zellen verwenden ein Epifluoreszenz- oder konfokalen Mikroskop und ein 63X oder 100X Ziel, DAPI-markierten Shigella identifizieren.
HINWEIS: Wie in den 1A gezeigt - 1C, können septin Käfige als Ringartige Strukturen sichtbar gemacht werden, ~ 0,6 um im Durchmesser, rund um cytosolische Bakterien Polymerisation Aktin und Rekrutierung von Autophagie-Marker (zB p62 und LC3) 7,8. Im Gegensatz dazu wird die Polymerisation Bakterien Aktin Schwänze nicht durch septin Käfige in Kompartimente werden und wird nicht gezielt auf 7,8 Autophagie werden. - Mit Hilfe eines Epi-Fluoreszenz oder konfokalen Mikroskop und einem 63X oder 100X Ziel, quantifizieren die Anzahl der intrazellulären Bakterien pro mikroskopischen Feld. Auch zu quantifizieren, die Anzahl der Bakterien in Käfigen eingeschlossen septin und Autophagie gezielte oder Polymerisation Aktin Schwänze und Flucht Autophagie.
- Um zu bestimmen, den Prozentsatz der Bakterien in septin Käfigen oder Polymerisation Aktin Schwänze eingeschlossen, nehmen Sie ein Bild Z-Stapel-Serie von InFEcted Zellen, verarbeiten die Bilder und zählen mindestens 500-1.000 Bakterien pro Experiment aus mindestens 3 unabhängigen Experimenten.
- Um das Bild der infreflektierte Zellen verwenden ein Epifluoreszenz- oder konfokalen Mikroskop und ein 63X oder 100X Ziel, DAPI-markierten Shigella identifizieren.
2. Funktionsanalyse von Autophagie und dem Zytoskelett In-vitro-
HINWEIS: Sowohl genetische und pharmakologische Ansätze können verwendet werden, um Autophagozytose in infizierten Gewebekulturzellen zu stören, und die Wirkung dieser Behandlung auf den Verlauf der Infektion überwacht werden.
- siRNA-vermittelte Silencing
- Platte 0,8 x 10 5 HeLa-Zellen auf Deckgläschen in Platten mit 6 Vertiefungen in vollständigem Medium.
- Transfektion am folgenden Tag mit einem Lipid-basierte Transfektionsreagenz mit siRNA gegen Autophagie und / oder Zytoskelett-Marker.
- Nach der gewünschten Inkubationszeit, infizieren die Zellen mit Shigella, wie in Abschnitt 1.3 beschrieben.
- Fix und beschriften Sie die Zellen, wie in Abschnitt 1.4 beschrieben.
- Pharmakologische Manipulation
Hinweis: Das Zytoskelett kann pharmakologisch manipuliert werden, zB um die Aktin-Zytoskelett Verwendung Cytochalasin D oder B Latrunculin Depolymerisation, um Depolymerisation von Mikrotubuli benutzen Nocodazol, um Actomyosin Aktivität Nutzung blebbistatin blockieren oder zu septin Montage Verwendung forchlorfeneuron stören. Autophagy kann mit Rapamycin stimuliert oder mit Hilfe bafilomycin blockiert werden.- Um das Zytoskelett während Shigella-Infektion zu manipulieren, zuerst infizieren die Zellen mit Shigella, wie in Abschnitt 1.3 beschrieben und genügend Zeit für die Bakterien in die Zellen eindringen und die Flucht aus dem Phagosom in das Zytosol (zB.,> 1,5 h nach Infektion).
- Verdünnen die Drogen aus der Stammlösung [Stammlösung in Dimethylsulfoxid (DMSO) suspendiert] in MEM zu einer endgültigen Konzentration von 5 M (Cytochalasin D, B Latrunculin, Nocodazol), 20 M (forchlorfeneuron) oder 50 M (blebbistatin) und Behandlung von Zellen 30 min bei 37 ° C aufweist. Die Gesamtmenge an Wirkstoff (Volumen des DMSO / dTeppich-Gemisch) aufgenommen pro Platte / Fläschchen von Zellen 1-5 ul (je nach Stammlösung) pro 2 ml Medium. Behandlung von Zellen mit einer ähnlichen Dosis von DMSO in MEM als negative Kontrolle verdünnt.
- Fix und beschriften Sie die Zellen, wie in Abschnitt 1.4 beschrieben.
HINWEIS: Für die Manipulation von Autophagie Fluss (in nicht-infizierten Zellen oder infizierten), erweitern medikamentöse Behandlung mit Rapamycin (20 nM) oder Bafilomycin (160 nM) von 4 bis 12 Stunden.
- Western Blot
HINWEIS: autophagische Aktivität kann durch Messung der Protein-Ebene Autophagozytose Marker wie p62 und LC3 quantifiziert werden.- Nach der gewünschten Inkubationszeit, sammeln und Lyse der Zellen für Immunoblotting. Führen Proteinextrakte auf 8, 10, oder 14% Acrylamid-Gele.
- Autophagischen Fluss, dh. die Rate der Autophagie, wie in 21,22 beschrieben, analysiert werden.
- Mikroskopische Bildgebung und Quantifizierung
- Mit Hilfe eines Epi-Fluoreszenz oder konfokalen Mikroskop und einem 63X oder 100X Objektive, die Wirkung der siRNA oder medikamentöse Behandlung auf Shigella-Infektion kann durch quantitative Mikroskopie ausgewertet werden (dh das Zählen von Autophagosomen, septin Käfige und Aktin Schwänze), wie in Abschnitt 1.5 beschrieben und in den 2A und 2B gezeigt.
3. In-vivo-Imaging von S. flexneri Wechselwirkungen mit Autophagie und dem Zytoskelett
HINWEIS: Der Zebrafisch-Modell von Shigella-Infektion kann verwendet werden, um septin Käfighaltung und Autophagie in vivo 19 zu untersuchen.
- Bereiten S. flexneri
- Kultur S. flexneri, wie in Abschnitt 1.1 beschrieben.
- Bei OD 600 = 0,3-0,6, Spin 8 ml Bakterien Subkultur bei 1.000 g für 10 min. Waschen des Pellets mit 1x PBS und Zentrifuge bei 1000 g für 10 min.
- Das Pellet in 80 ul 0,1% Phenol rot 1x PBS auf ~ 2.000 Bakterien / nl erhalten. Halten Sie die bactErial Vorbereitung auf Eis zu verlangsamen Wachstum.
Hinweis: Das Hinzufügen Phenolrot wird helfen, den Impfstoff bei der Injektion in die Larven zu visualisieren.
- Bereiten Zebrafisch-Larven zur Injektion
HINWEIS: Zebrafische werden als Eier gelegt und werden als Embryonen, bis 72 Stunden nach der Befruchtung, wenn sie Larven genannt identifiziert.- Züchten erwachsenen Zebrafisch wie in Westerfield 23, indem 4 Rüden und 8 Hündinnen beschrieben (in der Regel ein Verhältnis 2: 1) in ein separates Aquarium mit der Unterseite mit Marmor bedeckt (das wird von Erwachsenen essen die Eier hervorgebracht zu verhindern). Alternativ legen Eiersammlung Körbe in den Zuchtbecken in der Nacht zuvor.
HINWEIS: Die Eier werden befruchtet ~ 30 min nach gehen die Lichter an im Zebrafisch-Anlage 23, und sollte so schnell wie möglich gesammelt werden, um Schimmelbildung zu verhindern. Eiersammlung Körbe dienen, um die Eier zu sammeln, so dass sie leicht geerntet werden können und auch die Eier zu schützen, von Erwachsenen. - Sammeln Sie die Embryos und reinigen Sie sie durch Waschen in Embryo-Medien (E2) mit 0,003% Bleichmittel für 10 min. E2 mit Bleichmittel zu entfernen, waschen Embryonen 5x in E2-Medium, und wachsen die Embryonen in 10 cm Petrischale (100 Embryonen / 50 ml E2 Medium) bei 28 ° C.
- Wenn Embryonen oder Larven für die Mikroskopie-Studien bei 24 Stunden nach der Befruchtung verwendet werden, fügen 0,003% N-Phenylthioharnstoff an die E2-Medium zu Melanisierung verhindern. Halten Sie die Embryonen bei 28 ° C für eine normale Entwicklung.
HINWEIS: Zebrafisch-Larven sind bereit für die Infektion bei 72 Stunden nach der Befruchtung. - Zur Infektion und Mikroskopie Verfahren, betäuben Zebrafisch-Larven in 200 g / ml Tricaine in E2.
- Züchten erwachsenen Zebrafisch wie in Westerfield 23, indem 4 Rüden und 8 Hündinnen beschrieben (in der Regel ein Verhältnis 2: 1) in ein separates Aquarium mit der Unterseite mit Marmor bedeckt (das wird von Erwachsenen essen die Eier hervorgebracht zu verhindern). Alternativ legen Eiersammlung Körbe in den Zuchtbecken in der Nacht zuvor.
- Vorbereitung der Zebrafisch-Larven für intravenöse und lokale Infektion
HINWEIS: Um Zebrafisch Überleben während Shigella-Infektion zu bewerten, führen Schwanz intravenöse Injektionen. Um die Rekrutierung von septin und Autophagie Marker Shigella visualisieren, durchführen Infektion an lokalisierten Websites wie der Schwanz Muskel.- Für eine Schwanz intravenöse Injektion, positionieren Sie den narkotisierten Larven seitlich mit Blick auf die Nadel der Rückenseite. Wie in 3A gezeigt, legen Sie die Nadelspitze in der Nähe (posterior) an der urogenitalen Öffnung, mit dem Ziel für die Schwanzvene und durchbohren die Haut und liefern die gewünschten Bakteriendosis (Injektionsvolumen 1-5 nl).
HINWEIS: Die intravenöse Infektion ist schwierig zu führen und wird mehrere Wochen Training nehmen wohl mit diesem Verfahren zu bekommen. Einspritzen von Phenolrot (ohne Bakterien) für die Ausbildung wird helfen, die Injektionsstelle richtig zu beurteilen.
HINWEIS: Bei der Shigella wurden dosisabhängige Experimente gezeigt, dass eine geringe Dosis der Infektion (<1.000 CFU) wird innerhalb von 48 h frei, und eine hohe Dosis der Infektion (> 4.000 CFU) zu Mortalität innerhalb von 48 h 19 auszurichten. - Für einen Schwanz Muskel-Infektion, positionieren Sie den narkotisierten Larven, wie in Abschnitt 3.3.1 beschrieben. Wie in 3A gezeigt, legen Sie die Nadel vorsichtigy über Muskel Somiten (dh Segmente der Skelettmuskulatur) und injizieren ein kleines Volumen (dh., 1 nl) von Bakterienpräparat.
- Für eine Schwanz intravenöse Injektion, positionieren Sie den narkotisierten Larven seitlich mit Blick auf die Nadel der Rückenseite. Wie in 3A gezeigt, legen Sie die Nadelspitze in der Nähe (posterior) an der urogenitalen Öffnung, mit dem Ziel für die Schwanzvene und durchbohren die Haut und liefern die gewünschten Bakteriendosis (Injektionsvolumen 1-5 nl).
- Die intravenöse Injektion von Bakterien in Larven
- Ziehen Borosilikatglas Mikrokapillaren wie in 24 beschrieben.
- Verbinden Nadel an den Inhaber der dreidimensionalen Grobhand Manipulator und brechen die Nadelspitze mit feinen Pinzette.
- , Um die Nadel zu laden, einen Tropfen Bakterienkultur auf einem Deckglas. Schalten Sie die Mikroinjektor und Gasflasche, leicht tauchen die Nadelspitze in den Tropfen, und füllen Sie die Nadel mit der gewünschten Menge an Bakterienpräparat.
- Um das Injektionsvolumen zu kalibrieren, einen Tropfen Mineralöl auf einem Deckglas und spritzen die Bakterienpräparat. Messung des Durchmessers der Tropfen mit einem Mikrometer und die Berechnung der eingespritzten Volumen [V = (4/3) pi; r 3].
HINWEIS: Die Verwendung von Injektions Einstellungen 40 psi und 50 ms mit einer bacterial Vorbereitung wie in Abschnitt 3.1 beschrieben wird, geben ~ 2.000 KBE / nl. - Bereiten Sie die Einspritzplatte mit einer Kunststoffform wie in Wester 23 beschrieben.
- Übertragen die Larven an der Einspritzplatte und legen Sie sie mit einem feinen Pinsel. Orient und injizieren die Larven, wie in Abschnitt 3.3.1 beschrieben.
- Für die Beurteilung der Überlebenszebrafisch, Transfer infiziert Larven einzeln in 24-Well-Platten in 1 ml E2 / Vertiefung und Inkubation bei 28 ° C. Überwachen Sie die infizierten Larven täglich für die nächsten 2-5 Tage und Grundstück Überleben über die Zeit (3B).
- Plating Zebrafisch-Larven für bakterielle Quantifizierung
HINWEIS: Arbeiten unter einer sterilen Haube, um eine Kontamination zu vermeiden.- Um die Anzahl der Bakterien (zum Zeitpunkt 0 h nach Infektion) und für bakterielle Quantifizierung in den gewünschten Zeitpunkten in den Fisch eingespritzt zu bewerten, zu opfern Zebrafisch-Larven mit einer Überdosis Tricaine (200-500 mg / L). Zeigen einzelnen Larven in 1,5 ml polypropylene Mikrozentrifugenröhrchen mit 200 ul 0,1% Octylphenol-Ethylenoxid-Kondensat 1x PBS und mechanisch mit einem Pistill homogenisiert.
HINWEIS: Um die Keimbelastung in der Einspritzvolumen bestätigen, Pumpe eine gleiche Dosis in einen sterilen 1x PBS Tropfen und Platte es aus. - Machen Sie eine serielle Verdünnung der Zebrafisch-Larven Homogenate in sterilem Wasser und Platte auf Lysogenie Brühe (LB)-Agar-Platten. Larven kann alternativ auf Kongorot TCS-Platten werden zwischen Shigella diskriminieren nachdem behielt die virulenten Plasmid oder nicht.
HINWEIS: Platte 3 oder mehr nicht-infizierten Fische als Kontrolle, um den Status des Zebrafisch-Larven für die Infektion verwendet überprüfen. - Nach Inkubation über Nacht der Platten bei 37 ° C, zu zählen Bakterien-Kolonien. Wie in 3C gezeigt ist, repräsentieren unter Verwendung einer logarithmischen Skala.
HINWEIS: Bakterienbelastung während der Infektion von Zebrafisch-Larven können auch mit fluoreszenzmarkierten Shigella und mikroskopische i visualisiert werdenMaging, wie in Abschnitt 3.7 oder 3.8 (3D) beschrieben.
- Um die Anzahl der Bakterien (zum Zeitpunkt 0 h nach Infektion) und für bakterielle Quantifizierung in den gewünschten Zeitpunkten in den Fisch eingespritzt zu bewerten, zu opfern Zebrafisch-Larven mit einer Überdosis Tricaine (200-500 mg / L). Zeigen einzelnen Larven in 1,5 ml polypropylene Mikrozentrifugenröhrchen mit 200 ul 0,1% Octylphenol-Ethylenoxid-Kondensat 1x PBS und mechanisch mit einem Pistill homogenisiert.
- Zebrafisch-Larven Immunfärbung
- In gewünschten Zeitpunkten, zu opfern die Larven mit einer Überdosis von Tricaine. Sammeln der Fische in 1,5 ml Polypropylen-Mikrozentrifugenröhrchen (10 bis 20 Larven / Röhrchen).
- Befestigen Sie die Larven mit 4% Paraformaldehyd mit 0,4% Octylphenol Ethylenoxidkondensat in 1x PBS und Inkubation in einem Orbital Rührwerk (bis Larven Clustering zu vermeiden) für 2 Stunden (bei Raumtemperatur) oder über Nacht (bei 4 ° C).
HINWEIS: Die Elektronenmikroskopie kann für ultrastrukturelle Analysen der infizierten Larven Zebrafisch verwendet werden. In diesem Fall sollte anästhesiert Embryonen nach Mostowy et al 19 fixiert und verarbeitet werden. - Wasch 3x in 1x PBS 0,4% Octylphenol-Ethylenoxid-Kondensat für 5 min und dann in Blockierungslösung (10% fötales Kälberserum, 1% DMSO, 0,1% Polyoxyethylensorbitanmonolaurat in 1x PBS) für 1 h bei Raumtemperatur zu blockieren.
- DiLaute der primäre Antikörper in Blockierungslösung. Fügen Larven verdünnten primären Antikörper und Inkubation über Nacht bei 4 ° C in einem Orbital Rührwerk. Verwenden primären Antikörper, wie in Abschnitt 1.4.3 beschrieben.
- Für 15 min in 0,1% Polyoxyethylensorbitanmonolaurat 1x PBS bei Raumtemperatur waschen die Larven 4x.
- Verdünnen Sie die sekundären Antikörper in Blockierungslösung. Fügen Larven verdünnt sekundären Antikörper und Inkubation über Nacht bei 4 ° C in einem Orbital Rührwerk. Verwenden Sie die gleichen Sekundärantikörper und Phalloidin, wie in Abschnitt 1.4.4 beschrieben.
- Wasch 4x für 15 min in 0,1% Polyoxyethylensorbitanmonolaurat 1x PBS bei Raumtemperatur. Zur Färbung von Wirtszellkerne hinzuzufügen DAPI (150 nM Endkonzentration) während der ersten dieser 15 minütigen Waschungen.
- Für die Erhaltung der fluoreszenzmarkierten Larven, Inkubation sie schrittweise in einem Glycerin-Gradienten von 15, 30, 60, und 80% in 1x PBS und 0,1% Polyoxyethylensorbitanmonolaurat für 2 Stunden (verwässert bei Raum Temperamentratur) über Nacht (4 ° C).
HINWEIS: Bunt Larven kann für lange Zeiträume gelagert werden, in 80% Glycerin bei 4 ° C (zB 4 Monate.).
- Mikroskopische Imaging von Festzebrafisch-Larven
- Übertragen festen Glycerin eingebettet Larven zu einem kleinen Tropfen von 80% Glycerin in einer 35 mm Petrischale (für Stereomikroskopie) oder Vollglasbodenschale (für die konfokale miscopy).
- Nehmen Sie Z-Stapel-Bild-Serie von infizierten Larven und die Bilder zu verarbeiten, wie erforderlich.
- Verwenden Sie ein Epifluoreszenz- oder konfokalen Mikroskop und ein 10X oder 20X Objektiv für Abbildungs gesamten Organismus. Dann mit einem konfokalen Mikroskop und einem 40X, 63X oder 100X Ziel, einzelne Zellen sichtbar zu machen und die Rekrutierung von Autophagie und Zytoskelett Marker auf einzelne Bakterien in vivo 19 (4A und 4B).
HINWEIS: Infect Fisch in den Schwanz Muskel und montieren in Glycerin flach entlang der Unterseite der Glasbodenschale zu ermöglichen easy Fokus.
- Leben mikroskopischen Abbildung von Zebrafisch-Larven infiziert
HINWEIS: Die Larven sind optisch zugänglich ist, können dadurch in vivo Autophagosomen mit dem GFP-Lc3 Zebrafisch transgenen Linie 25 dargestellt werden. Zebrafisch-Larven infizieren, wie in Abschnitt 3.3 beschrieben und montieren wie in diesem Abschnitt beschrieben.- Bereiten niedrig schmelz 1% Agarose (LMA) in E2 nehmen und auf 35-37 ° C abkühlen, um Larven Schaden / Tötung zu vermeiden. Verteilen Tropfen LMA in einer 35 mm Petrischale (für Stereomikroskopie) oder Vollglasbodenschale (für die konfokale Mikroskopie).
- Transfer betäubt Zebrafisch-Larven einzeln (mit so wenig Wasser wie möglich) an die LMA fällt. Orient-Larven in die gewünschte Position mit einem Pinsel und warten, bis die Agarose zu verfestigen.
- Decken Sie die ganze Schalenoberfläche mit LMA und Überlagerung mit E2, die 200 ug / ml Tricaine, um die Vorbereitung vor dem Austrocknen zu vermeiden und ermöglichen Fische Sauerstoff aus dem Wasser austauschen.
- Verwenden Sie ein Epifluoreszenz- oder konfokalen Mikroskop und ein 10X oder 20X Ziel für die Abbildung des gesamten Zebrafisch-Larven. Verwenden Sie ein konfokales Mikroskop und einem 40X, 63X oder 100X Ziel, um bakterielle authopagosomes sichtbar zu machen (dh, GFP-Lc3 + ve Vakuolen umliegenden Shigella) in vivo.
- Nehmen Sie ein Z-Stapel von infizierten Larven im Laufe der Zeit (zB., Alle 2 min über mehrere Stunden), um Autophagosomen visualisieren und ihre Dynamik, in Echtzeit.
4. Funktionsanalyse von Autophagie und dem Zytoskelett In Vivo
HINWEIS: Die Auswirkungen der pharmakologischen und genetischen Störungen der Autophagie auf den Verlauf der Infektion kann bei der Ganztierebene überwacht werden, und auf der Ebene der einzelnen Zelle.
- Autophagie Manipulation durch Morpholino Injektion
- Rekonstituieren Morpholino-Oligonukleotide in sterilem Wasser zu einer Stammlösung von 1 mM unter Erwärmen bei 65 ° C für 10 min. Speicherbei Raumtemperatur.
HINWEIS: Morpholino-Oligonukleotid-Injektionen müssen in 1-4 Zellstadium Embryonen durchgeführt werden. - Vorbereitung Morpholino-Oligonukleotid Arbeitslösung mit sterilem 0,1% Phenolrot in Dulbeccos phosphatgepufferter Kochsalzlösung. Legen Sie die Nadel, wie in Abschnitt 3.4.2 beschrieben. Kann Morpholino Oligonukleotid Injektionsvolumen kalibriert werden, wie in Abschnitt 3.4.3 beschrieben.
HINWEIS: Phenolrot wird helfen, die eingespritzte Volumen zu visualisieren. - Bereiten Sie eine Embryo-Positionierung Kammer (dh., Einen Objektträger geklebt mit Sekundenkleber auf einer 10 cm Petrischale mit Deckel zugewandten Kanten der Nadel teilweise entfernt). Übertragen 1-4 Zell-Stadium Embryos in die Kammer mit einer kleinen Menge von Wasser und richten Sie sie mit einem feinen Pinsel.
- Durchdringen das Chorion und das Eigelb glatt. Einmal drinnen, das Pedal, um das gewünschte Volumen von Morpholino-Oligonukleotid-Lösung zu injizieren.
HINWEIS: Minimieren Sie das Injektionsvolumen auf 0,5 bis 2 nl; höheren Volumens than 5 nl kann Entwicklungsstörungen verursachen und erhöhen Ei-Sterblichkeit. - Nach der Mikroinjektion, sauber Embryonen (durch Bleichen, wie in Abschnitt 3.2 beschrieben) und Inkubation sie in einer Petrischale mit E2 bei 28 ° C.
- Infizieren 72 Stunden nach der Befruchtung Steuerung (dh Zebrafisch-Larven mit Steuer Morpholino Oligonukleotid injiziert) oder p62 morphants (dh., Zebrafisch-Larven mit p62 Morpholino Oligonukleotid injiziert) mit Shigella, wie in Abschnitt 3.4 beschrieben. Beurteilen Überleben und bakterielle Belastung für die nächsten 2-5 Tage, wie in Abschnitt 3.5 beschrieben. Bild fixiert Zebrafisch-Larven, wie in Abschnitt 3.7 beschrieben und in Abbildung 4C markiert ist, oder das Bild leben Zebrafischlarven, wie in Abschnitt 3.8 beschrieben.
Hinweis: Die effektive Dosis kann Morpholino-Oligonukleotid basierend auf ihre Effizienz zu Transkript Spleißen oder Proteintranslation (siehe Diskussion) hemmen bewertet werden.
- Rekonstituieren Morpholino-Oligonukleotide in sterilem Wasser zu einer Stammlösung von 1 mM unter Erwärmen bei 65 ° C für 10 min. Speicherbei Raumtemperatur.
Ergebnisse
Bei Infektion von Gewebekulturzellen in vitro, S. flexneri aus dem Phagosom entkommen und dringen in das Cytosol. Im Cytosol können Wirtszellen, die das Actin-basierte Motilität von Shigella durch Abschottung Bakterien in septin Käfige (1A) zu verhindern. Bakterien septin Käfigen eingeschlossenen kann auch durch Autophagozytose Marker p62 (1B) und LC3 (1C) gekennzeichnet werden. Diese Beobachtungen unterstreichen einen neuen Mechanismus der Immunabwehr, die Verbreitung von Krankheitserregern invasive beschränkt, und auch zeigen, neue Verbindungen zwischen Autophagie und dem Zytoskelett. Auffallend ist, dass die Erschöpfung der Autophagie Marker deutlich reduziert septin Käfighaltung von Bakterien (2A), und die Arbeit hat auch gezeigt, dass der Abbau der Käfighaltung septin Rekrutierung von Autophagie-Marker 8 deutlich reduziert. Somit sind zumindest im Fall von Shigella, septin Kranz und Autophagosom formation können als voneinander abhängige Prozesse betrachtet werden. Anderen zellulären Anforderungen Kompartimentierung von Shigella septin Käfige umfassen Aktin-Polymerisation und Aktomyosin Aktivität (2B).
Es gibt keine natürliche Mausmodell der Bakterienruhr, und Untersuchung von Shigella Pathogenese, septin Biologie und bakterielle Autophagie in vivo kann von einem neuen Tiermodell der Infektion, dem Zebrafisch-Larven 19 profitieren. Es ist möglich, Zebrafisch-Larven durch Injizieren Bakterien in verschiedenen anatomischen Stellen zu infizieren, wie intravenöse Injektionen für die Schwanz Überleben Experimente und Schwanzmuskel Injektionen in vivo-Mikroskopie (Abbildung 3A). Abhängig von der Dosis, S. flexneri injiziert im Zebrafisch-Larven können entweder innerhalb von 48 Stunden nach der Infektion gelöscht werden, oder kann in einer fortschreitenden und letztlich tödlichen Infektion (3B - 3D) führen. Shigella Virulenzfaktoren factors werden bei 28 ° C, die optimale Wachstumstemperatur von Zebrafisch exprimiert und Zebrafisch Infektion mit Shigella ist streng abhängig von seinem Typ III-Sekretionssystem (T3SS) 19, eine wesentliche Determinante der Virulenz in der menschlichen Krankheit. Zusammengenommen zeigen diese Beobachtungen, dass der Zebrafisch-Larve eine wertvolle neue Host für die in vivo-Analyse von Shigella-Infektion.
Die optische Zugänglichkeit der Zebrafisch-Larven ermöglicht die Visualisierung von septin Käfighaltung in vivo (4A), eine Leistung, die noch nie zuvor mit Säugerwirt Modelle erreicht wurde. Um Beweise zu ergänzen, dass septin Käfige einschließen Bakterien Autophagie in vivo gezielt, kann man transgenen Zebrafischlarven infizieren, die GFP-Lc3 und beobachten Autophagie Marker Rekrutierung Shigella (4B). Für ultrastrucutral Analyse von Shigella Autophagosomen in vivo, elEctron Mikroskopie verwendet werden, um deutlich die cytosolische Sequestration von Bakterien durch Doppelmembran Vakuolen 19 werden. Autophagie wird als eine Schlüsselkomponente der Zell-autonome Immunität und einem entscheidenden Abwehrmechanismus gegen Bakterien intracytosolic 14-16 angesehen. Autophagie-Funktion in vivo zu charakterisieren, kann p62 Morpholino-behandelten Zebrafisch-Larven eingesetzt werden. Im Unterschied zur Kern Autophagie Maschinen [zB., Die Autophagie 36 verwandte Proteine (ATG) 26], ist p62 nicht essentiell für die Entwicklung von Wirbeltieren und damit 27 Zebrafisch-Larven können in der Regel vor der Infektion zu entwickeln. Auffallend ist, dass p62-verarmten Larven mit S. beimpft flexneri Ergebnis signifikant erhöhte Sterblichkeit und eine erhöhte bakterielle Belastung 19. In Abstimmung mit in-vitro-Arbeiten zeigen, dass septin Kranz ist interdependent mit Autophagosom Bildung 7,8 wird septin Rekrutierung Shigella deutlich in p62-verarmten Larven reduziert ( 4C). Diese Daten zeigen, daß Zebrafisch Überleben hängt von p62-vermittelten Autophagozytose intrazelluläre bakterielle Infektion zu kontrollieren.
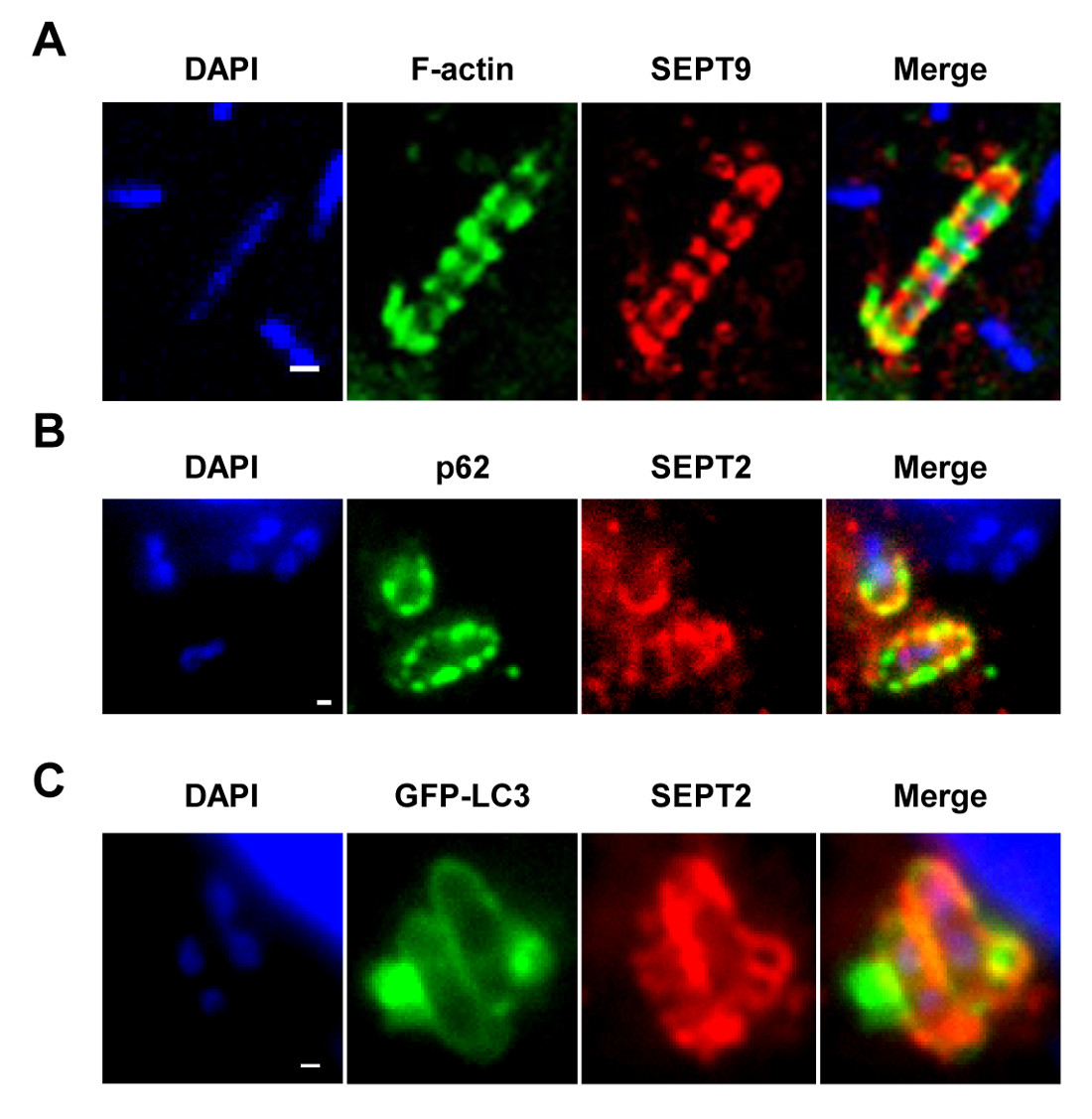
Abbildung 1. Die septin Käfig in vitro. (A) HeLa-Zellen wurden mit S. infiziert flexneri 4 h 40 min, fixiert, mit Antikörpern gegen SEPT9 und Phalloidin markiert und durch konfokale Mikroskopie abgebildet. Maßstab wurden 1 um. (B) HeLa-Zellen infiziert mit S. flexneri 4 h 40 min, fixiert, mit Antikörpern gegen p62 und SEPT2 beschriftet und durch Fluoreszenzmikroskopie abgebildet. Maßstab wurden 1 um. (C) HeLa-Zellen mit GFP-ATG8 / LC3 transfiziert, mit S. infiziert flexneri 4 h 40 min, fixiert, mit Antikörpern gegen SEPT2 von Fluoreszenzlicht km markiert und bebildertMikroskopie. Maßstabsleiste, 1 um. Diese Zahlen wurden von Mostowy et al 7 modifiziert.
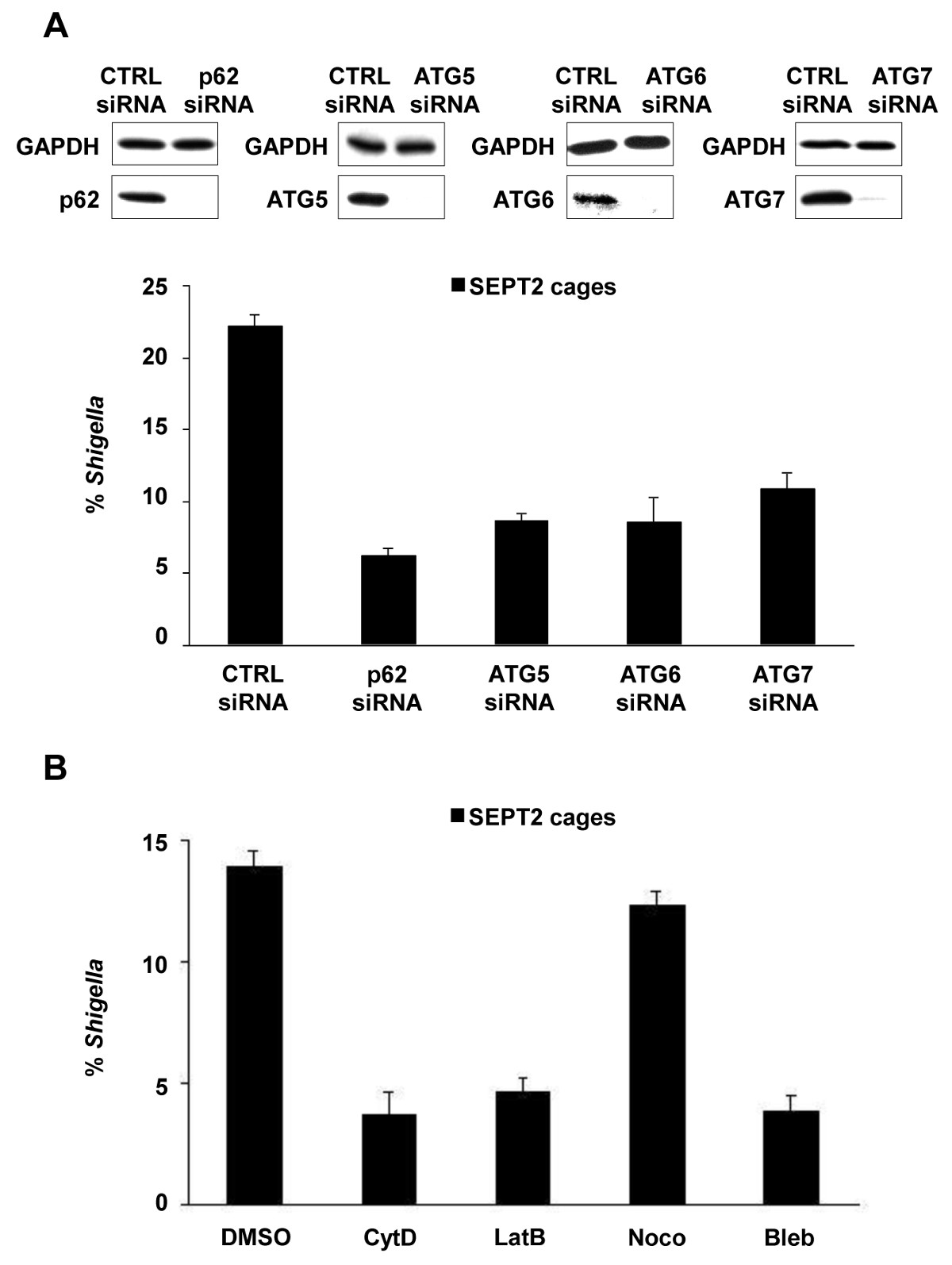
Abbildung 2. Cellular Anforderungen für Shigella -septin Käfig Bildung. (A) HeLa-Zellen wurden mit Kontroll behandelt (CTRL), p62, ATG5, ATG6 oder ATG7 siRNA. Ganz Zelllysaten von siRNA-behandelten Zellen wurden für GAPDH, p62, ATG5, ATG6 oder ATG7 immungeblottet, um die Effizienz von siRNA Erschöpfung (oben) zeigen. siRNA-behandelten Zellen wurden mit S. infiziert flexneri 4 h 40 min, festgelegt, und für die quantitative Mikroskopie markiert. Graphen (unten) stellen den Mittelwert ± SEM% innerhalb von Shigella SEPT2 Käfige aus n ≥3 Experimente pro Behandlung. (B) HeLa-Zellen wurden mit S. infiziert flexneri, mit DMSO behandelt, Cytochalasin D (CytD), Latrunculin B (LATB), Nocodazol (Noco) oder blebbistatin (Bleb) und nach 4 h 40 min wurden fixiert und für die quantitative Mikroskopie bezeichnet. Diagramme stellen den Mittelwert ± SEM der% Shigella innerhalb SEPT2 Käfige aus zwei unabhängigen Experimenten pro Behandlung. Diese Zahlen wurden aus Mostowy et al 7 geändert.
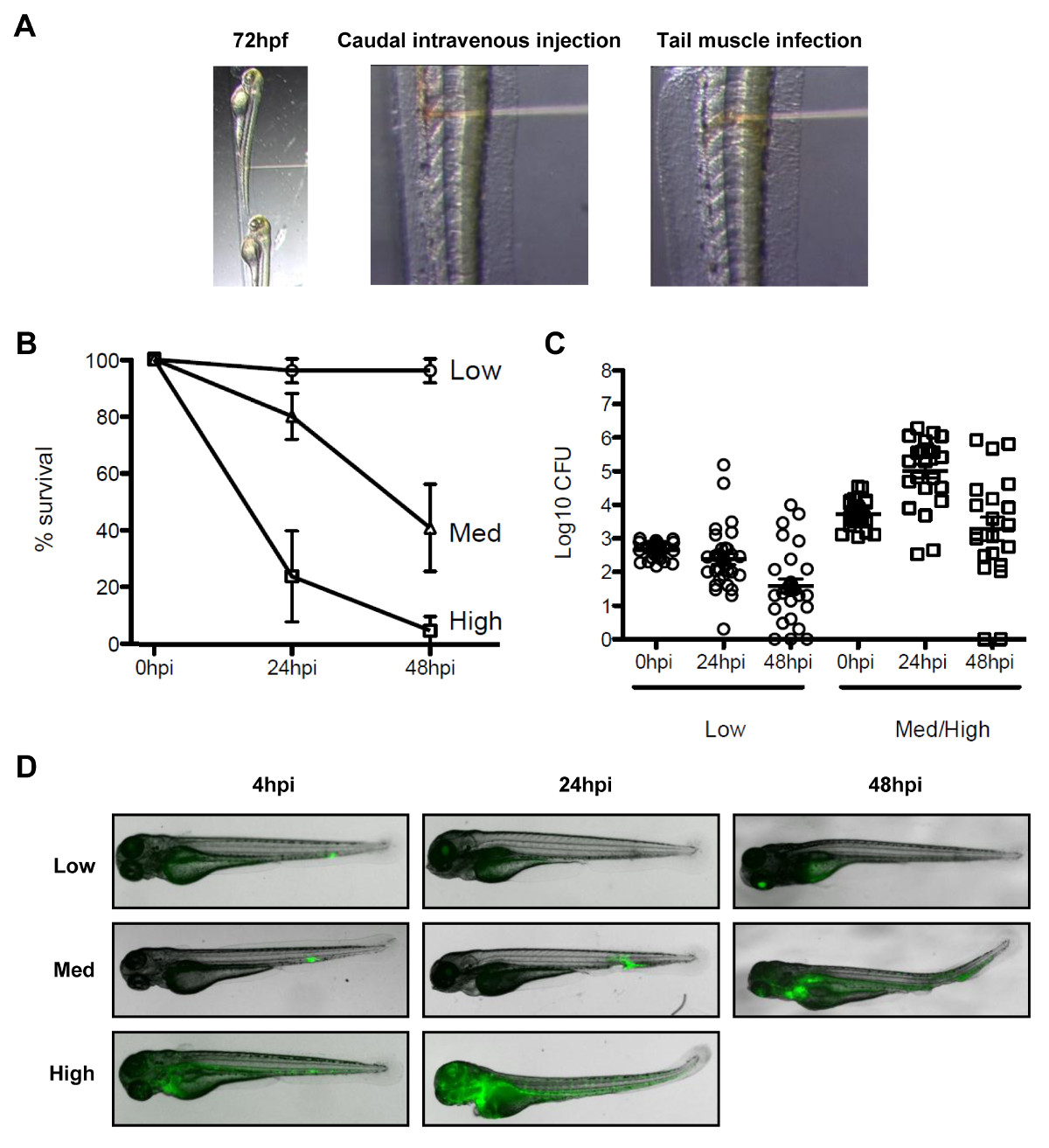
Abbildung 3. Der Zebrafisch-Modell von Shigella-Infektion. (A) Bilder, um die Orientierung des Zebrafisch-Larve unter dem Stereomikroskop zu veranschaulichen. (Links) Zebrafisch-Larven 72 Stunden nach der Befruchtung wurden seitlich in der Einspritzplatte mit ihrer Rückenseite nach der Injektionsnadel positioniert. (Mitte) Infektion der Blutbahn wurde von inj durchgeführtektierende die Bakterien (rot-Lösung) in die Schwanzvene, hinter der urogenitalen Öffnung. (Rechts) Infektion in den Schwanz Muskel wurde durch Injektion der Bakterien (rote Lösung) über einen Somitengeführt. (B) Überlebenskurven von 72 Stunden nach der Befruchtung Larven mit verschiedenen Dosen von S. spritzt flexneri und bei 28 ° C für 48 Stunden nach der Infektion inkubiert. Die effektive Impfstoff wurde entsprechend niedrig (<10 3 CFU, offene Kreise), mittlere (~ 4 x 10 3 CFU, offene Dreiecke) oder hoch (~ 10 4 CFU, offene Quadrate) eingestuft. Bedeuten% ± SEM (horizontale Balken) von n ≥3 Experimente pro Inokulum Klasse. (C) Aufzählung von lebenden Bakterien in Homogenaten aus einzelnen Larven zu verschiedenen Zeiten nach der Infektion durch Ausstreichen auf LB gemessen Hinweis, nur Larven mit der Infektion sind in Aufzählung Analyse einbezogen überlebt. Mittelwert ± SEM (horizontale Balken) ebenfalls dargestellt. (D) Verteilung der GFP-Shigella bestimmt durchLive-Bildgebung mit einem fluoreszierenden Stereomikroskop zu verschiedenen Zeiten nach der Infektion mit einem niedrigen, mittleren oder hohen Dosis Impfstoff (Schwanz intravenöse Injektionen). Overlay-Transmissionsbild (grau) und GFP-Fluoreszenz (grün) (B) -. (D) Diese Zahlen wurden von Mostowy et al 19 geändert.
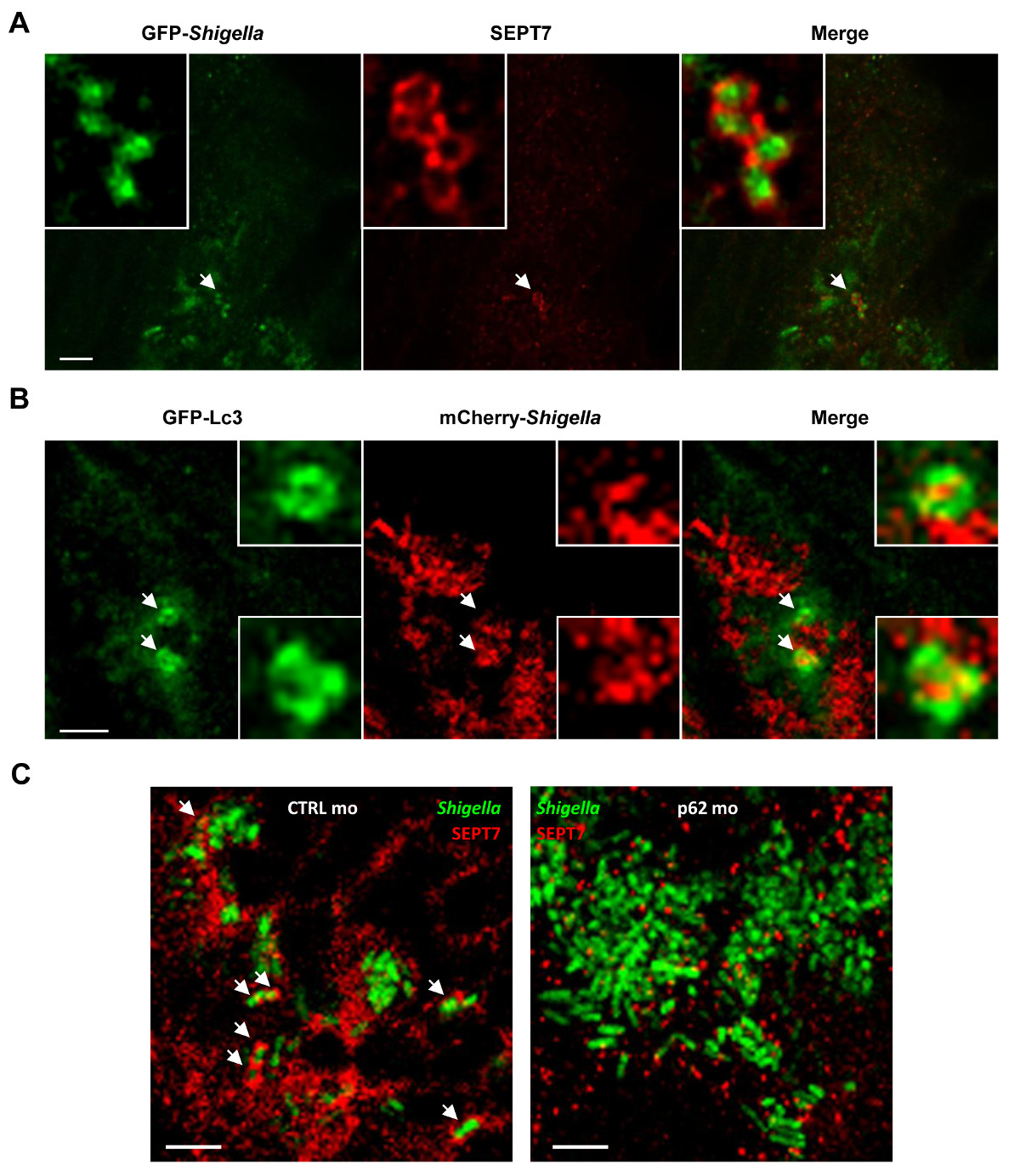
Abbildung 4. Die Zellbiologie der Shigella-Infektion in vivo. (A) Zebrafisch-Larven wurden in den Schwanz Muskel mit GFP-Shigella (niedrige Dosis) für 24 Stunden, fest, mit Antikörpern gegen SEPT7 (rot) und GFP-markierten (grün infiziert ) und durch konfokale Mikroskopie abgebildet. Maßstab wurden 5 um. (B) GFP-Lc3 Zebrafisch-Larven mit mCherry- Shigella (mittlere Dosis) für infiziert4 h fixiert, mit Antikörpern markiert gegen mCherry (rot) und GFP (grün) und durch konfokale Mikroskopie abgebildet. Oder p62 (rechtes Bild) wurden mit GFP-Morpholinos Shigella 4 Stunden (mittlere Dosis) infiziert, fixiert, mit Antikörpern gegen SEPT7 (beschriftet. Entweder mit Steuer (linkes Bild CTRL) Maßstab, 1,5 um (C) Zebrafisch-Larven behandelt rot) und GFP (grün) und durch konfokale Mikroskopie abgebildet. Pfeile markieren einige Beispiele von Shigella in septin Käfige (CTRL) oder nicht eingeschlossen (p62 abgereichertem) ein 4 Stunden nach der Infektion. Maßstabsleiste, 5 um. Diese Zahlen wurden von Mostowy et al 19 geändert.
Diskussion
Bei der Überwachung von Autophagie und das Zytoskelett in vitro unter Verwendung von Gewebekulturzellen, können die in den Abschnitten 1 und 2 beschriebenen Protokolle für eine Vielzahl von Gewebekulturzelltypen angewendet werden. Darüber hinaus, um die Autophagie folgen (zB ATG8 / LC3 + ve Autophagosomen) und Zytoskelett (zB., Actin Schwänze, septin Käfige) Dynamik in Echtzeit während der Infektion mit Shigella Live-Bildgebung können Gewebekulturzellen transient mit GFP transfiziert werden, RFP- oder GFP-markierten Konstrukte wie zuvor beschrieben, 7,8. (. Dh in der Regel für die Echtzeit-Analyse bedenkt, dass Shigella können 5-30% der HeLa-Zellen bei 100 eindringen wünschenswert: 1 MOI), den Anteil der Zellen, die durch Shigella infiziert zu erhöhen, direkt hinzufügen 400 ul Shigella (OD 600 = 0,3 0,6), um Zellen in 2 ml MEM (Serummangel) und warten Sie mindestens 1,5 Stunden nach der Infektion für eine ausreichende Bakterieneintrag, die Flucht aus dem Phagosom, Replikation, autophagy Anerkennung und septin Käfighaltung. Alternativ kann man die M90T Shigella AFAI Stamm, der das Adhäsin AfaE exprimiert und haben viel höhere Invasion Fähigkeiten in epithelialen Zellen im Vergleich zu dem Stamm 28 M90T verwenden. Zu beachten ist, die M90T AFAI Stamm wurde noch nicht in vivo unter Verwendung von Zebrafisch getestet. Platten von Shigella-Kolonien können bei 4 ° C für 2-3 Tage gehalten und für verschiedene Experimente verwendet werden. Im Laufe der Zeit wurden Kolonien von Shigella, die die Virulenz-Plasmid können die Kongorot absorbieren und erscheinen verloren haben, ihre Virulenz-Plasmid beibehalten haben. Aus diesem Grund empfehlen wir, frische Bakterienbestände verwenden, wenn möglich.
Bei der Überwachung der Zellbiologie der Infektion in vivo, in den Abschnitten 3 und 4 verwenden Wildtyp-AB-Linie Zebrafisch beschriebenen Protokollen. Um Shigella -leukocyte Wechselwirkungen zu überwachen, können transgenen Zebrafischlinien verwendet werden, zB MPX: GFP oder Lyz: DsRed, um visuelleize Neutrophilen 19,29,30 oder MPEG1: mCherry zu Makrophagen 19,31 visualisieren. Autophagie in vivo sichtbar zu machen, kann das GFP-transgenen Linie Lc3 Zebrafisch 19,24 verwendet werden, wie in Abschnitt 3.8 beschrieben.
Autophagie in vivo zu stören, hat die effektive Dosis Morpholino Oligonukleotid experimentell geprüft werden auf der Grundlage ihrer Effizienz Transkript Spleißen oder Proteintranslation zu hemmen. Es ist ratsam, eine Titration Experiment durchzuführen und die Erschöpfung durch RT-PCR (für Splice Morpholino-Oligonukleotid) bestätigen oder durch SDS-PAGE (für die translationale Morpholino-Oligonukleotid) 32. RNA-Isolierung aus Zebrafisch Embryonen oder Larven können mit Hilfe Guanidiniumthiocyanat-Phenol-Chloroform-Extraktion werden. Um Protein aus Zebrafisch-Larven (8 bis 15 Larven / Rohr) zu extrahieren, mechanisch zu homogenisieren mit einem Stößel in 200 ul Lysepuffer (1 M Tris, 5 M NaCl, 0,5 M EDTA, 0,01% Octylphenol Ethylenoxid Kondensate, und Protease-Inhibitor). Zentrifugenröhrchen bei 19.000 × g bei 4 ° C für 15 min und den Überstand in ein neues Röhrchen. Hinzufügen Laemmli-Puffer und Erwärmung der Probe bei 95 ° C für 15 min. Lysate können bei -80 ° C gelagert werden, bis sie benötigt, und kann durch Western-Blot wie in Abschnitt 2.3 beschrieben, bewertet werden.
Der Zebrafisch ist ein ausgezeichnetes Modell für die in vivo Anwendung Droge. Analyse mittels Morpholino-Oligonukleotide mit etablierten Medikamenten ergänzt werden, um die Autophagie (zB Rapamycin und Bafilomycin) zu manipulieren. Nicht infizierten und / oder infizierten Larven können mit Rapamycin (1,5 uM) oder Bafilomycin (80 nM) in E2 verdünnt und autophagischen Fluss kann durch Western-Blot wie in 25,33 beschrieben, bewertet werden behandelt werden. Die Folge der Autophagie Manipulation auf das Ergebnis der Infektion und das Überleben der infizierten Larven, wie in Abschnitt 3.5 beschrieben ausgewertet werden.
Neben dem Studium WirtszelleDeterminanten, in vitro und in-vivo-Protokolle können angewendet werden, um bakterielle Determinanten für die Autophagie Anerkennung erforderlich beurteilen, mit bakteriellen Mutanten-Stämme, die unterschiedlich von Autophagie erkannt werden, zB., Shigella ΔicsA (die Shigella Protein IcsA rekrutiert N-WASP und dann Arp2 / 3 für Aktin Schwanz und septin Käfig Bildung, in seiner Abwesenheit, in seiner Abwesenheit kann es keine Aktin-Schwänze, keine septin Käfige) und ShigellaΔicsB (Shigella vermeidet die Autophagie Antwort über das bakterielle Protein-Effektor ICSB, die die Einstellung von Autophagie Maschinen IcsA verhindert sein kann es mehr septin Käfige, mehr Autophagie) 7,8 sein.
Shigella keine natürliche Erreger der Zebrafisch und wächst optimal bei 37 ° C aufweist. Allerdings hat Arbeit, die Virulenzfaktoren für Shigella Invasion erforderlich gezeigt, die Flucht aus dem phagocytic Vakuole und Replikation in den cyTosol ausgedrückt werden und sind funktional in Zebrafisch-Larven bei 28 ° C 19. 28 ° C ist die am häufigsten verwendete Temperatur für Zebrafisch Aufzucht und Standardtemperatur auf Normal Zebrabärblingentwicklung 23 zu gewährleisten. Auffallend sind die großen Ereignisse, die zu pathogenen Bakterienruhr beim Menschen führen (dh Makrophagen-Zelltodes, Invasion und Vermehrung in Epithelzellen, Zell-zu-Zell-Ausbreitung, entzündliche Zerstörung der Wirts Epithel) treu in der Zebrafisch-Modell der Shigella-Infektion wieder 19.
Autophagie und Zytoskelett-Gene werden ubiquitär exprimiert und haben eine breite Palette von biologischen Funktionen. Maus-Studien haben gezeigt, dass Knockout von wesentlicher Autophagie 26 oder septin Gene 5 embryonal letalen gezeigt, und es ist wahrscheinlich, dass einige dieser Gene wird auch wichtig für die Zebrafisch-Entwicklung (sein, obwohl dieses Problem durch die Tatsache, dass mehrere Zebrafisch reduziert werden soll,paraloge Gene 33). Wenn ja, gibt es mehrere Alternativen, um dieses Problem, einschließlich (i) der Nutzung von pharmakologischen Reagenzien Autophagie und das Zytoskelett regulieren, (ii) Morpholinos können unten titriert werden, zu überwinden, kann (iii) Knockout von Genen, die für nur bestimmte Zelle ausgelegt werden Typen, und / oder (iv) Gene in autophagischen Erkennung beteiligt, die nicht wesentlich für Tier Entwicklung sind (zB., p62) kann ausgerichtet sein.
Während der Zebrafisch ist ein ideales Modellsystem, um die Autophagie und das Zytoskelett während Shigella-Infektion zu untersuchen, werden molekulare Werkzeuge derzeit fehlt. Das Feld muss neue Werkzeuge und Antriebs Zell-spezifische Expression der Proteine von Interesse zu generieren. Niederschlagen Ausdruck der Autophagie / Zytoskelett Gene werden neue Morpholino-Sequenzen erforderlich, und neue Methoden zur Genomtechnik (zB TALEN, CRISPR / Cas9) können ebenfalls verwendet werden. In der Zwischenzeit mehrere Werkzeuge zuvor für Mensch oder Maus-Studien erzeugtgleichermaßen für Zebrafisch arbeiten.
Die intrazellulären Bakterien S. flexneri hat als außergewöhnlichen Modellorganismus, um zentrale Fragen in der Biologie, einschließlich der Fähigkeit von Bakterien, die durch das Immunsystem erkannt werden 1,2 adressieren entstanden. Die Wirtszelle beschäftigt Septine auf die Motilität von S. beschränken flexneri und Ziel sie Autophagie, eine kritische Komponente der Zelle autonome Immunität 7,8. Diese Beobachtungen legen nahe, einen neuen Rahmen für die molekulare Autophagie und ihre Fähigkeit, Bakterien abgebaut zytosolischen studieren. Ein großes Problem ist jetzt vollständig entschlüsseln die molekularen und zellulären Vorgänge, und diese Ereignisse in vitro während bakterielle Infektion in vivo analysiert mit relevanten Tiermodellen validiert. Zu diesem Zweck hat der Zebrafisch als wertvolle neue Host für die Analyse von S. etabliert flexneri Infektion 19. Wechselwirkungen zwischen Bakterien und Wirtszellen können mit hoher Auflösung abgebildet werden, undder Zebrafisch-Modell sollte zum Verständnis der Zellbiologie von Shigella-Infektion in vivo nachzuweisen. Zebrafisch-Larven können verwendet werden, um die Rolle von bakteriellen Autophagozytose der Wirtsabwehr zu untersuchen, und die Arbeit hat gezeigt, dass die Störung Autophagozytose nachteilig in Reaktion auf Shigella Infektion 19 beeinflussen Host Überleben.
Die Beobachtungen aus der Studie von Shigella erzeugt, Septin Käfighaltung und Autophagie in vitro unter Verwendung von Gewebekulturzellen und in vivo mit Zebrafisch-Larven könnten grundlegende Fortschritte im Verständnis der Wirtsabwehr liefern. Sie könnten auch darauf hin, die Entwicklung neuer Strategien zur Bekämpfung von Infektionskrankheiten ausgerichtet.
Eine kritische Ziel dieses Berichts ist es, Sinn der molekularen und zellulären Vorgänge in vitro analysiert machen (dh Autophagie, Actin Schwänze, Septin Käfighaltung) während bakterielle Infektion in vivo im Rahmen einer entire Organismus, mit Zebrafisch-Larven. Wenn nicht mit Zebrafisch-Biologie und der Handhabung vertraut ist, kann man in die Tiefe Protokolle für die richtige Haltung Zebrafisch 23 und in vivo Analyse der Zebrafisch-Infektion 19,35 beziehen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Arbeit im Labor SM wird durch ein Wellcome Trust Forschung Career Development Fellowship [WT097411MA] unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Sigma-Aldrich | B1793 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Borosilicate glass microcapillars | Harvard Apparatus | 30038 | |
| Coarse manual manipulator | Narishige | M-152 | |
| Cytochalasin D | Sigma-Aldrich | C6762 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes | D1306 | |
| Dumont #5 fine tweezers | Fine Science Tools | 11254-20 | |
| Forchlorfeneuron | Sigma-Aldrich | 32974 | |
| Goat anti-mouse IgG (H+L) antibody | Molecular Probes | N/A | |
| Goat ant-rabbit IgG (H+L) antibody | Molecular Probes | N/A | |
| JetPEI transfection reagent | Polyplus transfection | 101-01N | |
| Latrunculin B | Sigma-Aldrich | L5288 | |
| LC3 antibody | Novus Biologicals | NB100-2220 | |
| Low melting agarose | Promega | V2111 | |
| MatTek glass bottom dish | MatTek corporation | P35G-1.0-14 | |
| MEM plus L-alanyl-L-glutamine | GIBCO | 41090028 | |
| MEM non-essential amino acids solution | GIBCO | 11140-035 | |
| Microinjector | Narishige | IM-300 | |
| Micropipette puller device | Sutter Instrument Co., Novato, | P-87 | |
| Mineral oil | Sigma-Aldrich | P35G-1.0-14 | |
| Monoclonal anti-tubulin, acetylated antibody | Sigma-Aldrich | T6793 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| N-phenylthiourea | Sigma-Aldrich | P7629 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Phalloidin | Molecular Probes | A12379 | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Protease inhibitor cocktail | Roche | 4693116001 | |
| p62/SQSTM1 antibody | Cliniscience | PM045 | |
| Rapamycin | Sigma-Aldrich | R8781 | |
| Sodium pyruvate | GIBCO | 11360039 | |
| Transfection reagent | Life Technologies | 12252-011 | |
| Vectashield hard set mounting medium containing DAPI | Vector Laboratories | H-1500 |
Referenzen
- Ashida, H., et al. Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr Opin Immunol. 23, 448-455 (2011).
- Phalipon, A., Sansonetti, P. J. Shigella's ways of manipulating the host intestinal innate and adaptive immune system: a tool box for survival. Immunol Cell Biol. 85, 119-129 (2007).
- Welch, M. D., Way, M. Arp2/3-mediated actin-based motility: A tail of pathogen abuse. Cell Host Microbe. 14, 242-255 (2013).
- Haglund, C. M., Welch, M. D. Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton. J Cell Biol. 195, 7-17 (2011).
- Mostowy, S., Cossart, P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 13, 183-194 (2012).
- Saarikangas, J., Barral, Y. The emerging functions of septins in metazoans. EMBO Rep. 12, 1118-1126 (2011).
- Mostowy, S., et al. Entrapment of intracytosolic bacteria by septin cage-like structures. Cell Host Microbe. 8, 433-444 (2010).
- Mostowy, S., et al. p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways. J Biol Chem. 286, 26987-26995 (2011).
- Mostowy, S., et al. Septins regulate bacterial entry into host cells. PLoS One. 4 (15), (2009).
- Mostowy, S., et al. Septin 11 restricts InlB-mediated invasion by Listeria. J Biol Chem. 284, 11613-11621 (2009).
- Phan, Q. T., et al. Role of endothelial cell Septin 7 in the endocytosis of Candida albicans. mBio. 4 (e00542-13), (2013).
- Mostowy, S., Cossart, P. Septins as key regulators of actin based processes in bacterial infection. Biol Chem. 392, 831-835 (2011).
- Levine, B., Mizushima, N., Virgin, H. W. Autophagy in immunity and inflammation. Nature. 469, 323-335 (2011).
- Randow, F., MacMicking, J. D., James, L. C. Cellular self-defense: how cell-autonomous immunity protects against pathogens. Science. 340, 701-706 (2013).
- Mostowy, S. Autophagy and bacterial clearance: a not so clear picture. Cell Microbiol. 2 (12063), (2012).
- Mostowy, S., Cossart, P. Bacterial autophagy: restriction or promotion of bacterial replication. Trends Cell Biol. 22, 283-291 (2012).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr Opin Immunol. 22, 10-19 (2010).
- Renshaw, S. A., Trede, N. S. A model 450 million years in the making: zebrafish and vertebrate immunity. Dis Model Mech. 5, 38-47 (2012).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. Plos Path. 9, e1003588 (2013).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Fixation and permeabilization of cells and tissues. Cold Spring Harb Protoc. , (2008).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 8, 445-544 (2012).
- Mizushima, N., Yoshimori, T., Levine, B. Methods in mammalian autophagy research. Cell. 140, 313-326 (2010).
- Westerfield, M. A guide for the laboratory use of zebrafish (Danio rerio). The Zebrafish Book. , (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. 61 (e3781), (2012).
- He, C., Bartholomew, C. R., Zhou, W., Klionsky, D. J. Assaying autophagic activity in transgenic GFP-Lc3 and GFP-Gabarap zebrafish embryos. Autophagy. 5 (4), 520-526 (2009).
- Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell. 147, 728-741 (2011).
- Komatsu, M., et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell. 131, 1149-1163 (2007).
- Nowicki, B., Coyne, K. E., Lublin, D. M., Nowicki, S., Hart, A. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. J Exp Med. 178, 2115-2121 (1993).
- Hall, C., Flores, M., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7 (42), (2007).
- Renshaw, S. A., et al. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, 2010-2010 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (9), (2009).
- He, C., Klionsky, D. J. Analyzing autophagy in zebrafish. Autophagy. 6, 642-644 (2010).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 25 (496 (7446)), 498-503 (2013).
- Levraud, J. P., Colucci-Guyon, E., Redd, M. J., Lutfalla, G., Herbomel, P. In vivo analysis of zebrafish innate immunity. Methods Mol Biol. 415, 337-363 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten