Method Article
Utilisation d'
Dans cet article
Résumé
Pour contrer la diffusion de l'agent pathogène, les cellules hôtes réorganisent leur cytosquelette de compartimenter les bactéries et d'induire l'autophagie. Utilisation de shigellose des cellules de culture de tissu, hôte et les déterminants de pathogènes sous-jacents de ce processus sont identifiés et caractérisés. En utilisant des modèles de poisson zèbre de shigellose, le rôle des molécules et des mécanismes découverts sont étudiés in vivo.
Résumé
Shigella flexneri est un pathogène intracellulaire qui peut échapper à phagosomes pour atteindre le cytosol, et polymériser l'hôte du cytosquelette d'actine pour promouvoir sa motilité et la diffusion. De nouveaux travaux ont montré que les protéines impliquées dans la motilité dépendant de l'actine sont également liés à l'autophagie, un processus de dégradation intracellulaire crucial pour l'immunité cellulaire autonome. Il est frappant, les cellules hôtes peuvent empêcher la motilité à base actine de S. flexneri la compartimentation des bactéries à l'intérieur de «cages septines» et en les ciblant sur l'autophagie. Ces observations indiquent que une compréhension plus complète de septines, une famille de protéines de liaison au GTP filamenteux, ouvrira de nouvelles perspectives dans le processus de l'autophagie. Ce rapport décrit les protocoles de surveiller les interactions autophagie cytosquelette causées par S. flexneri in vitro en utilisant des cellules de culture de tissus et in vivo en utilisant des larves de poisson zèbre. Ces protocoles permettent enquête de mechanis intracellulairesms qui contrôlent la dissémination bactérienne au niveau de l'organisme moléculaire, cellulaire, et ensemble.
Introduction
Shigella flexneri, une bactérie entéro-invasive à Gram négatif, ne peut échapper à phagosomes à le cytosol, et polymériser l'hôte cytosquelette d'actine pour échapper à la réponse immunitaire cytosoliques et promouvoir le mouvement intra et intercellulaire 1,2. En dépit de la connaissance de la base de la motilité actine in vitro 3,4, les mécanismes qui limitent la dissémination bactérienne in vivo n'ont pas été entièrement définies. Cela est essentiel pour une compréhension plus complète de l'immunité innée et la défense de l'hôte.
Septines, une famille de protéines hautement conservées parmi les métazoaires, est la guanosine triphosphate (GTP) liant le protéines qui s'assemblent en complexes hétéro-oligomériques et non polaires forment des filaments qui s'associent avec les membranes cellulaires et le cytosquelette 5,6. Des travaux récents ont découvert que les cellules hôtes infectées peuvent empêcher Shigella actine motilité base par des bactéries ciblées à compartimenter autophAGY intérieur «cages de septines», révélant le premier mécanisme cellulaire qui contrecarre l'actine motilité basé 7,8. Un large champ d'investigation se trouve maintenant dans «la biologie de septin et infection». ensemble de Septin, induite par une variété d'agents pathogènes (par exemple, la bactérie Listeria monocytogenes 7,9,10, Mycobacterium marinum 7,8, Candida albicans 11), peut apparaître comme une question clé dans la défense de l'hôte 5,12.
L'autophagie, un processus de dégradation intracellulaire hautement conservée, est considéré comme un élément clé de l'immunité cellulaire autonome en raison de sa capacité à fournir des bactéries cytosoliques vers le lysosome 13,14. Cependant, le rôle de l'autophagie bactérienne in vivo de restreindre ou de promouvoir la réplication bactérienne reste mal comprise 15,16. Le poisson zèbre (Danio rerio) a émergé comme un modèle vertébré pour l'étude des infections, car il est optiquement accessibleau stade larvaire, lorsque le système immunitaire inné est déjà fonctionnel 17,18. Des travaux récents ont caractérisé la sensibilité des larves de poisson zèbre à S. flexneri, un paradigme pour l'autophagie bactérienne 15, et a utilisé le modèle d'infection -zebrafish Shigella pour étudier la manipulation de l'autophagie pour la thérapie antibactérienne in vivo 19.
Ce rapport fournit de nouveaux outils et des analyses pour étudier S. interactions flexneri avec autophagie et le cytosquelette. Dans une première étape, les protocoles pour surveiller les interactions autophagie-cytosquelette sont décrits à l'aide de l'infection à Shigella lignée de cellules épithéliales humaines HeLa. Pour évaluer le rôle des interactions autophagie cytosquelette sur le processus d'infection à Shigella in vitro, les méthodes pour manipuler l'autophagie et les composants du cytosquelette (en utilisant siRNA ou réactifs pharmacologiques) sont fournis. De nouveaux travaux ont montré que l'utilisation infection à Shigella of larves de poisson zèbre, des tests similaires peuvent être appliquées à l'étude de la biologie de l'infection de cellules in vivo. Protocoles de préparer et d'infecter les larves de poisson zèbre sont détaillés, et d'évaluer la réponse de l'hôte à l'infection à Shigella in vivo, des protocoles pour déterminer la survie de l'hôte et de la charge bactérienne de larves infectées sont fournis. Méthodes pour surveiller le recrutement des marqueurs de septines et autophagie à Shigella (en utilisant soit les larves fixe ou vivant le poisson-zèbre) et aux méthodes de tester le rôle de ces processus in vivo [en utilisant des oligonucléotides morpholino (injectés dans 1-4 embryons au stade de cellules) ou des réactifs pharmacologiques ( ajouté directement à l'eau du bain poisson zèbre)] sont également discutés. Ce programme de travail devrait fournir des indications sur les mécanismes nécessaires pour le contrôle de l'infection par réponses de l'hôte cytosoliques.
Protocole
1. surveillance autophagie et le cytosquelette in vitro en utilisant des cellules de culture tissulaire
- Préparer S. flexneri
- Plate S. flexneri M90T (-type sauvage) de -80 ° C stock de glycérol sur un rouge Congo tryptique caséine soja (TCS) plaque de gélose. Incuber une nuit à 37 ° C. La même plaque peut être utilisée pour plusieurs expériences.
- Choisissez une colonie individuelle et de grandir dans 8 ml de milieu TCS dans un shaker nuit à 37 ° C.
REMARQUE: liaison Congo-rouge indique que le plasmide de virulence a été retenu. - Pour repiquer les bactéries de croissance exponentielle, inoculer TCS frais avec la culture bactérienne nuit à 1/80 de dilution et de grandir dans un shaker à 37 ° C à 600 OD = 0,3-0,6.
- Faites tourner la sous-culture bactérienne à 1000 g pendant 5 min. Laver le culot avec du MEM et centrifuger à 1000 g pendant 5 min. Reconstituer le culot dans du MEM à DO600 = 0,3-0,6.
- Préparer HeLa Cells pour infection
- Cultiver les cellules HeLa en "milieu complet", c'est à dire., MEM, plus L-alanyl-L-glutamine complétées avec 1 mM de pyruvate de sodium, une solution d'acides aminés non essentiels 0,1 mM, et 10% de sérum de veau foetal.
- Plaque de 1 à 1,5 x 10 5 cellules dans des plaques 6 puits ou de 24 48 heures avant le début de l'expérience. Plaque sur des lamelles de verre dans des plaques de 6 puits pour la microscopie, ou plaque de verre de 35 mm sur plats inférieurs à préparer pour l'imagerie en temps réel.
NOTE: (. Exemple, queues d'actine, les cages septines) Pour suivre l'autophagie (par exemple, ATG8 / LC3 + ve autophagosomes) et cytosquelette dynamique en temps réel lors de l'infection à Shigella en utilisant l'imagerie en temps réel, des cellules de culture de tissus peuvent être transfectées de façon transitoire en utilisant GFP, RFP- ou constructions CFP-marquées (voir Discussion).
- Infection
- Infecter les cellules avec 100: une multiplicité d'infection (MOI) de Shigella (DO600 = 0,3 à 0,6) dilué dans du MEM; ajouter directement dans les cellules HeLa plaqués en 6-wplaques aune 24 - 48 h avant l'infection (tel que décrit à la section 1.2) dans 2 ml de MEM (privées de sérum).
- Pour maximiser l'adhérence des bactéries aux cellules hôtes, des bactéries et des cellules de centrifugation à 700 g pendant 10 min à température ambiante. Après centrifugation, incuber pendant 30 min à 37 ° C, 5% CO 2 et de permettre l'infection de la parole.
- Laver les cellules infectées fois en milieu frais et incuber avec la gentamicine contenant un milieu complet (50 pg / ml, pour éliminer les bactéries extracellulaires) pour 1-4 heures en fonction de l'expérience.
- Fixation et de marquage des cellules HeLa infectées pour la microscopie
- Laver deux fois les cellules infectées avec du PBS 1x, et fixer pendant 15 minutes dans du paraformaldéhyde 4% dans du PBS 1x à température ambiante. Pour supprimer paraformaldéhyde, les cellules de lavage avec 2x 1x PBS.
- Incuber les cellules fixées dans 50 mM de chlorure d'ammonium pendant 10 min à température ambiante. Laver une fois avec PBS 1x, et perméabiliser les cellules pendant 4 min avec 0,1% de condensation d'oxyde d'éthylène octylphénol à la salle température.
REMARQUE: Alternatives à Octylphénol oxyde d'éthylène condensat pour perméabilisation, tels que la saponine ou le méthanol, peuvent être appliqués pour les différents préservation des structures cellulaires 20. - Laver les cellules en PBS 1x et incuber en chambre humide avec des anticorps primaires contre l'autophagie composants critiques (par exemple, p62 / SQSTM1) ou le cytosquelette d'septin (SEPT2, SEPT6, SEPT7, SEPT9, et SEPT11 sont exprimés dans les cellules HeLa) pendant 30 min (à température ambiante) à la nuit (à 4 ° C).
- Laver les cellules deux fois avec PBS 1x et incuber en chambre humide avec des anticorps secondaires, et de les étiqueter actine filamenteuse (F-actine) avec la phalloïdine, pendant 30 minutes (à température ambiante) à la nuit (à 4 ° C). Pour la coloration des noyaux cellulaires hôte ajouter 4 ", 6-diamidino-2-phénylindole (DAPI).
- Laver les cellules en PBS 1x et monter les lamelles de verre sur des lames en utilisant un milieu de montage.
- Imagerie microscopique des cellules HeLa infectées
- À l'image de l'infcellules échies utilisent une épifluorescence ou microscope confocal et un objectif 63X ou 100X pour identifier DAPI marqué Shigella.
NOTE: Comme le montrent les figures 1A - 1C, cages septines peuvent être visualisées sous forme de bague comme structures, ~ 0,6 m de diamètre, entourant les bactéries cytosoliques de polymérisation de l'actine et de recrutement des marqueurs de l'autophagie (par exemple, p62 et LC3) 7,8. En revanche, les bactéries de polymérisation queues d'actine ne seront pas cloisonnés par des cages de septines et ne seront pas visés à l'autophagie 7,8. - L'aide d'un microscope confocal épifluorescence ou et un objectif 63X ou 100X, de quantifier le nombre de bactéries intracellulaires par champ microscopique. Quantifier aussi le nombre de bactéries piégées dans des cages de septines et ciblées à l'autophagie, ou la polymérisation de l'actine et queues fuyant l'autophagie.
- Pour déterminer le pourcentage de bactéries piégées dans des cages de septines ou de polymérisation queues d'actine, prendre une série d'images Z-stack de infeDECT cellules, traiter les images et compter au moins 500-1000 bactéries par expérience d'au moins 3 expériences indépendantes.
- À l'image de l'infcellules échies utilisent une épifluorescence ou microscope confocal et un objectif 63X ou 100X pour identifier DAPI marqué Shigella.
2 Analyse fonctionnelle de l'autophagie et le cytosquelette in vitro
REMARQUE: Les deux approches pharmacologiques et génétiques peuvent être utilisés pour perturber l'autophagie dans les cellules de culture de tissus infectés, et l'impact de ces traitements sur l'évolution de l'infection peut être contrôlée.
- Taire de siRNA médiation
- Plaque 0,8 x 10 5 cellules HeLa sur des lamelles de verre dans des plaques de 6 puits dans du milieu complet.
- Transfecter le jour suivant en utilisant un réactif de transfection à base de lipides avec le siRNA contre autophagy et / ou des marqueurs cytosquelette.
- Après la période d'incubation désirée, infecter les cellules avec Shigella, comme décrit dans la section 1.3.
- Fixer et marquer les cellules comme décrit dans la section 1.4.
- Manipulation pharmacologique
NOTE: Le cytosquelette peut être manipulé pharmacologiquement, par exemple, à la dépolymérisation de l'actine utilisation du cytosquelette cytochalasine D ou latrunculine B, à la dépolymérisation de microtubules utilisent nocodazole, pour bloquer l'activité de l'actomyosine utilisation blebbistatin, ou de perturber septin utilisation d'assemblage forchlorfeneuron. Autophagy peut être stimulée à l'aide de la rapamycine ou bloquée à l'aide de la bafilomycine.- Pour manipuler le cytosquelette lors de l'infection à Shigella, d'abord infecter les cellules avec Shigella, comme décrit dans la section 1.3 et laisser suffisamment de temps pour que les bactéries pénètrent dans les cellules et d'échapper à la phagosome vers le cytosol (par exemple.,> 1,5 après l'infection h).
- Diluer les médicaments de la solution mère [solution mère en suspension dans du diméthylsulfoxyde (DMSO)] dans du MEM à une concentration finale de 5 M (cytochalasine D, B latrunculine, nocodazole), 20 M (forchlorfeneuron) ou 50 M (blebbistatin), et traiter les cellules 30 min à 37 ° C. La quantité totale de médicament (volume de DMSO / jmélange de tapis) ajoutée par plaque / flacon de cellules est de 1-5 pi (selon la solution mère) par 2 ml de milieu. Traiter les cellules avec une dose similaire de DMSO dilué dans du MEM en tant que contrôle négatif.
- Fixer et marquer les cellules comme décrit dans la section 1.4.
NOTE: Pour la manipulation de l'autophagie flux (dans les cellules infectées ou non infectées), étendre le traitement médicamenteux en utilisant la rapamycine (20 nM) ou bafilomycine (160 nM) de 4 à 12 heures.
- Western Blot
NOTE: L'activité autophagique peut être quantifiée en mesurant le niveau de marqueurs tels que autophagie p62 et la protéine LC3.- Après la période désirée d'incubation, la collecte et la lyse des cellules pour immunoblot. Extraits protéiques dirigés sur 8, 10 ou 14% des gels d'acrylamide.
- Flux autophagique, c'est à dire. le taux de l'autophagie, peut être analysé comme décrit dans 21,22.
- Imagerie microscopique et quantification
- L'aide d'un microscope confocal épifluorescence ou un objet et 63X ou 100Xive, l'effet de siRNA ou traitement de la toxicomanie sur l'infection à Shigella peut être évaluée par microscopie quantitative (c'est à dire, en comptant de autophagosomes, cages septines et queues d'actine) tels que décrits dans la section 1.5 et illustré sur les figures 2A et 2B.
3. imagerie in vivo de S. flexneri Interactions avec d'autophagie et le cytosquelette
REMARQUE: Le modèle de poisson zèbre des infections à Shigella peut être utilisé pour étudier septin cage et l'autophagie in vivo 19.
- Préparer S. flexneri
- Culture S. flexneri tel que décrit dans la section 1.1.
- A DO 600 = de 0,3 à 0,6, essorage 8 ml de sous-culture bactérienne à 1000 xg pendant 10 min. Laver le culot avec 1 x PBS et centrifuger à 1000 g pendant 10 min.
- Reprendre le culot dans 80 ul de 0,1% de phénol rouge 1x PBS pour obtenir ~ 2000 bactéries / nl. Gardez la bactpréparation ations sur la glace pour ralentir la croissance.
REMARQUE: Ajout de phénol rouge vous aidera à visualiser l'inoculum lors de l'injection dans les larves.
- Préparer le poisson zèbre larves pour injection
REMARQUE: Le poisson zèbre sont mis sous forme d'œufs et sont identifiés comme des embryons jusqu'à 72 heures après la fécondation, quand ils sont appelés larves.- Race poisson zèbre adulte tel que décrit dans Westerfield 23 en plaçant 4 hommes et 8 femmes (généralement un ratio de 2: 1) dans un aquarium séparé avec le fond couvert de marbres (qui empêchent les adultes de manger les œufs pondus). Sinon, placez les paniers de collecte des œufs à l'intérieur des bassins d'élevage de la veille.
REMARQUE: Les œufs sont fécondés ~ 30 minutes après que les lumières s'éteignent dans l'installation de poisson zèbre 23, et devraient être prélevés dès que possible pour éviter la croissance de moisissures. paniers de collecte d'oeufs servent à recueillir les oeufs de sorte qu'ils peuvent être facilement récoltées et également protéger les oeufs contre les adultes. - Recueillir l'embryons et les nettoyer par un lavage dans des milieux de l'embryon (E2) avec 0,003% de l'eau de Javel à 10 min. Retirer E2 eau de javel, laver embryons 5x en milieu E2, et développer les embryons dans 10 cm boîte de Pétri (100 embryons / 50 ml de milieu E2) à 28 ° C.
- Si les embryons ou les larves seront utilisées pour les études de microscopie, à 24 h après la fécondation ajouter 0,003% de N-phénylthiourée au milieu E2 pour éviter mélanisation. Gardez les embryons à 28 ° C pour un développement normal.
REMARQUE: les larves de poisson zèbre sont prêts pour l'infection à 72 heures après la fécondation. - Pour les procédures d'infection et de microscopie, anesthésier larves de poisson zèbre à 200 g / ml tricaïne en E2.
- Race poisson zèbre adulte tel que décrit dans Westerfield 23 en plaçant 4 hommes et 8 femmes (généralement un ratio de 2: 1) dans un aquarium séparé avec le fond couvert de marbres (qui empêchent les adultes de manger les œufs pondus). Sinon, placez les paniers de collecte des œufs à l'intérieur des bassins d'élevage de la veille.
- Préparation du poisson zèbre larves pour intraveineuse et l'infection locale
REMARQUE: Pour évaluer la survie du poisson zèbre cours de l'infection à Shigella, effectuer des injections intraveineuses caudale. Pour visualiser le recrutement des marqueurs de septines et autophagie à Shigella, effectuer l'infection à des sites localisés tels que la queue musculaire.- Pour une injection intraveineuse caudale, la position des larves anesthésiés latéralement avec la face dorsale tournée vers l'aiguille. Comme le montre la figure 3A, la placer à proximité de la pointe de l'aiguille (postérieure) de l'ouverture urogénitale, dans le but de la veine caudale, et percer la peau et fournir la dose souhaitée bactérienne (volume d'injection de 1 à 5 nl).
REMARQUE: l'infection par voie intraveineuse est difficile à effectuer et il faudra plusieurs semaines de formation pour se familiariser avec cette procédure. L'injection de phénol rouge (sans bactéries) pour la formation permettra d'évaluer le site d'injection correctement.
NOTE: Dans le cas de Shigella, les expériences reliées à la dose ont montré qu'une infection à faible dose (<1000 UFC) est effacée dans les 48 heures, et une infection de la dose élevée (> 4000 UFC) conduit à accueillir la mortalité dans les 48 heures 19. - Pour une infection du muscle de la queue, positionner les larves anesthésiés, comme décrit à la section 3.3.1. Comme le montre la figure 3A, la placer prudent d'aiguilley plus de somites musculaires (c.-à-segments de muscle squelettique) et injecter un petit volume (c'est à dire., 1 nl) de préparation bactérienne.
- Pour une injection intraveineuse caudale, la position des larves anesthésiés latéralement avec la face dorsale tournée vers l'aiguille. Comme le montre la figure 3A, la placer à proximité de la pointe de l'aiguille (postérieure) de l'ouverture urogénitale, dans le but de la veine caudale, et percer la peau et fournir la dose souhaitée bactérienne (volume d'injection de 1 à 5 nl).
- Injection intraveineuse de bactéries dans les larves
- Tirez Microcapillaires de verre borosilicate comme décrit dans 24.
- Connectez aiguille au titulaire du manipulateur manuel grossier en trois dimensions et de briser la pointe de l'aiguille avec des pincettes fines.
- Pour charger l'aiguille, déposer une goutte de culture bactérienne sur une lamelle. Allumez le cylindre de micro-injecteur et du gaz, un peu submerger la pointe de l'aiguille dans la goutte, et remplir l'aiguille avec la quantité désirée de préparation bactérienne.
- Pour calibrer le volume d'injection, déposer une goutte d'huile minérale sur une lamelle et injecter la préparation bactérienne. Mesurer le diamètre de la goutte à l'aide d'un micromètre et de calculer le volume injecté [V = (4/3) πr 3].
REMARQUE: Utilisation des paramètres d'injection de 40 psi et 50 ms avec un bactérial préparation comme décrit dans la section 3.1 donnera ~ 2000 UFC / nl. - Préparer la plaque d'injection en utilisant un moule en plastique comme décrit dans Westerfield 23.
- Transférer les larves de la plaque d'injection et les aligner l'aide d'un pinceau fin. Orient et d'injecter les larves comme décrit dans la section 3.3.1.
- Pour l'évaluation de la survie du poisson zèbre, le transfert infectés larves individuellement dans des plaques à 24 puits dans 1 ml de E2 / puits et incuber à 28 ° C. Surveiller les larves infectées par jour pour les 2-5 prochains jours et la survie de l'intrigue au fil du temps (figure 3B).
- Placage poisson zèbre larves pour la quantification des bactéries
REMARQUE: Travailler sous une hotte stérile pour éviter toute contamination.- Pour évaluer le nombre de bactéries injectées dans le poisson (au moment de l'infection post 0 h) et pour la quantification des bactéries à des moments souhaités, sacrifier larves de poisson zèbre avec une overdose de tricaïne (200-500 mg / L). Placez larves individu dans 1,5 ml polmicrotube ypropylene avec 200 ul de 0,1% de condensat d'oxyde d'éthylène octylphénol PBS 1x et homogénéiser mécaniquement à l'aide d'un pilon.
NOTE: Pour confirmer la charge bactérienne dans le volume d'injection, la pompe d'une dose égale à une chute de 1 x PBS stérile et la plaque le. - Faire une dilution en série des broyats de larves de poisson zèbre à l'eau stérile et de la plaque sur le bouillon de lysogénie (LB) des plaques d'agar. Les larves peuvent être plaqué alternativement sur des plaques rouge Congo TCS faire la distinction entre Shigella avoir maintenu le plasmide virulent ou non.
REMARQUE: Planche 3 ou plus de poissons non infectés comme un contrôle pour vérifier l'état de la larves de poisson zèbre utilisé pour l'infection. - Après une nuit d'incubation de plaques à 37 ° C, compter les colonies bactériennes. Comme le montre la figure 3C, représenter en utilisant une échelle logarithmique.
REMARQUE: la charge bactérienne lors de l'infection des larves de poisson zèbre peut également être visualisée à l'aide marqué par fluorescence Shigella et i microscopiqueforgemagie comme décrit à la section 3.7 ou 3.8 (figure 3D).
- Pour évaluer le nombre de bactéries injectées dans le poisson (au moment de l'infection post 0 h) et pour la quantification des bactéries à des moments souhaités, sacrifier larves de poisson zèbre avec une overdose de tricaïne (200-500 mg / L). Placez larves individu dans 1,5 ml polmicrotube ypropylene avec 200 ul de 0,1% de condensat d'oxyde d'éthylène octylphénol PBS 1x et homogénéiser mécaniquement à l'aide d'un pilon.
- Les larves de poisson zèbre Immunocoloration
- A des moments souhaités, sacrifier les larves à l'aide d'une surdose de tricaïne. Recueillir le poisson en tubes de 1,5 ml à centrifuger en polypropylène (10 à 20 larves / tube).
- Fixer les larves à l'aide du paraformaldéhyde 4% avec 0,4% d'oxyde d'éthylène octylphénol condensat en 1x PBS et incuber dans un agitateur orbital (pour éviter le regroupement des larves) pendant 2 heures (à température ambiante) ou la nuit (à 4 ° C).
NOTE: La microscopie électronique peut être utilisée pour des analyses ultrastructurales de larves de poisson zèbre infecté. Dans ce cas, les embryons anesthésiés doivent être fixées et traitées selon Mostowy et al 19. - Laver 3 fois dans du PBS 1x 0,4% octylphénol condensats d'oxyde d'éthylène pendant 5 min, puis bloquer dans une solution de blocage (10% de sérum de veau foetal, 1% de DMSO, 0,1% de monolaurate de polyoxyéthylène sorbitane en 1x PBS) pendant 1 heure à température ambiante.
- Dile luth anticorps primaires dans la solution de blocage. Ajouter les larves à l'anticorps primaire dilué et on incube pendant une nuit à 4 ° C dans un agitateur orbital. Utiliser des anticorps primaires comme décrit ci-dessus dans la section 1.4.3.
- Laver les 4x larves pendant 15 min dans 0,1% polyoxyéthylènesorbitane monolaurate 1x PBS à température ambiante.
- Diluer l'anticorps secondaire dans une solution de blocage. Ajouter larves de l'anticorps secondaire dilué et on incube pendant une nuit à 4 ° C dans un agitateur orbital. Utilisez les mêmes anticorps secondaires et phalloïdine comme décrit dans la section 1.4.4.
- Laver 4x pendant 15 min dans 0,1% de monolaurate de polyoxyéthylènesorbitan 1x PBS à température ambiante. Pour la coloration des noyaux de cellules hôtes ajouter DAPI (150 nM de concentration finale) pendant la première de ces lavages de 15 min.
- Pour la conservation des larves de marquage fluorescent, incuber progressivement en un gradient de glycerol de 15, 30, 60, et 80% dilué dans du PBS 1x et 0,1% de monolaurate de polyoxyéthylènesorbitan pendant 2 heures (à la chambre humeurture) pour la nuit (à 4 ° C).
REMARQUE: Stained larves peut être stocké pendant de longues périodes de temps dans 80% de glycérol à 4 ° C (par exemple, 4 mois.).
- Imagerie microscopique des larves de poisson zèbre fixe
- Transfert glycérol fixe larves intégré à une petite goutte de 80% de glycérol dans un plat de 35 mm de Pétri (pour Stéréomicroscopie) ou un plat complet fond de verre (pour miscopy confocale).
- Prenez Z-stack série d'images de larves infectées et traiter les images selon les besoins.
- Utilisez une épifluorescence ou microscope confocal et un objectif 10X ou 20X pour l'imagerie de l'organisme entier. Ensuite, utilisez un microscope confocal et un objectif 40X, 63X, 100X ou de visualiser des cellules individuelles et le recrutement de l'autophagie et du cytosquelette marqueurs à différentes bactéries in vivo 19 (figures 4A et 4B).
REMARQUE: infecter les poissons dans le muscle et la queue de montage dans la glycérine à plat le long du fond de la cuvette à fond transparent pour permettre eaaccent sy.
- Vivre microscopique imagerie de Infected poisson zèbre larves
REMARQUE: Les larves sont optiquement accessible, peut donc en autophagosomes vivo être visualisées en utilisant le poisson zèbre transgénique ligne 25 de la GFP-Lc3. Infecter les larves de poisson zèbre comme décrit dans la section 3.3 et monter comme décrit dans cette section.- Préparer bas point de fusion à 1% d'agarose (LMA) en E2 et laisser refroidir à 35-37 ° C pour éviter d'endommager les larves / meurtre. Distribuer gouttes de LMA dans un plat de 35 mm de Pétri (pour Stéréomicroscopie) ou un plat complet fond de verre (pour la microscopie confocale).
- Transfert anesthésié larves de poisson zèbre individuellement (avec le moins d'eau possible) à la LMA baisse. Larves Orient à la position désirée à l'aide d'un pinceau et d'attendre que la gélose se solidifier.
- Couvrir toute la surface du plat avec LMA, et la superposition avec E2 contenant 200 ug / ml tricaïne pour éviter la préparation de se dessécher et pour permettre aux poissons d'échanger l'oxygène de l'eau.
- Utilisez une épifluorescence ou microscope confocal et un objectif 10X ou 20X pour l'imagerie de l'ensemble de la larves de poisson zèbre. Utiliser un microscope confocal et un objectif 40X, 63X, 100X ou de visualiser authopagosomes bactériennes (c.-à-GFP-Lc3 + ve vacuoles autour Shigella) in vivo.
- Prenez un Z-stack de larves infectées au cours du temps (par exemple., Toutes les 2 min sur plusieurs heures) pour visualiser autophagosomes, et leur dynamique, en temps réel.
4 Analyse fonctionnelle de l'autophagie et le cytosquelette In Vivo
NOTE: L'impact des perturbations pharmacologiques et génétiques de l'autophagie sur le cours de l'infection peuvent être suivies au niveau de l'animal entier, et au niveau de la cellule unique.
- L'autophagie Manipulation par Morpholino injection
- Reconstituer morpholino oligonucléotides dans de l'eau stérile à une solution de réserve de 1 mM en chauffant à 65 ° C pendant 10 min. Magasinà la température ambiante.
REMARQUE: morpholino injections d'oligonucléotides doivent être effectuées dans 1-4 embryons au stade de cellule. - Préparer la solution de travail morpholino oligonucléotide stérile à 0,1% de rouge de phénol dans une solution saline tamponnée au phosphate de Dulbecco. Chargez l'aiguille comme décrit dans la section 3.4.2., Morpholino volume d'injection d'oligonucléotide peut être calibré tel que décrit à la section 3.4.3.
REMARQUE: Le rouge de phénol permettra de visualiser le volume injecté. - Préparer une chambre embryon de positionnement (c.-à-., Une lame de microscope avec cyanoacrylate collé sur une boîte de Pétri de 10 cm avec couvercle bords en regard de l'aiguille partiellement enlevé). Transfert 1-4 embryons au stade de cellule à la chambre avec une petite quantité d'eau et de les aligner avec un pinceau fin.
- Pénétrer dans le chorion et le jaune en douceur. Une fois à l'intérieur, appuyez sur la pédale d'injecter le volume souhaité de solution morpholino oligonucléotide.
REMARQUE: Réduire le volume d'injection de 0,5 à 2 nl; volumes tha supérieurn 5 nl peuvent causer des anomalies de développement et d'accroître la mortalité des oeufs. - Après la micro-injection, les embryons propres (par blanchiment tels que décrits dans la section 3.2) et les incuber dans une boîte de Pétri avec E2 à 28 ° C.
- Infecter 72 contrôle a posteriori de la fécondation h (c'est à dire, larves de poisson zèbre avec un morpholino témoin oligonucléotide) ou morphants p62 (c'est à dire., Larves de poisson zèbre injecté p62 morpholino oligonucléotide) par la bactérie Shigella, comme décrit dans la section 3.4. Évaluer la survie et la charge bactérienne pour les 2-5 prochains jours, comme décrit dans la section 3.5. Image fixe larves de poisson zèbre comme décrit dans la section 3.7 et mis en évidence dans la figure 4C, ou image vivante larves de poisson zèbre comme décrit dans la section 3.8.
NOTE: La dose efficace morpholino oligonucléotide peut être évaluée en fonction de son efficacité à inhiber l'épissage de transcription ou de la traduction des protéines (voir Discussion).
- Reconstituer morpholino oligonucléotides dans de l'eau stérile à une solution de réserve de 1 mM en chauffant à 65 ° C pendant 10 min. Magasinà la température ambiante.
Résultats
Lors de l'infection de cellules de culture de tissus in vitro, S. flexneri peut s'échapper du phagosome et envahir le cytosol. Dans le cytosol des cellules hôtes peuvent empêcher la mobilité sur la base de l'actine-Shigella par un cloisonnement à l'intérieur des cages de bactéries septines (Figure 1A). Les bactéries piégées par des cages de septines peuvent également être marqués par des marqueurs de autophagie p62 (figure 1B) et LC3 (Figure 1C). Ces observations mettent en évidence un nouveau mécanisme de défense de l'hôte qui limite la diffusion des agents pathogènes invasifs, et révèlent aussi de nouveaux liens entre l'autophagie et le cytosquelette. Il est frappant, l'épuisement des marqueurs de l'autophagie réduit considérablement septin mise en cage de bactéries (figure 2A), et les travaux ont également montré que l'épuisement des septin cage réduit considérablement le recrutement des marqueurs de l'autophagie 8. Ainsi, au moins dans le cas de Shigella, Septin ensemble de cage et formatio autophagosomen peut être considéré comme des processus interdépendants. D'autres exigences cellulaires pour le cloisonnement de Shigella par des cages de septines comprennent la polymérisation de l'actine et de l'activité de l'actomyosine (figure 2B).
Il n'existe pas de modèle naturel de la souris de la shigellose, et l'enquête de Shigella pathogenèse, septin biologie et l'autophagie bactérienne in vivo peuvent bénéficier d'un nouveau modèle animal de l'infection, les larves de poisson zèbre 19. Il est possible d'infecter les larves de poisson zèbre par injection de bactéries dans différents sites anatomiques telles que des injections intraveineuses caudale pour les expériences de survie, et la queue injections musculaires pour la microscopie in vivo (Figure 3A). En fonction de la dose, S. flexneri injecté dans les larves de poisson zèbre peut soit être réglés en moins de 48 heures après l'infection, ou peut entraîner une infection évolutive mortelle (figures 3B - 3D). Shigella virulence facteurs sont exprimés à 28 ° C, la température optimale de croissance de poisson-zèbre, de poisson zèbre et infection par Shigella est strictement dépendant de son système de sécrétion de type III (T3SS) 19, un facteur de virulence essentiel dans la maladie humaine. Pris ensemble, ces observations indiquent que la larve de poisson zèbre représente un nouvel hôte précieux pour l'analyse in vivo des infections à Shigella.
L'accessibilité optique de larves de poisson zèbre permet de visualiser septin cage in vivo (figure 4A), un exploit qui n'a jamais été accompli en utilisant des modèles hôtes de mammifères. Pour compléter la preuve que les cages septines piéger les bactéries ciblées à autophagy in vivo, on peut infecter les larves de poisson zèbre transgénique exprimant GFP-Lc3 observer recrutement et de marqueur de autophagy de Shigella (figure 4B). Pour une analyse de ultrastrucutral autophagosomes Shigella in vivo, elmicroscopie ECTRON peut être utilisé pour montrer clairement la séquestration cytosolique de bactéries par des doubles vacuoles de la membrane 19. L'autophagie est considéré comme un élément clé de l'immunité cellulaire autonome et un mécanisme de défense essentiel contre les bactéries intracytosolic 14-16. Afin de caractériser la fonction de autophagy in vivo, p62 larves de poisson zèbre morpholino-traité peut être utilisé. Contrairement à la machine de base de l'autophagie [ex., Les 36 autophagie protéines apparentées (ATG) 26], p62 n'est pas essentiel pour le développement des vertébrés et 27 larves de poisson zèbre peut ainsi se développer normalement avant l'infection. Il est frappant, les larves de p62 appauvri inoculés avec S. résultat flexneri une augmentation significative de la mortalité et une augmentation de la charge bactérienne 19. En accord avec les travaux in vitro montrant que l'assemblage septin cage est solidaire avec la formation autophagosome 7,8, le recrutement de septin à Shigella est nettement réduite chez les larves de p62 appauvri ( Figure 4C). Ces données montrent que la survie du poisson zèbre autophagy dépend de p62 médiée pour contrôler une infection bactérienne intracellulaire.
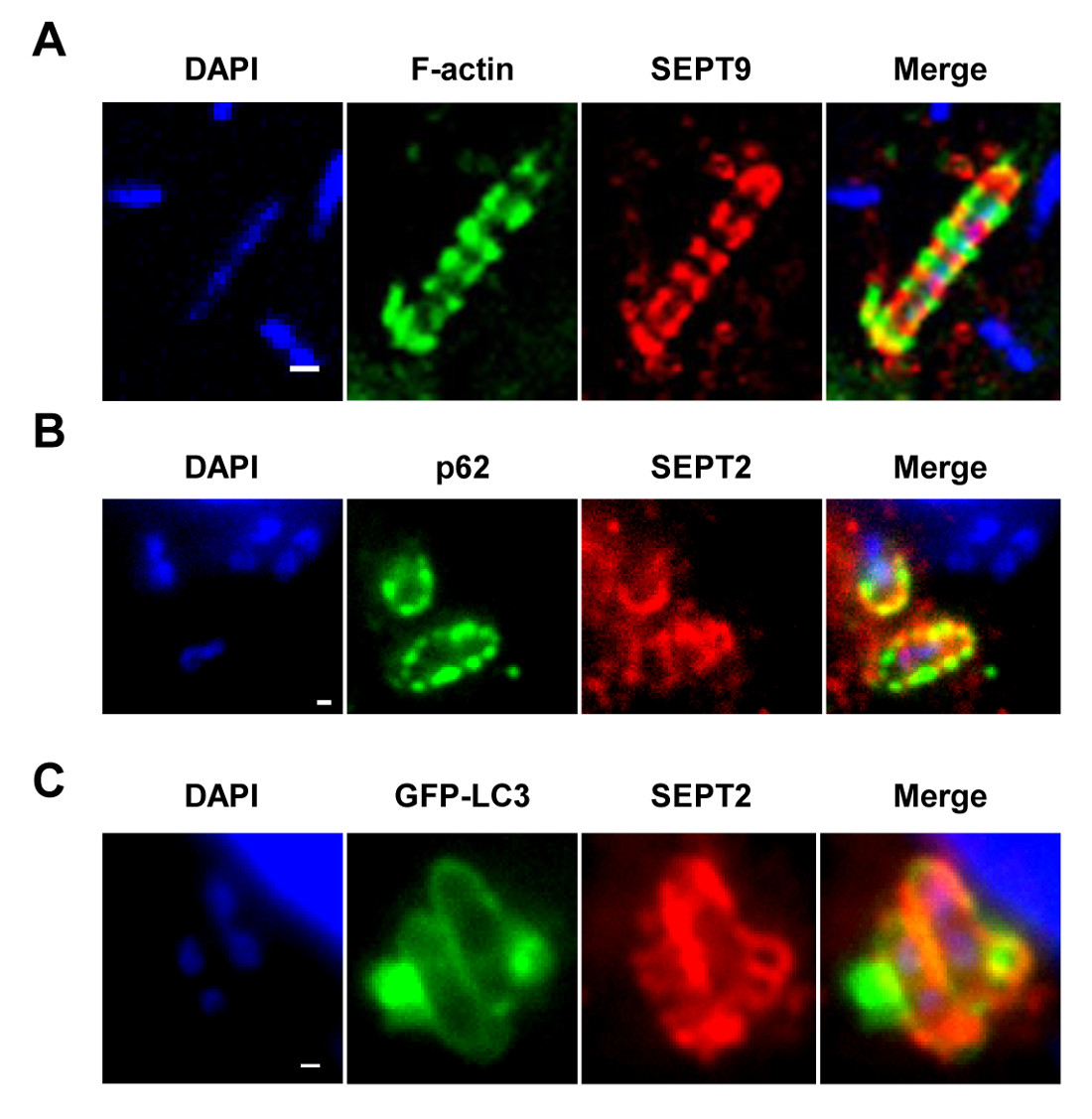
Figure 1: La cage septin in vitro. (A) Des cellules HeLa ont été infectées avec S. flexneri pendant 4 h 40 min, fixe, marqué avec des anticorps à SEPT9 et phalloïdine et imagée par microscopie confocale. La barre d'échelle, de 1 um. (B) cellules HeLa ont été infectées par S. flexneri pendant 4 h 40 min, fixe, marqué avec des anticorps dirigés contre la protéine p62 et SEPT2 et imagée par microscopie fluorescente. La barre d'échelle, de 1 um. cellules (C) HeLa ont été transfectées avec GFP-ATG8 / LC3, infecté par S. flexneri pendant 4 h 40 min, fixe, marqué avec des anticorps à SEPT2 et imagée par km fluorescentscroscopy. La barre d'échelle, 1 pm. Ces chiffres ont été modifiés de Mostowy et al 7.
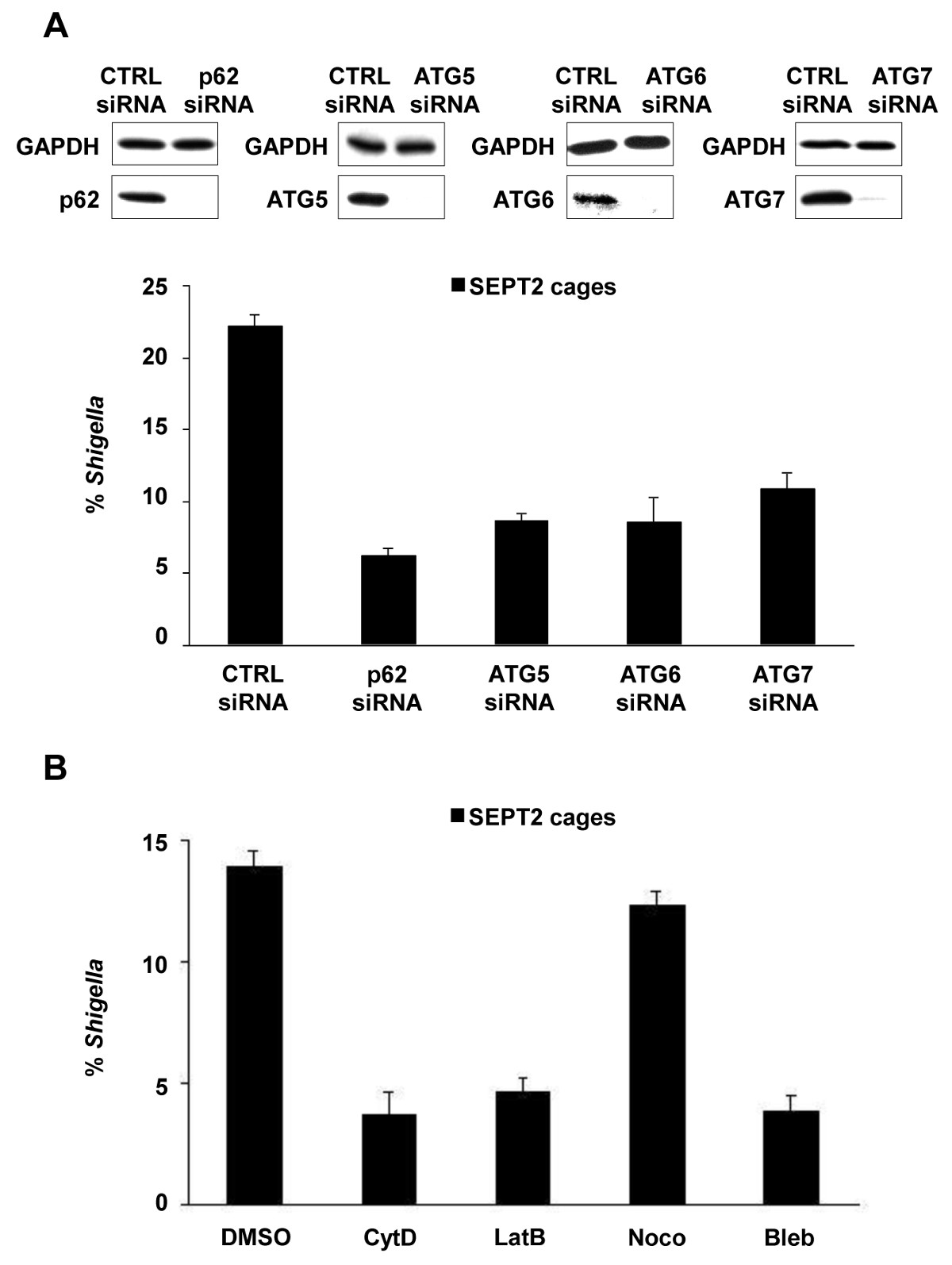
Figure 2: exigences cellulaires pour Shigella formation de cage -septin. (A) cellules HeLa ont été traités avec le contrôle (CTRL), p62, ATG5, ATG6 ou ATG7 siRNA. Lysats de cellules entières de cellules siRNA-traités ont été immunotransférés pour GAPDH, p62, ATG5, ATG6, ou ATG7 pour montrer l'efficacité des siRNA épuisement (en haut). cellules siARN traités ont été infectées par S. flexneri pendant 4 h 40 min, fixe, et marqué pour la microscopie quantitative. Graphiques (en bas) représentent la moyenne ± SEM% de Shigella dans des cages SEPT2 de n ≥3 expériences par le traitement. (B) cellules HeLa ont été infectées par S. falexneri, traités avec du DMSO, la cytochalasine D (cumul annuel), B latrunculine (TPVB), nocodazole (Noco), ou blebbistatin (Bleb) et après 4 h 40 min ont été fixées et marquées pour la microscopie quantitative. Graphiques représentent la moyenne ± SEM% de Shigella dans des cages SEPT2 de deux expériences indépendantes par traitement. Ces chiffres ont été modifiés de Mostowy et al 7.
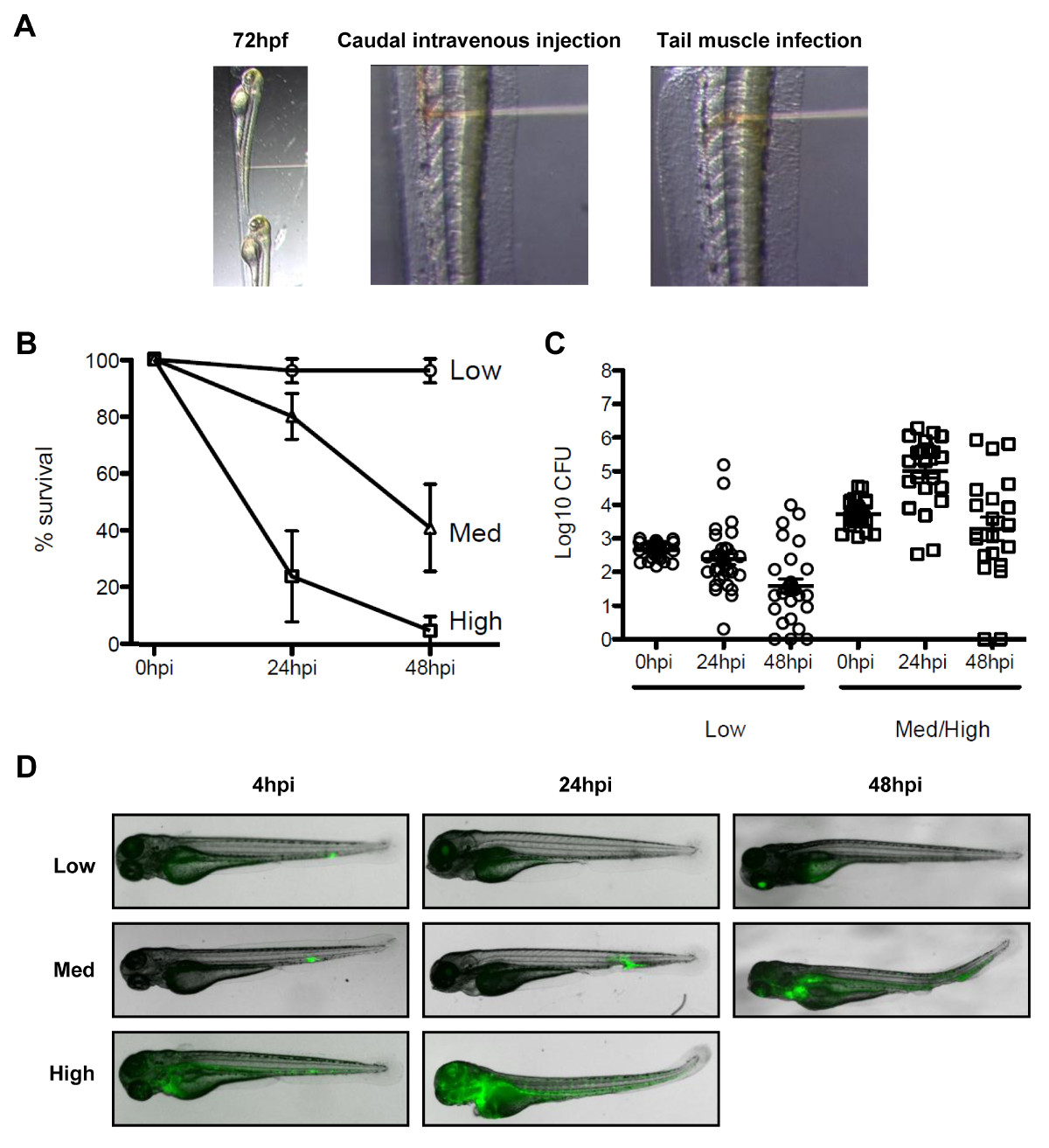
Figure 3 Le modèle de poisson zèbre d'infection à Shigella. (A) Images pour illustrer l'orientation de la larve de poisson zèbre sous la loupe binoculaire. (Panneau de gauche) poisson zèbre larves 72 heures après la fécondation ont été positionné latéralement dans la plaque d'injection avec leur face dorsale face à l'aiguille d'injection. Infection (panneau du milieu) Bloodstream a été réalisée par injète les bactéries de la solution (rouge) dans la veine caudale, postérieur à l'ouverture de urogénital. (Panneau droit) Infection dans la queue musculaire a été réalisée par l'injection des bactéries (solution rouge) sur une somites. (B) Les courbes de survie des larves après la fécondation de 72 h injecté avec différentes doses de S. flexneri et incubé à 28 ° C après l'infection pour 48 h. L'inoculum efficace a été classé comme faible (<10 3 UFC, cercles vides), moyen (~ 4 x 10 3 UFC, triangles ouverts) ou élevé (~ 10 4 UFC, carrés ouverts). % Moyen ± SEM (barres horizontales) à partir de n ≥3 expériences par classe d'inoculum. (C) énumération des bactéries vivantes dans des homogénats de larves individu à différents moments après l'infection mesurée par étalement sur LB Remarque, seules les larves ayant survécu à l'infection sont inclus dans l'analyse de dénombrement. Moyenne ± SEM (barres horizontales) également indiqué. (D) Distribution de GFP Shigella déterminé parimagerie en temps réel en utilisant un microscope stéréoscopique fluorescent à différents moments après l'infection en utilisant une basse, moyenne ou haute dose inoculum (caudales des injections intraveineuses). Superposition image de transmission (gris) et fluorescence de la GFP (vert) (B) de -. (D) Ces chiffres ont été modifiés de Mostowy et al 19.
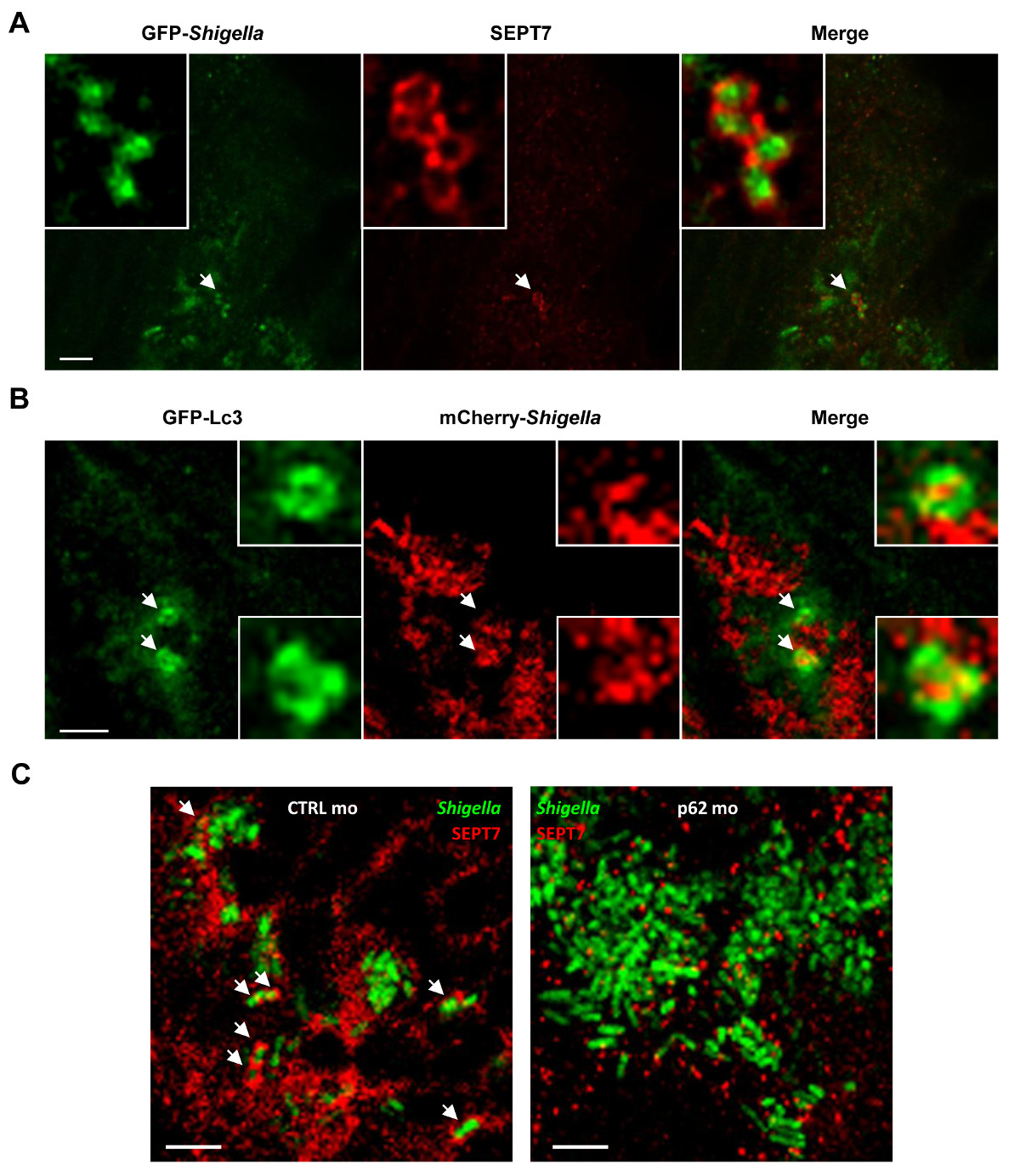
Figure 4 La biologie cellulaire des infections à Shigella in vivo. (A) des larves de poisson zèbre ont été infectés dans la queue musculaire avec GFP Shigella (faible dose) pendant 24 heures, fixe, marqué avec des anticorps contre SEPT7 (rouge) et à la GFP (green ), et imagée par microscopie confocale. La barre d'échelle, 5 um. (B) GFP-Lc3 larves de poisson zèbre ont été infectées par Shigella mCherry- (dose moyenne) pour4 h, fixe, marqué avec des anticorps contre mCherry (rouge) et de la GFP (vert), et imagée par microscopie confocale. . Barre d'échelle, de 1,5 um (C) les larves de poisson zèbre traités soit par contrôle (CTRL; image de gauche) ou p62 (image de droite) morpholinos ont été infectées par le GFP Shigella pendant 4 heures (dose moyenne), fixe, marqué avec des anticorps contre SEPT7 ( rouge) et de la GFP (vert), et imagée par microscopie confocale. Les flèches mettent en évidence des exemples de Shigella piégées dans des cages septines (CTRL) ou non (p62 épuisée) un après l'infection de 4 heures. La barre d'échelle, 5 um. Ces chiffres ont été modifiés de Mostowy et al 19.
Discussion
Lors de la surveillance et du cytosquelette autophagy in vitro en utilisant des cellules de culture tissulaire, les protocoles décrits dans les sections 1 et 2 peuvent être appliqués à une grande variété de types de cellules de culture tissulaire. De plus, pour suivre autophagy (par exemple, ATG8 / LC3 + ve autophagosomes) et du cytosquelette (par exemple,., Queues d'actine, des cages septines) dynamique, en temps réel au cours de l'infection à Shigella en utilisant l'imagerie en temps réel, des cellules de culture tissulaire peuvent être transfectées de manière transitoire en utilisant GFP, constructions RFP- ou CFP-marquées que précédemment décrits 7,8. Pour augmenter le pourcentage de cellules infectées par Shigella (par exemple, généralement souhaitable pour l'analyse en temps réel compte tenu de Shigella qui peut envahir 5-30% des cellules HeLa à 100: 1. MOI), ajouter 400 ul directement de Shigella (DO600 = 0,3 -0,6) pour les cellules dans 2 ml de MEM (privées de sérum) et attendre au moins 1,5 après l'infection h pour l'entrée bactérienne suffisante, échapper à la phagosome, la réplication, aureconnaissance tophagy et septin mise en cage. Alternativement, on peut utiliser la souche de Shigella M90T AfaI qui exprime l'adhésine AFAE et ont beaucoup plus élevés capacités d'invasion de cellules épithéliales par rapport à la souche M90T 28. Il faut noter que la souche M90T AfaI n'a pas encore été testée in vivo en utilisant le poisson zèbre. Les plaques de colonies de Shigella peuvent être conservés à 4 ° C pendant 2-3 jours et utilisées pour plusieurs expériences. Toutefois, au fil du temps, les colonies de Shigella qui ont perdu le plasmide de virulence peut aussi absorber le rouge Congo et semblent avoir conservé leur plasmide de virulence. Pour cette raison, nous recommandons d'utiliser les stocks bactériennes fraîches si possible.
Lors de la surveillance de la biologie cellulaire de l'infection in vivo, les protocoles décrits dans les sections 3 et 4 de type sauvage utilisation AB ligne le poisson zèbre. Pour surveiller les interactions -leukocyte Shigella, lignes de poisson zèbre transgénique peuvent être utilisés, par exemple, mpx: GFP ou lyz: DsRed de visueliser neutrophiles 19,29,30 ou MPEG1: mcherry de visualiser les macrophages 19,31. Pour visualiser l'autophagie in vivo, le poisson-zèbre transgénique ligne de GFP-Lc3 19,24 peut être utilisé tel que décrit dans la section 3.8.
Pour perturber autophagy in vivo, la dose efficace de l'oligonucléotide morpholino doit être évaluée expérimentalement sur la base de son efficacité à inhiber l'épissage de transcription ou une traduction en protéine. Il est conseillé de réaliser une expérience de titrage et pour confirmer l'épuisement par RT-PCR (par épissure oligonucléotide morpholino) ou par SDS-PAGE (par translation oligonucléotide morpholino) 32. isolement d'ARN à partir d'embryons de poisson zèbre ou de larves peut être réalisée en utilisant l'extraction thiocyanate de guanidinium-phénol-chloroforme. Pour extraire des protéines à partir de larves de poisson zèbre (8 à 15 larves / tube), homogénéiser mécaniquement à l'aide d'un pilon dans 200 ul de tampon de lyse (Tris 1 M, 5 M de NaCl, 0,5 M EDTA, 0,01% octylphénol oxyde d'éthylène condensate, et l'inhibiteur de protéase). Tubes à centrifuger à 19 000 g à 4 ° C pendant 15 min et transférer le surnageant dans un nouveau tube. Ajouter du tampon de Laemmli et on chauffe l'échantillon à 95 ° C pendant 15 min. Lysats peuvent être stockés à -80 ° C jusqu'à ce que nécessaire, et peuvent être évalués par Western blot comme décrit dans la section 2.3.
Le poisson zèbre est un excellent modèle pour l'application in vivo de médicaments. Analyse en utilisant des oligonucléotides morpholino peut être complétée avec des médicaments mis en place pour manipuler l'autophagie (par exemple, la rapamycine et bafilomycine). Les larves non infectées et / ou infecté peut être traitée avec de la rapamycine (1,5 uM) ou la bafilomycine (80 nM) dilués dans E2 et du flux autophagique peut être évaluée par Western blot comme décrit dans l'25,33. La conséquence de la manipulation de l'autophagie sur le résultat de l'infection et la survie des larves infectées peut être évaluée comme décrit dans la section 3.5.
En plus d'étudier cellule hôtedéterminants, in vitro et dans des protocoles in vivo peuvent être appliquées à évaluer les déterminants bactériens nécessaires à la reconnaissance de l'autophagie, en utilisant des souches mutantes de bactéries qui sont différentiellement reconnus par autophagy, par ex., Shigella ΔicsA (la protéine Shigella IcsA recrute N-WASP et Arp2 / 3 pour la queue de l'actine et la formation septin de la cage, en son absence, il ne peut y avoir la queue d'actine, pas de cages de septines) et ShigellaΔicsB (Shigella évite la réponse autophagique par la protéine d'effecteur bactérien CIPE, qui empêche le recrutement de la machinerie de l'autophagie ICSA; dans son absence il peut y avoir plusieurs cages de septines, plus autophagie) 7,8.
Shigella n'est pas un agent pathogène naturel de poisson-zèbre et une croissance optimale à 37 ° C. Cependant, des travaux ont montré que les facteurs de virulence nécessaires pour l'invasion de Shigella, échapper à la vacuole et la réplication dans le cyTosol peut être exprimé et sont fonctionnels chez les larves de poisson zèbre à 28 ° C 19. 28 ° C est la température la plus couramment utilisée pour l'élevage du poisson zèbre et de la température standard pour assurer le développement de poisson zèbre normale 23. Il est frappant, les grands événements pathogènes qui conduisent à la shigellose chez les humains (par exemple, la mort des cellules macrophages, l'invasion et la multiplication dans les cellules épithéliales, la propagation de cellule à cellule, la destruction inflammatoire de l'épithélium de l'hôte) sont fidèlement reproduits dans le modèle de poisson zèbre des infections à Shigella 19.
gènes de l'autophagie et du cytosquelette sont exprimé de façon ubiquitaire et avoir un large éventail de fonctions biologiques. Des études sur souris ont montré que l'autophagie essentiel huitièmes de finale de 26 ou septines gènes 5 sont embryonnaire mortelle, et il est probable que certains de ces gènes sera également essentielle pour le développement du poisson zèbre (bien que ce problème peut être réduit par le fait que le poisson zèbre ont plusieursgènes paralogues 33). Si c'est le cas, il existe plusieurs alternatives pour surmonter ce problème, y compris (i) l'utilisation de réactifs pharmacologiques pour réguler l'autophagie et le cytosquelette, (ii) morpholinos peuvent être titrés vers le bas, (iii) knock-out de gènes peut être conçu pour que cellule spécifique types, et / ou (iv) les gènes impliqués dans la reconnaissance autophagique qui ne sont pas essentiels pour le développement des animaux (par exemple., p62) peuvent être ciblés.
Alors que le poisson zèbre est un système modèle idéal pour étudier l'autophagie et le cytosquelette lors de l'infection à Shigella, outils moléculaires sont actuellement défaut. Le champ doit générer de nouveaux outils et de l'expression cellulaire spécifique d'entraînement des protéines d'intérêt. Pour abattre l'expression des gènes de l'autophagie / du cytosquelette, de nouvelles séquences morpholino sont nécessaires, et de nouvelles méthodes de l'ingénierie des génomes (par exemple, TALEN, CRISPR / Cas9) peuvent également être utilisés. Dans l'intervalle, plusieurs outils déjà générés pour les études humaines ou de sourispeut aussi travailler pour le poisson-zèbre.
Les bactéries intracellulaires S. flexneri a émergé comme un organisme modèle exceptionnel pour aborder les questions clés de la biologie, y compris la capacité des bactéries à être reconnu par le système immunitaire de 1,2. La cellule hôte emploie septines à limiter la mobilité de S. flexneri et les cibler à l'autophagie, une composante essentielle de la cellule immunité autonome 7,8. Ces observations suggèrent un nouveau cadre moléculaire pour étudier l'autophagie et sa capacité à dégrader les bactéries cytosoliques. Un problème majeur est maintenant de déchiffrer complètement les événements moléculaires et cellulaires sous-jacents, et de valider ces événements analysés in vitro lors de l'infection bactérienne in vivo sur des modèles animaux pertinents. A cette fin, le poisson-zèbre a été établi comme un nouvel hôte précieux pour l'analyse de S. infection flexneri 19. Les interactions entre les bactéries et les cellules hôtes peuvent être visualisés à haute résolution, etle modèle de poisson zèbre devrait se révéler utile pour la compréhension de la biologie cellulaire des infections à Shigella in vivo. Larves de poisson zèbre peut être utilisé pour étudier le rôle de l'autophagie des bactéries dans la défense de l'hôte, et le travail a montré que que la perturbation de l'autophagie peut nuire à la survie de l'hôte en réponse à l'infection à Shigella 19.
Les observations générées à partir de l'étude de Shigella, Septin mise en cage et l'autophagie in vitro en utilisant des cellules de culture de tissus et in vivo à l'aide de larves de poisson zèbre pourrait fournir des progrès fondamentaux dans la compréhension de défense de l'hôte. Ils pourraient également suggérer le développement de nouvelles stratégies visant à lutter contre les maladies infectieuses.
Un objectif essentiel de ce rapport est de donner un sens aux événements moléculaires et cellulaires analysés in vitro (c'est-à-autophagie, queues d'actine, Septin mise en cage) lors d'une infection bactérienne in vivo dans le cadre d'une entorganisme colère, en utilisant larves de poisson zèbre. Si ce n'est pas familier avec la biologie et la manipulation du poisson zèbre, on peut se référer à des protocoles de profondeur pour l'élevage du poisson zèbre bon 23 et analyse in vivo de l'infection poisson zèbre 19,35.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Le travail dans le laboratoire SM est soutenu par un Wellcome Trust Research Career Development Fellowship [WT097411MA].
matériels
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Sigma-Aldrich | B1793 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Borosilicate glass microcapillars | Harvard Apparatus | 30038 | |
| Coarse manual manipulator | Narishige | M-152 | |
| Cytochalasin D | Sigma-Aldrich | C6762 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes | D1306 | |
| Dumont #5 fine tweezers | Fine Science Tools | 11254-20 | |
| Forchlorfeneuron | Sigma-Aldrich | 32974 | |
| Goat anti-mouse IgG (H+L) antibody | Molecular Probes | N/A | |
| Goat ant-rabbit IgG (H+L) antibody | Molecular Probes | N/A | |
| JetPEI transfection reagent | Polyplus transfection | 101-01N | |
| Latrunculin B | Sigma-Aldrich | L5288 | |
| LC3 antibody | Novus Biologicals | NB100-2220 | |
| Low melting agarose | Promega | V2111 | |
| MatTek glass bottom dish | MatTek corporation | P35G-1.0-14 | |
| MEM plus L-alanyl-L-glutamine | GIBCO | 41090028 | |
| MEM non-essential amino acids solution | GIBCO | 11140-035 | |
| Microinjector | Narishige | IM-300 | |
| Micropipette puller device | Sutter Instrument Co., Novato, | P-87 | |
| Mineral oil | Sigma-Aldrich | P35G-1.0-14 | |
| Monoclonal anti-tubulin, acetylated antibody | Sigma-Aldrich | T6793 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| N-phenylthiourea | Sigma-Aldrich | P7629 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Phalloidin | Molecular Probes | A12379 | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Protease inhibitor cocktail | Roche | 4693116001 | |
| p62/SQSTM1 antibody | Cliniscience | PM045 | |
| Rapamycin | Sigma-Aldrich | R8781 | |
| Sodium pyruvate | GIBCO | 11360039 | |
| Transfection reagent | Life Technologies | 12252-011 | |
| Vectashield hard set mounting medium containing DAPI | Vector Laboratories | H-1500 |
Références
- Ashida, H., et al. Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr Opin Immunol. 23, 448-455 (2011).
- Phalipon, A., Sansonetti, P. J. Shigella's ways of manipulating the host intestinal innate and adaptive immune system: a tool box for survival. Immunol Cell Biol. 85, 119-129 (2007).
- Welch, M. D., Way, M. Arp2/3-mediated actin-based motility: A tail of pathogen abuse. Cell Host Microbe. 14, 242-255 (2013).
- Haglund, C. M., Welch, M. D. Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton. J Cell Biol. 195, 7-17 (2011).
- Mostowy, S., Cossart, P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 13, 183-194 (2012).
- Saarikangas, J., Barral, Y. The emerging functions of septins in metazoans. EMBO Rep. 12, 1118-1126 (2011).
- Mostowy, S., et al. Entrapment of intracytosolic bacteria by septin cage-like structures. Cell Host Microbe. 8, 433-444 (2010).
- Mostowy, S., et al. p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways. J Biol Chem. 286, 26987-26995 (2011).
- Mostowy, S., et al. Septins regulate bacterial entry into host cells. PLoS One. 4 (15), (2009).
- Mostowy, S., et al. Septin 11 restricts InlB-mediated invasion by Listeria. J Biol Chem. 284, 11613-11621 (2009).
- Phan, Q. T., et al. Role of endothelial cell Septin 7 in the endocytosis of Candida albicans. mBio. 4 (e00542-13), (2013).
- Mostowy, S., Cossart, P. Septins as key regulators of actin based processes in bacterial infection. Biol Chem. 392, 831-835 (2011).
- Levine, B., Mizushima, N., Virgin, H. W. Autophagy in immunity and inflammation. Nature. 469, 323-335 (2011).
- Randow, F., MacMicking, J. D., James, L. C. Cellular self-defense: how cell-autonomous immunity protects against pathogens. Science. 340, 701-706 (2013).
- Mostowy, S. Autophagy and bacterial clearance: a not so clear picture. Cell Microbiol. 2 (12063), (2012).
- Mostowy, S., Cossart, P. Bacterial autophagy: restriction or promotion of bacterial replication. Trends Cell Biol. 22, 283-291 (2012).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr Opin Immunol. 22, 10-19 (2010).
- Renshaw, S. A., Trede, N. S. A model 450 million years in the making: zebrafish and vertebrate immunity. Dis Model Mech. 5, 38-47 (2012).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. Plos Path. 9, e1003588 (2013).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Fixation and permeabilization of cells and tissues. Cold Spring Harb Protoc. , (2008).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 8, 445-544 (2012).
- Mizushima, N., Yoshimori, T., Levine, B. Methods in mammalian autophagy research. Cell. 140, 313-326 (2010).
- Westerfield, M. A guide for the laboratory use of zebrafish (Danio rerio). The Zebrafish Book. , (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. 61 (e3781), (2012).
- He, C., Bartholomew, C. R., Zhou, W., Klionsky, D. J. Assaying autophagic activity in transgenic GFP-Lc3 and GFP-Gabarap zebrafish embryos. Autophagy. 5 (4), 520-526 (2009).
- Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell. 147, 728-741 (2011).
- Komatsu, M., et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell. 131, 1149-1163 (2007).
- Nowicki, B., Coyne, K. E., Lublin, D. M., Nowicki, S., Hart, A. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. J Exp Med. 178, 2115-2121 (1993).
- Hall, C., Flores, M., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7 (42), (2007).
- Renshaw, S. A., et al. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, 2010-2010 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (9), (2009).
- He, C., Klionsky, D. J. Analyzing autophagy in zebrafish. Autophagy. 6, 642-644 (2010).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 25 (496 (7446)), 498-503 (2013).
- Levraud, J. P., Colucci-Guyon, E., Redd, M. J., Lutfalla, G., Herbomel, P. In vivo analysis of zebrafish innate immunity. Methods Mol Biol. 415, 337-363 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon