Method Article
A Novel
In diesem Artikel
Zusammenfassung
The accessibility of reliable models to investigate vascular blood interactions in humans is lacking. We present an in vitro model of cultured primary human endothelial cells combined with human whole blood to investigate cellular interactions both in the blood (ELISA) and the vascular compartment (microscopy).
Zusammenfassung
Die Mehrzahl aller bekannten Krankheiten, die durch Störungen des kardiovaskulären Systems begleitet. Studien über die Komplexität der Interaktion Wege während kardiovaskulärer Pathologien aktiviert werden, jedoch durch das Fehlen von robusten und physiologisch relevante Verfahren beschränkt. Um pathologischen vaskulären Ereignissen modelliert haben wir ein in-vitro-Assay zur Untersuchung der Wechselwirkung zwischen Endothel und Vollblut entwickelt. Der Assay besteht aus primären humanen Endothelzellen, die in Kontakt mit dem menschlichen Gesamtblut gegeben werden. Das Verfahren nutzt Nativblut mit keiner oder sehr wenig Antikoagulans, sodass Studie von empfindlichen Wechselwirkungen zwischen in einem Blutgefäß vorliegenden molekularen und zellulären Komponenten.
Wir untersuchten die Funktionalität des Tests durch Vergleichen der Gerinnungsaktivierung durch verschiedene Blutvolumen mit oder ohne menschlichen Nabelvenen-Endothelzellen (HUVEC) inkubiert. Während ein größeres Blutvolumen trugen zueine Zunahme der Bildung von Thrombin Antithrombin (TAT) -Komplexe, der Anwesenheit von HUVEC zu einem Abfall der Aktivierung der Gerinnung. Ferner verwendeten wir die Bildanalyse von Leukozyten-Bindung an HUVEC stimuliert mit Tumornekrosefaktor (TNF) und fanden das Vorhandensein von CD16 + Zellen signifikant höher auf TNF-stimulierten Zellen im Vergleich zu nicht stimulierten Zellen nach dem Kontakt mit Blut sein. Abschließend kann der Assay verwendet werden, um vaskuläre Pathologien, wobei Wechselwirkungen zwischen dem Endothel und der Blutkammer gestört werden studieren.
Einleitung
Methoden zur Analyse von Blut-Kreislauf-Interaktionen bei kardiovaskulären Erkrankungen sind generell mit Tierforschung Experimente. Ergebnisse in experimentellen Tiermodellen erstellt Forschung kann jedoch nur wenig oder keine Auswirkungen auf die menschliche Erkrankung. 1,2 Als solches gibt es einen Bedarf für eine gute und zuverlässige in-vitro-Modellen, um zelluläre Wechselwirkungen zwischen dem Blutabteil und vaskuläre Endothelzellen zu untersuchen eine menschenähnliche System. Wir haben deshalb eine Blut Endothelzellen Kammer Modell etabliert. Dieser basiert auf einer zum Wechselwirkungen zwischen Biomaterialien und menschlichem Vollblut untersuchen zuvor beschriebenen Modell. 3 Im Gegensatz zu anderen In-vitro-Setups, wo in der Regel beschränkte Anzahl gereinigten Komponenten, dh, Thrombozyten, Leukozyten oder Endothelzellen zur Verfügung stehen, enthält das vorliegende Modell alle die Komponenten präsentieren in einem Blutgefäß.
Der Aufbau der Blut endothelial cell Kammer-Modell ist auf die Verwendung von frisch entnommenen menschlichen Blutes mit wenig oder ohne Zusatz von Antikoagulans zu ermöglichen. Blut während längere Zeiträume gespeichert erwerben sogenannten Lagerläsionen, wo Abbau von Erythrozyten kann mit empfindlichen Wechselwirkungen zwischen Blut und Endothelzellen stören. 4
Gerinnselbildung während der Handhabung von Vollblut ex vivo zu vermeiden erfordert entweder hohe Dosen von Antikoagulans oder das gesamte Material in Kontakt mit Blut nicht-aktivierende sein. Als nicht-aktivierenden Oberflächen sind selten in der Laborumgebung können Materialien wahlweise mit einer Schutzschicht aus immobilisiertem Heparin ausgestattet werden. Eine Schutzschicht aus immobilisiertem Heparin, die meisten Materialien schaffen eine Oberfläche, wo Blutkontakt kann ohne eine Aktivierung der Gerinnungskaskade auftreten, angewendet werden kann (nachstehend als Corline Heparin Fläche (CHS) bezeichnet). 5 Somit kann durch Ausstattung der Kammern mit CHS, das Blut endothelialen cell Kammer Modell ermöglicht die Verwendung von sehr geringen Konzentrationen von Antikoagulans im Blut. Vermeidung der Zugabe von hohen Konzentrationen von Antikoagulans im Blut endothelial Kammer Modell ermöglicht es, empfindliche Wechselwirkungen innerhalb eines Blutgefäßes, die andernfalls verdeckt sein könnten, zu prüfen. 6
Das Blut Endothelzellen Kammer Modell besteht aus zwei Kammern, die durch Anbringen Kunststoffzylinder ausgebildet (Höhe: 8 mm; Radius: 9 mm) zu einem Kunststoffobjektträger. Die Kanten nach oben auf den Zylinder mit Nuten, die mit Gummi-O-Ringe zur Abdichtung der Kammern gegenüber dem Zellkulturträger ausgestattet sind, verwendet, ausgestattet. Die Kammern nur teilweise mit Blut gefüllt, wenn die Luft in die Kammer gelassen hält Blut in Bewegung, wenn die Kammern werden anschließend in eine vertikale Position (Figur 1) gedreht wird.
Um die Funktionalität des Modells zu bewerten, führten wir Experimente mit entweder einer vollständig beschichteten CHSKammer oder menschlichen Nabelschnurvenen-Endothelzellen (HUVEC). Zwei getrennte Blutvolumina wurden untersucht und die Bildung von Thrombin, Antithrombin (TAT) -Komplexe (ein indirekter Marker der Koagulation) wurde mit Enzym-gebundenen Immunosorbent-Assay (ELISA) gemessen. Wir haben dann beurteilt die Wirkung von Blutvolumina und Tumor-Nekrose-Faktor (TNF) stimuliert Endothelzellen auf Leukozytenrekrutierung durch Bildanalyse.
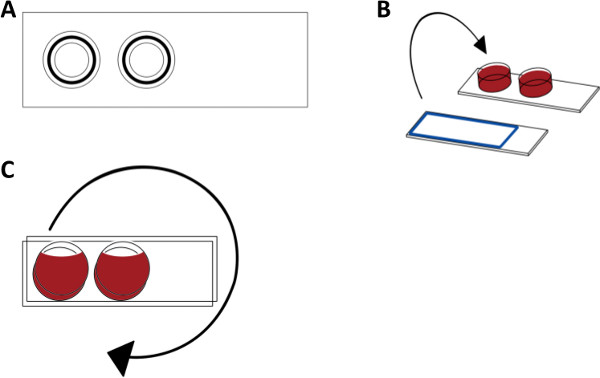
Abbildung 1. Aufbau des Blut Endothelzellen Kammer-Modell. (A) Draufsicht schematische Zeichnung der Blutkammer in PMMA. (B) Primäre humane Endothelzellen auf 1-well Kammer-Objektträgern kultiviert werden. Frisches menschliches Blut wird einem zwei Kammern auf einem Objektträger zugegeben. Die Kammern und zur Handhabung des Blutes verwendet alles Material mit einer Schutzbeschichtung HS behandelt. Nach dem Entfernen der Wände des cell Kulturträger, die Zellen gegenüber dem Blut angeordnet und das System gespannt wird geschlossen. (C) Das Blut endothelialen Zellkammern werden dann unter Drehung in 37 ° C inkubiert. Danach können die Reaktionen in der Blutkammer durch ELISA analysiert und die Endothelzellen kann durch Mikroskopie analysiert.
Protokoll
HINWEIS: Das Blut wurde von gesunden Individuen durch offene Systemvenenpunktion bei der Genehmigung mit der Ethical Review Board in Uppsala (Permit No. 2008/264) erstellt.
1. Seeding Cells
- Kultur primären menschlichen Nabelschnur-Endothelzellen (HUVEC) bei 37 ° C in 5% CO 2 in T75-Flaschen mit 1% Gelatine in PBS pH 7,4 beschichtet.
- Entfernen Kulturmedium aus einem T75-Kolben mit HUVEC (oder eine andere Art von primären humanen Endothelzellen) und wasche die Zellen mit 2,1 mM EDTA in PBS pH 7,4. Lösen die Zellen durch Zugabe von 1 ml 0,25% Trypsin-EDTA und Inkubation für 2 - 3 min in 37 ° C.
- Sammeln Zellen durch Spülen des Kolbens mit 9 ml 10% FBS in PBS pH 7,4 und übertragen die Zellsuspension in ein 15 ml Röhrchen. Spin down die Zellen bei 735 xg für 5 min.
- Entfernen Sie den Überstand und Zellpellet vorsichtig in endothelialen Zellwachstumsmedium mikrovaskulären (EG GMMV) und zählen Sie die Zellen in einer Bürker Kammer. Seed 21.000 cEllen / cm 2 in 1-Well-Zellkultur Dias und bei 37 ° C. 2 Tage der Kultur - Die HUVEC wird nach dem 1. konfluent werden. Überwachen Sie die Zellmorphologie und Konfluenz täglich unter einem Lichtmikroskop.
2. Herstellung von Vollblut
- Bereiten alle künstlichen Oberflächen, die mit Blut in Kontakt mit einer Doppelschicht aus immobilisiertem Heparin (CHS) sein wird gemäß den Anweisungen des Herstellers. CHS staub- beschichtete Materialien können bei Raumtemperatur bis zu 6 Monate ohne Funktionsverlust gelagert werden.
- Verwenden offenes System der Blutabnahme, um Blut aus einem gesunden Spender kurz (<30 min) vor dem Start des Blut endothelialen Kammer Experiment ziehen. Paar eine Injektionsnadel (18 G x 50 mm), um CHS beschichteten Silikonschlauch (Innendurchmesser: 2 mm) vor der Blutentnahme sorgfältig in ein CHS beschichteten 50-ml-Röhrchen. Supplement Blut mit unfraktioniertem Heparin, um eine Endkonzentration von 0,75 IU / ml zu erreichen. Mischen Sie das Blut sanft INVErting das Rohr 2 - 3 mal.
3. Blut Endothelial Chamber Modell
- Herstellung Blutkammern (1A, Draufsicht) in Acryl Polymethylmethacrylat (PMMA), die aus zwei Zylindern (Höhe 8 mm und der Radius 9 mm), die zu einer PMMA Schieber (25 x 75 mm) aufgeklebt werden. Montieren Sie die Kanten der Zylinder nach oben mit Gummi-O-Ringe, um die Blutkammer gegen die Glasobjektträger mit kultivierten Endothelzellen (Abbildung 1B) zu versiegeln. Drehen der Blutkammer zu dem Kulturträger mit Endothelzellen danach in einer vertikalen Position (1C) verbunden ist.
- Verwenden Sie ein CHS beschichtet Pipettenspitze bis 1,5 ml Blut in jeder CHS beschichtet Kammer kümmert sich nicht um das Blut zu aktivieren übertragen.
- 1 ml Blut in Mikrozentrifugenröhrchen mit 30 ul 0,34 MK 3 EDTA auf eine Endkonzentration von 10 mM K 3 EDTA zur Bestimmung der anfänglichen Plasmaproteinkonzentrationen zu erreichen mitein Enzym Linked Immunosorbent Assay (ELISA). Vorsichtig das Blut und die Rohre halten auf Eis.
- Entfernen Sie die Kunststoffwände der Zellkulturobjektträgern gemäß den Anweisungen des Herstellers und sorgfältig waschen Sie die Zellen in PBS pH 7,4. Achten Sie darauf, anschließend entfernen Sie so viel Flüssigkeit wie möglich aus den Folien. Lassen Sie sich nicht die Zellen austrocknen.
- Legen Sie die Folie auf der Oberseite der Blutkammern, mit Zellen mit Blick auf das Blut. Sichern Sie den Schlitten, indem eine Klammer um das Blut von Endothelzellen Kammer. Verwenden Sie einen Kunststoff-Rutsche für zusätzliche Unterstützung zum Bruch der Zellkultur Glasobjektträger zu vermeiden, wenn Sie den Klemme.
- Befestigen Sie den Blut Endothelzellen Kammer auf einem rotierenden Rad (40 cm Durchmesser) in einem 37 ° C Wasserbad. Drehen jeder Kammer auf das Rad bei 0,5 × g für 30 min.
- Nach der Inkubation zerlegen Blut Endothelzellen Kammer. Waschen Sie die Zellkulturträger in PBS pH 7,4 und fixieren die Zellen in eiskaltem 1% Paraformaldehyd (PFA) foder 10 min. 1 ml Blut aus jeder Kammer zu Mikrozentrifugenröhrchen mit 30 ul 0,34 MK 3 EDTA auf eine Endkonzentration von 10 mM K 3 EDTA zu erreichen, und die Röhrchen vorsichtig mischen. Halten Sie die Röhrchen auf Eis.
- Zentrifugieren der Röhrchen bei 4.560 xg für 10 min bei 4 ° C. Übertragen Sie das Blutplasma, um neue Reaktionsgefäße und lagern in -70 ° C bis zur weiteren Analyse.
4. Analyse der Blut Endothelial Wechselwirkungen
- Zuführen Immunfluoreszenzfärbung mit Maus-anti-Mensch-CD16, gefolgt von sekundären Ziege-anti-Maus-Alexa 488 und Phalloidin-TexasRed. Führen Sie jede Färbung Schritt für 1 h bei Raumtemperatur und Waschen der Objektträger in PBS pH 7,4 zwischen jedem Schritt. Gegenfärbung der Zellkerne mit DAPI für 10 min bei Raumtemperatur. Analyse Blutkomponenten an die Endothelzellen durch Fluoreszenzmikroskopie in Kombination mit Bildanalyse unter Verwendung von geeigneten Bildanalysesoftware, wie CellProfiler gebunden.
- Quantify die Reaktionen im Blut Fach mit Thrombin-Antithrombin (TAT) ELISA nach Herstellerangaben der Plasmaproben.
- Verwenden geeigneter statistischer Instrumente, z. B., einem ungepaarten t-Test, um die Daten zu analysieren.
Ergebnisse
Die Notwendigkeit der CHS Coating
Um Reaktionen in Vollblut spezifisch für die von den Endothelzellen hervorgerufen zu messen, müssen alle für das Blut Endothelzellen Kammer verwendeten Materialien mit einer CHS Schlichte vor Gebrauch eingerichtet werden. 2A (links) zeigt eine unbeschichtete Kammer nach 30 min Blutkontakt mit einem deutlich sichtbaren vorliegenden gerinnen. Behandeln der Kammer mit CHS (2A, rechts) auf der anderen Seite schützt das Blut aus unkontrollierte Aktivierung, so dass die Ergebnisse aufgrund der Endothelzellen Blut Wechselwirkungen.
Die Wirkung des Blutvolumen in der Kammer
Aktivierung der Koagulation ist als die Wahrscheinlichkeit der Wechselwirkung zwischen aktivierten Gerinnungsfaktoren erhöht wird wahrscheinlicher in stagnierenden Blut. Im Blut von Endothelzellen Kammer-Modell, wird das Blut in Bewegung aufgrund der Zirkulation einer Luftblase im Inneren der Kammer gehalten. In order, um die Wirkung von Änderungen des Blutvolumens Luftblasengröße zu bestimmen, und damit auch wurde eine CHS beschichtet Kammer zu einer CHS beschichteten Glasobjektträger, die mit 1,5 ml oder 1,75 ml Vollblut für 30 min getestet wurde, verbunden ist. Das Blutvolumen ohne Bewegung der Luftblase ist 2,5 Mal größer als 1,75 ml Blut in die Kammer aufgenommen Vergleich dazu, wenn 1,5 ml Blut verwendet wird (2B). Die gemessenen TAT-Werte vorgeschlagen TAT-Bildung mit einem erhöhten Blutvolumens (2D) erhöht. Wenn HUVEC (2C) wurden entweder mit 1,5 oder 1,75 ml Vollblut inkubiert wurde kein Unterschied zwischen den beiden Gruppen festgestellt, was darauf hindeutet, dass endotheliale Zellen die Aktivierung der Koagulation (2D) zu modulieren.
Die Wirkung von TNF auf Blood Cell Rekrutierung und Aktivierung von Gerin
Um die Wirkung von TNF auf die Rekrutierung von Leukozyten zu untersuchen, wurden HUVEC treated mit 20 ng / ml TNF & agr; 4 Stunden vor der Blutkontakt. Blutkontakt - entweder mit 1,5 ml oder 1,75 ml Blut - wurde für 30 min, wonach die Kulturträger wurden für CD16 (2F) gefärbt fort, abgebildet und die Zahl der CD16 + Zellen quantifiziert wurde. Die Rekrutierung von CD16 + Zellen signifikant erhöht mit TNF-Behandlung (2E) 100-256 CD16 + Zellen / mm 2 (p <0,0001) mit 1,5 ml Blut und 172 bis 378 (P <0,0001) mit 1,75 ml Blut. Die Bildung von TAT-Komplexe wurden in den entsprechenden Plasmaproben Blut entweder mit TNF behandelten oder unbehandelten Zellen (Figur 2G) inkubiert gemessen. TNF-stimulierten Zellen induzierte eine ungefähre Verdoppelung der TAT-Komplexe im Vergleich zu unbehandelten Zellen.
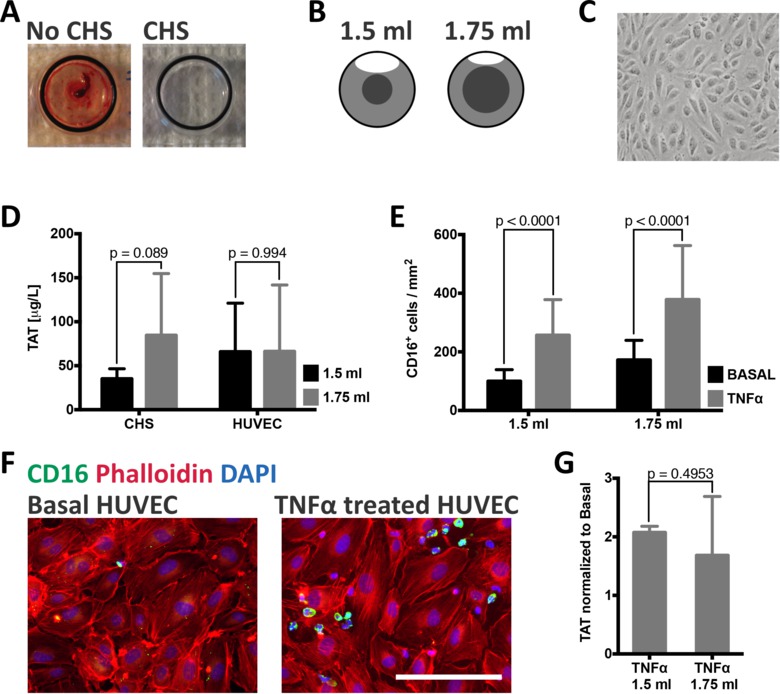
Feigeure 2: Funktionalität des Blutes Endothelzellen Kammer-Modell. (A) Chambers mit oder ohne CHS wurden mit Vollblut inkubiert. Ohne CHS wurde ein Gerinnsel nach 30 min gebildet. Messung der Thrombin-Antithrombin (TAT) -Komplexe, indirekter Marker der Gerinnung in Vollblut ohne CHS inkubiert war> 6000 pg / ml. (B) Das Blutvolumen nicht in Bewegung gehalten durch den rotierenden Luftblase mit unterschiedlichen Blutvolumina variieren. Mit der Zugabe von 1,5 ml des Blutes wird dieses Volumen 0,3 ml sein, während es auf 0,74 ml unter Zusatz von 1,75 ml zu erhöhen. (C) abgebildeten HUVEC mit Phasenkontrastmikroskopie zeigen typische endotheliale Zellmorphologie einer konfluenten Monoschicht vor Blutkontakt. (D) TAT-Werte für vollständig CHS beschichteten Kammern zeigen eine geringe Differenz, wenn verschiedene Blutvolumina werden hinzugefügt. Die Zugabe von 1,5 ml Blut in Folge 35 ± 11 pg / ml (n = 7) im Vergleich zu 1,75 ml, das in 85 resultierte77; 70 & mgr; g / ml TAT (n = 8). Dieser Unterschied ist nicht mehr vorhanden, wenn HUVEC mit den gleichen Blutmengen inkubiert; 66 ± 55 ug / ml 1,5 ml (n = 5) und 66 ± 29 pg / ml 1,75 ml (n = 7). (E) Quantifizierung der Zahl der CD16 + Zellen auf entweder unstimuliert oder stimuliert TNF & agr vorliegenden HUVECs nach Blutkontakt. Die Zahl der CD16 + Zellen signifikant erhöht mit TNF stimulierten Zellen, die entweder mit 1,5 ml (basal: 100 ± 40 Zellen / mm; TNFa: 256 ± 121 Zellen / mm) inkubiert und 1,75 ml (basal: 172 ± 67 Zellen / mm; TNF: 378 ± 185 Zellen / mm) von Vollblut (F) Repräsentative Bilder der unstimulierten und TNF-stimulierte HUVEC für Phalloidin (rot gefärbt), CD16 (grün) und DAPI (blau).. Maßstabsbalken = 250 & mgr; m (g) die Bildung von TAT-Komplexe wird grob durch TNF stimulierten Zellen verdoppelt im Vergleich zu unbehandelten Zellen mit Blut (1,5 ml inkubiert. 2.1 ± 0,1 mal mehr TAT, n = 3; 1,75 ml: 1,7 ± 1,0 mal mehr TAT, n = 4). Alle Werte sind als Mittelwert ± Standardabweichung dargestellt; p-Werte wurden durch ungepaarte t-Tests berechnet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Mehrere Interaktionen zwischen der Blutgefäßwand und werden normalerweise in einem Ruhezustand aufgrund der Nichtklebe und antithrombotische Beschaffenheit des Endothels gehalten. 7 Bei pathologischen Zuständen, die eine Entzündung, wird das Endothel mit einer resultierenden Zunahme der Haftrezeptorexpression 8 aktiviert und eine reduzierte Fähigkeit zur Hemmung der Hämostase. 9 Aktivierung der Kaskadenanlagen im Blut wiederum verstärkt die Thrombogenität des Endothels verursacht weitere Thrombose und Leukozytenrekrutierung. 10 Um ein besseres Verständnis für diese heikle Interaktionen zwischen Endothelzellen und Vollblut zu gewinnen, haben wir entwickelten ein neuartiges Verfahren, bei dem in vitro kultivierten Endothelzellen in Kontakt mit Vollblut gegeben. Nach unserem Wissen ist unser Setup der Erste, der Endothelzellen mit menschlichem Vollblut mit keinen oder sehr wenig Antikoagulans für längere Zeiträume inkubiert zeigen.
nt "> Die Empfindlichkeit dieses Systems wird durch Venenpunktion offenen System in Kombination mit einer Schutzschicht aus immobilisiertem Heparin auf alle mit Blut in Kontakt gebracht Oberflächen ermöglicht. Die Verwendung eines offenen Systems während der Blutbeschaffungs reduziert die Aktivierung der Kaskadensysteme während der Blutentnahme während die die Verwendung einer selbstbestimmten Menge von Antikoagulans. Kommerziell erhältliche evakuierten Blutröhrchen kann jedoch abhängig von den beabsichtigten Endpunkte der Studie verwendet werden. Die Endkonzentration von Antikoagulans zu den meisten kommerziell erhältlichen geschlossenen System Röhrchen gegeben empfindlich hemmen und ansonsten schwer in der Setup studieren Wechselwirkungen. 6 eine Schutz Heparin Oberfläche beseitigt weiterhin die Aktivierung des Blutes durch Oberflächenkontakt mit anderen als den Endothelzellen Oberflächen. 5 Tatsächlich Inkubation von Vollblut mit einer kleinen Menge an unfraktioniertem Heparin ergänzt Kammer ohne den Schutz der CHS in Folge der Gerinnselbildung. Die Luftblase in der Kammer ermöglicht Mischen des Blutes während der Inkubation mit den Endothelzellen. Um die Wirkung des Luftblasengröße zu bewerten, haben wir zwei verschiedene Blutvolumen. In diesem Modell messen wir ähnliche TAT Ebenen unabhängig von Luftblasengröße in Kammern mit HUVEC inkubiert. TAT war, stieg jedoch mit einem kleineren Luftblasengröße in den voll CHS behandelten Kammern. Diese in Übereinstimmung mit den zuvor beschriebenen Eigenschaften der Endothelzellen 11 zeigt eine regulatorische Wirkung auf die verstärkte Aktivierung der Gerinnung durch die Endothelzellen, die in der inerten CHS Kammer fehlt vorgesehen. Die Luftblase in dem System erzeugt eine Strömung bei einer Drehung der Kammer. Die Größe der Blase ist, die Kräfte in diesem Drehsystem beeinflussen. Dies wird durch unsere Ergebnisse in 2D gezeigt waren eine kleinere Blase erzeugt höhere TAT Werten, die eine verringerte Kraft auf den Blut dh die Blutbewegunginnerhalb der Kammer geringer ist und dadurch die Aktivierung des Kaskadensystems in einem höheren Ausmaß auftritt. Es sollte erwähnt werden, dass in diesem System schaffen wir eine rotierende Strömung, die in der Geschwindigkeit verschieden sein wird über die Kammer mit der höchsten Geschwindigkeit auf den Wänden und dem niedrigsten in der Mitte. Dies ist offensichtlich nicht eine optimale Umgebung hinsichtlich Strömung und Scherbeanspruchung für die Endothelzellen, aber wir haben ein System Herstellung von stabilen und reproduzierbaren Ergebnissen. Weitere optimalen Bedingungen würde beinhalten zirkulierenden laminare Strömung in der Abwesenheit von Turbulenzen. Dies ist jedoch nicht möglich, in der hier dargestellten Modells und unseres Wissens ein solches System nicht verfügbar ist aktuell. Obwohl es mehrere mikrofluidische Systeme im Handel erhältlich, die nicht möglich ist, mit Vollblut ohne oder mit geringen Mengen von Antikoagulans zu dem System hinzugefügt werden, wodurch kombinieren können korrekten empfindliche Auswertung der Wechselwirkungen zwischen allen im Blut und Endothelzellen Komponenten ermöglichen.Weiterhin gab es eine 2-fache Zunahme bei der Einstellung von Blutzellen in Richtung TNF aktiviert HUVEC in Kombination mit einem verdoppelten Bildung von TAT unabhängig von dem Blutvolumen. Dies belegt die Stabilität des Modellsystems und zeigt auch die Möglichkeit, ein aktiviertes Endothel in Kombination mit Vollblut verwenden. Zukunft der Blutkammer Endothelzellen verwendet werden, um Blutzellrekrutierung zu aktivierten Endothelzellen durch eine Vielzahl von Markern auf Zellen unter verschiedenen Bedingungen und Stufen der Aktivierung exprimiert untersuchen. Darüber hinaus kann das Modell in Kombination mit pharmakologischen Mitteln, um Auswirkungen auf Entzündungszustände auswerten verwendet werden.
Zusammenfassend zeigen wir den großen Vorteil der Kombination einer Kammermodell mit menschlichem Blut und Gefäßzellen, um eine vollständige menschliche in vitro-System die relevanten Untersuchungen von Gefäßerkrankungen durchführen zu erstellen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Studie wurde unterstützt durch Zuschüsse aus dem Schwedischen Forschungsrat (90293501, A0290401, A0290402), Siebte Rahmenprogramm der Europäischen Gemeinschaft im Rahmen der Finanzhilfevereinbarung unterstützt Nr 602.699 (DIREKT), der NovoNordisk Stiftung, der Gurli und Edward Brunnberg Stiftung, Stamm Therapie, Vleugel Stiftung und Åke Wiberg Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Human Umbilican Vein Endothelial Cells (HUVEC) | PromoCell | C-12200 | Any other type of primary human endothelial cell may be used. |
| Endothelial Cell Growth Medium MV (ECGM MV) | PromoCell | C-22120 | |
| Gelatin | Sigma-Aldrich | G-2500 | Prepare 1% gelatin in PBS, incubate 5 ml in a T75 for 15 min and remove before culturing cells. |
| TAT ELISA | Enzyme Research Lab. | TAT-EIA-C | |
| Mouse anti-human CD16 | DAKO | F7011 | Dilution 1:100 |
| Goat anti-mouse Alexa 488 | Molecular Probes | A11001 | Dilution 1:500 |
| Phalloidin-Texas Red | Molecular Probes | A22287 | Dilution 1:200 |
| DAPI | Molecular Probes | D1306 | Dilution 10 μg/ml |
| EDTA | Sigma | E-6758 | |
| 0.25% Trypsin-EDTA | Gibco Life Tecnologies | 25200-056 | |
| Fetal Bovine Serum (FBS) | Gibco Life Technologies | 10437 | |
| 1 well cell culture slides | BD Falcon | 354101 | |
| Blood Chambers | NA | NA | Blood Chamber may be manufactured in PMMA or any other plastic able to bind CHS |
| Clamps | Office Depot | 2052204 | |
| Corline Heparin Surface (CHS) | Corline Systems AB | 945-00 | |
| Hypodermic needle | Terumo | NN-1850R | Size: 18 G x 5 mm |
| Unfractionated Heparin (UFH) | Leo Pharma | 585679 | |
| K3EDTA | Alfa Aesar | 1709958 | Prepare a 0.34 M stock solution in milliQ H2O |
| PFA | Sigma-Aldrich | P-6148 | |
| Fluorescence microscope | Nikon | 80i | |
| Light microscope | Nikon | TS100 | |
| Image analysis software | Broad Institute | CellProfiler | Available for free at www.cellprofiler.org |
Referenzen
- Mestas, J., Hughes, C. C. W. Of Mice and Not Men: Differences between Mouse and Human Immunology. J Immunol. 172 (2), 2731-2738 (2004).
- Seok, J., et al. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110 (9), 3507-3512 (2013).
- Hong, J., Ekdahl, K. N., Reynolds, H., Larsson, R., Nilsson, B. A new in vitro model to study interaction between whole blood and biomaterials. Studies of platelet and coagulation activation acid the effect of aspirin. Biomaterials. 20 (7), 603-611 (1999).
- Doctor, A., Spinella, P. Effect of Processing and Storage on Red Blood Cell Function In. Vivo. Semin Perinatol. 36 (4), 248-259 (2012).
- Andersson, J., et al. Optimal heparin surface concentration and antithrombin binding capacity as evaluated with human non-anticoagulated blood in vitro. J Biomed Mater Res A. 67 (2), 458-466 (2003).
- Ekdahl, K. N., Hong, J., Hamad, O. A., Larsson, R., Nilsson, B. Evaluation of the blood compatibility of materials, cells, and tissues: basic concepts, test models, and practical guidelines. Adv Exp Med Biol. 735, 257-270 (2013).
- Aird, W. C. Spatial and temporal dynamics of the endothelium. J Thromb Haemost. 3 (7), 1392-1406 (2005).
- Cines, D. B., et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders. Blood. 91 (10), 3527-3561 (1998).
- Kirchhofer, D., Tschopp, T. B., Hadvary, P., Baumgartner, H. R. Endothelial cells stimulated with tumor necrosis factor-alpha express varying amounts of tissue factor resulting in inhomogenous fibrin deposition in a native blood flow system. Effects of thrombin inhibitors. J Clin Invest. (5), 2073-2083 (1994).
- Esmon, C. T. Molecular circuits in thrombosis and inflammation. Thromb Haemost. 109 (3), 416-420 (2013).
- Rosenberg, R. D., Aird, W. C. Vascular-Bed–Specific Hemostasis and Hypercoagulable States. N Engl J Med. 340 (20), 1555-1564 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten