Method Article
In Situ Ca 2+ Imaging des enterischen Nervensystems
In diesem Artikel
Zusammenfassung
The enteric nervous system (ENS) is a network of neurons and glia located in the gut wall that controls intestinal reflexes. This protocol describes methods for recording the activity of enteric neurons and glia in live preparations of ENS using Ca2+ imaging.
Zusammenfassung
Reflex behaviors of the intestine are controlled by the enteric nervous system (ENS). The ENS is an integrative network of neurons and glia in two ganglionated plexuses housed in the gut wall. Enteric neurons and enteric glia are the only cell types within the enteric ganglia. The activity of enteric neurons and glia is responsible for coordinating intestinal functions. This protocol describes methods for observing the activity of neurons and glia within the intact ENS by imaging intracellular calcium (Ca2+) transients with fluorescent indicator dyes. Our technical discussion focuses on methods for Ca2+ imaging in whole-mount preparations of the myenteric plexus from the rodent bowel. Bulk loading of ENS whole-mounts with a high-affinity Ca2+ indicator such as Fluo-4 permits measurements of Ca2+ responses in individual neurons or glial cells. These responses can be evoked repeatedly and reliably, which permits quantitative studies using pharmacological tools. Ca2+ responses in cells of the ENS are recorded using a fluorescence microscope equipped with a cooled charge-coupled device (CCD) camera. Fluorescence measurements obtained using Ca2+ imaging in whole-mount preparations offer a straightforward means of characterizing the mechanisms and potential functional consequences of Ca2+ responses in enteric neurons and glial cells.
Einleitung
Das enterische Nervensystem (ENS) ist in zwei ganglionated Plexus in der Wand des Verdauungstraktes 1 eingebettet organisiert. Diese intramuskuläre neuronalen Schaltkreise, die Plexus myentericus (MP) und submuköse Plexus (SMP), werden von Neuronen und Glia magensaftresistenten (Abbildung 1) 2 zusammen. Die MP und SMP Regulierung gastrointestinale (GI) Funktionen wie Motilität und epithelialen Absorption und Sekretion bzw. 3. Magensaftresistente Gliazellen sind in unmittelbarer Nähe zu Neuronen im Ganglion aber Populationen von magensaftresistenten Glia befindet Darüber hinaus bestehen innerhalb verbindenden Faserbahnen und außerGangLien Teile der Darmwand 3,4. Magensaftresistente Gliazellen wurden ursprünglich angenommen, dass nur nutritive Unterstützung Neuronen liefern. Doch neuere Studien deuten stark darauf hin, dass Neuron-Glia Interaktionen sind für die ENS-Funktionen 5,6. Zum Beispiel Daten zeigen, dass enterische Glia "hören" neuronale Aktivität 7und Modulieren neuronaler Schaltkreise 6,8, enterischen Neuronen zu schützen vor oxidativem Stress 9 und sind in der Lage zur Erzeugung von neuen enterischen Neuronen in Reaktion auf eine Verletzung 10,11. Die in diesem Beitrag vorgestellten Protokoll bietet eine einfache und robuste Methode, um das komplexe Zusammenspiel von Neuronen und Glia enterische Verwendung von in situ intrazellulären Ca 2+ Bildgebung zu untersuchen.
Ca 2+ ist ein allgegenwärtiges Signalmolekül in erregbaren Zellen und spielt eine wesentliche Rolle bei der synaptischen Signalereignisse im Nervensystem 12. Die Anregung der Neuronen oder Gliazellen ente löst eine Erhebung in cytoplasmatischen Ca 2+ -Konzentration entweder durch Einstrom durch Ca 2+ durchlässige Kanäle oder Ca 2+ -Freisetzung aus intrazellulären Kalziumspeichern. Imaging Ca 2+ Transienten in Neuronen und Glia mit fluoreszierenden Farbstoffen ist eine etablierte und weit verbreitete Technik, um die funktionelle Organisation und Dynamik zu studierendie ENS 13-17. Ca2 + Imaging hat sich gezeigt, ein wichtiges Instrument bei der Untersuchung intakt GI Gewebesegmente, um die Ausbreitung der Erregbarkeit durch ICC Schrittmacher Netzwerke 18 und Darm der glatten Muskulatur 19,20 aufzuklären sein. Es ermöglicht es Forschern, ein breites Spektrum von physiologischen Parametern zu untersuchen und liefert Informationen über sowohl die räumliche Verteilung und zeitliche Dynamik. Die Zellen können effizient in einem minimal-invasiven Weise unter Verwendung membranpermeable Fluoreszenzindikatoren und optimierte Färbeprotokollen 21 gefärbt werden. Dies bietet die Möglichkeit, eine große Anzahl von Neuronen und Glia ente in funktionell erhaltenen Zubereitungen 14-16,22 überwachen, sowie in vivo 23. Whole-mount Gewebezubereitungen Masse mit einer hochaffinen Ca 2+ Indikatorfarbstoff beladen, wie Fluo-4, das seine Fluoreszenz steigt, wenn Ca 2+ gebunden. Veränderungen in der Fluoreszenz werden durch eine CCD-Kamera und ana zeichnetensiert digital 6. Das Aufkommen von Ca 2+ bot die Gelegenheit, Neuronen und Gliazellen Zell-Interaktionen, Reaktionsfähigkeit auf verschiedene Reize zu überwachen und die Beteiligung dieser Zelltypen im Magen-Darm-Prozesse in Echtzeit.
In situ ist Ca2 + Imaging großen Einblick in die Signalmechanismen von enterischen Neuronen und Glia ergab und besitzt mehrere deutliche Vorteile gegenüber Zellkulturmodellen 6,24. Zum einen in situ Vorbereitungen halten die native Matrix-Umgebung von Neuronen und Glia und lassen den Großteil ihrer Verbindungen zu Gewebe intakt Ziel. Zweitens werden die Genetik und die Morphologie der kultivierten ente Glia signifikant verändert im Vergleich zu in vivo 6,24. Drittens werden viele hetero Wechselwirkungen in primären Zellkultur verloren, und diese Grenzen der Beurteilung der Zell-Zell-Interaktionen. Obwohl kultivierten Zellen sind gut für die Untersuchung der fundamentalen Eigenschaften, die usefulne geeignetss für die Untersuchung komplexer Interaktionen zwischen enterischen Gliazellen und Neuronen ist begrenzt. Untersuchung von Neuron-Glia-Wechselwirkung mit einem in situ Ansatz ist physiologisch relevant wie die synaptischen Bahnen intakt 25 bleiben. Im Vergleich zu Zellkulturansätzen, eine in-situ-Ansatz bietet bessere Bedingungen für die systematische Verständnis der komplexen Wechselwirkungen zwischen Neuronen und Gliazellen ente. Darüber hinaus ist die planare Organisation der ganglionated Plexus ganz Montage Präparate ideal für Fluoreszenz-Bildgebung des intrazellulären Ca 2+ Transienten und diese Technik bietet eine einfache Methode zur Bewertung Neuron-Glia-Aktivität im ENS.
Protokoll
HINWEIS: Die folgenden Verfahren mit Gewebe von Labortieren entsprechen den AVMA Richtlinien für die Euthanasie von Tieren 2013 und wurden im Vorfeld von der Michigan State University IACUC zugelassen.
1. Gewebepräparation
- Anesthetize Forschungstier in einer Kammer, die 2,5% Isofluran in Sauerstoff oder indem 3-5 ml Flüssigkeit Isofluran auf ein saugfähiges Material, auf dem Boden der Kammer, so dass eine physikalische Barriere verhindert Tiere vor einem direkten Kontakt mit der Isofluran. Test für die Tiefe der Anästhesie durch Einklemmen der Fußballen.
HINWEIS: Die Narkosetiefe wird als angemessen erachtet, wenn es keinen Rückzug Reflex der hinteren Gliedmaßen. Sobald angemessen betäubt, einschläfern die Maus durch Genickbruch - Legen Sie das Tier in Rückenlage und reinigen Bauchhaut mit 70% Ethanol. Verwenden einer Pinzette, um Bauchhaut eingeklemmt an der Mittellinie und verwenden chirurgische Scheren, ein 6 cm Medien machenl Schnitt entlang der Linea alba, interne Verdauungsorgane aussetzen.
- Verwenden stumpfen Pinzette zu finden und setzen den Ileum in das Bauchfell. Schneiden Sie das Ileum / Doppelpunkt Gekröse mit Schere und beginnen Entschlüsselung der Darm.
- Sobald die Länge des Darms ausreichend aufgeklärt, schneiden den Darm distal zum Magen und proximal zum Blinddarm eine Ileum Zubereitung. Für eine Dickdarmvorbereitung, schneiden Sie den Doppelpunkt distal der Blinddarm und proximal des Mastdarms.
- Schnelles Entfernen des Darmsegment und legen Sie sie in ein Becherglas mit DMEM / F12-Medium mit 3 uM Nicardipinhydrochlorid und 1 uM Scopolamin-Hydrochlorid ergänzt auf Eis (im Folgenden als "Medien" bezeichnet). Die Zugabe dieser Inhibitoren erleichtert Mikrodissektion und die anschließende Bildgebung durch Lähmung der Darm glatten Muskulatur.
- Geschnittenen Segmentes von Interesse (zB, Jejunum, Ileum, distalen oder proximalen Kolon) basierend auf den bekannten anatomischen Markierungen. Typischerweise utilize Gewebe vom distalen Ileum oder distale Kolon. Allerdings haben das gleiche Verfahren, um in allen Darmabschnitten zu isolieren, Last und Bild myentericus Neuronen und Gliazellen.
- Entfernen Sie ein kleines Segment (4-6 cm) der gewünschten Darmsegment und in ein Sylgard-beschichtete Petrischale mit Kalt Medien gefüllt.
- Sichern Sie das proximale und distale Ende des Darmsegment mit Insekten Stifte und öffnen Sie das Darmrohr, indem Sie eine gerade, in Längsrichtung des mesenterialen Grenze geschnitten.
- Pin Flachgewebe unter leichter Spannung mit Schleimhautseite nach oben und sorgfältig sezieren entfernt Schleimhautschicht mit feinen Pinzetten (# 5 und # 5/45 funktionieren am besten) und sehr feine Feder Schere.
HINWEIS: Die Entfernung der Schleimhaut kann für die ENS ziemlich traumatisch sein, wenn nicht richtig gemacht. Zur Qualitätspräparate, achten Sie darauf, abrupten Entfernung der Schleimhaut durch Schälen oder Abschaben begrenzen. Die beste Vorgehensweise ist es, die Schleimhaut zu heben und unter schneiden mit einer feinen Schere. - Schneiden Sie das Gewebe in kleinere Vorbereitungs (etwa 0,5 cm 2) und der Stift in die Abbildungsschalen (4 Ecken mit kreisförmigen Muskelschicht nach oben) auf Eis mit frischen Medien platziert.
- Sorgfältig sezieren entfernt Ringmuskel durch Auseinander necken mit feinen Pinzette, um den Plexus myentericus aus. Vermeiden Sie übermäßige Dehnung.
- Zeigen Bildschale wieder auf Eis und Veränderung Lösung durch frische Medien.
- Planen 2 ml Enzymmischung pro Schale [Dispase 1 U / ml (4,48 mg / 8 ml), Collagenase Typ II 150 U / ml (5,45 mg / 8 ml) in Medium].
- Gerichte entfernen aus Eis und fügen Sie die Enzymmischung aus Schritt 1.13.
- Geschirr Inkubieren bei RT für 15 min mit 5% CO 2/95% Luft.
- Wash Gewebepräparaten mit Medien 3 Mal und wieder Stift Ecken.
2. Laden Fluo-4 Dye
HINWEIS: Vermeiden Sie Photobleichung durch die Zusammenarbeit mit begrenztem Licht beim Umgang mit Fluoreszenzfarbstoffen und Gewebe mit Indikatorfarbstoffe geladen.
- Bereiten Sie 4 uM Fluo-4 Beladungslösung.
- 1,5 ml Medium und 1,2 ul einer 250 mM Probenecid Lager in ein 1,5-ul-Aliquot von 4 mM Fluo-4 auf Lager. Bis 50 & mgr; g Fluo-4 AM; 4 mM Fluo-4 Lager wird durch Zugabe von 11,4 & mgr; l Pluronic F-127 (0,25% Cremaphor-EL ergänzt 20% DMSO) hergestellt.
- Minipreps Inkubieren in Fluo-4 Aufgabelösung für 45 min in einem dunklen Inkubator bei 37 ° C.
- Von Inkubator ausziehen und Vorbereitungen mit Medien 3 mal.
- Austauschmedium für Medien, enthaltend 200 uM Probenecid und Inkubation 15 min bei 37 ° C vor der Bilderzeugung.
HINWEIS: Probenecid ist ein Medikament, das Multidrug-Resistenz-Transporter in Nervenzellen hemmt. Die Zugabe dieses Medikament hemmt die Fähigkeit der Neuronen Farbstoffe extrudieren und verbessert neuronalen Kennzeichnung. Massenladens von Ca 2+ Indikatorfarbstoffen in Abwesenheit von Probenecid produziert Gliazellen Belastung. Die Zugabe von Probenecid ermöglicht die Visualisierung der neuronalen und glialen Antworten. - Bereiten Geändert Krebs Puffer.
- Machen eine modifizierte Krebs-Puffer, so daß die Endkonzentrationen (in mM) der Komponenten sind wie folgt: 121 NaCl, 5,9 KCl, 2,5 CaCl 2, 1,2 MgCl 2, 1,2 NaH 2 PO 4, 10 HEPES, 21,2 NaHCO 3, 1 Brenztrauben Säure und 8 Glucose (pH-Wert mit NaOH auf 7,4 eingestellt). In 3 uM Nicardipin und 1 uM Scopolamin zu Muskelkontraktionen während Ca 2+ hemmt Bildgebung und ganze-mount Dissektionen.
3. Imaging and Analysis
HINWEIS: Verwenden Sie zumindest ein grundbildgebende Anlage mit einer Leuchtstofflampe, Mikroskop, einer Qualität CCD-Kamera und entsprechende Erfassungssoftware. Variieren die Zugabe von anderen Komponenten in Abhängigkeit von der Lichtquelle und der spezifischen Anwendung. Ein Filterrad und Verschluss muss mit einem herkömmlichen Xenon-Bogenlichtquelle verwendet werden. Allerdings sind LED-Lichtquellen und Beleuchtungssysteme erfordern diese Komponenten.
- Positionieren Sie die recording Kammer unter dem Mikroskop und mit einem Schwerkraftfluss Perfusionssystem mit mehreren beheizten Spritze Reservoirs ein ständiger Perfusionsrate von 2-3 ml / min von 37 ° C Krebs-Puffer. Achten Sie darauf, die Luftblasenbildung sowohl in der Eingangs- und Saugleitung an eine Vakuumfalle verbunden zu verhindern.
- Bringen Sie die gewünschten Plexus in den Fokus unter Hellfeldbeleuchtung. Vermeiden Sie eine Überbelichtung Gewebe, das auf ein Foto, Bleich führen kann.
- Untersuchen Sie die Fluo-4 Belastung innerhalb Ganglien und wählen gesunden Ganglien für die Bildgebung. Ungesunde / beschädigt Ganglien wird Autofluoreszenz oder punktförmige Morphologie aufweisen und sollte nicht für die Bildgebung verwendet werden.
- Sobald Ganglion ausgewählt ist, abzulenken Lichtweg zur Kamera und Livebild mit Bildaufnahme-Software zu erhalten. Stellen Sie sicher, dass die Ganglien ist scharf und stellen Bildaufnahmerate und Belichtungszeiten.
HINWEIS: Bildaufnahmeraten und Zeiten je nach den Ereignissen Ermittler aufnehmen möchten variieren. Für die meisten Experimente, Bilderwerden traditionell bei 0,5-1 Hz für Gliazellen und bis erworben 2-10 Hz für Neuronen aufgrund glial Ca 2+ Reaktionen sind nicht so schnell wie Ca 2+ Transienten in Neuronen. - Beginnen Sie experimentieren und zu etablieren Grundaktivität für 30 Sekunden.
- Anwenden vorgewärmten Drogen von Interesse, wie Agonisten und Antagonisten unter Verwendung der Schwerkraftströmung Perfusionssystem mit einer Geschwindigkeit von 2-3 ml / min. Folgen Anwendung von Agonisten / Antagonisten durch die Rückkehr zu einer normalen Perfusion von Puffer und ermöglichen eine Wäsche / Erholungszeit von mindestens 10 min.
HINWEIS: Die Drug Application-Zeiten hängen von der einzelnen Verbindung und experimentelles Design variieren. Im Allgemeinen ist ein 20-30 sec Anwendung Agonist ausreichend G-Protein-gekoppelten Rezeptoren in Neuronen und Gliazellen aktivieren. Jedoch ligandengesteuerten Ionenkanäle (wie Nikotinacetylcholinrezeptoren) erfordern Anwendungszeiten von nicht mehr als 5-10 sec. Weitere Dauer Expositionen verursachen Liganden gesteuerte Ionenkanäle, schnell desensitize. Antagonisten sollte für ca. 3-15 Minuten angewendet werden, um eine vollständige Blockade des Rezeptors Wege zu gewährleisten. Dies ist jedoch eine grobe Verallgemeinerung und Ermittler sollten immer optimieren jede experimentelle Droge in ihrem jeweiligen Paradigma. - Stoppen Sie die Aufnahme und Ansicht Zeitraffer-Film des Experiments. Sorgfältig ausgewählte Regions of Interest (ROI) mit dem entsprechenden Bildanalyse-Software.
- Verwenden Sie Software, um zu normalisieren und vergleichen ROI Fluoreszenzintensität gegen seine ursprüngliche Ausgangsfluoreszenzwert. Veränderungen normalisierten Fluoreszenz direkt proportional zu den Änderungen der [Ca2 +].
- Verwenden einer Modifikation eines Verfahrens unter Verwendung & Delta; F / F = ((F 1 - F 0) / F 0), die vorher beschrieben 26 ROI - ((F 1 - F 0) / F 0) Hintergrund, wobei F1 die Fluoreszenz bei einer gegebenen Punkt und F0 ist die Grundlinie Fluoreszenz, um die Beurteilung Genauigkeit zu verbessern. Diese Modifikation Hilfsmittelbei der Verringerung der Lärm von Fluoreszenzänderungen in Gewebepräparaten, die Bewegung zu zeigen von der Muskelschicht der Plexus myentericus zugrunde liegen.
Ergebnisse
Die richtige Anwendung dieser Technik können Forscher die genaue Messung der intrazellulären Ca 2+ [Ca2 +] i-Transienten in enterischen Neuronen und Glia ganz-mount Gewebezubereitungen. Ein repräsentatives Beispiel für einen Agonisten hervorgerufene Ca 2+ Antworten in Gliazellen in einem myentericus Ganglion von der Maus Doppelpunkt bei Video 1 gezeigt. Die folgenden Ergebnisse sind dazu gedacht, einige repräsentative Ergebnisse, die wir unter Verwendung dieses Verfahrens zu illustrieren. Erstens, Figur 2 zeigt die Ergebnisse eines Experiments Messente glial [Ca 2+] i im Ansprechen auf eine Stimulation durch ATP in Meerschweinchen colonic Längsmuskel-Plexus myentericus (LMMP) Zubereitungen. Insbesondere zeigt diese Figur die Methode für die korrekte Analyse der Versuchsprotokoll vor, einschließlich der Umriss des analysierten myentericus Ganglien und Sternchen bezeichnet die Lage des enterischen Neuronen aufgeführt. Diese Ergebnisse zeigen auch illustrate die optimale Dosis von hundert mikromolaren ATP über die Inanspruchnahme des [Ca 2+] i in Meerschweinchen myentericus Gliazellen. Diese Antwort kann verwendet werden, um enterische Glia-Stimulation zu kalibrieren und zu normalisieren Reaktionen auf Reize zu testen. Nächstes Bild 3 verdeutlicht, wie man richtig wählen Regions of Interest (ROIs) umgeben Gliazellen, mit umgebenden gelben Kreisen gezeigt. Diese Ergebnisse zeigen auch die gewünschten Fluoreszenzänderungen unter basalen Bedingungen und in Reaktion auf pharmakologische Stimuli. Schließlich Abbildung 4 zeigt die räumliche Überlegungen für die Wahl enterischen Gliazellen und Neuronen für [Ca 2+] i Antworten ganz-Mount-Präparaten.
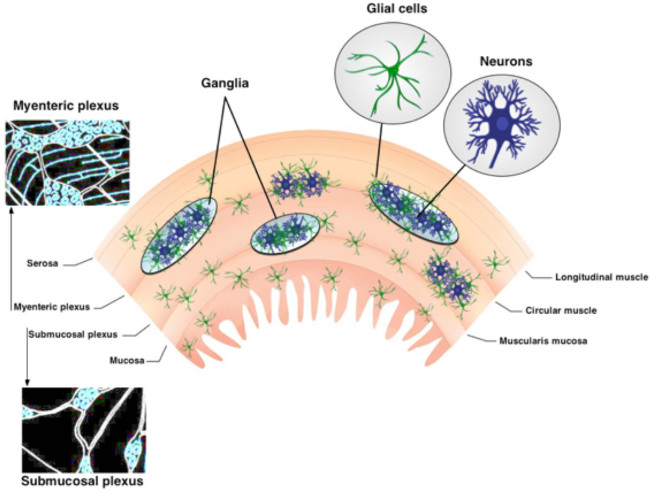
Abbildung 1. Organisation der ENS. Die ENS enthält zwei Haupt ganglionated Plexus. Der Plexus myentericus zwischen dem l liegtongitudinal und Kreismuskelschichten. Die submuköse Plexus zwischen der Schleimhaut und der Ringmuskelschicht entfernt. Die ENS ist ausschließlich von Neuronen und Glia ente zusammen. Nervenfaserbahnen verbinden den Ganglien. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
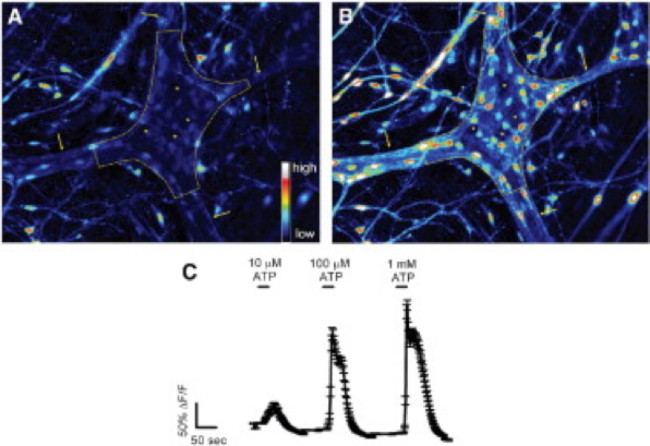
Abbildung 2. Enteric Glia im Meerschweinchen Kolon Plexus myentericus reagieren auf in situ ATP. (A) Fluo-4 Fluoreszenz in einem myentericus Ganglien unter basalen Bedingungen (durch eine gestrichelte Linie umrandet). Pfeile zeigen auf dicken interganglionic Faserbahnen. (B) Nach der Stimulation mit 100 mmol / L ATP, Gliazellen, aber nicht Nervenzellen, schnell zu erhöhen Fluo-4 Fluoreszenz, die eine Zunahme der [Ca 2+] i. Beachten Sie, dass reagierenden Zellen klein sind und umgeben die viel größer Neuronen (durch Sternchen markiert dunklen Räumen). (C) Magensaft Glia ATP reagieren in einer Dosis-abhängige Weise mit 1 mmol / L entlocken Maximalreaktionen 24. Bitte klicken Sie hier, um einen Blick Größere Version der Abbildung.
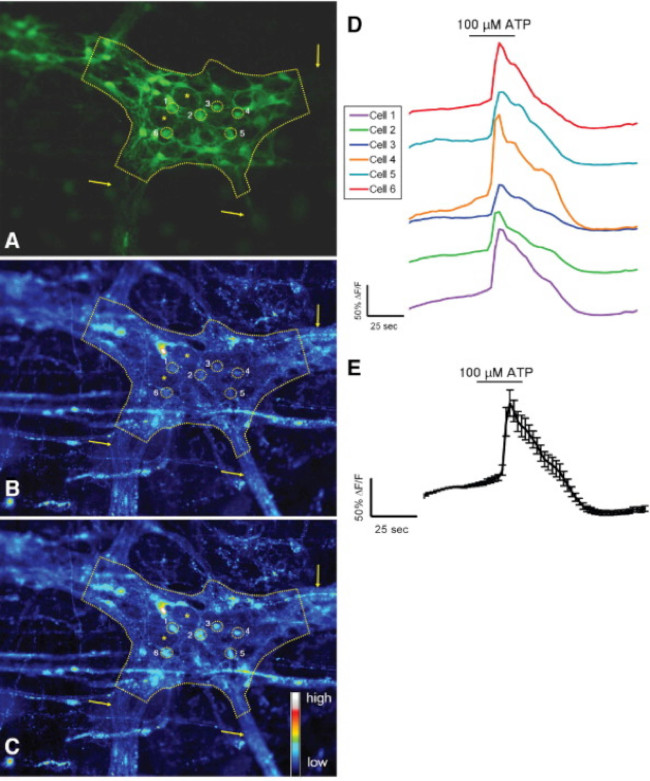
Abbildung 3. Murine S-100-GFP + Zellen in der Darm Plexus myentericus reagieren auf in situ ATP. (A) S-100-GFP + Gliazellen (grün) in einem Maus Kolon myentericus Ganglien (durch eine gestrichelte Linie umrandet). Sechs Regionen von Interesse (ROIs) umgeben Gliazellen in den Ganglien werden als gelbe Kreise dargestellt. Die Pfeile zeigen die dicken Faserbahnen, die in die Ganglien. Sternchen denote Speicherort 2 enterischen Neuronen. (B) Das gleiche Ganglion zeigt Rhod-2 Fluoreszenz unter basalen Bedingungen. (C) nach Stimulation mit 100 & mgr; mol / l ATP, Gliazellen reagieren mit erhöhter [Ca 2+] i, wie durch erhöhte Rhod- gezeigten 2 Fluoreszenz. (D) Traces auf jede in A-C gezeigt ROI entspricht. (E) Mittelwert der Reaktion (Mittelwert ± SEM) der 6 in D 24 gezeigt ROIs. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
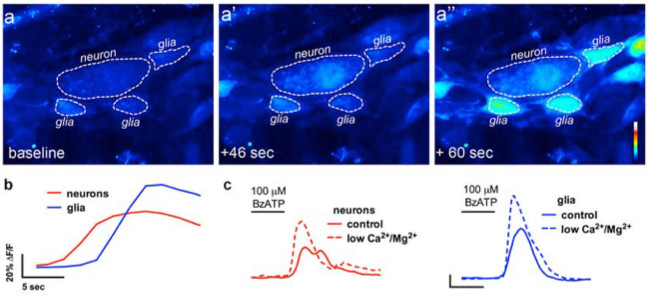
Abbildung 4. Die In-situ-Bildgebung von magensaft Neuron-to-Glia-Kommunikation. (A) Repräsentative Bilder (pseudocolored) von einem Ca 2+ Imaging Experiment, bei dem eine ganze-mountHerstellung des Plexus myentericus wurden mit der neuronalen P2X7-Rezeptor-Agonist BzATP (100 & mgr; M, 30 sec) in Frage gestellt. Man beachte, dass die neuronale Agonisten verursacht eine Erhöhung Fluo4 Fluoreszenz in dem Neuron (A ') vor der umgebenden ente glial Zellen (A "). (B) Analyse der Änderung in der Fluoreszenz mit der Zeit in der Glia (blau) und Neuronen (rote ) bei der Anwendung der neuronalen Agonist BzATP. (C), neuronale und gliale antwortet BzATP in normaler Puffer (durchgezogene Linien) und in einem Puffer mit niedrigem Ca 2+ und Mg 2+ (gestrichelte Linien), die neuronale P2X7-Rezeptoren 13 potenzieren. Bitte Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Video 1 Agonist hervorgerufene Ca 2+ Reaktion in magensaftresistenten Glia insitu. Dieses Video zeigt eine myentericus Ganglien von der Maus distalen Kolon mit dem Ca 2+ Indikatorfarbstoff Fluo-4 beladen. Die Gliazellen Agonisten, ADP, wird dem Bad zugesetzt, wenn angegeben. ADP ruft eine Erhöhung der intrazellulären Ca 2+ in enterischen Glia durch den vorübergehenden Anstieg in Fluo-4 Fluoreszenz beobachtet. Bitte klicken Sie hier, um dieses Video anzusehen.
Diskussion
The methodologies described in this manuscript provide a consistent approach to effectively study neurons and enteric glia in the ENS. Although imaging neurons and enteric glia in culture has yielded a wealth of insight into the function of individual cells, studying these cells in their native, multi-cellular environment is crucial for our understanding their physiology and pathophysiology. Fluorescence microscopy is a crucial technique for assessing multidirectional interactions of cells in the ENS. Loading cells of the ENS with selective fluorescent markers and image acquisition with high-resolution microscopy permits quantitative observations of cellular activity in the ENS. Imaging live tissue samples of the ENS is performed relatively quickly and generates large amounts of in-depth functional and spatial data. Mouse myenteric and submucosal plexus preparations used in these experiments allow for molecular and genetic manipulation approaches. Ca2+ imaging in whole-mount preparations provides a useful tool for the assessment of neuron-glia interactions.
In advanced experimental paradigms, several probes can be combined to obtain information about different events within the cells. Fluorescence microscopy can record images with enhanced contrast of specific molecules, if an appropriate fluorescent label is used. Fluo-4 was chosen because it possesses a large dynamic range. Sufficient incubation time is vital when using the AM dyes in ENS. Dye concentration and loading method may need to be adjusted to achieve best results. Ideal preparations should be loaded with sufficient dye to visualize changes in fluorescence but not so much so that the dye chelates the target ions and interferes with intracellular signaling. Exposure to fluorescent light should be limited to prevent phototoxicity in cells and photobleaching of dyes.
Investigators must be careful with several steps of this experiment, especially solution and tissue preparation. Particular care has to be taken during processing and dissection of ENS tissue in order to maintain cellular functions. The GI tract contains several layers and tissue varieties, which pose challenges for dissection and imaging quality in these whole-mount preparations 27. Furthermore, the interconnecting fiber tracts of the MP are wider and ganglia are larger than those of the SMP 2. The neuronal density of the myenteric plexus is higher compared to that of the submucosal plexus 28. Slow and imprecise dissections will have detrimental effects on the quality of the plexus preparations and thus the overall success of the experiments. Therefore, clean/undamaged tools, practice and manual dexterity are critical to this procedure.
In whole-mount tissue preparations, careful consideration should be taken when drawing the regions of interest (ROI) to correctly assess the kinetics and degree of observed change in fluorescence intensity of the desired cell type. As the ganglia are located on a contractile muscle layer, motion artifacts caused by gut motility are a primary concern during in situ imaging. Thus, suppressing these motion disturbances through re-pinning tissue preparations after incubation with enzymes and the addition of pharmacological inhibition (nicardipine/scopolamine) to buffers permits clear and reliable image acquisition. Aside from pharmacology and mechanical approaches to prevent tissue movement, recent studies illustrate the application of advanced software methodologies and cell type response characteristics to correct for residual tissue movement in the recordings and improve the accuracy of analysis 29. Barring these technical hurdles, this method provides physiologically relevant conditions to assess morphologic and quantitative characteristics of neurons and enteric glia in the ENS.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by grants from the Pharmaceutical Research and Manufacturers Association of America (PhRMA) Foundation (to B. Gulbransen), National Institutes of Health (Building Interdisciplinary Research Careers in Women’s Health) grant K12 HD065879 (B. Gulbransen) and start-up funds from Michigan State University (B. Gulbransen).
Materialien
| Name | Company | Catalog Number | Comments |
| BubbleStop Syringe Heater | AutoMate Scientific | 10-4-35-G | |
| CaCl2 | Sigma | C3306 | |
| Collagenase, Type II, powder | Gibco | 17101-015 | |
| Dispase | Sigma-Aldrich | 42613-33-2 | |
| Dissection tools | Roboz | ||
| DMSO | Sigma-Aldrich | D5879 | |
| Fixed-stage microscope | Olympus | BX51WI | |
| Fluo-4 AM dye | Invitrogen | F-14201 | |
| Glucose | Sigma | G8270 | |
| Insect pins | Fine Science Tools | Minutien Pins | |
| iQ Live Cell Imaging Software | Andor | Andor iQ3 | |
| KCl | Sigma | P3911 | |
| MgCl2 | Sigma | M9272 | |
| NaCl | Sigma | S9888 | |
| NaH2PO4 | Sigma | S8282 | |
| NaHCO3 | Sigma | S6014 | |
| Neo sCMOS camera | Andor | Neo 5.5 sCMOS | |
| Nicardipine | Sigma | N7510 | |
| Perfusion chamber | Custom | ||
| Peristaltic pump | Harvard Apparatus | Model 720 | |
| Pluronic F-127 | Invitrogen | P3000MP | |
| Probenecid | Molecular Probes | P36400 | |
| Scopolamine | Sigma | S1013 | |
| Sutter Lambda DG-4 | Sutter | DG-4 | |
| Sylgard | Dow Corning | 184 | |
| Temperature Controller | Warner Instruments | TC-344C |
Referenzen
- Furness, J. B. Types of neurons in the enteric nervous system. Journal of the Autonomic Nervous System. 81 (1-3), 87-96 (2000).
- Furness, J. B. The organization of the autonomic nervous system: peripheral connections. Neuroscience. 130 (1-2), 1-5 (2006).
- Pham, T. D., Gershon, M. D., Rothman, T. P. Time of origin of neurons in the murine enteric nervous system: sequence in relation to phenotype. Journal of Comparative Neurology. 314 (4), 789-798 (1991).
- Nasser, Y., et al. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 291, G912-927 (2006).
- Glial cells in the gut. Neurogastroenterology & Motility. 17 (6), 777-790 (2005).
- Broadhead, M. J., Bayguinov, P. O., Okamoto, T., Heredia, D. J., Smith, T. K. Ca2+ transients in myenteric glial cells during the colonic migrating motor complex in the isolated murine large intestine. J. Physiol. 590, 335-350 (2012).
- Gulbransen, B. D., Bains, J. S., Sharkey, K. A. Enteric glia are targets of the sympathetic innervation of the myenteric plexus in the guinea pig distal colon. J. Neurosci. 30, 6801-6809 (2010).
- McClain, J. L., et al. Ca2+ Responses in Enteric Glia Are Mediated by Connexin-43 Hemichannels and Modulate Colonic Transit in Mice. Gastroenterology. 146 (2), 497-507 (2014).
- Chandrasekharan, B., et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress. Neurogastroenterology & Motility. 23 (2), e131-e126 (2011).
- Abdo, H., et al. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 24, 1082-1092 (2010).
- Aube, A. C., et al. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 55, 630-637 (2006).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nature Reviews Molecular cell biology. 1 (1), 11-21 (2000).
- Gulbransen, B. D., et al. Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis. Nat Med. 18, 600-604 (2012).
- Bayguinov, P. O., Hennig, G. W., Smith, T. K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon. J Physiol. 588, 399-421 (2010).
- Okamoto, T., Bayguinov, P. O., Broadhead, M. J., Smith, T. K. Ca(2+) transients in submucous neurons during the colonic migrating motor complex in the isolated murine large intestine. Neurogastroenterol Motil. 24 (8), 769-778 (2012).
- Kunze, W. A., Clerc, N., Furness, J. B., Gola, M. The soma and neurites of primary afferent neurons in the guinea-pig intestine respond differentially to deformation. J Physiol. 526, 375-385 (2000).
- Schemann, M., Michel, K., Peters, S., Bischoff, S. C., Neunlist, M. Imaging and the gastrointestinal tract: mapping the human enteric nervous system. Am J Physiol. 282, G919-G925 (2002).
- Hennig, G. W., et al. Visualization of spread of pacemaker activity in through ICC in guinea-pig antrum. Neurogastro Motil. 14, 575(2001).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Induction and organization of Ca2+ waves by enteric neural reflexes. Nature. 399, 62-66 (1999).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Propagation and neural regulation of calcium waves in longitudinal and circular muscle layers of guinea-pig small intestine. Gastroenterology. 118, 982-984 (2000).
- Jessen, K. R., et al. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. Journal of Neuroscience. 3 (11), 2206-2218 (1983).
- Gulbransen, B. D., Sharkey, K. A. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 9, 625-632 (2012).
- Gomes, P., et al. ATP-dependent paracrine communication between enteric neurons and glia in a primary cell culture derived from embryonic mice. Neurogastroenterology & Motility. 21 (8), e870-e862 (2009).
- Gulbransen, B. D., Sharkey, K. A. Purinergic neuron-to-glia signaling in the enteric nervous system. Gastroenterology. 136, 1349-1358 (2009).
- Ren, J., Bertrand, P. P. Purinergic receptors and synaptic transmission in enteric neurons. Purinergic Signal. 4, 255-266 (2008).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol Rev. 79, 1089-1125 (1999).
- Dongcheng, Z., et al. Neural crest regionalisation for enteric nervous system formation: implications for Hirschsprung's disease and stem cell therapy. Developmental Biology. 339 (2), 280-294 (2010).
- Gershon, M. D. Behind an enteric neuron there may lie a glial cell. J Clin Invest. 121, 3386-3389 (2011).
- Boesmans, W., et al. Imaging neuron-glia interactions in the enteric nervous system. Frontiers in Cellular Neuroscience. 7, (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten