Method Article
장용 신경계의 제자리 칼슘 이미징에서
요약
The enteric nervous system (ENS) is a network of neurons and glia located in the gut wall that controls intestinal reflexes. This protocol describes methods for recording the activity of enteric neurons and glia in live preparations of ENS using Ca2+ imaging.
초록
Reflex behaviors of the intestine are controlled by the enteric nervous system (ENS). The ENS is an integrative network of neurons and glia in two ganglionated plexuses housed in the gut wall. Enteric neurons and enteric glia are the only cell types within the enteric ganglia. The activity of enteric neurons and glia is responsible for coordinating intestinal functions. This protocol describes methods for observing the activity of neurons and glia within the intact ENS by imaging intracellular calcium (Ca2+) transients with fluorescent indicator dyes. Our technical discussion focuses on methods for Ca2+ imaging in whole-mount preparations of the myenteric plexus from the rodent bowel. Bulk loading of ENS whole-mounts with a high-affinity Ca2+ indicator such as Fluo-4 permits measurements of Ca2+ responses in individual neurons or glial cells. These responses can be evoked repeatedly and reliably, which permits quantitative studies using pharmacological tools. Ca2+ responses in cells of the ENS are recorded using a fluorescence microscope equipped with a cooled charge-coupled device (CCD) camera. Fluorescence measurements obtained using Ca2+ imaging in whole-mount preparations offer a straightforward means of characterizing the mechanisms and potential functional consequences of Ca2+ responses in enteric neurons and glial cells.
서문
장 신경계 (ENS)는 소화 기관 (1)의 벽에 내장 된 두 개의 ganglionated 얼기으로 구성되어 있습니다. 이 근육 내 신경 회로는, myenteric 신경 얼기 (MP) 및 점막하 신경총 (SMP)은 신경 세포와 장 아교 세포 (그림 1)이 구성된다. MP와 SMP는 장 운동 및 상피 흡수와 분비, 각각 3과 위장관 (GI)의 기능을 조절한다. 장내 아교 세포가 신경 내의 신경 세포 만 장 아교 세포의 인구 가까이에 위치하고 있습니다 또한 섬유 책자 및 창자 벽 3,4의 추가-신경절 부분을 상호 연결 내에 존재한다. 장내 아교 세포는 원래 신경 세포 만 영양 지원을 제공하기 위해 믿었다. 그러나 최근의 연구는 강하게 ENS는 5,6 기능에 대한 신경 세포 - glia 상호 작용이 필수적하는 것이 좋습니다. 예를 들어, 데이터는 장 아교 세포가 신경 세포의 활동 7 "수신"보여그리고, 신경 회로 6,8- 변조 산화 스트레스 (9)로부터 장용성 뉴런을 보호하고 10,11 부상에 응답하여 새로운 장용성 뉴런을 생성 할 수있다. 이 기술 검토에 제시된 프로토콜은 현장 세포 내 칼슘 이미징 사용 신경과 장 아교 세포 사이의 복잡한 상호 작용을 조사하는 간단하고 강력한 방법을 제공한다.
칼슘은 흥분성 세포에서 유비쿼터스 신호 분자와 신경 시스템 (12)에서 시냅스 신호 이벤트에 필수적인 역할을한다. 신경 세포 또는 장내 아교 세포의 여기 어느 유입에 의해 칼슘 -permeable 채널 또는 CA를 통해 세포 내 칼슘 상점에서 2 + 릴리스 세포 내 칼슘 농도의 상승을 이끌어 낸다. 이미징 CA의 형광 염료와 뉴런과 교세포에서 2 + 과도은 설립과 기능 조직과의 역학을 연구하는 널리 사용되는 기술이다ENS 13-17. 칼슘 이미징은 ICC의 심장 박동 네트워크 18 장 평활근 (19, 20)을 통해 흥분의 확산을 명료하게 그대로 GI 조직 세그먼트를 공부하는 중요한 도구가 될 것으로 나타났다. 그것은 생리 학적 매개 변수의 넓은 스펙트럼을 조사하는 연구를 가능하게하고 자신의 공간 분포와 시간적 동력학에 대한 정보를 제공합니다. 세포를 효율적으로 막 투과성 형광 염색 지표와 최적화 프로토콜 (21)을 이용하여 최소 침습 방식으로 염색 할 수있다. 이는 생체 내 23뿐만 아니라 기능적으로 보존 제제 14-16,22에 다수의 뉴런 및 신경교 장용성를 모니터링 할 수있는 기회를 제공한다. 전체 - 마운트 조직 제제는 칼슘 결합하면 그 형광을 증가 FLUO-4로 고친 화성 칼슘 지시 염료 로케이션 벌크있다. 형광의 변화는 CCD 카메라와 아나 기록디지털 6 분석하였으며. 칼슘의 출현은 다양한 자극에 대한 신경 세포 및 글 리아 세포의 상호 작용, 응답을 모니터링 할 수있는 기회 및 실시간 프로세스 위장관에서 이러한 세포 유형의 개입을 제공 하였다.
현장에서 칼슘 이미징은 장 신경 세포와 아교 세포의 신호 전달 메커니즘에 큰 통찰력을 산출하고 세포 배양 모델 6,24에 비해 몇 가지 뚜렷한 장점을 가지고있다. 먼저, 반응계에서 제제는 뉴런 및 신경교의 기본 매트릭스 환경을 그대로 유지하고 조직을 대상으로 그 커넥터의 대부분을 떠난다. 둘째, 유전학 및 배양 장 아교 세포의 형태는 크게 생체 6,24에 비해 변경된다. 셋째, 많은 이형 상호 작용 1 차 세포 배양 손실과 세포 - 세포 상호 작용을 평가하는이 제한됩니다. 배양 된 세포는 잘 기본적인 특성 조사, 그들의 usefulne에 적합하지만장 아교 세포와 신경 세포 사이의 복잡한 상호 작용을 연구 SS 제한됩니다. 시냅스 경로 (25) 그대로 남아있는 현장에 접근 방법을 사용하여 조사하는 신경 세포 - glia의 상호 작용은 더 생리 학적으로 관련이있다. 세포 배양 방법에 비하여 시츄 접근 체계적 신경원과 신경교 장용성 간의 복잡한 상호 작용을 이해하기위한 개선 된 조건을 제공한다. 또한, 전체 마운트 준비에 ganglionated 신경총의 평면 조직은 세포 내 칼슘 과도의 형광 이미징에 이상적이며,이 기술은 ENS에서 신경 세포 아교 세포의 활동을 평가하기위한 간단한 방법을 제공합니다.
프로토콜
참고 : 실험 동물에서 조직을 포함하는 다음 절차는 동물 2013 년 안락사에 대한 AVMA 가이드 라인과 일치하고 미시간 주립 대학 IACUC의 사전 승인되었다.
1. 조직 준비
- 산소 또는 물리적 배리어는 이소 플루 란과의 직접적인 접촉으로부터 동물을 막을 수 있도록, 상기 챔버의 바닥에 흡수성 재료 상에 액체 이소 플루 3-5 mL로 배치하여 2.5 %의 이소 플루 란을 포함하는 챔버에서 연구 동물을 마취. 발바닥을 곤란하게하여 마취의 깊이를 테스트합니다.
주 : 뒷다리의 움츠림 반사가 없을 때 마취 깊이가 적절하다고 인정된다. 적절하게 마취되면, 자궁 경부 전위로 마우스를 안락사 - 앙와위에서 동물을 배치하고 70 % 에탄올로 복부 피부를 청소합니다. 중간 선에서 복부 피부를 꼬집어 집게를 사용하여 6cm 미디어를 만들기 위해 수술 가위를 사용원격 교육 알바를 따라 L 절개 내부의 소화 기관을 노출.
- 찾아 복막 내부의 회장을 노출 무딘 집게를 사용합니다. 가위로 회장 / 결장 장간막을 잘라 소장을 무너 시작합니다.
- 소장의 길이를 충분히 풀어지면, 회장 제제에서 맹장 위장 근위 및 원위 부위를 잘라. 대장 준비 기간, 직장에 맹장과 근위 대장 원위부를 잘라.
- 신속 장내 세그먼트를 제거하고 3 μM의 카르 디핀 염산염 1 μM 스코 폴 아민 하이드로 클로라이드로 보충 DMEM / F12 미디어를 비커에 배치 얼음 (이하 "용지"라한다). 이러한 억제제의 첨가는 소화관 평활근 마비하여 미세 절제 및 후속 영상화를 용이하게한다.
- 설립 해부학 적 마커를 기반으로 관심의 컷 세그먼트 (예를 들면, 공장, 회장 원위부 또는 근위부 대장). 일반적으로 utiliz말단 회장 원위부 대장의 전자 조직. 그러나 모든 장 지역에서, 부하 및 이미지 myenteric 신경 세포와 아교 세포를 분리하기 위해 동일한 기본 절차를 사용합니다.
- 냉장 미디어 가득 실 가드 코팅 된 배양 접시에 원하는 장 세그먼트과 장소의 작은 부분 (4-6cm)를 제거합니다.
- 근위 및 곤충 핀 장 세그먼트의 말단부를 안전하고 직선을 만들어 장 관을 열고, 길이 장간막 국경을 따라 잘라.
- 미세 집게 (# 5, # 최고의 45분의 5 일)과 아주 좋은 봄 가위를 사용하여 점막 층을 멀리 해부까지 조심스럽게 점막면이 빛 장력 평면 핀 조직.
주 : 제대로 수행하지 않을 경우 점막의 제거는 ENS에 대해 매우 충격적인 일 수있다. 품질 준비를 들어, 박 리나 긁어 점막의 갑작스러운 제거를 제한하기 위해주의를 기울입니다. 가장 좋은 방법은 점막을 들어 올려 미세 가위로 아래 절단하는 것입니다. - 작은 준비로 조직을 잘라의 영상 요리로 (약 0.5 cm 2) 핀 신선한 미디어와 얼음에 배치 (원형 근육 층이 위를 향 4 코너).
- 조심스럽게 myenteric 신경 얼기를 노출 미세 핀셋으로 떨어져 괴롭 히고 의해 원형 근육을 멀리 해부하다. 과도한 스트레칭을 피하십시오.
- 신선한 미디어와 얼음과 변화 솔루션을 다시 이미징 요리를 놓습니다.
- 접시 당 효소 믹스 2 ㎖를 준비 [스파 아제 (Dispase) 1 U / ㎖ (4.48 ㎎ / 8 ㎖), 콜라게나 제 유형 II 150 U / ㎖ (5.45 ㎎ / 8 ml)에 미디어].
- 얼음에서 요리를 제거하고 단계 1.13에서 효소 믹스를 추가합니다.
- 5 % CO 95분의 2 % 공기와 함께 실온에서 15 분 동안 인큐베이션을 요리.
- 미디어 3 회 다시 핀 모서리 씻을 조직 준비.
2.로드 FLUO-4 염료
참고 : 표시 염료로드 형광 염료 및 조직을 처리하는 동안 제한된 빛과 협력하여 photobleaching에 피하십시오.
- 4 μM FLUO-4 로딩 솔루션을 준비합니다.
- 4 mM의 FLUO-4 주식의 1.5 μL 나누어지는 1.5 ml의 미디어 및 250 mM의 프로 베네 시드 주식의 1.2 μl를 추가합니다. FLUO-4 AM로 50 μg의 (0.25 % cremaphor-EL 보충 된 DMSO 중 20 %) 4- FLUO-4 mM의 스톡 플루로 닉 F-127 11.4 μl를 첨가하여 제조된다.
- 37 ° C에서 어두운 배양기에서 45 분 동안 로딩 FLUO-4 용액 상태로 준비 부화.
- 인큐베이터에서 제거 및 미디어 3 회와 준비를 씻는다.
- 미디어가 200 μM의 프로 베네 시드를 포함 및 이미징 전에 37 ° C에서 15 분을 품어의 환율 미디어.
참고 : 프로 베네 시드가 신경 세포에 약제 내성 수송을 억제하는 약물이다. 이 약물의 첨가는 염색을 돌출 뉴런의 기능을 억제하고 신경 라벨링을 향상시킨다. 프로 베네 시드가없는 상태에서 칼슘 2 + 지표 염료의 대량로드는 주로 아교 세포로드를 생성합니다. 프로 베네 시드의 추가는 신경 세포와 신경 교세포의 답변 시각화 할 수 있습니다. - 준비 KRE 수정학사 버퍼입니다.
- 확인 구성 요소 (MM)에 최종 농도는 다음과 같습니다 것을 수정 크렙스 버퍼와 같은 : (121)의 NaCl, 5.9의 KCl, 2.5 CaCl2를, 1.2의 MgCl 2, 1.2의 NaH 2 PO 4, 10 HEPES, 21.2의 NaHCO3, 1 피루브산을 산 (NaOH로 7.4로 조정 산도) 8 포도당. 칼슘 동안 2 + 이미징 근육의 수축을 억제하는 3 μM의 니 카르 디핀 (nicardipine) 및 1 μM 스코 폴라 민을 추가하고 해부를 전체 마운트합니다.
3. 이미징 및 분석
참고 : 형광 광원, 현미경, 품질 CCD 카메라와 적절한 수집 소프트웨어와 함께 적어도 기본 이미징 장비를 사용합니다. 광원과 특정 응용에 따라 다른 구성 요소의 추가를 변화한다. 필터 휠과 셔터가 전통적인 크세논 아크 광원과 함께 사용되어야한다. 그러나, LED 광원 및 조명 시스템은 이러한 구성 요소가 필요하지 않습니다.
- 녹화를 배치현미경 챔버를 가열 ORDING 복수 주사기 저수지 중력 유동 관류 시스템을 사용하여 37 ° C, 크렙스 완충액 2-3 ml / 분의 속도로 연속 관류를 확립한다. 진공 트랩에 연결된 모두 입력 및 흡입 라인에 공기 방울 형성을 방지해야합니다.
- 밝은 필드 조명 아래에서 초점이 원하는 총을 가져와. 사진 표백 될 수 있습니다 조직, 과도한 노출을 피하십시오.
- 신경절 내에서 FLUO-4로드 검사 및 이미징 건강한 신경을 선택합니다. 건강에 해로운 / 손상된 신경은 자기 형광 또는 반점 형태를 전시하고 영상에 사용되어서는 안된다.
- 신경절가 선택되면, 카메라에 빛의 경로를 전환하고 화상 취득 소프트웨어 라이브 화상을 획득. 그 신경절가 포커스와 설정 이미지 수집 속도와 노출 시간에 있는지 확인하십시오.
참고 : 이미지 수집 속도와 시간이 수사 기록 할 이벤트에 따라 달라질 수 있습니다. 대부분의 실험, 이미지아교 칼슘 응답이 칼슘 뉴런에서 2 + 과도만큼 빠른하지 않기 때문에 전통적으로 뉴런 2-10 Hz로 신경 교세포에 대한 0.5 Hz에서까지 취득. - 실험을 시작하고 30 초 동안 기본 활동을 설정합니다.
- 예컨대 2-3 ml / 분의 속도로 중력 유동 관류 시스템을 이용하여 수용체 작용제 및 길항제로서 관심 예열 약물을 적용한다. 정상 버퍼의 관류에 반환하여 작용제 / 길항제의 응용 프로그램에 따라 적어도 10 분 세척 / 회복 기간을 수 있습니다.
참고 : 약물 응용 프로그램 시간은 개별 화합물 및 실험 설계에 따라 달라질 수 있습니다. 일반적으로, 효능 제의 20 ~ 30 초 애플리케이션은 뉴런 및 아교 세포에서 G 단백질 결합 수용체를 활성화하기에 충분하다. 하지만, (예 : 니코틴 성 아세틸 콜린 수용체와 같은) 리간드 관문 이온 채널은 더 이상 적용 5-10 초의 시간을 필요로한다. 또한 기간 노출 리간드 게이트 이온 채널이 빠르게 발생할 것이다 DESEnsitize. 길항제는 수용체 경로의 완전한 차단을 보장하기 위해 약 3-15 분 동안 적용되어야한다. 그러나,이 총 일반화와 연구자들은 항상 특정 패러다임에 어떤 실험 약물을 최적화해야한다. - 실험의 기록 및보기 시간 경과 영화를 중지합니다. 적절한 이미지 분석 소프트웨어를 사용하여 관심 엄선 영역 (ROI 'S).
- 정상화의 초기 기준 형광 값과 ROI 형광 강도를 비교하는 소프트웨어를 사용합니다. 정규화 된 형광의 변화는 [칼슘]의 변화에 직접적으로 비례한다.
- ROI - ΔF / F = (F 0) / F 0 (F 1) - 사용하여 이전에 (26)를 설명하는 방법의 변경 사용 ((F 1 - F 0) / F 0) F1은 형광 주어진에있는 배경, 포인트 및 F0는 평가의 정확도를 향상시키기 위해,베이스 라인 형광이다. 이 수정 보조myenteric 신경총 기초가 근육층의 이동을 나타내는 조직의 준비 형광 변화로부터 노이즈를 감소한다.
결과
이 기술의 올바른 사용을 위해 조직 준비를 마운트 전체 조사자가 정확하게 세포 내 칼슘 2 + [칼슘 2 +] 나는 장 신경 세포의 과도와의 아교 세포를 측정 할 수 있습니다. 마우스 콜론에서 myenteric 신경절 내에서 아교 세포의 효능-유발 칼슘 반응의 대표적인 예는 비디오 1에 표시됩니다. 다음과 같은 결과가 우리가이 방법을 사용하여 얻은 몇 가지 대표적인 결과를 설명하기위한 것입니다. 첫째, 그림 2 장 폐해를 측정하는 실험의 결과를 보여줍니다 [칼슘] 내가 기니피그 결장 종 myenteric 근육 신경총 (LMMP) 준비 내 ATP에 의한 자극에 대한 반응의 변화. 구체적으로는,이 도면은 분석 myenteric 신경절 뉴런 및 장용성의 위치를 나타내는 별표의 윤곽을 포함하여 상기 열거 실험 프로토콜의 적절한 분석을위한 방법을 도시한다. 또한 이러한 결과 전[칼슘 2 +] 난 기니 돼지 myenteric 아교 세포의 동원에 100 마이크로 몰 ATP의 최적 복용량을 llustrate. 이 응답은 장용성 신경교 자극을 교정 및 테스트 자극에 대한 반응을 정규화하기 위해 사용될 수있다. 다음으로,도 3이 제대로이자 (로아) 신경 교세포 주변 지역을 선택하는 방법 해명, 노란색 동그라미 주변으로 표시. 이러한 결과는 또한 기저 조건 및 약리학 적 자극에 대한 응답에서 원하는 형광 변화를 보여줍니다. 마지막으로, 그림 4는 전체 마운트 준비에 [칼슘] 내가 응답을 장내 아교 세포와 신경 세포를 선택하기위한 공간 고려 사항을 보여줍니다.
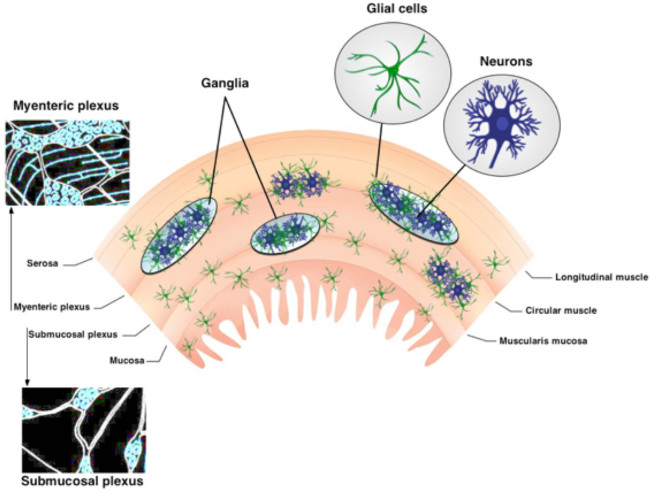
ENS 그림 1. 조직. ENS는 두 가지 주요 ganglionated 얼기가 포함되어 있습니다. myenteric 신경 얼기는 L 사이에 위치ongitudinal 원형 근육 층. 점막하 신경총은 점막과 원형 근육 층 사이에 위치하고 있습니다. ENS는 유일하게 신경과 장 아교 세포로 구성되어 있습니다. 신경 섬유 책자가 신경을 연결합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
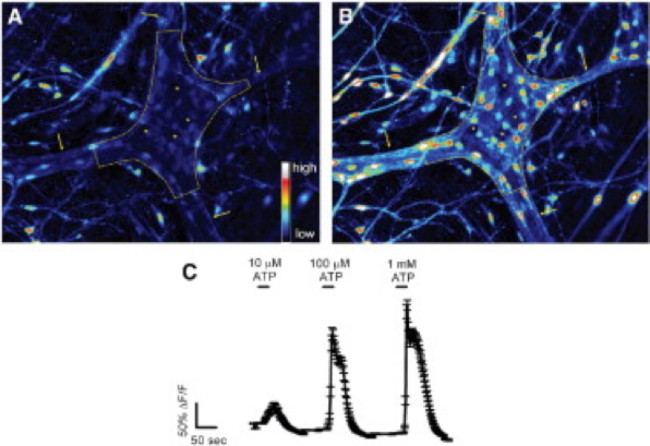
기니피그 결장 myenteric 신경 얼기 응답 그림 2. 장내 글리는 현장에서 ATP합니다. (A) myenteric 신경절 FLUO-4 형광 기저 조건 하에서 (점선으로 윤곽). 화살표는 100 μmol / L의 ATP, 신경 교세포로 자극시 (B). 두꺼운 절간 섬유 책자를 가리 아니라 신경, 빠르게 증가 FLUO-4 [칼슘]의 증가를 나타내는 형광 전. 응답 세포가 작은 것을 참고 (별표로 표시 어두운 공간을) 훨씬 더 큰 신경을 둘러싸고 있습니다. (C) 장내 아교 세포는 1 밀리몰 / L은 최대 응답 (24)를 도출과 용량 의존적으로 ATP에 응답합니다. 를 보려면 여기를 클릭하십시오 이 그림의 더 큰 버전.
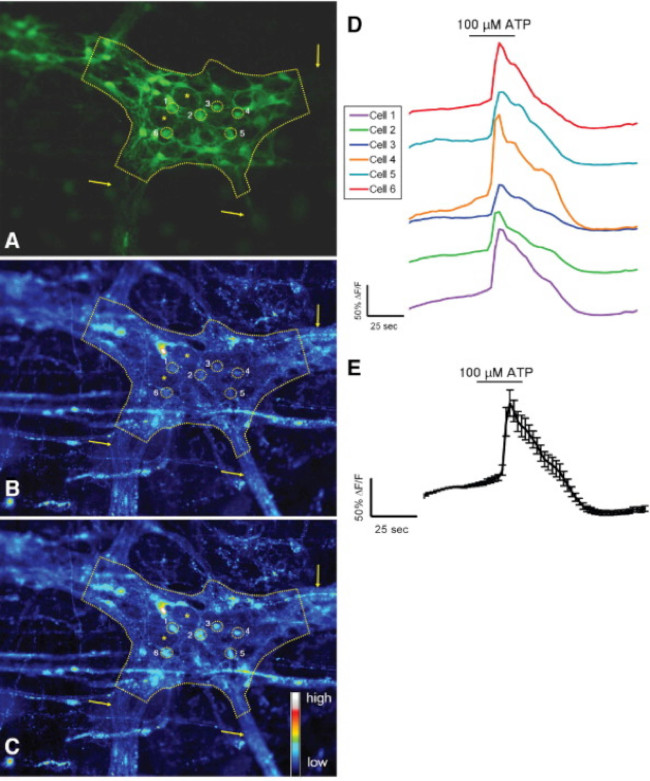
현장에서 ATP 할 수있는 대장 myenteric 신경 얼기 응답 그림 3. 설치류 S-100-GFP는 + 세포. (A) S-100-GFP + 마우스 대장 myenteric 신경절의 신경 교세포 (녹색) (점선으로 설명). 이자 (로아) 신경 내의 신경 교세포 주변의 6 개 지역은 노란색 동그라미로 표시됩니다. 화살표는 신경절으로 이어지는 두꺼운 섬유 책자를 나타냅니다. 별표 D2 장 신경 세포의 enote 위치. (B) 기저 상태에서로드와-2 형광을 나타내는 같은 신경절. (C) 100 μmol / L의 ATP 자극에 따라, 신경 교세포는 [칼슘 2 +] 나는이 같은 증가 Rhod-으로 표시 증가로 응답 이 형광. (D)는 A-C에 표시된 각각의 투자 수익 (ROI)에 해당하는 추적합니다. (E) D (24)에 표시된 6 개의 ROI의 응답을 (SEM 평균 ±) '평균. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
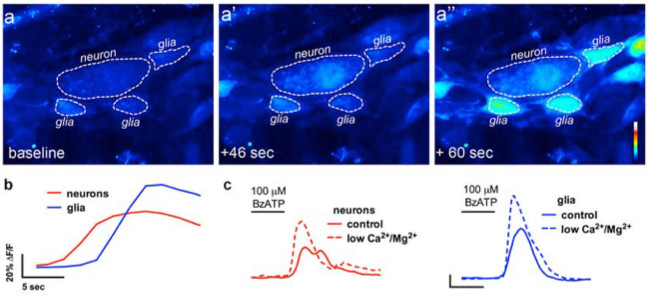
장 신경 세포 간 아교 세포 통신의 현장 영상에서 그림 4. 칼슘 이미징 실험에서 (A) 대표 이미지 (모조) 여기서 전체 마운트myenteric 신경총의 제조 신경 P2X7 수용체 효능 BzATP (100 μM, 30 초)에 도전했다. 신경 작용제 주변 장용성 교세포 (A ") 이전 뉴런 (A ')에서 Fluo4 형광의 증가를 초래 있습니다. (B)을 신경교 (블루)과 뉴런의 경시 형광의 변화를 분석 (적색 ) 정상 버퍼 (실선에 BzATP에 신경 작용제, BzATP. (C) 신경 세포와 신경 교세포의 답변 응용 프로그램 다음) 및 버퍼에 신경 P2X7 수용체 (13)을 강화시키는 낮은 칼슘과 마그네슘 2+ (점선)를 포함. 하십시오 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
장내 아교 세포에서 비디오 1 작용제-유발 칼슘 응답현장.이 비디오는 칼슘 지시 염료, FLUO-4로드 마우스 원위부에서 myenteric 신경절을 보여줍니다. 표시된 경우 신경교 세포 작용제, ADP는 욕에 첨가된다. ADP가 FLUO-4 형광의 과도 상승에 의해 관찰 장 아교 세포의 세포 내 칼슘의 증가를 2+ 이끌어 낸다. 이 비디오를 시청하려면 여기를 클릭하십시오.
토론
The methodologies described in this manuscript provide a consistent approach to effectively study neurons and enteric glia in the ENS. Although imaging neurons and enteric glia in culture has yielded a wealth of insight into the function of individual cells, studying these cells in their native, multi-cellular environment is crucial for our understanding their physiology and pathophysiology. Fluorescence microscopy is a crucial technique for assessing multidirectional interactions of cells in the ENS. Loading cells of the ENS with selective fluorescent markers and image acquisition with high-resolution microscopy permits quantitative observations of cellular activity in the ENS. Imaging live tissue samples of the ENS is performed relatively quickly and generates large amounts of in-depth functional and spatial data. Mouse myenteric and submucosal plexus preparations used in these experiments allow for molecular and genetic manipulation approaches. Ca2+ imaging in whole-mount preparations provides a useful tool for the assessment of neuron-glia interactions.
In advanced experimental paradigms, several probes can be combined to obtain information about different events within the cells. Fluorescence microscopy can record images with enhanced contrast of specific molecules, if an appropriate fluorescent label is used. Fluo-4 was chosen because it possesses a large dynamic range. Sufficient incubation time is vital when using the AM dyes in ENS. Dye concentration and loading method may need to be adjusted to achieve best results. Ideal preparations should be loaded with sufficient dye to visualize changes in fluorescence but not so much so that the dye chelates the target ions and interferes with intracellular signaling. Exposure to fluorescent light should be limited to prevent phototoxicity in cells and photobleaching of dyes.
Investigators must be careful with several steps of this experiment, especially solution and tissue preparation. Particular care has to be taken during processing and dissection of ENS tissue in order to maintain cellular functions. The GI tract contains several layers and tissue varieties, which pose challenges for dissection and imaging quality in these whole-mount preparations 27. Furthermore, the interconnecting fiber tracts of the MP are wider and ganglia are larger than those of the SMP 2. The neuronal density of the myenteric plexus is higher compared to that of the submucosal plexus 28. Slow and imprecise dissections will have detrimental effects on the quality of the plexus preparations and thus the overall success of the experiments. Therefore, clean/undamaged tools, practice and manual dexterity are critical to this procedure.
In whole-mount tissue preparations, careful consideration should be taken when drawing the regions of interest (ROI) to correctly assess the kinetics and degree of observed change in fluorescence intensity of the desired cell type. As the ganglia are located on a contractile muscle layer, motion artifacts caused by gut motility are a primary concern during in situ imaging. Thus, suppressing these motion disturbances through re-pinning tissue preparations after incubation with enzymes and the addition of pharmacological inhibition (nicardipine/scopolamine) to buffers permits clear and reliable image acquisition. Aside from pharmacology and mechanical approaches to prevent tissue movement, recent studies illustrate the application of advanced software methodologies and cell type response characteristics to correct for residual tissue movement in the recordings and improve the accuracy of analysis 29. Barring these technical hurdles, this method provides physiologically relevant conditions to assess morphologic and quantitative characteristics of neurons and enteric glia in the ENS.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by grants from the Pharmaceutical Research and Manufacturers Association of America (PhRMA) Foundation (to B. Gulbransen), National Institutes of Health (Building Interdisciplinary Research Careers in Women’s Health) grant K12 HD065879 (B. Gulbransen) and start-up funds from Michigan State University (B. Gulbransen).
자료
| Name | Company | Catalog Number | Comments |
| BubbleStop Syringe Heater | AutoMate Scientific | 10-4-35-G | |
| CaCl2 | Sigma | C3306 | |
| Collagenase, Type II, powder | Gibco | 17101-015 | |
| Dispase | Sigma-Aldrich | 42613-33-2 | |
| Dissection tools | Roboz | ||
| DMSO | Sigma-Aldrich | D5879 | |
| Fixed-stage microscope | Olympus | BX51WI | |
| Fluo-4 AM dye | Invitrogen | F-14201 | |
| Glucose | Sigma | G8270 | |
| Insect pins | Fine Science Tools | Minutien Pins | |
| iQ Live Cell Imaging Software | Andor | Andor iQ3 | |
| KCl | Sigma | P3911 | |
| MgCl2 | Sigma | M9272 | |
| NaCl | Sigma | S9888 | |
| NaH2PO4 | Sigma | S8282 | |
| NaHCO3 | Sigma | S6014 | |
| Neo sCMOS camera | Andor | Neo 5.5 sCMOS | |
| Nicardipine | Sigma | N7510 | |
| Perfusion chamber | Custom | ||
| Peristaltic pump | Harvard Apparatus | Model 720 | |
| Pluronic F-127 | Invitrogen | P3000MP | |
| Probenecid | Molecular Probes | P36400 | |
| Scopolamine | Sigma | S1013 | |
| Sutter Lambda DG-4 | Sutter | DG-4 | |
| Sylgard | Dow Corning | 184 | |
| Temperature Controller | Warner Instruments | TC-344C |
참고문헌
- Furness, J. B. Types of neurons in the enteric nervous system. Journal of the Autonomic Nervous System. 81 (1-3), 87-96 (2000).
- Furness, J. B. The organization of the autonomic nervous system: peripheral connections. Neuroscience. 130 (1-2), 1-5 (2006).
- Pham, T. D., Gershon, M. D., Rothman, T. P. Time of origin of neurons in the murine enteric nervous system: sequence in relation to phenotype. Journal of Comparative Neurology. 314 (4), 789-798 (1991).
- Nasser, Y., et al. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 291, G912-927 (2006).
- Glial cells in the gut. Neurogastroenterology & Motility. 17 (6), 777-790 (2005).
- Broadhead, M. J., Bayguinov, P. O., Okamoto, T., Heredia, D. J., Smith, T. K. Ca2+ transients in myenteric glial cells during the colonic migrating motor complex in the isolated murine large intestine. J. Physiol. 590, 335-350 (2012).
- Gulbransen, B. D., Bains, J. S., Sharkey, K. A. Enteric glia are targets of the sympathetic innervation of the myenteric plexus in the guinea pig distal colon. J. Neurosci. 30, 6801-6809 (2010).
- McClain, J. L., et al. Ca2+ Responses in Enteric Glia Are Mediated by Connexin-43 Hemichannels and Modulate Colonic Transit in Mice. Gastroenterology. 146 (2), 497-507 (2014).
- Chandrasekharan, B., et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress. Neurogastroenterology & Motility. 23 (2), e131-e126 (2011).
- Abdo, H., et al. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 24, 1082-1092 (2010).
- Aube, A. C., et al. Changes in enteric neurone phenotype and intestinal functions in a transgenic mouse model of enteric glia disruption. Gut. 55, 630-637 (2006).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nature Reviews Molecular cell biology. 1 (1), 11-21 (2000).
- Gulbransen, B. D., et al. Activation of neuronal P2X7 receptor-pannexin-1 mediates death of enteric neurons during colitis. Nat Med. 18, 600-604 (2012).
- Bayguinov, P. O., Hennig, G. W., Smith, T. K. Calcium activity in different classes of myenteric neurons underlying the migrating motor complex in the murine colon. J Physiol. 588, 399-421 (2010).
- Okamoto, T., Bayguinov, P. O., Broadhead, M. J., Smith, T. K. Ca(2+) transients in submucous neurons during the colonic migrating motor complex in the isolated murine large intestine. Neurogastroenterol Motil. 24 (8), 769-778 (2012).
- Kunze, W. A., Clerc, N., Furness, J. B., Gola, M. The soma and neurites of primary afferent neurons in the guinea-pig intestine respond differentially to deformation. J Physiol. 526, 375-385 (2000).
- Schemann, M., Michel, K., Peters, S., Bischoff, S. C., Neunlist, M. Imaging and the gastrointestinal tract: mapping the human enteric nervous system. Am J Physiol. 282, G919-G925 (2002).
- Hennig, G. W., et al. Visualization of spread of pacemaker activity in through ICC in guinea-pig antrum. Neurogastro Motil. 14, 575(2001).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Induction and organization of Ca2+ waves by enteric neural reflexes. Nature. 399, 62-66 (1999).
- Stevens, R. J., Publicover, N. G., Smith, T. K. Propagation and neural regulation of calcium waves in longitudinal and circular muscle layers of guinea-pig small intestine. Gastroenterology. 118, 982-984 (2000).
- Jessen, K. R., et al. Astrocyte-like glia in the peripheral nervous system: an immunohistochemical study of enteric glia. Journal of Neuroscience. 3 (11), 2206-2218 (1983).
- Gulbransen, B. D., Sharkey, K. A. Novel functional roles for enteric glia in the gastrointestinal tract. Nat Rev Gastroenterol Hepatol. 9, 625-632 (2012).
- Gomes, P., et al. ATP-dependent paracrine communication between enteric neurons and glia in a primary cell culture derived from embryonic mice. Neurogastroenterology & Motility. 21 (8), e870-e862 (2009).
- Gulbransen, B. D., Sharkey, K. A. Purinergic neuron-to-glia signaling in the enteric nervous system. Gastroenterology. 136, 1349-1358 (2009).
- Ren, J., Bertrand, P. P. Purinergic receptors and synaptic transmission in enteric neurons. Purinergic Signal. 4, 255-266 (2008).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol Rev. 79, 1089-1125 (1999).
- Dongcheng, Z., et al. Neural crest regionalisation for enteric nervous system formation: implications for Hirschsprung's disease and stem cell therapy. Developmental Biology. 339 (2), 280-294 (2010).
- Gershon, M. D. Behind an enteric neuron there may lie a glial cell. J Clin Invest. 121, 3386-3389 (2011).
- Boesmans, W., et al. Imaging neuron-glia interactions in the enteric nervous system. Frontiers in Cellular Neuroscience. 7, (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유