Method Article
Experimentelle Demyelinisierung und Remyelinisierung von Murine Rückenmark von Focal Injektion von Lysolecithin
In diesem Artikel
Zusammenfassung
Demyelinating diseases can be modeled in animals by focal application of lysolecithin into the CNS. A single injection of lysolecithin into mouse spinal cord produces a lesion that spontaneously repairs over time. The goal is to study factors involved in de- and remyelination, and to test agents for enhancing repair.
Zusammenfassung
Multiple Sklerose ist eine entzündliche demyelinisierende Erkrankung des zentralen Nervensystems, gekennzeichnet durch die Bildung von Plaque, verloren geht Oligodendrozyten Myelin, Axonen und Nervenzellen. Remyelinisierung ist ein körpereigenes Reparaturmechanismus, wodurch neue Myelin wird im Anschluss an die Proliferation, Rekrutierung und Differenzierung der Oligodendrozyten-Vorläuferzellen in Myelin bildenden Oligodendrozyten produziert und ist notwendig, um Axone vor weiteren Schäden zu schützen. Derzeit werden alle Therapeutika für die Behandlung von Multipler Sklerose zielen auf den aberranten Immunkomponente der Erkrankung, die entzündliche Schübe zu verringern, aber nicht verhindern, dass das Fortschreiten zu irreversiblen neurologischen Verfall. Es ist daher unerlässlich, dass die Remyelinisierung fördernde Strategien entwickelt, die den Krankheitsverlauf verzögern kann und vielleicht umkehren neurologische Symptome werden. Mehrere Tiermodelle der Demyelinisierung existieren, einschließlich experimentellen autoimmunen Enzephalomyelitis und curprizone; jedoch gibt es Begrentungen in ihrer Verwendung für das Studium Remyelinisierung. Ein robusteres Ansatz ist die Brenn Injektion von Toxinen in das Zentralnervensystem, einschließlich der Waschmittel Lysolecithin in das Rückenmark der weißen Substanz von Nagetieren. In diesem Protokoll zeigen wir, dass das chirurgische Verfahren im Injizieren Lysolecithin des ventralen weißen Substanz von Mäusen beteiligt ist schnell, kostengünstig und erfordert keine zusätzlichen Materialien als die im Handel erhältlich. Dieses Verfahren ist nicht nur wichtig für die Untersuchung der normalen Ereignissen in der Remyelinisierung Prozess beteiligt, sondern auch als eine vorklinische Werkzeug zum Screenen von Kandidaten Remyelinisierung fördernde Therapeutika.
Einleitung
Multiple Sklerose (MS) ist eine chronische demyelinisierende Erkrankung des zentralen Nervensystems (ZNS), die durch Immunzellinfiltration und die Plaques enthaltenden verloren Myelin Oligodendrozyten Axonen und Nervenzellen. Die meisten Patienten haben einen Krankheitsverlauf, bestehend aus entzündlichen Schübe begleitet von einer Vielzahl von neurologischen Symptome, gefolgt von Perioden der Remission. Über die Hälfte dieser Patienten schließlich den Übergang zu einer sekundär progredienten Stadium ohne erkennbare Rückfälle, aber kontinuierlichen Rückgang neurologischen. Es wird angenommen, daß diese fortschreitende Verschlechterung aufgrund axonale Schäden und Verluste ist, beigetragen teilweise durch chronische Demyelinisierung. Strategien, um verlorene Myelin wiederhergestellt werden daher als ein viel versprechender Behandlungsansatz bis zur Krankheitsprogression zu verzögern und vielleicht umkehren neurologische Symptome.
Remyelinisierung ist ein körpereigenes Reparaturreaktion im ZNS, wobei neue Myelinscheiden aus rekrutiert Oligodendrozyten-Vorläuferzellen erzeugt(OPC), die in Myelin bildenden Oligodendrozyten differenzieren. Remyelinisierung hat in Tiermodellen gezeigt, recht robust 1-3, jedoch sinkt die Effizienz mit dem Alter 4 zu sein. Tatsächlich tritt Remyelinisierung beim Menschen, obwohl es nicht vollständig in der Mehrzahl von MS-Patienten 5 ist. Alle derzeit verfügbaren Medikamente für MS in erster Linie zielen die aberrante Immunkomponente der Erkrankung und, während effektiv bei der Reduzierung Rückfälle, nicht merklich verzögert Fortschreiten der Krankheit. Die nächste Generation von therapeutischen Strategien für die Behandlung von MS werden Fortschritte in der Immunmodulation mit Verbesserung des endogenen Remyelinisierung um beide Schübe und Progression 6 verhindern integrieren.
Eine Methode, um zu studieren De- und Remyelinisierung im Zentralnervensystem beinhaltet die direkte Injektion der Waschmittel Lysophosphatidylcholin (Lysolecithin) in das Rückenmark weißen Substanz 1,3,7. Dieses Verfahren erzeugt eine gut charakterisierte demyelinating Verletzungen hauptsächlich aus Makrophagen / Mikroglia-Infiltration und Aktivierung 8,9, reaktive Astrogliose, Störung des axonalen Homöostase / axonalen Verletzungen und OPC-Proliferation und Migration 10. Die Läsion vorhersehbar entwickelt sich über einen Zeitraum von ein paar Wochen, und ist schließlich in der Lage, vollständig remyelinisierende. Diese Methode ist besonders nützlich bei der Untersuchung der Choreografie der Ereignisse in De- und Remyelinisierung beteiligt gewesen. Weiterhin hat sich als Instrument für die präklinische Prüfung von Kandidaten Therapien angenommen worden, um die Reparatur zu beschleunigen nach einer demyelinisierenden Beleidigung.
Protokoll
HINWEIS: Die in diesem Verfahren verwendeten Tiere wurden gemäß dem Canadian Council on Animal Care (CCAC) Richtlinien betreut. Ethik wurden von der Animal Care Committee der University of Calgary zugelassen.
1. Bereiten Sie Spritze zur Injektion
- Löse Lysolecithin auf eine 1% ige Lösung in Phosphat-gepufferter Salzlösung (PBS; pH 7.4) aufgenommen und bei -20 ° C in kleinen Aliquots (75 ul). Tauwetter ein Fläschchen auf RT.
HINWEIS: Wenn Lysolecithin ungelöst, beschallen das Rohr in einem Ultraschallreiniger (40 kHz) für ungefähr 30 min, um eine einheitliche Lösung zu bilden. - Gehen Sie mit dem Pre-gezogen Glaskapillare mit äußerster Vorsicht, um eine Beschädigung der empfindlichen Spitze. Die Mutter einer 10 ul Injektion Spritze abschrauben und ziehen Sie ihn auf den flachen Ende der Kapillare, gefolgt von 2 Aderendhülse, sicherzustellen, dass die passenden Enden der Ferrulen ausrichten und die Kapillare ist gemütlich in der konischen Hülse (Abbildung 1). Spülen Sie die Spritze mit isopropyl Alkohol und nehmen Sie den Kolben. Nach dem Trocknen, schrauben Sie die Nadelanordnung handfest auf die Injektionsspritze.
- Befestigen Sie die Metallnabe Nadel auf die Grundierung Spritze. Pierce eine Gummischeibe mit der Nadel und schieben Sie sie bis auf den Grund. Füllen Sie die Spritze mit Grundierung Lysolecithin. Der Entlüftungs Spritze leicht drücken bis Flüssigkeit an der Spitze der Nadel sichtbar wird. Dies stellt sicher, Luftblasen nicht in die Injektionsspritze eingeführt werden.
- Legen Sie die Metall-Hub Nadel der Spritze in die Grundierung Injektionsspritze. Einen festen Dichtung mit der Gummischeibe, langsam die Grundierung Spritze drücken, bis die Kapillare füllt bis zur Spitze mit Lösung. Entfernen Sie vorsichtig die Grundierung Spritze und gleichzeitig gedrückt, um den Lauf der Injektionsspritze, ohne dabei Luftblasen zu füllen. Legen Sie den Kolben in die Injektionsspritze und sicherzustellen Lösung fließt von der Spitze der Kapillare, wenn der Kolben sanft gedrückt wird.
HINWEIS: Wenn Luftblasen in der Kappe zu sehen sindIllary oder Injektionsspritze, muss die Spritze Herstellung von Anfang an wiederholt werden. Kontinuierliche Fluid in der Einspritzvorrichtung ist kritisch, um genaue Injektionsvolumina sicherzustellen. - Das ausgefüllte Injektionsspritze auf dem Arm eines stereotaktischen Mikromanipulator. Dies vervollständigte Vorrichtung in der Lage, 15-20 Tiere benötigen, bevor neu befüllt werden injizieren.
- Entsorgen Sie die Rest Lysolecithin aus der Grundierung Spritze. Zurückziehen und mehrmals drücken Isopropylalkohol, und nehmen Sie den Metallnabe Nadel. Warten Sie einige Stunden für den Rest Isopropyl-Alkohol in der Grundierung Spritze vor dem erneuten Befüllen verdampfen.
2. Bereiten Tier für Operationsverfahren
Hinweis: Dieses Verfahren ist für die weibliche C57BL / 6-Mäuse im Alter von 8-10 Wochen beschrieben.
- Betäuben des Tieres mit einer intraperitonealen Injektion von Ketamin (200 mg / kg) und Xylazin (10 mg / kg) oder pro Institutional Animal Care Vorschriften. Plan für dieTier unter Narkose für ca. 1 Stunde, wenn mit injizierbaren Anästhesie.
- Testen Sie, ob das Tier tief durch festes Einklemmen des Fußes betäubt. Ein richtig anästhesiert Tier nicht auf die Pinch reagieren.
- Mit Knipser, rasieren eine 2-3 cm 2 Fläche auf der Rückenseite des Tieres, in der Nähe der Ohren. Achten Sie darauf, das Gehör beschädigen.
- Wischen Sie den Bereich mit 70% Ethanol auf eine Gaze aufgebracht. Stellen Sie sicher, alles abgeschnitten Haare aus dem Bereich entfernt wurde. Desinfizieren Sie den Bereich mit Jod.
- Vaseline in die Augen, um das Trocknen während des Verfahrens zu verhindern.
- Halten Sie das Tier in einem beheizten Rückgewinnungskammer bis bereit, das Verfahren zu beginnen.
3. Führen Sie die Operationsverfahren
HINWEIS: Für angemessene aseptische Technik für alle Schritte des Verfahrens. Dazu gehören die ordnungsgemäße Verwendung von Handschuhen, Haarnetze, Masken und Vorhänge. Alle Werkzeuge sollten, bevor er in contac sterilisiert werdent mit dem Tier.
- Bewegen Sie das Tier an einen stereotaktischen Rahmen, bis Rückenseite, erhöht in der Mitte Abschnitt von gefalteten Papierhandtücher, um die Krümmung der Wirbelsäule zu übertreiben. Befestigen Sie die Arme und Schwanz mit chirurgischen Band und sichern Sie den Kopf mit einer Zahnklammer. Stabilisierende Ohr Bars sind nicht notwendig für dieses Verfahren.
- Verwenden Sie ein Skalpell, um einen 3 cm Mittelschnitt zu machen, beginnend direkt unter den Ohren und Schneiden in der kaudal.
- Suchen Sie die Kluft zwischen den 2 großen adipösen Strukturen und benutzen feinen Pinzette in jeder Hand, um diese auseinander zu ziehen. Verbreiten Sie Retraktoren auf das Operationsfeld zu öffnen.
- Unter einem Operationsmikroskop, suchen Sie die prominente Auswuchs Prozess des T2 Wirbel (Hinweis: Diese Funktion ist charakteristisch für den C57BL / 6-Maus-Stamm). Führen Sie eine stumpfe Dissektion mit geschlossener Frühjahr Schere durch die Überlagerung der Muskulatur, um besser zu visualisieren T2. Mit der Pinzette, fühlen für den harten Oberflächen von T3 und T4 die richtige anatomische Lage zu bestätigen.
- Mit Federschere, machen flache seitliche Schnitte (2-3 mm tief) des Bindegewebes zwischen T3 und T4. Aufgrund der natürlichen Abstand zwischen den Wirbeln in der oberen Brustabschnitt der Maus Wirbelsäule ist eine Laminektomie nicht notwendig, offenbaren das Rückenmark. Denken Sie, dass zu tief ein Schnitt wird durchstoßen und beschädigen Sie das Kabel.
HINWEIS: Ein kleiner Grad der Blutung ist bei diesem Schritt gemeinsam. Wenn dies geschieht, halten Sie einen Schwamm Speer in den Bereich, bis die Blutungen Subventionen (30-60 s). - Visualisieren Sie das Rückenmark. Es wird mit einer dicken Schicht aus sichtbar Dura abgedeckt werden, wenn diese Hirnhautschicht wurde noch nicht geschnitten, gleichzeitig jedoch das Kabel. Ein prominenter Blutgefäß läuft Schwanz / rostral durch die ungefähre Mittellinie des Rückenmarks.
HINWEIS: Diese Gefäßsystem sollte nicht als ein Wahrzeichen für die Mittellinie verwendet werden. Stattdessen sollte eine ausreichende Beleuchtung der grau-weiße Angelegenheit Grenzen flankieren den dorsalen Säule zu offenbaren, und diese sollten verwendet werden, um die Mittellinie zu schätzen. - Wenn der Durableibt erhalten, stellen sanfte seitliche Schrammen mit einer 32 G Metallnadel, bis es gelöscht wird. Ziel ist es, die Dura zu entfernen, während nicht schneiden Sie die verbleibenden zugrunde liegenden Hirnhäute, die nicht so dick und schwerer zu finden sind.
HINWEIS: Freisetzung von Liquor eine Verletzung der Arachnoidea und während dies ohne mechanische Schädigung des Gewebes auftreten, sollte die akkumulierte Cerebrospinalflüssigkeit mit einem Schwamm Lanze entfernt, um die Oberfläche des schnur besser sichtbar werden. - Bewegen Sie die Injektionsspritze an Ort und Stelle und langsam absenken, bis die Spitze der Kapillare gerade noch berührt das Rückenmark sofort seitlichen von beiden Seiten der Mittellinie. Verriegeln Sie den Arm in Position.
- Verwenden Sie die abgestufte Messungen der Z-Richtung der stereotaktischen Arm um eine Grundlinie Positionsmessung zu machen. Von diesem Messwert, subtrahieren 1,3 mm. Verwenden Sie eine schnelle und flache Abwärtsbewegung, um das Gewebe zu durchdringen und dann lassen Sie das kapillare, bis die neue Messung erreicht ist. Optional: wenn gewünscht,Läsionen in der dorsalen Säule kann durch das gleiche Stechbewegung an der Mittellinie und einer Tiefe von 0,3 mm (siehe Diskussion für weitere Informationen) erzeugt werden.
ANMERKUNG: Diese Werte spezifisch für Injektion zwischen T3 und T4. Wenn die Entscheidung, um die Injektion an irgendeiner anderen Stelle in der Wirbelsäule durchzuführen, müssen diese Werte von allen verfügbaren Mausgehirnatlas abgeleitet werden. - Verwenden Sie die Mikromanipulator in der ventralen Rückenmark weißen Substanz drücken Lysolecithin. Make 1 Drehung der Mikromanipulator alle 5 Sekunden 2 Minuten, was zu einem Endvolumen von 0,5 & mgr; l. Verlassen Sie die Kapillare in Platz für 2 weitere Minuten, um Rückfluss von Lösung zu verhindern, und dann vorsichtig die Kapillare.
- Binden Sie einen einzigen Faden in der Überlagerung der Wirbelsäule Muskel / Fettgewebe. Verwenden Sie eine nicht-Knopfnaht, um die Haut zu schließen. Anwenden mehr Jod Inzisionsstelle.
- Legen Sie das Tier in einem beheizten Rückgewinnungskammer, bis sie wieder, dann wieder in seinem Käfig. Bewerben Analgetika post-operativ nach institutionellen Tierpflegevorschriften. Zusätzliche postoperative Pflege ist in der Regel nicht erforderlich, da die Tiere uneingeschränkt gehfähig und in der Lage, selbst Fress- und Trink, sobald sie aus der Narkose.
- Wiederholen Sie den Vorgang für die restlichen Tiere.
HINWEIS: Mit Kompetenz, der Betrieb kann in 10-15 Minuten pro Tier vor allem mit Hilfe einer zweiten Person zu binden Nähten abgeschlossen sein. Das gleiche Glaskapillare können für ca. 15-20 Operationen verwendet werden, bevor die Spitze stumpf und muss ersetzt werden. Steueroperationen können identisch ausgeführt werden, wie beschrieben, mit einer Injektion von PBS in das Rückenmark statt Lysolecithin. Wir empfehlen nicht, die Reinigung der Kapillaren für die zukünftige Verwendung.
4. Die Gewebeverarbeitung und -analyse
- Opfern die Tiere mit einer intraperitonealen Dosis von Ketamin (500 mg / kg) und Xylazin (25 mg / kg) in gewünschten Zeitpunkten. Läsionen in der foll entwickeln typischerweiseaufgrund Weise: 1-3 Tage, aktive Demyelinisierung; 3-7 Tage, OPC-Einstellung; 7-10 Tage, Oligodendrozyten-Differenzierung; 10-21 Tage, aktiv Remyelinisierung 2,10,11.
- Um Gewebe für die Histologie vorbereitet, zunächst eine transkardialer Perfusion 12 führen mit 20 ml RT PBS, gefolgt von 20 ml eiskaltem 4% Paraformaldehyd in PBS. Für die Herstellung von Harz eingebetteten Gewebe für halb- oder ultradünne Schnitte, siehe Schritt 4.9.
- Entfernen Sie das Rückenmark mit gebogenen Knochen Schere, um durch die einzelnen Wirbel ab zervikalen Ende der Wirbelsäule und Arbeiten bis in den unteren Brust Ebene geschnitten. Fixieren die Rückenmark O / N in 4% Paraformaldehyd in PBS bei 4 ° C. Schalten Sie die Kabel auf 30% Saccharose in PBS bei 4 ° C für mindestens 72 Stunden.
- Identifizieren der Injektionsstelle nach einer Anomalie auf der dorsalen Oberfläche des Rückenmarks. Schneiden Sie ein 3 mm Gewebestück (mit der Injektionsstelle in der Mitte) und in cryomolds, die optimale Schnitttemperatur (OAT) co richten Sie die Stückempound. Hängen Sie die Unterseite der cryomolds in einem gekühlten Mischung aus 2-Methyl und Trockeneis, bis der Oktober vollständig gefroren ist. Bei -80 ° C bis zu seiner Sektion.
- Abschnitt der Rückenmark auf einem Kryostaten bei einer Breite von 20 & mgr; m auf Objektträgern und an der Luft trocknen O / N vor dem Speichern der Objektträger bei -20 ° C.
- Detect Läsion Lage und Größe mit einem Eriochrom Cyanin histologische Fleck von Myelin 13. Führen Sie alle Schritte bei Raumtemperatur. Luft trocknen Folien für 30 min. Die Objektträger in Klärmittel für 1 min, gefolgt von Rehydratisierung in abgestuften Ethanollösungen (100%, 95%, 90%, 70%, 50%, Wasser) für jeweils 1 min.
- Die Objektträger in Eriochrome Cyanin-Lösung für 15 min, gefolgt von einer 1 min mit Wasser gewaschen. Differenzieren in 0,5% Ammoniumhydroxid für 10 sec, gefolgt von einer 1 min mit Wasser gewaschen. Entwässern in abgestuften Ethanollösungen (in umgekehrter Reihenfolge wie oben beschrieben) für 1 min jeweils, Deckglas mit Montage Medien und Bild auf einer Hellfeld-mikop.
- Verwenden Sie die Immunhistochemie auf Axone und Myelin zu visualisieren. Luft trocknen Folien für 30 min. Entwässern mit abgestuften Ethanol (Wasser, 50%, 70%, 90%, 95%, 100%) für jede 2 Minuten bei Raumtemperatur und dann in umgekehrter Reihenfolge wieder zu Wasser. Dieser Schritt führt zu einer höheren Auflösung der einzelnen Ringe 14 Myelin.
- Blockieren nicht-spezifischer Antikörper-Wechselwirkungen unter Verwendung von 10% Ziegenserum und 0,25% Triton X-100 in PBS für 60 min bei RT. Verdünnte primäre Antikörper (Maus-anti-SMI312 1: 2.000 Kaninchen-Anti-MBP 1: 1000) in PBS und Inkubation auf Folien O / N bei 4 ° C.
- Für 5 min mit PBS bei RT Waschen 5mal. Verdünnte sekundäre Antikörper (Alexa 488-Anti-Kaninchen 1: 500, Alexa 546-Anti-Maus 1: 500) in PBS und Inkubation auf Objektträgern für 60 min bei RT. Für 5 min mit PBS bei RT Waschen 5mal. Halterung gleitet mit Deckgläschen mit Gelvatol und Bild auf einem Fluoreszenzmikroskop.
- Immunhistochemie an Zellen des Oligodendrozyten-Linie sichtbar. Befolgen Sie die Anweisungen für step 4,7 Weglassen der Dehydratisierung / Rehydratisierung Schritt und unter Verwendung von 10% Pferdeserum anstelle von Ziegenserum. Verwenden Sie die folgenden primären Antikörper Verdünnungen: Ziege-Anti-PDGFRα 1: 100, Maus-Anti-A1 1: 200, Kaninchen-Anti-Olig2 1: 200. Verwenden Sie die folgenden sekundären Antikörperverdünnungen: Alexa 488 Anti-Ziege 1: 500, Alexa 594-Anti-Maus 1: 500, Alexa 647-Anti-Kaninchen 1: 500.
- Um Gewebe für halb- oder ultradünne Schnitte vorzubereiten, zuerst eine transkardialer Perfusion 12 führen mit 20 ml RT PBS, gefolgt von 20 ml eiskaltem 4% Paraformaldehyd / 1% Glutaraldehyd in PBS. Entfernen des Rückenmarks, wie in Schritt 4.3 beschrieben. Fix O / N in 4% Paraformaldehyd / 1% Glutaraldehyd in PBS bei 4 ° C.
- Identifizieren Sie die Injektionsstelle, wie in Schritt 4.4 beschrieben. Schneiden Sie ein 1 mm Stück mit dem Gewebe der Injektionsstelle. Zusätzlich 1 mm Blöcke auf jeder Seite der Läsion, wenn gewünscht, hergestellt werden, sowie.
- In einer Abzugshaube, fügen Sie das 10-fache Volumen 1% Osmiumtetroxid / 1,5% Kaliumferrocyanid auf jeden Block auf dem Eisfür 60 min.
HINWEIS: Osmiumtetroxid ist eine hochgiftige Substanz, und sollte mit äußerster Vorsicht behandelt werden. Alle Materialien, die in Kontakt mit Osmiumtetroxid sollte in Maisöl (das doppelte Volumen wie Osmiumtetroxid-Lösung) zur Neutralisation platziert werden. - Waschen Korden 3 mal mit 0,2 M Cacodylat 10 min bei RT, Verwerfen in Maisöl. Entwässern mit abgestuften Ethanollösungen (Wasser, 50%, 70%, 90%, 2-mal mit 95%, 2-mal mit 100% 2-mal mit Propylenoxid) für 10 Minuten bei RT.
- Betten Sie Kabel in Harz nach Herstellerangaben.
- Schneiden Blöcke auf einem Ultramikrotom und montieren Schnitte auf Wassertropfen auf Objektträgern. Objektträger auf eine heiße Platte (ca. 50 ° C) bis zur Trockne.
- Visualisieren Myelin durch Zugabe einiger Tropfen von 1% Toluidinblau / 2% Borax-Lösung auf die Objektträger für 10-15 sec bei 50 ° C. Mit Wasser abspülen, trocken und Deckglas mit Montage Medien. Bildausschnitte auf einem Hellfeld-Mikroskop.
Ergebnisse
Brenn Injektion von Lysolecithin des ventralen weißen Substanz erzeugt eine diskrete demyelinisierende Läsion, die über eine Strecke von etwa 3 mm (2) detektierbar ist. Immunhistochemische Färbung der Läsion Kern für Myelin (MBP) und Axonen (SMI312) zeigt Axonen von Myelin bei 7 Tagen (Abbildung 3) abgestreift wurden. Von 14 Tagen werden viele Axone von MBP-positive Ringe, die das Auftreten von Remyelinisierung schlägt umgeben. Anfärben von Zellen des Oligodendrozyten Linie (PDGFRα, Olig2, CC1), gibt es eine signifikante Zunahme sowohl der Gesamtzahl der Zellen am Tag 14 im Vergleich zu 7 Tagen, sowie die Verteilung der reifen Oligodendrocyten Vergleich zu OPCs (Figur 4) . In Übereinstimmung mit diesem Befund Semidünnschnitte mit Toluidinblau gefärbt zeigen das Vorhandensein von dünnen Myelinhüllen nach 14 Tagen, die selten bei 7 Tagen (Abbildung 5) detektiert werden, was anzeigt, dass diese i remyelinatednternodes.
Das Verfahren ist sehr gut reproduzierbar zwischen Tieren. Variation tritt auf, wenn schwere Atmung verändert die stationäre Position der Kapillare, das ist in der Regel kein Problem mit ausreichenden Sedierung. Beschädigung Axone erscheint minimal sein, außer in der Mitte der Läsion, die sich seit der frühesten Verwendung des Modells 1 beschrieben wurde. Wir glauben, dass diese gegen mechanische Schädigung der Glaskapillare, da sie auch beobachtet werden in PBS injizierten Kontrollen. Dennoch tendiert Variabilität klein sein, und wir und andere mit einem ähnlichen Verfahren Unterschiede zwischen Versuchsbedingungen mit nur 4 Tieren pro Gruppe 15 erfaßt haben.
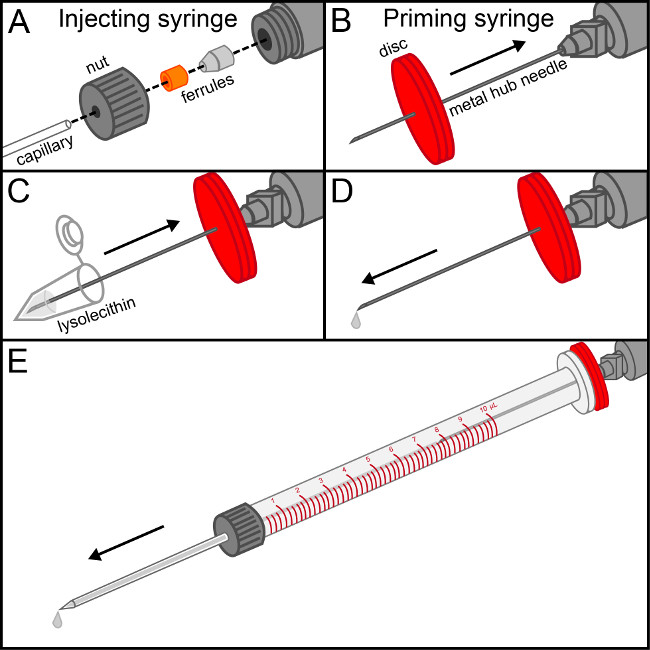
Abbildung 1. Montage der Injektionsspritze. (A) Die Mutter des Injektionsspritze wird auf t Gewinde er flache Ende der Glaskapillare, gefolgt von dem 2 Ferrulen sind, daß ihre Passungsenden Verriegelung. Sobald die Kapillare fest im konischen Hülse eng ist die Baugruppe handfest auf das Ende der Injektionsspritze eingeschraubt. (B) Stück das Zentrum einer Gummischeibe mit dem Metall-Hub Nadel an der Spritze befestigt Grundierung und schieben Sie sie bis zum die Basis. (C) herausziehen Lysolecithin Lösung in die Grundierung Spritze. (D) die Grundierung Spritze vorsichtig drücken, bis der erste Tropfen Lysolecithin an der Spitze der Nadel sichtbar ist. (E) Legen Sie die Priming-Spritze in den Lauf von der Einspritz Spritze, so dass eine feste Dichtung mit der Gummischeibe. Die Lösung vorsichtig zu drücken, bis es mit dem Ende der Kapillare läuft. Vorsichtig ziehen Sie die Grundierung Spritze und gleichzeitig Druck auf den Kolben, um das Metall-Hub Nadel, ohne dabei Luftblasen in die Injektionsspritze entfernen.Upload / 52.679 / 52679fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 2. Representative Lysolecithin Läsion mit Erio- chromcyanin gefärbt. Serienschnitte eines charakteristischen Lysolecithin Läsion an 14 Tagen mit Erio- chromcyanin gebeizt (400 & mgr; m voneinander entfernt), um Myelin (blau) sichtbar zu machen. Beachten Sie, dass Demyelinisierung auf der ventralen weißen Substanz beschränkt und dass die Läsion erstreckt sich über etwa 3 mm im rostralen / kaudal. Maßstabsbalken = 1 mm. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3. Axone und Myelin indie Lysolecithin Modell. (A) Ein Schein (PBS) injiziert Rückenmark nach 7 Tagen zeigt gesunde Axone, die von Myelin Ringen umgeben sind. (B) A Lysolecithin Läsion nach 7 Tagen zeigt entblößt Axone als auch abgebaut Myelin. (C) Nach 14 Tagen ein Anteil der Axone (Beispiele mit weißen Pfeilen bezeichnet) mit dem Wiederauftreten von Myelin Ringe verbunden. Maßstabsbalken = 10 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
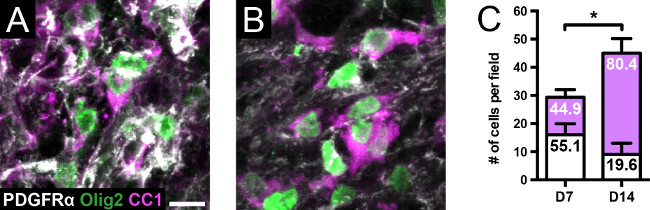
Abbildung 4. Oligodendrocyte Linie Zellen im Lysolecithin Modell. (A, C) nach 7 Tagen, es gibt eine größere Darstellung PDGFRα + OPCs (weiße Balken), bezogen auf A1 + Oligodendrozyten (magenta Balken); die Zahlen in den Balken geben Prozentsätze. Olig2 wurde untersuchtBestätigen Färbung von Oligodendrozyten Linie Zellen. (B, C) Nach 14 Tagen gibt es einen signifikanten Anstieg in der Gesamtzahl der Oligodendrozyten Linie Zellen im Vergleich zu 7 Tagen (p <0,05, zweiseitiger t-Test, n = 4 pro Gruppe ). Es gibt auch einen signifikanten Anstieg in der Verteilung der Oligodendrozyten OPCs nach 14 Tagen im Vergleich zu 7 Tagen (p <0,0001, Fisher-Exact-Test). Maßstabsbalken = 10 & mgr; m. Jedes Feld wird in einem Original-Vergrößerung von 60X eingefangen. Werte sind Mittelwerte ± SD. * Bedeutet, p <0.05. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
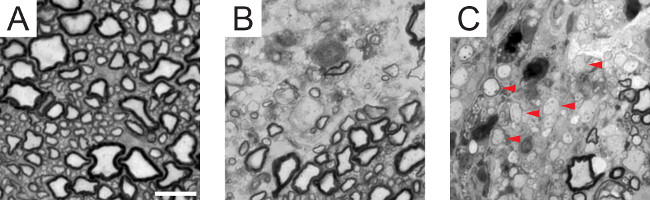
Abbildung 5. Remyelinisierung im Lysolecithin Modell. (A) eine Querschnitts Toluidinblau gefärbt Semidünnschnitt der ventralen weißen Substanz in einem healthy Maus zeigt Axone über einen weiten Bereich von Kaliber mit entsprechenden Myelindicke. (B) nach 7 Tagen, ein Mangel an Myelinscheiden ist neben einem nicht betroffenen Gebiet (rechts unten) beobachtet. (C) Nach 14 Tagen dünn markScheiden ( Beispiele mit roten Pfeilen gekennzeichnet) erscheinen in der gesamten Läsion, was auf remyelinated Segmenten. Maßstabsbalken = 10 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
Eine Reihe von Tiermodellen wurden entwickelt, um MS, die meisten erkennbar der experimentellen autoimmunen Enzephalomyelitis (EAE) Modell zu studieren. In EAE sind Nagetiere gegen ein Fragment eines Myelin-Peptid und entzündlichen Läsionen Entwicklung manifestiert sich in aufsteigenden Lähmungen zu unterziehen. Während dieses Modell als hilfreich präklinische Prüfung von immunmodulatorischen MS Medikamente, ist es nicht ideal für das Studium Remyelinisierung aus drei Gründen: Erstens ist die Lage der entzündlichen Läsionen etwas zufällig, und Ortung Läsionen bei der Verarbeitung von Gewebe für die halb- oder ultradünnen Abschnitte kann eine Herausforderung sein. Der zweite ist, dass die Remyelinisierung tritt über einen bestimmten Zeitverlauf und die genaue Alter eines einzelnen EAE Läsion nicht ohne kontinuierliche nichtinvasive Magnetresonanztomographie bekannt sein. Das dritte ist, dass die Remyelinisierung ist ein natürlich auftretendes Phänomen in Nagetieren und der Nachweis Remyelinisierung nach Wirkstoffbehandlung in EAE kann ein primäres Ergebnis der Arzneimittel sein, aber inStatt ein sekundäres Phänomen der Verringerung der Entzündung.
Ein anderes übliches Verfahren zur Herstellung von Demyelinisierung durch Einführen des Kupferchelatbildners Cuprizon in der Nahrung erzielt. Dies führt zu einer weit verbreiteten Demyelinisierung, insbesondere im Corpus callosum. Es gibt Beschränkungen bei der Untersuchung des Corpus callosum als Ort der Remyelinisierung aus den folgenden Gründen: Erstens Axon Durchmesser (und somit Myelindicke) kleiner sind als bei anderen ZNS-Regionen, und dadurch dünn remyelinated Scheiden können nicht von denen, die nie demyelinisierten waren sein. Zweitens, weil die Maus Balken enthält> 70% marklosen Axonen 16, kann es nicht klar, ob ein remyelinated Segment gilt Reparatur geschädigter Myelin oder De-novo-Synthese Myelin im Erwachsenen, die in der Regel tritt auf, 17 sein.
Es ist unsere Überzeugung, dass das beste Modell für die Untersuchung Remyelinisierung ist die direkte Injektion von Toxinen, entweder Lysolecithin, ethidium Bromid-, oder andere, in die Schwanzhirnschenkel 18 oder dem Rückenmark der weißen Substanz. Der frühere Ort wird nur durch präzise 3-Dimension stereotaktische Injektion gelöst und auf größere Nagetiere (Ratten) aufgrund der geringen Größe der Kleinhirnstiele beschränkt. Dies schließt die umfangreichen Ressourcen von transgenen Mäusen, bei der Untersuchung De- und Remyelinisierung. Das Rückenmark enthält jedoch viele große weiße Substanz Striche, die leicht zugänglich sind operativ. Räume zwischen den Wirbeln im rostralen thorakalen Segment ermöglicht Belichtung des Rückenmarks, ohne die Notwendigkeit für eine Laminektomie, die ein notwendiger Schritt bei kaudalen thorakalen chirurgischen Verfahren ist. Ein Vorteil der speziell auf die ventrale weißen Substanz ist, dass die Axone sind gleichmäßig größer ist als die dorsale weißen Substanz, so dass die Quantifizierung der Remyelinisierung ein eindeutiger Aufgaben ähnlich wie die Herausforderungen im Zusammenhang mit den Balken verbunden. Darüber hinaus macht die ventrale weißen Substanz eine viel größere tArget Bereich zu injizieren; mehrere hundert Mikrometer seitlich im dorsalen Bereich würde die Kapillare außerhalb der Kolonne zu platzieren, während die gleiche Abweichung ventral würde immer noch eine herausragende demyelinisierende Läsionen zu erzeugen. Einige Protokolle injizieren Lysolecithin sowohl in die dorsalen und ventralen Spalten derselben Tier 19. Dies kann sowohl die Wahrscheinlichkeit einer richtigen Kapillare Platzierung und die Anzahl der messbaren Läsionen in weniger Tiere zu erhöhen. Während die vorgestellten aktuellen Daten ist von 8 bis 10 Wochen alten Tieren zum Zeitpunkt der Operation haben wir hatten auch Erfolg mit dem gleichen Verfahren auf 8-10 Monate alten Mäusen, in denen die Remyelinisierung wird als deutlich langsamer 4 beschrieben.
Die Quantifizierung der Remyelinisierung ist keine triviale Aufgabe. Eine zentrale Dogma postuliert, dass remyelinated Segmente kürzer und dünner im Durchschnitt als gesunde und damit g-Ratio-Berechnungen (Axondurchmesser geteilt durch Axon Myelin + Durchmesser) der Querschnittshalb or Ultradünnschnitte wurden Standardverfahren geworden. Es ist jedoch bekannt, dass remyelinated Segmente verdicken mit der Zeit 2 und eine kürzlich durchgeführte Studie mit einer transgenen Reporter remyelinisierende Oligodendrozyten legt nahe, dass viele Internodien schließlich nicht von Steuer 20 geworden. Quantifizieren der Anzahl reifer Oligodendrocyten innerhalb der Läsion ist ein indirekter Weg zur Reparatur zu messen, wie Oligodendrozyten geeignet ist, eine große Anzahl an Internodien, und ein signifikanter Anteil der Remyelinisierung-je nach Modell verwendet, kann von Schwann-Zellen 3 auftreten. Natürlich, wie Remyelinisierung wurde zur Wiederherstellung der saltatory Leitung 21 in Verbindung gebracht worden, die endgültige Metrik Reparatur würde funktionelle Erholung von neurologischen Defiziten sein. Während Remyelinisierung wurde auf Wiederherstellung der Funktion bei einigen Arten 22,23 in Verbindung gebracht worden, es war nicht ein Standardverfahren in murinen Lysolecithin Studien geworden. Dies ist wahrscheinlich auf einen Mangel an offenen observLage Defizite entweder von dorsal oder ventral Läsionen im Vergleich zu robusteren Demyelinisierung Modelle wie EAE und sogar Cuprizon. Wir glauben, dass funktionelle Defizite von Lysolecithin Einspritzung und anschließende Erholung mit Remyelinisierung resultierenden, nur zu beobachten sein mit empfindlichen Tests feiner sensomotorische Funktion.
Eine PubMed-Suche von "Remyelinisierung" neben einem der oben genannten, wenn auch eine brüske methodischen Ansatz Tiermodellen, zeigt weniger Suchtreffer für Lysolecithin (109) gegenüber EAE (188) und Cuprizon (197). Wenn unser Argument, dass Lysolecithin Demyelinisierung ist die überlegene Ansatz für das Studium Remyelinisierung, warum ist es die am wenigsten diskutiert? Vielleicht eine Besorgnis für die Verwendung dieser Methode beruht auf dem Glauben, der technischen Schwierigkeiten bei der Durchführung der Operation. In Wirklichkeit ist dieses Verfahren schnell, kostengünstig, und ist nicht schwieriger als Routine Gewebedissektion, Materialien, die alle handels sind erforderlichüblichen. Es ist unsere Hoffnung, dass dieses Protokoll beweist, nützlich für diejenigen, die diese leistungsstarke Modell in ihr Repertoire für die Untersuchung der spannenden und wachsenden Bereich der Myelinreparatur hinzufügen möchten.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This project was funded by a grant from the Multiple Sclerosis Society of Canada and the Alberta Innovates - Health Solutions CRIO Team program. MBK is a recipient of studentships from Alberta Innovates - Health Solutions and the Multiple Sclerosis Society of Canada. SKJ is funded by a graduate student support grant from the Alberta endMS Regional Research and Training Center of the Multiple Sclerosis Society of Canada. The authors wish to acknowledge Dr. Jan van Minnen and the Regeneration Unit in Neurobiology core facility for training and use of equipment.
Materialien
| Name | Company | Catalog Number | Comments |
| spring scissors | Fine Science Tools | 15004-08 | |
| forceps | Fine Science Tools | 11254-20 | |
| retractor | Fine Science Tools | 17003-03 | |
| clippers | Philips | QG3330 | |
| heating recovery chamber | Peco Services | V1200 | |
| surgical tape | 3M | 1527-1 | |
| scalpel handle | Fine Science Tools | 10003-12 | |
| scalpel blade | Feather | No. 15 | |
| sponge spear | Beaver Visitec | 581089 | |
| 5-0 Vicryl sutures | Ethicon | J511G | |
| curved ToughCut spring scissors | Fine Science Tools | 15123-12 | |
| 32 G metal needle | BD | 305106 | |
| needle holders | Fine Science Tools | 12002-14 | |
| angled forceps | Fine Science Tools | 11251-35 | |
| cotton tipped applicator | Puritan | 806-WC | |
| gauze pads | Safe Cross First Aid | 3763 | |
| 10 μl syringe | Hamilton | 7635-01 | make sure to purchase the microliter, not gastight syringe |
| compression fitting | Hamilton | 55750-01 | contains the 2 ferrules and removable nut, but the nut that comes with the 10 μl syringe is a tighter fit |
| priming kit | Hamilton | PRMKIT | contains the priming syringe, removable hub needle and the rubber discs |
| pre-pulled glass capillaries | WPI | TIP10TW1 (pack of 10) | contains capillaries with 10 μm inner diameter. 30 μm inner diameter also work (TIP30TW1) |
| stereotactic frame | David Kopf instruments | Model 900 | |
| Ultrasonic cleaner | Fisher Scientific | FS-20 | |
| Tissue-Tek optimal cutting temperature (OCT) compound | VWR | 25608-930 | |
| Tissue-Tek intermediate cryomold | VWR | 25608-924 | |
| cryostat | Leica | CM1900 | |
| microscope slides | VWR | 48311-703 | |
| bright field microscope | Olympus | BX51 | |
| ultramicrotome | Leica EM UC7 | EM UC7 | |
| Lysophosphatidylchoine | Sigma | L1381 | |
| 2-methylbutane | Sigma | M32631 | |
| Triton x-100 | Sigma | X-100 | |
| goat serum | Sigma | G9023 | |
| Mouse anti-SMI312 antibody | Covance | SMI-312R | 1:2,000 dilution |
| Rabbit anti-MBP antibody | Abcam | AB40390 | 1:1000 dilution |
| Goat anti-PDGFRα antibody | R&D Systems | AF1062 | 1:100 dilution |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | 1:200 dilution |
| Mouse anti-CC1 antibody | Calbiochem | OP80 | 1:200 dilution |
| Alexa Fluor 488 goat anti-rabbit IgG | Life technologies | A-11008 | 1:500 dilution |
| Alexa Fluor 546 goat anti-mouse IgG | Life technologies | A-11003 | 1:500 dilution |
| Alexa Fluor 488 donkey anti-goat IgG | Jackson Immuno | 705-546-147 | 1:500 dilution |
| Alexa Fluor 594 donkey anti-mouse IgG | Jackson Immuno | 715-586-151 | 1:500 dilution |
| Alexa Fluor 647 donkey anti-rabbit IgG | Jackson Immuno | 711-606-152 | 1:500 dilution |
| PBS | Oxoid | BR0014 | |
| isopropyl alcohol | Sigma | 109827 | |
| ketamine | CDMV | ||
| xylazine | CDMV | ||
| iodine | West Penetone | 2021 | |
| Vaseline petroleum jelly | VWR | CA05971 | |
| paraformaldehyde | Sigma | P6148 | |
| sucrose | Sigma | S5016 | |
| Eriochrome Cyanine R | Sigma | 32752 | |
| sulfuric acid | Sigma | 320501 | |
| iron(III) chloride | Sigma | 157740 | |
| ammonium hydroxide | Sigma | 320145 | |
| Acrytol | Leica Biosystems | 3801700 | |
| Citrisolv | Fisher Scientific | 22-143-975 | |
| horse serum | Sigma | H0146 | |
| glutaraldehyde | Electron Micrscopy Sciences | 16220 | |
| osmum tetroxide | Electron Micrscopy Sciences | 19150 | highly toxic |
| potassium hexacyanoferrate (II) trihydrate | Sigma | P3289 | |
| corn oil | Sigma | C8267 | |
| polyvinyl alcohol | Sigma | P8136 | |
| glycerol | Sigma | G9012 | |
| cacodylic acid | Electron Micrscopy Sciences | 12300 | |
| propylene oxide | Electron Micrscopy Sciences | 20401 | |
| EMBED kit | Electron Micrscopy Sciences | 14120 | |
| Toluidine Blue O | Sigma | T3260 | |
| Sodium tetraborate decahydrate | Sigma | S9640 | |
| Recipes | |||
| Eriochrome cyanine solution | |||
| Ingredient | Amount to add | ||
| Eriochrome Cyanine R | 0.8 g | ||
| sulfuric acid | 400 ml 0.5% | ||
| iron(III)chloride | 20 ml 10% | ||
| water | 80 ml | ||
| *add eriochrome cyanine to sulfuric acid, followed by iron(III) chloride and water. Solution can be kept after use. Make fresh once per year. | |||
| Gelvatol | |||
| Ingredient | Amount to add | ||
| PBS | 140 mL | ||
| polyvinyl alcohol | 20 g | ||
| glycerol | 40 g | ||
| *mix well, place at 37 °C O/N, centrifuge at 1,960 x g 30 min, aliquot into 40 tubes |
Referenzen
- Blakemore, W. F., Eames, R. A., Smith, K. J., McDonald, W. I. Remyelination in the spinal cord of the cat following intraspinal injections of lysolecithin. J. Neurol. Sci. 33 (1-3), 31-43 (1977).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. J. Neurocytol. 24 (10), 775-781 (1995).
- Blakemore, W. F. Invasion of Schwann-cells into the spinal-cord of rat following local injections of lysolecithin. Neuropathol. Appl. Neurobiol. 2 (1), 21-39 (1976).
- Shields, S. A., Gilson, J. M., Blakemore, W. F., Franklin, R. J. Remyelination occurs as extensively but more slowly in old rats compared to young rats following gliotoxin-induced CNS demyelination. Glia. 28 (1), 77-83 (1999).
- Patrikios, P., et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain. 129 (Pt 12), 3165-3172 (2006).
- Keough, M. B., Yong, V. W. Remyelination therapy for multiple sclerosis). Neurotherapeutics. 10 (1), 44-54 (2013).
- Hall, S. M. The effect of injections of lysophosphatidyl choline into white matter of the adult mouse spinal cord. J. Cell Sci. 10 (2), 535-546 (1972).
- Miron, V. E., et al. M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat. Neurosci. 16 (9), 1211-1218 (2013).
- Kotter, M. R., Setzu, A., Sim, F. J., Van Rooijen, N., Franklin, R. J. Macrophage depletion impairs oligodendrocyte remyelination following lysolecithin-induced demyelination. Glia. 35 (3), 202-212 (2001).
- Lau, L. W., et al. Chondroitin sulfate proteoglycans in demyelinated lesions impair remyelination. Ann. Neurol. 72 (3), 419-432 (2012).
- Fancy, S. P., et al. Dysregulation of the Wnt pathway inhibits timely myelination and remyelination in the mammalian CNS. Genes Dev. 23 (13), 1571-1585 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), (2012).
- Skihar, V., et al. Promoting oligodendrogenesis and myelin repair using the multiple sclerosis medication glatiramer acetate. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17992-17997 (2009).
- Plemel, J. R., et al. Platelet-derived growth factor-responsive neural precursors give rise to myelinating oligodendrocytes after transplantation into the spinal cords of contused rats and dysmyelinated mice. Glia. 59 (12), 1891-1910 (2011).
- Chong, S. Y., et al. Neurite outgrowth inhibitor Nogo-A establishes spatial segregation and extent of oligodendrocyte myelination. Proc. Natl. Acad. Sci. U.S.A. 109 (4), 1299-1304 (2012).
- Sturrock, R. R. Myelination of the mouse corpus callosum. Neuropathol. Appl. Neurobiol. 6 (6), 415-420 (1980).
- Young, K. M., et al. Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron. 77 (5), 873-885 (2013).
- Woodruff, R. H., Franklin, R. J. Demyelination and remyelination of the caudal cerebellar peduncle of adult rats following stereotaxic injections of lysolecithin, ethidium bromide, and complement/anti-galactocerebroside: a comparative study. Glia. 25 (3), 216-228 (1999).
- Mei, F., et al. Micropillar assays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nat. Med. 20 (8), 954-960 (2014).
- Powers, B. E., et al. Remyelination reporter reveals prolonged refinement of spontaneously regenerated myelin. Proc. Natl. Acad. Sci. U.S.A. 110 (10), 4075-4080 (2013).
- Smith, K. J., Blakemore, W. F., McDonald, W. I. Central remyelination restores secure conduction. Nature. 280 (5721), 395-396 (1979).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120 (Pt 1), 27-37 (1997).
- Duncan, I. D., Brower, A., Kondo, Y., Curlee, J. F. Jr, Schultz, R. D. Extensive remyelination of the CNS leads to functional recovery. Proc. Natl. Acad. Sci. U.S.A. 106 (16), 6832-6836 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten