Method Article
Experimental desmielinização e remielinização de Medula Espinhal Murino por Injeção Focal de lisolecitina
Neste Artigo
Resumo
Demyelinating diseases can be modeled in animals by focal application of lysolecithin into the CNS. A single injection of lysolecithin into mouse spinal cord produces a lesion that spontaneously repairs over time. The goal is to study factors involved in de- and remyelination, and to test agents for enhancing repair.
Resumo
A esclerose múltipla é uma doença desmielinizante inflamatória do sistema nervoso central, caracterizada por formação de placas contendo oligodendrócitos perdidos, mielina, axónios e neurónios. Remielinização é um mecanismo de reparação endógena nova mielina pelo qual é produzida a proliferação subsequente, recrutamento e diferenciação de células precursoras de oligodendrócitos em oligodendrócitos formadoras de mielina, e é necessária para proteger os axônios de danos adicionais. Actualmente, todos os agentes terapêuticos para o tratamento de esclerose múltipla a identificar o componente imune aberrante da doença, o que reduz as recaídas inflamatórias, mas não evitam a progressão irreversível declínio neurológico. Portanto, é imperativo que as estratégias de promoção da remielinização ser desenvolvido que pode atrasar a progressão da doença e talvez reverter os sintomas neurológicos. Existem diversos modelos animais de desmielinização, incluindo a encefalomielite auto-imune experimental e curprizone; no entanto, há limitações em seu uso para estudar a remielinização. Uma abordagem mais robusta é a injecção focal de toxinas para o sistema nervoso central, incluindo a lisolecitina detergente na matéria branca da medula espinhal de roedores. Neste protocolo, demonstramos que o procedimento cirúrgico envolvido em injetar lisolecitina na matéria branca ventral de ratos é rápido, custo-benefício, e não requer materiais adicionais do que as disponíveis no mercado. Este procedimento é importante não só para estudar os eventos normais envolvidas no processo de remielinização, mas também como uma ferramenta de pré-clínico para o rastreio de candidatos terapêuticos promotoras remielinização.
Introdução
A esclerose múltipla (EM) é uma doença desmielinizante crónica do sistema nervoso central (SNC) caracterizada pela infiltração de células imunológicas e placas contendo perdidos de mielina, oligodendrócitos, neurónios e axónios. A maioria dos pacientes tem um curso de doença consiste em recaídas inflamatórias acompanhados por uma vasta gama de sintomas neurológicos, seguidos de períodos de remissão. Mais da metade desses pacientes, eventualmente, fazer a transição para uma fase secundária progressiva sem seqüelas aparentes, mas contínuo declínio neurológico. Acredita-se que esta deterioração progressiva é devido a lesão axonal e perda, contribuiu, em parte, pela desmielinização crónica. Estratégias para restaurar a mielina perdido, sendo reconhecida como uma abordagem de tratamento promissora para retardar a progressão da doença e talvez reverter os sintomas neurológicos.
Remielinização é uma resposta de reparação endógena no sistema nervoso central através do qual novos bainhas de mielina são geradas a partir de células precursoras de oligodendrócitos recrutados(OPC) que se diferenciam em oligodendrócitos formadoras de mielina. Remielinização tem sido demonstrado em modelos animais para ser bastante robusta 1-3, no entanto, a sua eficiência diminui com a idade de 4 anos. Com efeito, a remielinização ocorre em seres humanos embora seja incompleta na maioria dos pacientes com EM 5. Todos os medicamentos actualmente disponíveis para o MS como alvo principalmente o componente imune aberrante da doença e, enquanto eficaz na redução de recaídas, não significativamente retardar a progressão da doença. A próxima geração de estratégias terapêuticas para o tratamento da EM vai integrar avanços na imunomodulação, com o reforço da remielinização endógeno, a fim de evitar que os dois recaídas e progressão 6.
Um método para estudar mento e remielinização no SNC envolve a injecção directa do lisofosfatidilcolino detergente (lisolecitina) para a medula espinhal 1,3,7 substância branca. Este procedimento produz um demyelinat bem caracterizadoing prejuízo, que consiste principalmente de macrófagos / infiltração microglial e ativação 8,9, astrogliosis reativa, perturbação da homeostase axonal / lesão axonal, e da proliferação e migração OPC 10. A lesão evolui de maneira previsível durante o período de algumas semanas e, eventualmente, é capaz de totalmente remielinizante. Este método tem sido particularmente útil no estudo da coreografia dos eventos envolvidos na despolarização e remielinização. Além disso, ele foi adotado como uma ferramenta para testes pré-clínicos de terapias candidatos a acelerar a reparação após um insulto desmielinizante.
Protocolo
NOTA: Os animais utilizados neste procedimento foram tratados de acordo com a Canadian Council on Animal Care (CCAC) orientações. Ética foram aprovados pelo Comitê de Cuidados Animal da Universidade de Calgary.
1. Prepare a seringa para a injeção
- Dissolve-se lisolecitina para uma solução a 1% em solução salina tamponada com fosfato (PBS; pH 7,4) e armazenar a -20 ° C em pequenas aliquotas (75 ul). Descongelar um frasco à temperatura ambiente.
NOTA: se lisolecitina é não dissolvido, sonicar o tubo num aparelho de limpeza de ultra-sons (40 kHz) durante aproximadamente 30 minutos para formar uma solução uniforme. - Lidar com o capilar de vidro pré-puxou com extremo cuidado para não danificar a ponta delicada. Desaperte a porca de uma seringa injetar 10 ul e passe-o para a parte plana do capilar seguido por 2 ponteiras, garantindo que os fins de acasalamento das virolas alinhar e capilar é confortável na ponteira cónica (Figura 1). Lavar a seringa com isopropálcool il e remover o êmbolo. Depois de seco, o parafuso do lado conjunto de agulha apertado na seringa de injeção.
- Coloque a agulha de metal hub para a seringa priming. Pierce um disco de borracha com a agulha e deslize-o para a base. Encha a seringa aspirante com lisolecitina. Suavemente deprimir a seringa priming até que o líquido é visível na ponta da agulha. Isto assegura bolhas de ar não será introduzido na seringa de injecção.
- Insira a agulha de metal hub da seringa priming para a seringa de injecção. Fazendo uma vedação firme com o disco de borracha, aperte lentamente a seringa preparação até que o capilar enche até a ponta com a solução. Remover cuidadosamente a seringa priming enquanto simultaneamente pressionando para encher o cilindro da seringa de injecção de sem introduzir bolhas de ar. Inserir o êmbolo na seringa de injecção e assegurar a solução flui a partir da ponta do capilar medida que o êmbolo é pressionado suavemente.
NOTA: Se as bolhas de ar são visíveis na tampaIllary ou injecção de seringa, a preparação da seringa deve ser repetido desde o início. Fluido contínuo no aparelho de injecção é crítico para assegurar o volume de injecção precisos. - Ligue a seringa injetar completou para o braço de um micromanipulator estereotáxica. Este aparelho completou será capaz de injectar 15-20 animais antes de precisar de ser reabastecido.
- Descartar a lisolecitina restante da seringa priming. Retirar e deprimir álcool isopropílico várias vezes, e retirar a agulha hub metal. Esperar algumas horas para que o álcool isopropílico restante na seringa priming para evaporar antes de encher novamente.
2. Prepare-se de animal para o procedimento cirúrgico
NOTA: Este procedimento é descrito para o sexo feminino camundongos C57BL / 6, com idades entre 8-10 semanas.
- Anestesiar o animal com uma injecção intraperitoneal de cetamina (200 mg / kg) e xilazina (10 mg / kg) ou por regulamentação de cuidados de animais institucionais. Plano para aanimal a ser sob anestesia para cerca de 1 hora, se utilizar a anestesia injectável.
- Teste de que o animal é anestesiado profundamente com firmeza que comprime o pé. Um animal de devidamente anestesiados não vai responder ao aperto.
- Usando clippers, raspar a 2 cm área 2-3 no lado dorsal do animal, perto das orelhas. Tenha cuidado para não danificar os ouvidos.
- Limpe a área limpa com etanol 70% aplicada a uma compressa de gaze. Assegurar-se que o cabelo cortado foi removida da área. Desinfectar a área com iodo.
- Aplicar vaselina para os olhos para evitar a secagem durante todo o procedimento.
- Manter o animal em uma câmara de recuperação aquecida até que esteja pronto para iniciar o procedimento.
3. Execute o procedimento cirúrgico
NOTA: Certifique-se de uma técnica asséptica adequada para todas as etapas do processo. Isso inclui o uso adequado de luvas, toucas, máscaras e cortinas. Todos os instrumentos devem ser esterilizados antes de vir em contact com o animal.
- Mova o animal a um quadro estereotáxico, lado dorsal up, elevada no meio, seção por toalhas de papel dobradas para exagerar a curvatura da coluna vertebral. Prenda os braços e cauda com esparadrapo e proteger a cabeça com um grampo de dente. Estabilizar barras de ouvido não são necessárias para este procedimento.
- Usar um bisturi para fazer uma incisão na linha média, 3 cm, começando logo abaixo das orelhas e corte na direcção caudal.
- Localize o fosso entre as duas grandes estruturas adiposas e usar uma pinça fina em cada mão para retirar estes apart. Espalhe afastadores para abrir o campo cirúrgico.
- Sob um microscópio cirúrgico, localize o processo de crescimento proeminente da vértebra T2 (Nota: este recurso é característica da C57BL / 6 do mouse estirpe). Realize uma dissecção romba com tesoura primavera fechados através da musculatura sobreposição para melhor visualizar T2. Usando a pinça, sentir para as superfícies duras de T3 e T4 para confirmar localização anatômica correta.
- Com uma tesoura primavera, fazer cortes laterais rasas (2-3 mm de profundidade) do tecido conjuntivo entre T3 e T4. Devido ao espaçamento natural entre as vértebras torácica na porção superior da coluna vertebral do rato, uma laminectomia não é necessário para revelar a medula espinhal. Esteja consciente de que muito fundo um corte irá perfurar e danificar o cabo.
NOTA: Um pequeno grau de sangramento é comum durante este passo. Se isso ocorrer, mantenha uma lança esponja na área até que os subsídios sangramento (30-60 seg). - Visualizar a medula espinhal. Vai ser coberto com uma espessa camada de dura-máter visível se esta camada meníngea ainda não foi cortado, mas expondo o cabo. Um vaso sanguíneo proeminente corre caudal / rostral através da linha média aproximada da medula espinhal.
NOTA: Este vasculatura não deve ser usada como um ponto de referência para a linha média. Em vez disso, iluminação adequada deve revelar os limites da matéria branca e cinzenta que flanqueiam a coluna dorsal, e estes devem ser usados para estimar a linha média. - Se a dura-máterpermanece intacta, fazer arranhões laterais suaves com uma agulha de metal G 32 até que seja limpa. O objectivo é remover a dura-máter ao mesmo tempo que não corta as meninges subjacentes restantes, que não são tão espessa e difícil de ver.
NOTA: Lançamento do líquido cefalorraquidiano indica uma violação da aracnóide e enquanto isso pode ocorrer sem danos mecânicos ao tecido, o fluido cerebrospinal acumulada deve ser removida com uma lança esponja para melhor visualizar a superfície do fio. - Mover a seringa no lugar e injectando lentamente baixar até a ponta do capilar apenas mal toca na medula espinhal imediatamente lateral de cada lado da linha média. Bloqueie o braço no lugar.
- Use as medições graduais do braço estereotáxica direcção Z para fazer uma medição da posição da linha de base. A partir desta leitura, subtrair 1,3 milímetros. Use um movimento descendente rápida e superficial para furar o tecido e abaixe cuidadosamente o capilar até que a nova medida é atingido. Opcional: se desejado,lesões na coluna dorsal pode ser produzido pelo mesmo movimento de perfuração na linha média e uma profundidade de 0,3 mm (ver a discussão para mais informação).
NOTA: Estes valores são específicos para injetar entre T3 e T4. Se optar para executar a injecção em qualquer outro local na medula espinal, estes valores têm de ser derivados a partir de qualquer atlas do cérebro do rato disponíveis. - Use a micromanipulator para deprimir lisolecitina na substância branca da medula espinhal ventral. Adicione uma rotação do micromanipulador a cada 5 segundos durante 2 minutos, resultando num volume final de 0,5 mL. Deixe o capilar no local por 2 min adicionais para evitar o refluxo da solução, e em seguida, retire cuidadosamente o capilar.
- Amarrar um único fio de sutura no tecido muscular / adiposo que se sobrepõe à coluna vertebral. Utilize uma sutura não interrompida para fechar a pele. Aplique mais iodo para o local da incisão.
- Colocar o animal em uma câmara de recuperação aquecida até que se recupere, em seguida, devolvê-lo à sua gaiola. Aplicar analgésicos pós-operatório conforme a legislação de cuidados de animais institucionais. Cuidados pós-operatórios adicionais normalmente não é necessário, pois os animais são totalmente ambulatorial e capaz de auto-alimentação e beber logo que a recuperação da anestesia.
- Repita o procedimento para os restantes animais.
NOTA: Com a proficiência, a operação pode ser concluída em 10-15 min por animal, em particular com a ajuda de uma segunda pessoa amarrando suturas. O mesmo capilar de vidro pode ser utilizado para cerca de 15-20 antes de cirurgias a ponta ficar romba e deve ser substituído. Cirurgias de controlo pode ser realizado de forma idêntica à descrita, com uma injecção de PBS na espinal-medula, em vez de lisolecitina. Nós não recomendamos a limpeza dos capilares para uso futuro.
4. Tissue Processamento e Análise
- Sacrificar os animais com uma overdose intraperitoneal de cetamina (500 mg / kg) e xilazina (25 mg / kg) em pontos de tempo desejados. As lesões normalmente evoluir no exerdevido maneira: 1-3 dias, desmielinização ativa; 3-7 dias, recrutamento OPC; 7-10 dias, a diferenciação oligodendrocyte; 10-21 dias, remielinização ativa 2,10,11.
- Para preparar o tecido para exame histológico, realizar primeiro uma perfusão transcardial com 12 20 ml de PBS temperatura ambiente seguido por 20 ml de gelo-frio paraformaldeído a 4% em PBS. Para a preparação de resina de tecido embebido para seccionamento semi- ou ultrafina, veja o passo 4.9.
- Remover a medula óssea utilizando uma tesoura para cortar através de curvas cada vértebras começando na extremidade cervical da coluna vertebral e trabalhando para baixo para o nível torácico inferior. Fixar as medulas espinais O / N em paraformaldeído a 4% em PBS a 4 ° C. Mudar os cabos a 30% de sacarose em PBS a 4 ° C durante pelo menos 72 horas.
- Identificar o local da injecção como uma anormalidade na superfície dorsal da medula espinhal. Cortar uma pe 3 mm de tecido (com o local da injecção no centro) e alinhar as peças em cryomolds contendo temperatura de corte óptima (OCT) compound. Suspender o lado de baixo dos cryomolds numa mistura gelada de 2-metilbutano e gelo seco até o OCT é completamente congelada. Armazenar a -80 ° C até estar pronto para seção.
- Secção medulas espinhais de um criostato com uma largura de 20 um em lâminas de microscópio e deixar secar ao ar S / N antes de armazenar as lâminas a -20 ° C.
- Detectar a localização da lesão e tamanho usando um eriocromo cyanine mancha histológica de mielina 13. Execute todas as etapas na RT. Lâminas de ar seco durante 30 minutos. Colocar as lâminas em agente para 1 min, seguido de re-hidratação em soluções de etanol graduadas (100%, 95%, 90%, 70%, 50%, água) para limpar 1 min cada.
- Colocar as lâminas em solução de cianina eriocromo durante 15 min, seguido por uma lavagem de 1 minuto com água. Diferenciar em hidróxido de amónio a 0,5% durante 10 segundos, seguido de uma lavagem de 1 minuto com água. Desidratar em soluções de etanol classificados (ordem inversa, como descrito acima) durante 1 min cada, lamela com meios de montagem, e imagem em um brilhante em campo microscope.
- Use imunohistoquímica para visualizar os axônios e mielina. Lâminas de ar seco durante 30 minutos. Desidratar com etanol graduado (água, 50%, 70%, 90%, 95%, 100%), durante 2 minutos cada à temperatura ambiente, em seguida a ordem inversa de volta à água. Este passo resulta numa maior resolução de anéis individuais de mielina 14.
- Bloquear interacções não específicas de anticorpos, utilizando 10% de soro de cabra e 0,25% de triton X-100 em PBS durante 60 min à temperatura ambiente. Dilui-se anticorpos primários (anticorpo de ratinho anti-SMI312 1: 2.000, de coelho anti-MBP 1: 1000) em PBS e incubar em lâminas de O / N a 4 ° C.
- Lavar 5 vezes durante 5 min com PBS à temperatura ambiente. Dilui-se os anticorpos secundários (Alexa 488 anti-coelho a 1: 500, Alexa 546 anti-rato a 1: 500) em PBS e incubar em lâminas durante 60 minutos à RT. Lavar 5 vezes durante 5 min com PBS à temperatura ambiente. Monte desliza com lamelas usando gelvatol e imagem num microscópio fluorescente.
- Use imunohistoquímica para visualizar as células da linhagem de oligodendrócitos. Siga o procedimento para step 4,7, omitindo o passo de desidratação / re-hidratação, e usando 10% de soro de cavalo, em vez de soro de cabra. Use as seguintes diluições de anticorpos primários: anticorpo de cabra anti-PDGFRα 1: 100, de ratinho anti-CC1 1: 200, de coelho anti-Olig2 1: 200. Use as seguintes diluições secundárias: Alexa 488 anti-cabra 1: 500, Alexa 594 anti-rato de 1: 500, Alexa 647 anti-coelho 1: 500.
- Para preparar o tecido para o corte semi- ou ultrafina, em primeiro lugar executar uma perfusão transcardial 12 com 20 ml RT PBS seguido de 20 ml gelada paraformaldeído 4% / 1% em PBS. Remover medula espinal, tal como descrito na etapa 4.3. Fix O / N em paraformaldeído a 4% / glutaraldeído a 1% em PBS a 4 ° C.
- Identificar o local da injecção tal como descrito no passo 4.4. Cortar um pedaço de 1 mm com tecido contendo o local de injecção. Blocos Adicionais 1 mm de cada lado da lesão pode ser preparado, bem como se desejar.
- Numa hotte, adicionar 10 vezes o volume de 1% de tetróxido de ósmio / 1,5% de ferrocianeto de potássio para cada bloco em gelodurante 60 min.
NOTA: tetróxido de ósmio é uma substância altamente tóxica e deve ser tratado com extremo cuidado. Todos os materiais em contacto com tetróxido de ósmio deve ser colocada em óleo de milho (duas vezes o volume de solução de tetróxido de ósmio) para neutralização. - Lavar os cabos 3 vezes com 0,2 M de cacodilato durante 10 min à TA, descartando em óleo de milho. Desidratar com soluções de etanol graduadas (água, 50%, 70%, 90%, 2 vezes com 95%, 2 vezes, com 100%, 2 vezes com óxido de propileno) durante 10 minutos à RT.
- Cabos de inserir em resina, conforme as instruções do fabricante.
- Cortar blocos em um ultramicrotome e montar secções em gotículas de água em lâminas de microscópio. Colocar as lâminas em uma placa quente (aproximadamente 50 ° C) até secarem.
- Visualize mielina, adicionando algumas gotas de 1% toluidina solução bórax / 2% para os slides para 10-15 seg a 50 ° C. Enxágüe com água, seca e lamela com media de montagem. Seções imagem em um microscópio de campo claro.
Resultados
Injecção focal de lisolecitina na matéria branca ventral produz uma lesão desmielinizante discreta que é detectável por uma distância de aproximadamente 3 mm (Figura 2). Coloração imuno-histoquímica do núcleo lesão de mielina (MBP) e axônios (SMI312) mostra axônios que foram despojados de mielina em 7 dias (Figura 3). Por 14 dias, muitos axônios são cercados por anéis de MBP-positivos, o que sugere a ocorrência de remielinização. A coloração para células da linhagem de oligodendrócitos (PDGFRα, Olig2, CC1), há um aumento significativo tanto no número total de células em 14 dias em comparação com 7 dias, assim como a distribuição de oligodendrócitos maduros em comparação com OPCs (Figura 4) . Consistente com essa descoberta, secções cortes semifinos corados com azul de toluidina revela a presença de bainhas de mielina fina aos 14 dias que raramente são detectados em 7 dias (Figura 5), indicando que estes são remielinizados internodes.
O procedimento é altamente reprodutível entre animais. A variação ocorre quando a respiração pesada altera a posição estacionária do capilar-isso geralmente não é um problema com sedação adequada. Danos aos axônios parece ser mínimo, exceto no centro da lesão, o que tem sido descrita desde o primeiro uso do modelo 1. Acreditamos que este seja o trauma mecânico do capilar de vidro, como também é observável em PBS injetado controles. No entanto, a variabilidade tende a ser pequeno, e nós e os outros usando um procedimento semelhante detectaram diferenças entre as condições experimentais com apenas 4 animais por grupo 15.
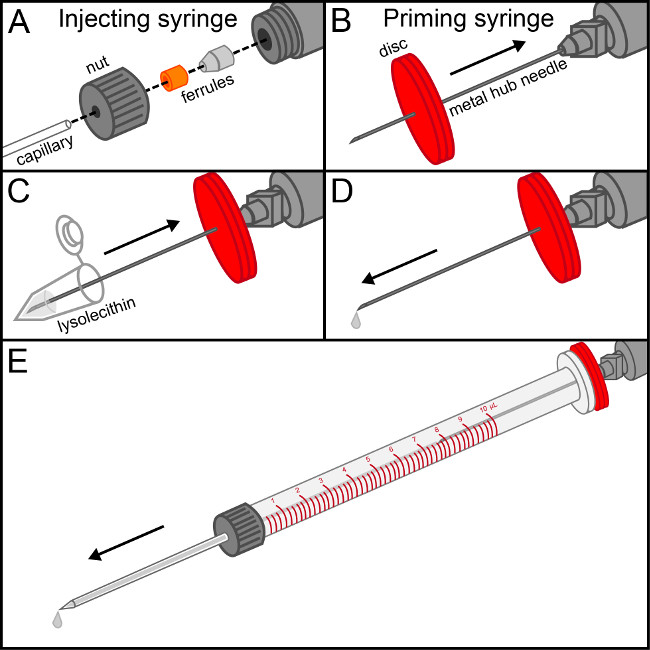
Figura 1. Montagem da seringa de injecção. (A) A porca da seringa de injecção é enroscada t ele extremidade plana do capilar de vidro, seguido por 2 a virolas de tal modo que o seu acasalamento termina encravamento. Uma vez que o capilar está firmemente confortável no ponteira cónica, o conjunto é parafusada mão apertada sobre a extremidade da seringa de injeção. (B) a peça central de um disco de borracha com a agulha hub de metal presa à seringa priming e deslize-o para baixo para a base. (C) Retirar lisolecitina solução para a seringa priming. (D) suavemente deprimir a seringa de preparação até que a primeira gota de lisolecitina é visível na ponta da agulha. (E) Inserir a seringa para dentro do tambor de escorvamento da injecção Seringa, fazendo um selo firme com o disco de borracha. Deprimir a solução suavemente até que ele fique com a extremidade do capilar. Retire cuidadosamente a seringa priming, mantendo a pressão sobre o êmbolo para remover a agulha de metal hub sem a introdução de bolhas de ar dentro da seringa de injeção.fazer upload / 52679 / "target =" _ 52679fig1large.jpg blank "> Clique aqui para ver uma versão maior desta figura.

Figura 2. representativas lisolecitina lesão coradas com eriocromo cianina. As secções em série (400 mm espaçados aparte) de uma lesão característica lisolecitina aos 14 dias coradas com eriocromo cianina para visualizar mielina (azul). Note-se que a desmielinização está restrita à substância branca ventral e que a lesão se estende por cerca de 3 mm no rostral / direcção caudal. Barra de escala = 1 mm. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. Os axônios e mielina emo modelo de lisolecitina. (A) A farsa (PBS) injetado medula espinhal aos 7 dias mostra axônios saudáveis que são cercados por anéis de mielina. (B) A lisolecitina lesão em 7 dias apresentam axônios desnudada, bem como mielina degradada. (C) Aos 14 dias, a proporção de axónios (exemplos assinalados com setas brancas) são associados com o reaparecimento de anéis de mielina. Barra de escala = 10 mm. Por favor, clique aqui para ver uma versão maior desta figura.
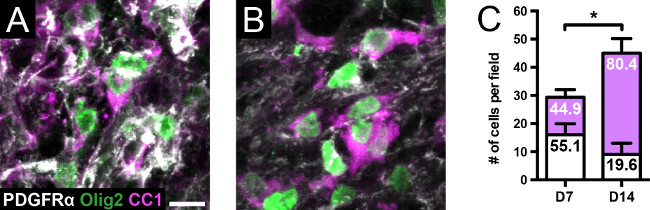
Figura 4. Células Oligodendrocyte linhagem no modelo lisolecitina. (A, C) Aos 7 dias, há uma maior representação de PDGFRα + OPCs (barras brancas), em relação a + oligodendrócitos CC1 (barras magenta); os números dentro das barras representam porcentagens. Olig2 foi sondado paraconfirmar a coloração de células da linhagem de oligodendrócitos. (B, C) Aos 14 dias, existe um aumento significativo no número total de células da linhagem de oligodendrócitos, em comparação com 7 dias (p <0,05, bicaudal, t-teste, n = 4 por grupo ). Há também um aumento significativo na distribuição de oligodendrócitos de OPCs em 14 dias, comparado com 7 dias (p <0,0001, teste exacto de Fisher). Escala da barra = 10 m. Cada campo é capturada em um aumento original de 60X. Os valores são média ± DP. * Significa p <0,05. Por favor, clique aqui para ver uma versão maior desta figura.
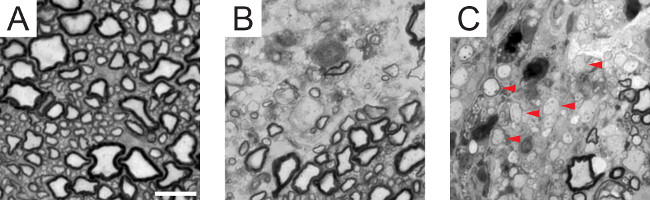
Figura 5. remielinização no modelo de lisolecitina. (A) A azul de toluidina transversal manchado cortes semifinos seção da substância branca ventral em um heaimunda rato mostra axónios longo de uma larga gama de calibre com a respectiva espessura de mielina. (B) No dia 7, uma falta de bainhas de mielina é observada adjacente a uma área afectada (inferior direito). (C) Aos 14 dias, as bainhas finamente mielinizadas ( exemplos assinalados com setas vermelhas) aparecem em toda a lesão, indicativo de segmentos remielinizados. Barra de escala = 10 mm. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Um número de modelos animais têm sido desenvolvidos para estudar MS, reconhecidamente mais o modelo experimental de encefalomielite autoimune (EAE). Em EAE, roedores são imunizados contra um fragmento de um péptido de mielina e submetidos a um desenvolvimento lesão inflamatória manifestando em paralisia ascendente. Embora este modelo tem sido útil para testes pré-clínicos de medicamentos imunomoduladores MS, não é ideal para estudar a remielinização por três razões principais: em primeiro lugar, a localização de lesões inflamatórias é um pouco aleatório, e localização de lesões durante o processamento de tecidos para semi- ou ultrafino seções pode ser um desafio. A segunda é que a remielinização ocorre ao longo de um período de tempo específico, e a idade exata de uma única lesão EAE não pode ser conhecido sem contínua não-invasivo ressonância magnética. O terceiro é que a remielinização é um fenómeno que ocorre naturalmente em roedores, e evidências de remielinização após o tratamento de droga na EAE pode não ser o resultado primário da droga, mas emStead um fenômeno secundário de reduzir a inflamação.
Outro método comum de produção de desmielinização é conseguido através da introdução do agente quelante de cobre cuprizona na dieta. Isso resulta em desmielinização generalizada, principalmente no corpo caloso. Há limitações no estudo do corpo caloso como um site de remielinização, pelas seguintes razões: em primeiro lugar, os diâmetros dos axônios (e, assim, a espessura da mielina) são menores do que outras regiões do SNC, e bainhas assim fina remielinizados podem ser indistinguíveis daqueles que nunca foram demyelinated. Em segundo lugar, porque o corpus callosum rato contém> 70% de axónios sem mielina 16, pode não ser claro se um segmento remielinizados é verdadeiro reparação de mielina danificada ou a síntese de novo da mielina no adulto, o qual ocorre normalmente 17.
É da nossa crença de que o melhor modelo para estudar a remielinização é a injeção direta de toxinas, ou lisolecitina, ethidbrometo de ium, ou outros, para os pedúnculos cerebrais caudais 18 ou a substância branca da medula espinhal. O ex-localização só é conseguida através de injeção estereotáxica de 3 dimensão precisa, e está limitada a maiores roedores (ratos), devido ao pequeno tamanho dos pedúnculos cerebelares. Isso exclui o recurso extensivo de camundongos transgênicos em estudar de- e remielinização. A medula espinhal, no entanto, contém muitos grandes tratos de substância branca, que são facilmente acessíveis cirurgicamente. Os espaços entre as vértebras no segmento torácico rostral permite a exposição da medula espinal, sem a necessidade de uma laminectomia, que é um passo necessário para procedimentos cirúrgicos torácicos caudais. Uma vantagem de visar especificamente a substância branca ventral é que os axónios são uniformemente maior do que a substância branca dorsal, fazendo quantificação de remielinização uma função análoga para os desafios associados com o corpo caloso menos ambíguo. Além disso, a substância branca ventral torna-se uma muito maior target zona para injectar; várias centenas de microns lateralmente na região dorsal colocaria o capilar fora da coluna, enquanto o mesmo desvio ventralmente ainda produziria uma lesão desmielinizante proeminente. Alguns protocolos de injectar lisolecitina em ambos dorsal e ventral de colunas do mesmo animal 19. Isto pode aumentar tanto a probabilidade de colocação capilar adequado e o número de lesões quantificáveis em menos animais. Embora os dados atuais apresentados é 8-10 semanas animais velhos no momento da operação, também tiveram sucesso usando o mesmo procedimento em camundongos velhos 8-10 meses, onde remielinização é descrito como sendo marcadamente mais lento 4.
Quantificação de remielinização não é uma tarefa trivial. Um dogma central postula que segmentos remielinizados são mais curtos e mais fino, em média, do que suas contrapartes saudáveis e, assim, cálculos g-Ratio (diâmetro do axônio dividido pelo axônio + diâmetro mielina) de transversal semi-oseções r ultrafinos tornaram-se procedimento padrão. No entanto, sabe-se que os segmentos remielinizados engrossar com o tempo de 2 e um estudo recente usando um repórter transgénico de oligodendrócitos remielinizante sugere que muitos entrenós eventualmente tornar-se indistinguíveis de controle 20. Quantificar o número de oligodendrócitos maduros dentro da lesão é uma forma indireta de medir reparação, como oligodendrócitos são capazes de fazer um grande número de entrenós, e uma proporção significativa de no modelo dependendo-remielinização usada-pode ocorrer a partir de células de Schwann 3. É claro que, como a remielinização tem sido associada a restauração de condução saltatory 21, a métrica de reparação final seria a recuperação funcional de défices neurológicos. Enquanto a remielinização tem sido relacionada com a recuperação da função em algumas espécies 22,23, não tornou-se um procedimento padrão em estudos murinos lisolecitina. Isto é provavelmente devido a uma falta de observ ostensivasdéficits capazes de lesões ou dorsal ou ventral, em comparação com modelos desmielinização mais robustas, como EAE e até mesmo cuprizona. Acreditamos que os déficits funcionais resultantes de lisolecitina injeção, e posterior recuperação com remielinização, só será observável por meio de testes sensíveis de funcionamento sensório-motor fino.
A pesquisa PubMed de "remielinização" ao lado de qualquer um dos modelos animais listados acima, ainda que uma abordagem metodológica brusque, mostra menos acertos de pesquisa para lisolecitina (109) em comparação com EAE (188) e cuprizona (197). Se o nosso argumento de que lisolecitina desmielinização é a abordagem superior para estudar a remielinização, por que é o menos discutido? Talvez uma apreensão para usar este método deriva da crença de dificuldade técnica na realização da intervenção cirúrgica. Na realidade, este procedimento é rápido, custo-benefício, e não é mais difícil do que a dissecação de tecidos de rotina, exigindo materiais que são todos commercialmente disponível. É nossa esperança que este protocolo se mostrou útil para aqueles que desejam adicionar este modelo poderoso para o seu repertório para estudar o campo emocionante e expansão de reparação da mielina.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This project was funded by a grant from the Multiple Sclerosis Society of Canada and the Alberta Innovates - Health Solutions CRIO Team program. MBK is a recipient of studentships from Alberta Innovates - Health Solutions and the Multiple Sclerosis Society of Canada. SKJ is funded by a graduate student support grant from the Alberta endMS Regional Research and Training Center of the Multiple Sclerosis Society of Canada. The authors wish to acknowledge Dr. Jan van Minnen and the Regeneration Unit in Neurobiology core facility for training and use of equipment.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| spring scissors | Fine Science Tools | 15004-08 | |
| forceps | Fine Science Tools | 11254-20 | |
| retractor | Fine Science Tools | 17003-03 | |
| clippers | Philips | QG3330 | |
| heating recovery chamber | Peco Services | V1200 | |
| surgical tape | 3M | 1527-1 | |
| scalpel handle | Fine Science Tools | 10003-12 | |
| scalpel blade | Feather | No. 15 | |
| sponge spear | Beaver Visitec | 581089 | |
| 5-0 Vicryl sutures | Ethicon | J511G | |
| curved ToughCut spring scissors | Fine Science Tools | 15123-12 | |
| 32 gauge metal needle | BD | 305106 | |
| needle holders | Fine Science Tools | 12002-14 | |
| angled forceps | Fine Science Tools | 11251-35 | |
| cotton tipped applicator | Puritan | 806-WC | |
| gauze pads | Safe Cross First Aid | 3763 | |
| 10 μL syringe | Hamilton | 7635-01 | make sure to purchase the microliter, not gastight syringe |
| compression fitting | Hamilton | 55750-01 | contains the 2 ferrules and removable nut, but the nut that comes with the 10 μL syringe is a tighter fit |
| priming kit | Hamilton | PRMKIT | contains the priming syringe, removable hub needle and the rubber discs |
| pre-pulled glass capillaries | WPI | TIP10TW1 (pack of 10) | contains capillaries with 10 μm inner diameter. 30 μm inner diameter also work (TIP30TW1) |
| stereotactic frame | David Kopf instruments | Model 900 | |
| Ultrasonic cleaner | Fisher Scientific | FS-20 | |
| Tissue-Tek optimal cutting temperature (OCT) compound | VWR | 25608-930 | |
| Tissue-Tek intermediate cryomold | VWR | 25608-924 | |
| cryostat | Leica | CM1900 | |
| microscope slides | VWR | 48311-703 | |
| bright field microscope | Olympus | BX51 | |
| ultramicrotome | Leica EM UC7 | EM UC7 | |
| Lysophosphatidylchoine | Sigma | L1381 | |
| 2-methylbutane | Sigma | M32631 | |
| Triton x-100 | Sigma | X-100 | |
| goat serum | Sigma | G9023 | |
| Mouse anti-SMI312 antibody | Covance | SMI-312R | 1:2000 dilution |
| Rabbit anti-MBP antibody | Abcam | AB40390 | 1:1000 dilution |
| Goat anti-PDGFRα antibody | R&D Systems | AF1062 | 1:100 dilution |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | 1:200 dilution |
| Mouse anti-CC1 antibody | Calbiochem | OP80 | 1:200 dilution |
| Alexa Fluor 488 goat anti-rabbit IgG | Life technologies | A-11008 | 1:500 dilution |
| Alexa Fluor 546 goat anti-mouse IgG | Life technologies | A-11003 | 1:500 dilution |
| Alexa Fluor 488 donkey anti-goat IgG | Jackson Immuno | 705-546-147 | 1:500 dilution |
| Alexa Fluor 594 donkey anti-mouse IgG | Jackson Immuno | 715-586-151 | 1:500 dilution |
| Alexa Fluor 647 donkey anti-rabbit IgG | Jackson Immuno | 711-606-152 | 1:500 dilution |
| PBS | Oxoid | BR0014 | |
| isopropyl alcohol | Sigma | 109827 | |
| ketamine | CDMV | ||
| xylazine | CDMV | ||
| iodine | West Penetone | 2021 | |
| Vaseline petroleum jelly | VWR | CA05971 | |
| paraformaldehyde | Sigma | P6148 | |
| sucrose | Sigma | S5016 | |
| Eriochrome Cyanine R | Sigma | 32752 | |
| sulfuric acid | Sigma | 320501 | |
| iron(III) chloride | Sigma | 157740 | |
| ammonium hydroxide | Sigma | 320145 | |
| Acrytol | Leica Biosystems | 3801700 | |
| Citrisolv | Fisher Scientific | 22-143-975 | |
| horse serum | Sigma | H0146 | |
| glutaraldehyde | Electron Micrscopy Sciences | 16220 | |
| osmum tetroxide | Electron Micrscopy Sciences | 19150 | highly toxic |
| potassium hexacyanoferrate (II) trihydrate | Sigma | P3289 | |
| corn oil | Sigma | C8267 | |
| polyvinyl alcohol | Sigma | P8136 | |
| glycerol | Sigma | G9012 | |
| cacodylic acid | Electron Micrscopy Sciences | 12300 | |
| propylene oxide | Electron Micrscopy Sciences | 20401 | |
| EMBED kit | Electron Micrscopy Sciences | 14120 | |
| Toluidine Blue O | Sigma | T3260 | |
| Sodium tetraborate decahydrate | Sigma | S9640 | |
| Recipes | |||
| Eriochrome cyanine solution | |||
| Ingredient | Amount to add | ||
| Eriochrome Cyanine R | 0.8 g | ||
| sulfuric acid | 400 mL 0.5% | ||
| iron(III)chloride | 20 mL 10% | ||
| water | 80 mL | ||
| *add eriochrome cyanine to sulfuric acid, followed by iron(III) chloride and water. Solution can be kept after use. Make fresh once per year. | |||
| Gelvatol | |||
| Ingredient | Amount to add | ||
| PBS | 140 mL | ||
| polyvinyl alcohol | 20 g | ||
| glycerol | 40 g | ||
| *mix well, place at 37 °C overnight, centrifuge at 1960xg 30 min, aliquot into 40 tubes |
Referências
- Blakemore, W. F., Eames, R. A., Smith, K. J., McDonald, W. I. Remyelination in the spinal cord of the cat following intraspinal injections of lysolecithin. J. Neurol. Sci. 33 (1-3), 31-43 (1977).
- Jeffery, N. D., Blakemore, W. F. Remyelination of mouse spinal cord axons demyelinated by local injection of lysolecithin. J. Neurocytol. 24 (10), 775-781 (1995).
- Blakemore, W. F. Invasion of Schwann-cells into the spinal-cord of rat following local injections of lysolecithin. Neuropathol. Appl. Neurobiol. 2 (1), 21-39 (1976).
- Shields, S. A., Gilson, J. M., Blakemore, W. F., Franklin, R. J. Remyelination occurs as extensively but more slowly in old rats compared to young rats following gliotoxin-induced CNS demyelination. Glia. 28 (1), 77-83 (1999).
- Patrikios, P., et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain. 129 (Pt 12), 3165-3172 (2006).
- Keough, M. B., Yong, V. W. Remyelination therapy for multiple sclerosis). Neurotherapeutics. 10 (1), 44-54 (2013).
- Hall, S. M. The effect of injections of lysophosphatidyl choline into white matter of the adult mouse spinal cord. J. Cell Sci. 10 (2), 535-546 (1972).
- Miron, V. E., et al. M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nat. Neurosci. 16 (9), 1211-1218 (2013).
- Kotter, M. R., Setzu, A., Sim, F. J., Van Rooijen, N., Franklin, R. J. Macrophage depletion impairs oligodendrocyte remyelination following lysolecithin-induced demyelination. Glia. 35 (3), 202-212 (2001).
- Lau, L. W., et al. Chondroitin sulfate proteoglycans in demyelinated lesions impair remyelination. Ann. Neurol. 72 (3), 419-432 (2012).
- Fancy, S. P., et al. Dysregulation of the Wnt pathway inhibits timely myelination and remyelination in the mammalian CNS. Genes Dev. 23 (13), 1571-1585 (2009).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J. Vis. Exp. (65), (2012).
- Skihar, V., et al. Promoting oligodendrogenesis and myelin repair using the multiple sclerosis medication glatiramer acetate. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17992-17997 (2009).
- Plemel, J. R., et al. Platelet-derived growth factor-responsive neural precursors give rise to myelinating oligodendrocytes after transplantation into the spinal cords of contused rats and dysmyelinated mice. Glia. 59 (12), 1891-1910 (2011).
- Chong, S. Y., et al. Neurite outgrowth inhibitor Nogo-A establishes spatial segregation and extent of oligodendrocyte myelination. Proc. Natl. Acad. Sci. U.S.A. 109 (4), 1299-1304 (2012).
- Sturrock, R. R. Myelination of the mouse corpus callosum. Neuropathol. Appl. Neurobiol. 6 (6), 415-420 (1980).
- Young, K. M., et al. Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron. 77 (5), 873-885 (2013).
- Woodruff, R. H., Franklin, R. J. Demyelination and remyelination of the caudal cerebellar peduncle of adult rats following stereotaxic injections of lysolecithin, ethidium bromide, and complement/anti-galactocerebroside: a comparative study. Glia. 25 (3), 216-228 (1999).
- Mei, F., et al. Micropillar assays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nat. Med. 20 (8), 954-960 (2014).
- Powers, B. E., et al. Remyelination reporter reveals prolonged refinement of spontaneously regenerated myelin. Proc. Natl. Acad. Sci. U.S.A. 110 (10), 4075-4080 (2013).
- Smith, K. J., Blakemore, W. F., McDonald, W. I. Central remyelination restores secure conduction. Nature. 280 (5721), 395-396 (1979).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120 (Pt 1), 27-37 (1997).
- Duncan, I. D., Brower, A., Kondo, Y., Curlee, J. F., Schultz, R. D. Extensive remyelination of the CNS leads to functional recovery. Proc. Natl. Acad. Sci. U.S.A. 106 (16), 6832-6836 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados