Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Photostrukturierungs Proteinen und Zellen in wässriger Umgebung Mit TiO
In diesem Artikel
Zusammenfassung
We describe a protocol for modifying cell affinity of a scaffold surface in aqueous environment. The method takes advantage of titanium dioxide photocatalysis to decompose organic film in the photo-irradiated region. We show that it can be used to create microdomains of scaffolding proteins, both ex situ and in situ.
Zusammenfassung
Organische Verunreinigungen auf der Oberfläche eines Titandioxid (TiO 2), adsorbiert durch Photokatalyse unter ultraviolettem Licht (UV) zerlegt werden. Hier beschreiben wir eine neuartige Protokoll unter Verwendung des TiO 2 Photokatalyse zur Zellaffinität der Substratoberfläche lokal zu verändern. Für dieses Experiment wurde eine dünne TiO 2 -Schicht wurde durch Sputtern beschichtet auf einem Deckglas, und die TiO 2 -Oberfläche wurde anschließend mit einem Organosilan Monoschicht aus Octadecyltrichlorsilan (OTS) ableitet, die die Zelladhäsion hemmt modifiziert. Die Probe wurde in einem Zellkulturmedium eingetaucht ist, und konzentrierte UV-Licht wurde auf einem achteckigen Bereich bestrahlt. Wenn eine neuronale Zelllinie PC12-Zellen wurden auf der Probe überzogen, Zellen, die nur auf die UV-bestrahlte Fläche haftet. Wir zeigen weiter, daß diese Oberflächenmodifikation kann auch in situ erfolgen, das heißt, auch wenn die Zellen auf dem Substrat wächst. Korrekte Modifikation der Oberfläche benötigt eine extrazelluläre Matrix protein Kollagen in dem Medium zum Zeitpunkt der UV-Bestrahlung vorliegen. Die hier vorgestellte Methode kann potenziell in Strukturierung mehrere Zelltypen für den Bau von Co-Kultur-Systeme oder willkürlich zu manipulieren Zellen unter Kultur eingesetzt werden.
Einleitung
Halbleiter-Lithographieverfahren und seine Derivate - wie Photolithographie 1,2, Elektronenstrahllithographie 3-6 und 7-10 Mikrokontaktdruck - sind mittlerweile ein etabliertes Werkzeug in der Zellbiologie, lebende Zellen in einer definierten Position und Geometrie wachsen. Die Musterungsverfahren beruht auf der Verwendung von mikro Substrate, bestehend aus Mikro-Insel Zelle permissive Beschichtung in einem nicht-permissiven Hintergrund. Ein solches Substrat dient als Vorlage, um Muster der Zellen. Diese Technologien haben uns zur Verfügung gestellt, die die neuen Methoden, um Zellen und ihre Funktion Ingenieur bei einem Ein- und Mehrzellebene, um die inhärenten Eigenschaften von Zellen zu extrahieren, und um den Durchsatz von zellbasierten Wirkstoff-Screening-11 zu erhöhen.
Der Grad Freiheits in Zellmusterungs würde erheblich zunehmen, wenn die Schablonenmustergeometrie in situ verändert werden, das heißt, während die Zellen auf den n kultivierturface. Die herkömmlichen Verfahren zur Musterbildung kann hier nicht direkt angewendet werden, da sie Verfahrensproben in der Atmosphäre oder im Vakuum. Deshalb werden verschiedene neue Oberflächenmodifikationstechniken sind vorgeschlagen worden, die basieren, zB auf photoreaktiven Verbindungen 12,13 oder Laserablation 5,14, um nur einige zu nennen. Die vorgeschlagenen Verfahren sind gut durch Robertus et al von Choi et al. 16 und Nakanishi 17 überprüft. 15, und in jüngerer Zeit.
Hier in diesem Artikel beschreiben wir eine neue Methode der in-situ-Oberflächenmodifizierung, die Vorteile der photokatalytischen Zersetzung von organischen Molekülen auf einem Titandioxid nimmt (TiO 2) Fläche 18,19. In diesem Verfahren wird ein TiO 2 -Film zwischen dem Glassubstrat und dem organischen Film, der die Zellen eine Schnittstelle eingeführt und der organische Film in situ durch lokales Bestrahlen mit ultravioletten (UV) zerlegtLicht in einem interessierenden Bereich (λ <388 nm). Wir zeigen, dass das neue Protokoll kann verwendet werden, um Mikrostrukturen der extrazellulären Matrixproteinen und lebenden Zellen sowohl ex situ und in situ zu erzeugen. TiO 2 ist biokompatibel, chemisch stabil und optisch transparente, Features, von denen macht es freundlich in Zellkulturexperimenten einzuführen. Dieses Protokoll stellt eine Materialwissenschaften basierte Alternative zur Modifizierung von Zellkultur-Gerüsten in Zellkulturumgebung.
Protokoll
1. Herstellung von TiO 2 beschichtetes Deckglas
- Anzahl die Deckgläser mit einem Diamantreißnadel. Dies trägt nicht nur zur Spur jedes Deckgläschen zu halten, sondern auch um sicherzustellen, dass die richtige Seite der Probe nach oben weist. Reinigen der Deck zunächst unter fließendem ddH 2 O, dann mit dem in Piranha-Lösung eingetaucht werden (H 2 SO 4: H 2 O 2 = 4: 1). Nach 10 Minuten, spülen Sie die Deckgläser gründlich, 8-mal in ddH 2 O. Trocknen Sie die Deckgläser unter N 2 fließen.
- Eingestellt TiO 2 -Target in der Radiofrequenz (RF) Sputtersystem. Bringen Sie die Deckgläser auf einem Probenhalter der Sputteranlage mit einem Polyimid-Band. Setzen Sie den Probenhalter in der Sputterkammer. Kammer evakuieren bis der Druck 2,0 × 10 -4 Pa.
- Einzuführen Ar-Gas in die Kammer und den Abscheidungsdruck auf 4,0 mTorr. Während der Verschluss geschlossen ist, schrittweise zu erhöhendie HF-Leistung bis 70 W.
- Öffnen des Verschlusses und Sputter für 15 min, um eine Folie mit einer Dicke von 120-150 nm (Abbildung 1: Schritt A) zu erhalten. Wachstumsrate des Films muss für jede einzelne Maschine abgeleitet werden.
2. Oberflächenbeschichtung mit Handy abweisenden Film
- Hydrophilisierung der TiO 2 -Oberfläche durch Behandeln der Probe mit O 2 -Plasma, nach Anweisungen des Herstellers des Plasmareaktors bereitgestellt. Wir behandeln die Probe für 5 Minuten bei 200 W mit O 2 Fluß von 100 sccm. Tauchen Sie die Probe in ddH 2 O und bestätigen, dass die Oberfläche superhydrophil ist. Trocknen Sie die Oberfläche gründlich unter N 2 -Strom.
- Vorbereitung 1 mM Octadecyltrichlorsilan (OTS) Lösung durch Zugabe von 39,6 ul OTS zu 100 ml Toluol gegeben. Eintauchen der Probe in die Lösung für 1 h bei RT. Führen Sie diesen Schritt innerhalb einer N 2 -gefüllten Handschuhbeutel (Abbildung 1: Schritt B).
- Um physisorbierte Moleküle zu entfernen, sonicate die Probe in Toluol, Aceton, Ethanol und ddH 2 O für 5 Minuten jeden, in dieser Reihenfolge. Spülen Sie die Proben vier Mal in frischem ddH 2 O und trocknen Sie die Oberfläche unter einem N 2 -Strom. Sollte die Oberfläche hydrophob mit einem Kontaktwinkel von 100-110 ° betragen.
3. Ex-situ-Oberflächenstrukturierung
- Arbeiten in einer Sterilbank, zu ziehen mehrere Kratzspuren mit einer Diamant-Reißnadel auf der Oberfläche. Die Markierungen helfen bei der Verfolgung der bearbeiteten Regionen und bringt auch Mikroskope in den Fokus. Sterilisieren der OTS-beschichteten TiO 2 durch Eintauchen der Probe in 70% Ethanol für 5 min. Dann zweimal spülen Sie die Probe in sterilisierte ddH 2 O
- Legen Sie die Probe in einem 35-mm-Schale, und 2 ml PC12 Wachstumsmedium (siehe Schritt 4.2). Inkubation für mehr als 3 Stunden in einem CO 2 -Inkubator (37 ° C). Diese Vorgehensweise soll Serumalbumine absorbiert auf der Oberfläche zu lassen. Adsorbiert Albumine hemmen anschließende Adsorption von anderen proteIns und Zellen (1: Schritt C).
- Während der Wartezeit, die Einrichtung des invertierten Fluoreszenzmikroskop.
- Schalten Sie die Bogenlampe, die UV-Filterwürfel einzufügen, und stellen Sie die Objektivlinse zu 20X.
- Messen der Lichtintensität I (W cm -2) unter Verwendung eines UV-Intensitätsmesser, und berechnen Bestrahlungszeit t (in Sekunden) für eine Dosis von d (in J cm -2) als: t = d / I.
Um zum Beispiel bei einer Dosis von 200 J cm -2 bestrahlt unter Verwendung einer Lichtquelle von 600 mW cm -2, beträgt 333 sec Bestrahlung erforderlich. - Verwenden Sie eine Objektmikrometer und schließen Sie die Feldblende zum Einstellen der Größe der Region zu bestrahlenden, beispielsweise 200 & mgr; m.
- Nach 3 Stunden Inkubation ergänzen das Medium mit 200 ul 3,0 mg ml-1-Typ-IV-Kollagen (Col-IV; Endkonzentration von 300 & mgr; g ml -1).
- Übertragen Sie die 35-mm-Schale auf den Mikroskoptisch. Finden Sie den Kratzer mLade Fokus des Mikroskops auf die Probenoberfläche und Bestrahlen mit UV-Licht bei einer Dosis von 200 J cm -2 (Abbildung 1: Schritt D). Der Bereich der UV-Bestrahlung kann entweder durch Einstellen der Öffnung der Leuchtfeldblende oder durch Ersetzen der Feldblende mit einer Metallmaske Schiedsgeometrie verändert werden.
- Ersetzen Sie das Medium mit frischem Wachstumsmedium (ohne Col-IV), und legen Sie die Probe wieder in den Inkubator.
4. Cell Culture
- Routinekultur von PC12-Zellen wird auf einem kollagenbeschichteten Plastikschale durchgeführt.
- Zur Beschichtung eines 60-mm-Gewebekulturschale mit Col-IV, zuerst die Oberfläche nass mit ddH 2 O und saugen alle ddH 2 O.
- Bereiten 300 & mgr; g ml -1 Col-IV durch Verdünnen der ursprünglichen Lösung (3 mg ml -1) 10x mit ddH 2 O.
- Fügen Sie 200 ul von 300 & mgr; g ml -1 Col-IV pro 60-mm-Schale. Lassen Sie die durch die Oberfläche verteilt Lösung.
- Dry-Ter in einer Laminarströmungshaube Teller für ca. 1 Std.
- Die Oberfläche zweimal gründlich mit 4 ml Dulbecco-phosphatgepufferter Kochsalzlösung (D-PBS). Bei Nichtgebrauch des beschichtete Schale sofort, spülen Sie die Teller einmal mit 4 ml ddH 2 O. Nach Absaugen ddH 2 O, speichern Sie die Schüssel in den Inkubator. Versuchen Sie nicht, halten Sie es für mehr als zwei Wochen gelagert.
- PC12-Zellen werden in einem Wachstumsmedium, das besteht aus gewachsen: Dulbeccos modifiziertes Eagle-Medium (low glucose) + 10% fötales Rinderserum + 5% Pferdeserum + 1% Penicillin-Streptomycin-Lösung. Inkubieren Sie die Zellen in einem CO 2 Inkubator (37 ° C, 5% CO 2), und ersetzen Sie jeden zweiten Tag die Hälfte des Mediums. Passage-Zellen, bevor sie zu erreichen Fluss.
- Saugen Sie das Wachstumsmedium, und fügen Sie 2 ml PBS + (D-PBS + 10 mg ml -1 Rinderserumalbumin (BSA) + 10 mM EDTA) vorgewärmt auf 37 ° C. Inkubation für 5 min bei 37 ° C. Klopfen Sie leicht das Gericht auf alle Produkte zu lösenlls.
- Sammeln Zellen in einem 15 ml konischen Röhrchen. Spülen Sie die Schale mit 3 ml frischem D-PBS, auf 37 ° C vorgewärmt.
- Zentrifugieren Sie die Röhrchen bei 150 · g für 4 min.
- Den Überstand aspirieren, und fügen Sie 1 ml des Wachstumsmediums.
- Für Routinekultur, teilen Sie die Zellen 1: 3 bis 1: 5.
- Um Zellen Platte auf dem UV-modifizierte OTS / TiO 2 Probe zu zählen Zelldichte und fügen Sie 3,0 x 10 5 Zellen in einer 35-mm-Schale (Abbildung 1: Schritt E). Inkubiere die Schale in den befeuchteten Inkubator (37 ° C, 5% CO 2) für 1-2 Tage. Naiven und der Nervenwachstumsfaktor (NGF) -differentiated PC12-Zellen können für die Strukturierung Experimente eingesetzt werden. NGF Differenzierung werden 100 ng ml -1 von 7S-NGF in das Wachstumsmedium mehrere Tage vor Ausplattieren der Zellen auf die Probe gegeben. NGF-Differenzierung scheint die Haftfähigkeit der PC12-Zellen zu erhöhen und erleichtert die Handhabung, insbesondere bei der in-situ Strukturierungs eXperimente.
5. In-Situ Oberflächenstrukturierung
- Nach 1-2 Tagen Kultur auf die ex-situ modifizierten Oberfläche, zu bestätigen, dass die Zellen für die Befestigung und wächst nur auf dem UV-Bestrahlungsbereich. Richten Sie das Mikroskop, wie in Schritt 3.4 beschrieben.
- Übertragung der Probe auf eine neue 35-mm-Gewebekulturschale, die das Wachstumsmedium, 100 ng ml -1 NGF (in dem Fall der Verwendung NGF-differenzierten Zellen) und 100 & mgr; g ml -1 Col-IV.
- Die Schale auf dem Mikroskoptisch. Finden Sie die passende Position, und strahlen UV-Licht bei einer Dosis von 200 J cm -2 (Abbildung 1: Schritt F, G). Die neu erstellte permissive Bereich ist mit einem Sternchen in Figur 1 angegeben: Schritt G.
- Versuchen, die Verarbeitung einer einzelnen Probe innerhalb von 30 Minuten zu vervollständigen. Nach der Bestrahlung, übertragen Sie die Probe wieder in das Medium ohne Col-IV.
- Seien Sie besonders vorsichtig bei der Durchführung die Schale mit cultured Zellen und Überführung der Probe vom Gericht, austeilen Ablösen der strukturierten Zellen zu verhindern.
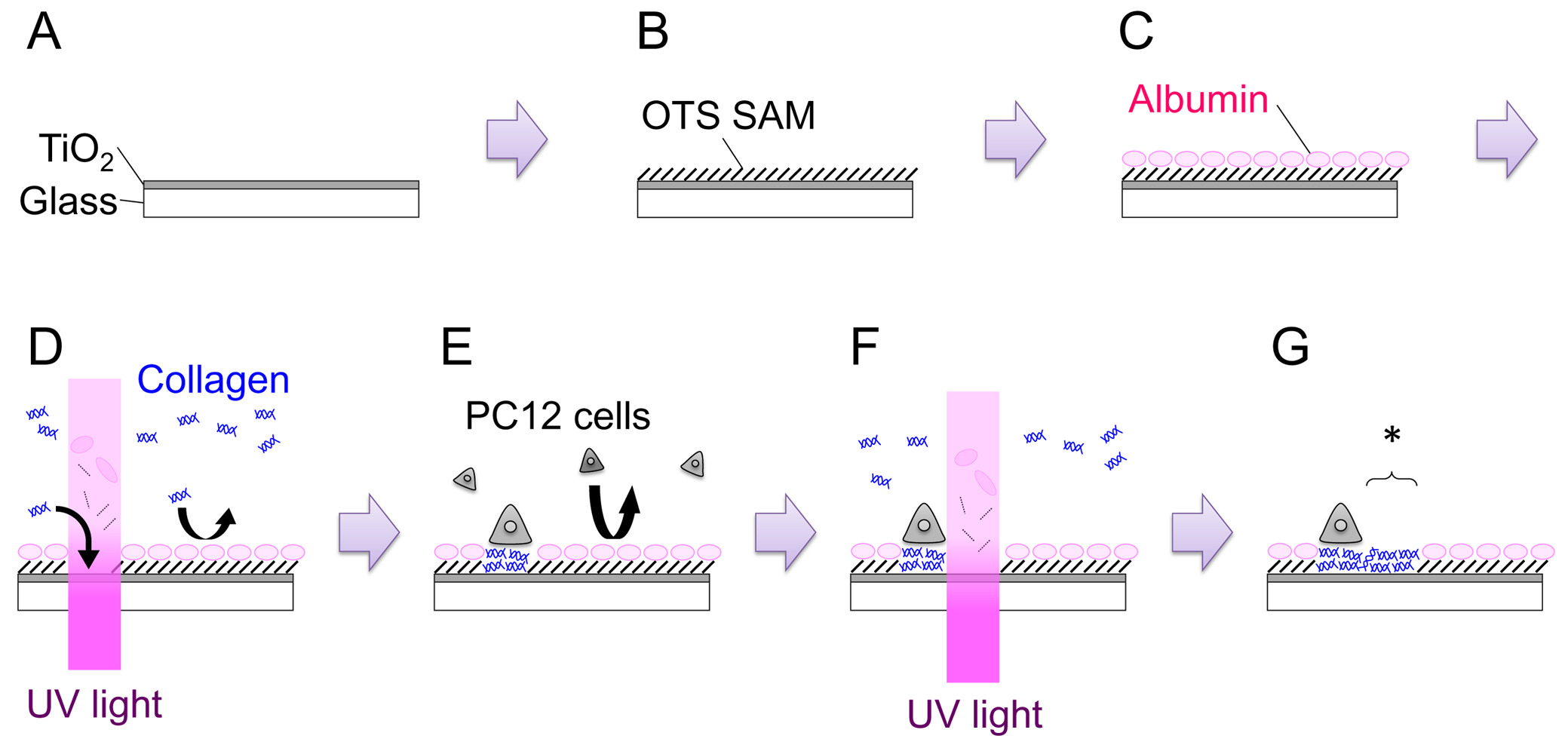
Abbildung 1. Schematische Darstellung des gesamten Prozesses. Siehe Text für Details. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Ergebnisse
2A zeigt eine Querschnittsrasterelektronenmikroskopie (SEM) -Bild der durch Sputtern abgelagerten TiO 2 -Films. Aus der Beobachtung wurde Dicke des Films auf ungefähr 150 nm zu sein. Hier fällt auf, die Flachheit des abgeschiedenen TiO 2 -Films. Weiteren Analyse durch Rasterkraftmikroskopie (AFM) ergab, dass die Wurzel aus dem mittleren quadratischen (RMS) Rauheit der Oberfläche betrug 0,2 nm (2B).
Wenn der TiO 2 -Oberflä...
Diskussion
In unserem aktuellen Protokoll wurde TiO 2 Film von RF-Magnetron-Sputtern gebildet. Wir bevorzugen diese Methode der Abscheidung, da es uns erlaubt, reproduzierbare Herstellung einer photokatalytischen TiO 2 -Schicht mit einer sub-nm Rauheit. Obwohl Sputter-Abscheidungsverfahren vertraut Materialwissenschaftler und Elektronik-Ingenieure sind, kann es nicht ganz zugänglich Biologen sein. In diesem Fall würde spinnbeschichteten TiO 2 -Films 23 eine Alternative sein. Bei diesem...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Authors thank Mr. Kotaro Okubo for the kind assistance with SEM imaging. This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Basic Research (B) (20310069), Grant-in-Aid for Research Activity Start-up (25880021), and by research grants from the Kurata Memorial Hitachi Science and Technology Foundation and the Nippon Sheet Glass Foundation for Materials Science and Engineering.
Materialien
| Name | Company | Catalog Number | Comments |
| Glass coverslip | Warner Instruments | CS-15R15 | 15 mm diameter, #1.5 thickness |
| Diamond scriber | Ogura Jewel Industry | D-Point Pen | |
| RF sputtering system | ANELVA | SPC350 | |
| TiO2 sputtering target | Kojundo Chemical Lab | Titanium (IV) oxide, target | Purity, 99.9% |
| Plasma reactor | Yamato | PR301 | |
| n-octadecyltrichlorosilane (OTS) | Aldrich | 104817 | |
| Toluene | Wako | 204-01866 | |
| Tissue-culture dish (35 mm) | Greiner | 627160 | |
| Tissue-culture dish (60 mm) | BD Falcon | 353002 | |
| Type-IV collagen | Nitta Gelatin | Cellmatrix Type IV | |
| D-PBS | Gibco | 14190-144 | |
| Dulbecco's modified Eagle's medium (DMEM) | Gibco | 11885-084 | |
| Fetal bovine serum | Gibco | 12483-020 | Heat-inactivate and pass through a 0.22 μm filter before use |
| Horse serum | Gibco | 26050-088 | Pass through a 0.22 μm filter before use |
| Penicillin-streptomycin (100x) | Nacalai tesque | 26253-84 | |
| 7S nerve growth factor (NGF) | Alomone Labs | N-130 | |
| Bovine serum albumin (BSA) | Sigma | A2153 | |
| EDTA | Dojindo | N001 | Stock solution in 0.5 M |
| TiO2 nanoparticle | Tayca | TKD-701 |
Referenzen
- Hughes, M. A., Brennan, P. M., Bunting, A. S., Shipston, M. J., Murray, A. F. Cell Patterning on Photolithographically Defined Parylene-C: SiO2 Substrates. J. Vis. Exp. (85), e50929 (2014).
- Kleinfeld, D., Kahler, K. H., Hockberger, P. E. Controlled Outgrowth of Dissociated Neurons on Patterned Substrates. J. Neurosci. 8, 4098-4120 (1988).
- Pensen, D., Heinz, W. F., Werbin, J. L., Hoh, J. H., Haviland, D. B. Electron Beam Patterning of Fibronectin Nanodots that Support Focal Adhesion Formation. Soft Matter. 3, 1280-1284 (2007).
- Tanii, T., et al. Application of Organosilane Monolayer Template to Quantitative Evaluation of Cancer Cell Adhesive Ability. Jpn. J. Appl. Phys. 50, 06GL01 (2011).
- Yamamoto, H., et al. In-Situ Guidance of Individual Neuronal Processes by Wet Femtosecond Laser Processing of Self-Assembled Monolayers. Appl. Phys. Lett. 99, 163701-1610 (2011).
- Yamamoto, H., et al. Differential Neurite Outgrowth is Required for Axon Specification by Cultured Hippocampal Neurons. J. Neurochem. 123, 904-910 (2012).
- Shen, K., Qi, J., Kam, L. C. Microcontact Printing of Proteins for Cell Biology. J. Vis. Exp. (22), e1065 (2008).
- Johnson, D. M., LaFranzo, N. A., Maurer, J. A. Creating Two-Dimensional Patterned Substrates for Protein and Cell Confinement. J. Vis. Exp. (55), e3164 (2011).
- Singhvi, R., et al. Engineering Cell Shape and Function. Science. 264, 696-698 (1126).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric Control of Cell Life and Death. Science. 276, 1425-1428 (1997).
- Degot, S., et al. Improved Visualization and Quantitative Analysis of Drug Effects using Micropatterned Cells. J. Vis. Exp. (46), e2514 (2010).
- Nakanishi, J., et al. Photoactivation of a Substrate for Cell Adhesion under Standard Fluorescence Microscopes. J. Am. Chem. Soc. 126, 16314-16315 (2004).
- Kim, M., et al. Addressable Micropatterning of Multiple Proteins and Cells by Microscope Projection Photolithography Based on a Protein Friendly Photoresist. Langmuir. 26, 12112-12118 (2010).
- Deka, G., Okano, K., Kao, F. -. J. Dynamic Photopatterning of Cells In Situ by Q-Switched Neodymium-Doped Yttrium Ortho-Vanadate. Laser. J. Biomed. Opt. 19, 011012 (2014).
- Robertus, J., Browne, W. R., Feringa, B. L. Dynamic Control over Cell Adhesive Properties using Molecular-Based Surface Engineering Strategies. Chem. Soc. Rev. 39, 354-378 (2010).
- Choi, I., Yeo, W. -. S. Self-Assembled Monolayers with Dynamicity Stemming from (Bio)chemical Conversions: From Construction to Application. ChemPhysChem. 14, 55-69 (2013).
- Nakanishi, J. Switchable Substrates for Analyzing and Engineering Cellular Functions. Chem. Asian J. 9, 406-417 (2014).
- Yamamoto, H., et al. In Situ Modification of Cell-Culture Scaffolds by Photocatalytic Decomposition of Organosilane Monolayers. Biofabrication. 6, 035021 (2014).
- Sekine, K., Yamamoto, H., Kono, S., Ikeda, T., Kuroda, A., Tanii, T. Surface Modification of Cell Scaffold in Aqueous Solution using TiO2 Photocatalysis and Linker Protein L2 for Patterning Primary Neurons. e-J. Surf. Sci. Nanotech. 13, 213-218 (2015).
- Arima, Y., Iwata, H. Effects of Surface Functional Groups on Protein Adsorption and Subsequent Cell Adhesion using Self-Assembled Monolayers. J. Mater. Chem. 17, 4079-4087 (2007).
- Fujishima, A., Zhang, X., Tryk, D. A. TiO2 Photocatalysis and Related Surface Phenomena. Surf. Sci. Rep. 63, 515-582 (2008).
- Sigal, G. B., Mrksich, M., Whitesides, G. M. Effect of Surface Wettability on the Adsorption of Proteins and Detergents. J. Am. Chem. Soc. 120, 3464-3473 (1998).
- Zhang, X., et al. A Transparent and Photo-Patternable Superhydrophobic Film. Chem. Commun. 2007, 4949-4951 (1039).
- Kaech, S., Banker, G. Culturing Hippocampal Neurons. Nat. Protoc. 1, 2406-2415 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten