Method Article
Multifunktionale, Mikropipette-basierte Methode für den Einbau und Stimulation der bakteriellen mechanosensitiven Ionenkanäle in Droplet Schnittstelle Bilayers
In diesem Artikel
Zusammenfassung
Bakterielle mechanosensitive Kanäle können als mechanoelektrische Wandler in biomolekularen Geräten verwendet werden. Tropfenschnittstelle Doppelschichten (DIBs), Zell-inspirierten Bausteine für solche Geräte, stellen neue Plattformen zu integrieren und zu stimulieren mechanosensitive Kanäle. Hier zeigen wir, einen neuen Mikropipette Verfahren zur Bildung DIB, die die Untersuchung mechanosensitiver Kanäle unter mechanischer Stimulation.
Zusammenfassung
MscL, eine große Leitfähigkeit mechanosensitive Kanal (MSC), ist ein allgegenwärtiges Osmolyt Ablassventil, die Bakterien überleben abrupten hypo-osmotischen Schocks hilft. Es wurde entdeckt, und mit Hilfe der Patch-Clamp-Technik fast drei Jahrzehnte rigoros sucht. Seine grundlegende Rolle übersetzen Spannung auf der Zellmembran in Antwort Permeabilität aufgebracht ist es ein starker Kandidat als mechanoelektrischen Wandlers in künstliche Membran-basierte Biomoleküle wirken. Serving als Bausteine zu solchen Geräten können Tropfenschnittstelle Doppelschichten (DIBs) als neue Plattform für die Einbeziehung und Stimulierung der MscL Kanäle verwendet werden. Hier beschreiben wir eine Mikropipette-basierte Methode, um DIBs bilden und messen die Aktivität der einge MscL Kanäle. Dieses Verfahren besteht aus Lipid-umhüllten wässrigen Tröpfchen auf die Spitzen der zwei gegenüberliegende (koaxial positioniert) Borsilikatglas-Mikro verankert. Als Tropfen in Kontakt gebracht werden, ist ein Lipid-Doppelschicht-Schnittstellegebildet. Diese Technik bietet Kontrolle über die chemische Zusammensetzung und die Größe der einzelnen Tröpfchen sowie die Abmessungen der Doppelschicht-Schnittstelle. Mit einer der Mikropipetten, um eine harmonische piezoelektrischen Aktuator befestigt bietet die Möglichkeit, eine gewünschte oszillierende Impulse zu liefern. Durch Analyse der Formen der Tröpfchen während der Deformation kann die Spannung an der Grenzfläche erzeugt geschätzt werden. Unter Verwendung dieser Technik wird die erste Aktivität MscL Kanäle in einem DIB-System gemeldet. Neben MS-Kanälen können Aktivitäten anderer Arten von Kanälen mit dieser Methode untersucht werden, was beweist, die Multifunktionalität dieser Plattform. Das hier vorgestellte Verfahren ermöglicht die Messung der Grundmembraneigenschaften, eine bessere Kontrolle über die Bildung von symmetrischen und asymmetrischen Membranen, und ist eine Alternative zu stimulieren und zu studieren mechanosensitive Kanälen.
Einleitung
In den letzten zehn Jahren, wobei die Anordnung der künstlichen Lipid-Doppelschichten wurde wesentlich durch die Entwicklung der Tröpfchengrenzfläche Bilayer Verfahren vorgerückt. Bekannt als stabil und robust, verhängt DIBs sich als alternative Modellsysteme zur klassischen gemalt (Mueller) und gefaltet (Montal-Müller) planare Doppelschichten 1. Obwohl die Idee der Verwendung von Tröpfchen auf Lipiddoppelschichten zu erstellen geht zurück auf die 1960er Jahre 2, es war nicht bis vor kurzem Popularität gewonnen. Der erste erfolgreiche Versuch wurde von der Takeushi Gruppe 3, gefolgt von mehreren Studien, die Doppelschichtbildung unter Verwendung eines Netzwerks von Tröpfchen durch die Bayley Gruppe 4-6 berichtet. In jüngerer Zeit wurden Verkapselungstechniken vom Leo-Gruppe 7-9, der das Konzept der Verwendung von DIBs als Bausteine neuartige Stimuli reagierende Materialsysteme 10 Pionierarbeit vorgeschlagen. In früheren Studien wurden DIB ihre Fähigkeit, an elektrische 9,11, chem reagieren erwiesenschen 10,12 und optische Reize 13. Verschiedene Biomolekülen mit unterschiedlichen Funktionalitäten stimuliresponsive wurden effektiv stimuliert, wenn in der DIB 10,14 rekonstituiert. Angesichts dieser erfolgreichen Versuche eine wichtige Frage aufgeworfen: könnte die DIB reagieren auf mechanische Reiz, wenn geeignete Biomoleküle eingebaut? Die auf einem DIB wirkenden Grenzflächenkräfte unterscheiden sich von denen in anderen Zweischichtsystem 15,16. Daher konnte die Spannung in der Doppelschicht von den Tröpfchen gehalten durch Regulieren Spannung an den Wasser-Lipid-Öl-Schnittstellen gesteuert werden; ein Konzept, nicht mit den lackierten oder gefaltete Doppelschicht-Systeme anwendbar.
MscL Kanälen, die weithin als Osmolyt Freigabeventile und Grundelemente der bakteriellen Cytoplasmamembran bekannt ist, reagieren auf erhöhte Membranspannung 17,18. Im Falle einer hypoosmotischen Schocks, mehrere Kanäle, die in der Membran einer kleinen Zelle 19 kann eine mas erzeugensive Durchlässigkeit als Reaktion auf schnell los Ionen und kleinen Molekülen, spart Bakterien aus der Lyse 20. Biophysikalisch wird MscL gut untersucht und vor allem durch die herausragende Patch-Clamp-Technik 21-23 gekennzeichnet. Zuverlässige Strukturmodelle erklären Gating-Mechanismus 24,25 MscL ist vorgeschlagen auf die seines Homologen Kristallstruktur 26,27, Modellierung 28, und die Ergebnisse der umfangreiche Experimente 24,29-31 basiert. Unter einer angelegten Spannung von ~ 10 mN / m, der geschlossene Kanal, der von einem engen Bündel von Transmembran-Helices besteht, verwandelt sich in einen Ring der stark geneigten Helices Bildung einer ~ 28 einen mit Wasser gefüllten leitenden Poren 21,24,32. Es wurde auch festgestellt, daß die Hydrophobie des hermetischen Durchlaß, an der Kreuzung der inneren TM1 Domänen angeordnet ist, bestimmt die Aktivierungsschwelle des Kanals 33. Entsprechend wurde festgestellt, dass durch Verringerung der Hydrophobizität des Gate, die tension Schwellen konnte abgesenkt 22 werden. Diese Eigenschaft der MscL möglich das Design der verschiedenen steuerbaren Ventile 34 hergestellt, in erster Linie für Drug-Delivery-Zwecke. Für alle oben genannten Eigenschaften und auf der Grundlage ihrer grundlegenden Rolle der Übersetzung Zellmembran übermäßigen Spannungen in elektrophysiologischen Aktivitäten, macht MscL eine großartige Passform als mechanoelektrische Wandler in DIBs.
In diesem Artikel präsentieren wir eine ursprüngliche Mikropipette-basierte Methode, um DIBs bilden und messen die Aktivität der einge MscL Kanäle unter mechanischer Stimulation. Wir berichten zum ersten Mal, die Reaktion der DIBs zu mechanischen Reiz und der funktionellen Wiederherstellung des V23T niedrigschwelligen Mutante MscL in DIBs 35.
Die Versuchsanlage besteht aus Lipid-umhüllten wässrigen Tröpfchen auf die Spitzen der zwei gegenüberliegende Glasmikropipetten verankert Borosilikatglas. Wenn Tröpfchen in Kontakt gebracht einer Lipiddoppelschicht-Schnittstelle ist foRMED. Diese Technik bietet Kontrolle über die chemische Zusammensetzung und die Grße jedes Tröpfchens (bulk) sowie die Abmessungen der Doppelschicht-Schnittstelle. Zusätzlich könnte asymmetrische Membranen mit verschiedenen Lipidzusammensetzungen in jeder Broschüre leicht gebildet werden. Mit einer der Mikropipetten, um eine harmonische piezoelektrischen Aktuator angeschlossen ist, bietet die Möglichkeit, eine vorprogrammierte Einzelzyklus oder Schwing Reiz anzuwenden. Spannung wird auf den künstlichen Membran, durch die Kompression der beiden Tröpfchen stütz geliefert. Als Ergebnis der Tröpfchenverformung, die Bereiche Wasser-Lipid-Öl-Schnittstellen erhöhen, und gleichzeitig wird der Winkel zwischen den Tröpfchen verringert, was zu einer Erhöhung der Membranspannung und transiente MscL Aktivierung. Durch Analyse der Formen der Tröpfchen während der Verformung könnte die Spannung an der Grenzfläche erzeugt geschätzt werden. Auch wenn der Schwerpunkt in diesem Artikel ist auf den mechanisch-Übertragungseigenschaften des DIB wir auch betonen, dass andere Arten von Bio-Moleküle, wie Alamethicin, kann durch dieses multifunktionale Plattform aktiviert werden. Wir stellen hier alle technischen Aspekte der Herstellung, der Montage und Durchführung von Messungen mit diesem neuen Verfahren in einem Schritt-für-Schritt-Weise.
Protokoll
1. Herstellung von PEG-DMA Hydrogele
- Wählen Sie eine geeignete Mess- / Mischbehälter (Kolben, Becherglas usw.) Für die Anwendung. Reinigen Sie es gründlich mit Reinigungsmittel und Wasser, und wischen Sie sie mit einem fusselfreien Tuch Wischer.
- Handschuhe tragen, um zu vermeiden Kontamination der Glaswaren mit Ölen aus Fingerspitzen. Spülen Sie den Behälter mit ausreichend deionisiertem Wasser, um Reinigungsmittelrückstände zu entfernen.
- Wischen Sie den Behälter mit einem fusselfreien Tuch loszuwerden, das Wasser zu bekommen, dann Spray mit Isopropylalkohol (IPA, 99,5%), und wischen Sie, bis sauber. Legen Sie sie in einer Vakuumkammer, damit alle IPA vollständig verdampfen. Reinigen Sie den Rest der Laborgeräte in dem Hydrogel bildenden Prozesses mit destilliertem Wasser verwendet.
- Zur Herstellung einer 40% (w / v) PEG-DMA Hydrogellösung wiegen 4 g des Poly (ethylenglycol) dimethacrylat (PEG-DMA; MW = 1000 g / mol) Polymer unter Verwendung eines Labormaßstab.
- Legen Sie die gewogen PEG-DMA in Kolben und Wärme mit einem Ultraschallbad bei 45-55 ° C bis der Feststoff PEG-DMA hat verflüssigt. Während des Prozesses, decken Sie die Öffnung der Flasche mit Parafilm / Wachspapier, um Wasser heraus zu halten.
- Sobald die PEG-DMA hat verflüssigt, fügen Sie Pufferlösung (500 mM KCl, 10 mM MOPS, pH 7,0) bis zum Gesamtvolumen erreicht ~ 10 ml (ausreichend für mehrere Experimente über einen Zeitraum von sechs Monaten).
- Hinzufügen des Härtungsmittels zu 0,5% (w / v). In diesem Fall fügen 0,05 g des Härtungsmittels zu der 10 ml-Mischung. Der Kolben wird wieder in die Ultraschallbad und lassen Sie es lösen sich in Lösung (ca. 10 min, 250 Watt).
Hinweis: Wenn das Härtungsmittel wurde zu der Lösung hinzugefügt worden ist, werden die Hydrogele zu härten (zu verfestigen), wenn zu jeder Lichtquelle für eine ausreichende Zeit ausgesetzt wird. Als Beitrag zur Bekämpfung dieser, wickeln Sie das Fläschchen / Behälter mit schwarzem Klebeband und bewahren Sie sie an einem dunklen Ort. Diese Lösung kann für einige Wochen bei Raumtemperatur (22 ° C) gelagert werden.
2. Herstellung von Liposomes
- Herstellung von 10 ml einer 2 mg / ml Lipidlösung durch Zugabe von 10 ml Puffer (500 mM KCl, 10 mM MOPS, pH 7,0) zu 20 mg 1,2-diphytanoyl- sn-glycero-3-phosphocholin (DPhPC) synthetische Lipiden als gefriergetrocknetes Pulver erhältlich. Achten Sie darauf, sowohl Lipidvesikeln und Pufferlösung gründlich gemischt werden (sollte die Mischung homogen und trübe aussehen, wenn alles gelöst ist).
- Kühlschrank (-20 ° C) und der neuen Lipidgemisch für insgesamt sechs Mal komplett aufzutauen. Ließ das Gemisch bei Raumtemperatur auftauen, noch nie in einer erhitzten Umgebung.
- Mit einem handelsüblichen Extruder zu extrudieren, die Lipide, indem zuerst durch einen 0,4 & mgr; m Polycarbonat-Membranfilter und dann durch ein 0,1 um Membranfilter zwingt die gesamte Lipidsuspension sechsmal. Dieses Verfahren ergibt Teilchen mit Durchmessern in der Nähe von 100 nm (die gleich der Porengröße des Filters).
Hinweis: andere Lipide und Lipid-Verhältnisse können über diesen mich vorbereitet werdenthode. Liposomen bei 4 ° C für mehrere Wochen gelagert werden.
3. MscL Isolierung und Rekonstitution
- Streak aus einer Temperatur Agaroseplatte, das 100 ug / ml Ampicillin, E. coli MJF465 Zellen mit einem Plasmid, das das pB10b V23T MscL Gen mit einem 6-His-Tag am 3'-Ende (C-Terminus) erweitert. Damit die Platte Kultur über Nacht (12-16 h) bei 37 ° C in einer stationären Inkubator. Das Plasmid wird für ausgewählte und in Zellen mit 100 ug / ml Ampicillin in Standard-LB-Medium gehalten. Am nächsten Tag statt 20 ml LB-Medium mit 100 ug / ml Ampicillin in einer Kultivierung Vesikel (ein 50-ml-Kolben oder, was verfügbar ist, um die Kultur zu halten). Nehmen Sie die Platte, die über Nacht kultiviert wurde, und wählen Sie eine Kolonie von der Platte, um mit einer sterilen Inokulation Stick zu übertragen (zu impfen) auf die vorbereitete 20 ml LB-Medium. Damit das 20 ml Kultur über Nacht (12-16 h) in einem Schüttelinkubator wachsen bei 37 ° C bei 250 Umdrehungen pro Minute.
- Dekantiert man die 20 ml overnight Kultur in 2-4 L LB-Medium. Ampicillin ist nicht mehr erforderlich. Schütteln die Flaschen in einem Schüttelinkubator bei 250 UpM bei 37 ° C, bis die OD 600 0,5 erreicht. Hinzufügen Isopropyl β-D-1-thiogalactopyranosid (IPTG) bis zu einer Endkonzentration von 0,6 mM und ließ die Kultur für eine weitere Stunde (OD 600 = 0,8-1,0) zu gehen.
- Setzen Sie die Flaschen auf Eis, um die Kulturen zu kühlen und dann sammeln die Bakterien durch Zentrifugation. Verwenden sechs 400 ml konischen Röhrchen und zentrifugiert (oder so viele wie die verwendeten Rotors erlaubt) für 5-8 Minuten bei 7.438 × g, die ausreicht, um die Bakterien zu pelletieren ist. Den Überstand umfüllen, und wiederholen Sie den Vorgang, bis alle Zellen aus den Medien werden geerntet. Die Anzahl der Drehungen erforderlich in Abhängigkeit von der Menge der Kultur, die gewachsen ist und das verwendete Rotor basiert. Für einen 2-l-Kultur ist es lediglich notwendig, um die Zellen einmal Spin-Down. Übertragen Sie alle geernteten Zellen in eine einzelne Zentrifugenröhrchen.
- Resuspendieren des Zellpellets in ~ 20 ml Französisch drücken Puffer (100 mM KPi und 5 mM MgCl 2, pH 7,4). Die Suspension sollte dicht (wie Sahne oder Milch) zu sein. Unmittelbar vor Französisch-Taste die Suspension hinzuzufügen der Proteaseinhibitor Phenylmethylsulfonylfluorid (PMSF) auf eine Endkonzentration von 2 mM und kräftig mischen.
- Französisch-drücken Sie die Kultur, in einem 35 ml Französisch-Druckzelle, bei 10.000 bis 16.000 psi. Spin down die Aussetzung zu trennen die aufgebrochenen Zellen bei 7438 · g, 10 min bei 4 ° C.
- Setzen Sie den Überstand in ein separates Röhrchen, und fügen Sie Lysozym und DNase (0,2 mg / ml). Lassen stehende Taumel für 10 min bei Raumtemperatur.
HINWEIS: DNase ist optional; es die Viskosität für die Hochgeschwindigkeits-Zentrifugation reduziert. Lysozym ist kritisch; Sie verdaut die Reste der Zellwand und trägt zur Steigerung der Ausbeute des Membranextraktion mit einem milden nicht-denaturierenden Detergens durchgeführt.
- Verteilen Sie den Überstand-Mix in zwei Ultrazentrifugenröhrchen und drehen Sie sie an106,883-153,911 xg (abhängig vom Rotor) bei 4 ° C für 40 min. Nach Zentrifugation wird der Überstand dekantiert, und der bräunliche Pellet am Boden (der Gesamtmembranfraktion) kann in dem Rohr für eine langfristige Lagerung eingefroren (- 80 ° C) oder für den unmittelbaren Proteinreinigung verwendet.
- Bereiten 0,5-1 l Hohe Imidazolpuffer: 100 mM NaCl + 500 mM Imidazol, titriert auf pH 7,2-7,4 mit konzentrierter HCl. Man beachte, daß Imidazol ist eine gute Puffersubstanz für sich.
- Vorbereitung 0,5-1 L des Nieder Imidazolpuffer: 100 mM NaCl, 15 mM Imidazol + durch geeignetes Verdünnen der Puffer oben mit 100 mM NaCl. Keine pH-Einstellung erforderlich ist.
- Nehmen Sie 100-150 ml jeder Puffer in separaten Flaschen, und fügen Sie 1% (w / v) b-Octylglucopyranosid (OG). Man rührt die Lösung gut und filtern sie durch ein 0,22 um-Filter. Diese Lösungen sind die Nieder- und Hoch Imidazol Chromatographie-Lösungen.
- Bereiten Extraktionspuffer, nehmen Sie 50 ml Low-Imidazol-Puffer, und fügen Sie 3% (w / v)OG und filtern den Puffer.
- Verwenden Membranpellets von 0,5-2 g Frischgewicht zur Proteinisolierung. Hinzuzufügen 5-7 ml Extraktionspuffer, das Pellet und homogenisieren in einem 30 ml handbetriebenen Glaskolben-Homogenisator. Mit 5-10 sanften Strichen bilden eine homogene Suspension ohne Klumpen. Seien Sie vorsichtig, wird Scherspannung bekannt, Proteindenaturierung verursachen.
- Spin down die unlöslichen Teilchen (Mid-Range-Zentrifuge, Festwinkelrotor, 38,478-68,405 xg, bei 4 ° C für 15 min). Unterdessen nehmen 3 ml Ni NTA-Kügelchen (6 ml Suspension) und einmal waschen Sie sie mit dem Nieder Imidazolpuffer (w / o OG), die sie in einem 15 ml Schütteln Schraubkappe Rohr. Lassen Sie die Perlen setzen sich auf dem Boden (~ 5-7 min) oder Spin sie hinunter auf 129 bis 201 g für eine Minute bei 4 ° C. Sobald das Pellet wird gebildet, Dekantieren Sie vorsichtig den Überstand mit der Hand und wiederholen Sie den Vorgang. Äquilibrieren der Kügelchen mit 2-3 ml 3% OG Extraktionspuffer.
- Mischen Sie die homogenisierte Mischung (Membranpellet und Extraktionspuffer) von 3.12 mit 3-3,5 ml Ni NTA-Perlen. Lassen Sie die Mischung Wäschetrockner in einem Schraubverschluss Rohr für 60 min (Batch-Laden). Drehen Sie die Perlen nach unten bei 201 xg (30 sec), Dekantieren des Überstandes mit der Hand, und waschen Sie die Perlen mit 1% OG Nieder Imidazolpuffer einmal. Pellet die Perlen wie in 3.13 wieder und wieder zu suspendieren sie in 20-30 ml frisches Nieder Imidazolpuffer.
- Packen Sie eine kleine Säule (mit einem oberen Fluss Adapter) mit den Ni NTA-Perlen, und lassen Sie die Perlen absetzen durch Öffnen des Hahn, um den Extrakt Fluss durch (nicht erlauben die Perlen zu trocknen) lassen. Mit einem Aliquot von 10 ml Niedrig Imidazolpuffer (1% OG) mit dem Absperrhahn geöffnet Waschen der Kügelchen.
- Laden Sie die Chromatographie Maschine mit reinem Nieder- und Hoch Imidazol-Puffer etwa 25 ml von jedem an der Maschine definierten Flussrate (variiert pro Maschine); Dies geschieht, indem die Nieder Imidazolpuffer durch das System zuerst gemacht. Null das optische Aufzeichnungsgerät bei OD 260 (Baseline). Beachten Sie, dass der Puffer ist ganz anders als Wasser, weil Low-grade-Imidazol hat impurities die UV absorbieren. Setzen Sie den Durchflussadapter an die Säule und befestigen es an der Maschine.
- Nachwaschen der Säule mit niedrigem Imidazolpuffer (bei 1 ml / min), bis die OD der Strömung durch die Grundlinie erreicht, kommt (es kann 10-20 ml dauern). Dies beseitigt die ungebundenen Proteine von der Säule.
- Anwenden eines linearen Gradienten von Imidazol von 20 bis 500 mm, für 30 min bei 1 ml / min. Sammeln Sie 4 ml-Fraktionen bei OD 600 zeigt einen Anstieg. Die ersten beiden Fraktionen sind voll von locker gebundenen Proteine, während MscL-6His beginnt Elution bei ca. 40% des linearen Gradienten. Die Mehrheit der Protein scheint in den Fraktionen 3-8.
HINWEIS: ein linearer Anstieg der OD wird durch die zunehmende% Imidazol zu beachten. - Pool der Fraktionen 3-4, 5-6 und 7-8 zusammen. Gegebenenfalls Konzentrieren der Fraktionen einzeln. Konzentrieren sich die Fraktionen 6-10 fach mit Fliehkraftfilter. Nach 20 min bei 804 xg Spin und bei 4 ° C vorsichtig resuspendieren konzentrierte Protein,das Protein dazu neigt, an dem Filter haften.
- Zurückzuziehen 50 ul Aliquots, mischen sie mit SDS-Probenpuffer, und überprüfen Sie die Proteinreinheit mit PAGE-Gelelektrophorese.
HINWEIS: MscL wird als Fuzzy-Bande von ungefähr 17 kDa zu der Unterseite des Gels wandern. - Mithilfe der konzentrierten Fraktionen, um das Protein unter Verwendung eines Protein-Assay-Kits quantifiziert, nach den Anweisungen des Herstellers. Eine typische Ausbeute aus 0,8 g Membranpellet bis zu 0,2 mg des reinen Proteins in den vereinigten Fraktionen.
- Rekonstituieren V23T MscL in DPhPC Liposomen durch Dialyse. Nehmen Sie eine 10 mg / ml Chloroformlösung von DPhPC und Aliquot von 0,5 ml (dh 5 mg Lipid) davon in drei Einweg-Rund (12 x 130 mm) Glasröhren. Trocknen Sie das Lipid unter den Strom von Stickstoff und die Reste von Chloroform zu entfernen unter Vakuum (4-6 h).
- Hinzuzufügen 15 20 mg gepulvertes OG zum trockenen Lipids in jedes Röhrchen, löst ihn in 2 ml Dialysepuffer (100 mM KCl, 5 mM KPi, pH 7,2), Wirbel und mildly beschallen. Die OG-gelöst Lipide sollte eine klare Lösung zu bilden.
- Konzentriertes V23T MscL Lösungen zu jedem Röhrchen 1 zu erreichen: 100, 1: 300 und 1: 1.000-Protein-zu-Lipid-Verhältnisse und Wirbelschacht. Schneiden und waschen drei Stücke (~ 12 cm lang) der Dialyseschlauch (MWCO 8000, 7,5 mm Durchmesser, haben drei Paare von nummerierten Clips bereit.)
- Platzieren der solubilisierten Lipid-Protein-Mischungen innerhalb der Schläuche, sorgfältig schließen die Enden mit Clips und dialysiert gegen 2 l Puffer (100 mM KCl, 5 mM KPi, pH 7,2) für 48 h bei 4 ° C mit vier Änderungen des Puffer alle 12 Stunden. Nach der Dialyse sind die Proteo-Liposomen bereit.
HINWEIS: Die Liposomenlösung kann mit 2 mM NaN3 (Natriumazid) ergänzt und bei 4 ° C gelagert werden. Vermeiden Sie das Einfrieren.
4. Herstellung des Ölbehälters
- Bohren zwei gegenüberliegende Löcher (1,0 mm Durchmesser) den ganzen Weg durch die Wand eines 2 Zoll Durchmesser, 1,5 cm langen Acryl cylinder 1 cm vom Boden (1A).
- Bohren Sie zwei 4 mm Löcher konzentrisch zu dem zuvor gebohrten Löcher 1 mm. Die Tiefen der Löcher sollten 1 mm jeweils (stellen Sie sicher nicht, den ganzen Weg zu bohren) sein. Diese Löcher werden gemacht, um die Gummidichtungen passen.
- Platz und Leim zwei Gummidichtungen mit 1 mm Innendurchmesser in den größeren Löchern, um Öl aus undichten verhindern.
- Kleben Sie die bearbeiteten Zylinder um eine 10 cm x 10 cm dünnen Acrylplatte mit jeder Mehrzweck Epoxy (Abbildung 1).
Am Tag des Experiments:
5. Herstellung von Elektroden
- Schneiden Sie ein 7 cm Länge von zwei 250 & mgr; m Durchmesser Silberdrähte, und tauchen ihre Spitzen in Bleichmittel für zwei Stunden, um eine Silberchlorid (AgCl) Beschichtung dann. Eine graue Farbe zeigt an, dass eine AgCl-Beschichtung wurde (Abbildung 2E) gebildet.
- Mit einem Glasschneider, Split ein 10 cm lang, 1 / 0,58 OD / ID mm Borosilikatglas Klasse capillary in zwei 5 cm Kapillaren.
- Unter Verwendung einer 34 Gauge Nadel microfil füllen die Kapillaren mit dem PEG-DMA-Hydrogel. Um die hydratisierten Hydrogel quillt aus der Kapillare zu verhindern, halten Sie einen 3 mm Abstand an der Spitze, und stellen Sie sicher, es gibt keine Luftblasen in den Kapillaren.
- Legen Sie die Ag / AgCl-Elektroden in das Hydrogel gefüllten Kapillaren (2E).
- Heilung der PEG-DMA-Hydrogels durch radikalische Photopolymerisation bei Einwirkung von UV-Licht für 2 min bei 1 W mit einer UV-Punktschweißpistole.
6. Einrichten des Experiment
HINWEIS: Das Experiment ist Setup unter einem Faraday-Käfig mit einem Masseanschluss auf der Patch-Verstärker geerdet.
- Befestigen Sie eine der Mikropipetten zu einer geraden Mikroelektrodenhalter, die einen Stecker (2E) hat.
- Verbinden den Mikroelektrodenhalter an der heads des Pflasters Verstärker (2A). Um die hea verbindendstage an Masse, löten eine 18-Gauge-isoliertem Kupferdraht auf einen geeigneten Anschluss für das heads.
- Montieren Sie die heads auf einem 3-Achsen manuelle Mikromanipulator. Befestigen Sie die headsMontagePlatte (es sollte zusammen mit dem Mikromanipulator gekauft werden oder benutzerdefinierte in einer Maschinenhalle gemacht) mit dem Mikromanipulator und dann den heads an der Montageplatte mit geeigneten Schrauben.
- Befestigen Sie den zweiten Mikropipette zu der Linearantrieb durch einen im Labor hergestellten Anschluss und hängen Sie dann sowohl auf einem zweiten Mikromanipulator (2B). Die Mikropipetten sollten einander gegenüber werden, ausgerichtet sind, und horizontal nivelliert. Hinweis: Die Marke und Stil der Manipulatoren keine Rolle.
- In einem Glasfläschchen, mischen Sie 0,1 ml der DPhPC Liposomen mit 0,01 ml des V23T MscL Proteoliposom Lösung.
Anmerkung: Dieser Schritt ist erforderlich, um das Protein-zu-Lipid-Verhältnis (~ 0,0002), die kritisch für die Bildung einer stabilen Lipid bilaye reduzierenr.
- Unter Verwendung einer 34 Gauge Nadel microfil, füllen die Spitzen der beiden Mikropipetten mit Proteoliposom Lösung (3A).
- Zeigen Reservoir oben auf einem aufrechten Mikroskop, und füttern die Mikropipetten durch die gegenüberliegende 1 mm Löchern (2B). Hinweis: Alle Mikroskop so lange auf die Tröpfchen konnte deutlich zu erkennen, verwendet werden könnten.
- Füllreservoirs zur Oberfläche mit Hexadecan (99%). Die Hexadecan braucht keine weitere Reinigung.
- Die kugelförmige Tröpfchen an der Spitze der Mikropipette zu bilden, mit einem dritten 10 um Durchmesser Borsilikatglas-Mikropipette, auf einem dritten Mikromanipulator montiert, um verdünnte V23T MscL Proteoliposom-Lösung (~ 0,00052 ml) auf die Spitzen der Mikropipetten verzichten und bilden die Tröpfchen (Abbildung 3).
- Steuern Sie die Größe der Tröpfchen (durch Verringern oder Erhöhen der Lautstärke) nach Wunsch und lassen Sie sie für 10 Minuten für die Monoschichten vollständig zu bilden, ruhen (Fild 3).
- Bringt die Tröpfchen in Kontakt, werden Doppelschichtbildung innerhalb von 1 bis 2 Minuten auf.
7. Einrichten der Software und Ausrüstung
- Vorbereitung der Software, indem auf den Computern, Mikroskop, piezoelektrischen Oszillatorregelung, Funktionsgeneratoren, patch Verstärker und der rauscharme Datenerfassungssystem.
Hinweis: Alle Patch-Verstärker verwendet werden und die folgenden Anweisungen gelten speziell für die, die wir verwendet, und das ist in der Materialien und Geräte-Liste aufgeführt. - Auf der Frontplatte der Patch-Verstärker, stellen Sie die "Mode" Knöpfe, um Vhold / IHOLD und V-Klemme.
- Auf der Frontplatte gesetzt der "Tiefpass" Bessel-Filter bis 1 kHz und Output Gain bis 2.
- Stellen Sie die "Konfiguration", um ganze Zelle β = 1.
- Sicherzustellen, dass der Rest der Noppen auf Null oder in der Neutralstellung.
- Probieren Sie alle DIB Strommessungen bei 5 kHzmit einem 1 kHz Bessel Anti-Aliasing-Filter.
- Führen Software durch Doppelklick auf das Symbol auf dem Desktop.
- Klicken Sie auf "Configure> Digitizer", um den Dialog "Digitizer" zu öffnen, und klicken Sie dann auf die Schaltfläche "Ändern".
- Im Dialog "Ändern Digitizer" die Option "Digidata 1440 Series" aus der Liste "Digitizer Type".
- Klicken Sie auf die Schaltfläche Scannen, um den Digitizer zu erkennen.
- Klicken Sie auf "OK", um den Dialog "Change Digitizer" zu verlassen, und klicken Sie dann auf "OK", um den Dialog "Digitizer" zu verlassen.
- Klicken Sie auf "Configure> Lab Bench".
- In der Registerkarte Eingangssignale von dem Labortisch, wählen Analog in einem unter Digitizer Kanäle. Stellen Sie den Skalierungsfaktor auf 0.002.
8. Bildung der Lipiddoppelschicht
- Über ein BNC-Kabel den Ausgang des awaveform Generator mit dem externen Befehlseingangsfront eingeschaltet (auf der Rückseite des Datenerfassungssystem). Senden Sie eine 10 Hz, 500 mV pk-to-pk Dreieckswellenform an die heads.
- Unter Verwendung der Mikromanipulator, verschieben Sie die Glasmikropipetten horizontal, um Tröpfchen in Kontakt zu bringen, bis sie leicht berühren, und warten Sie, Doppelschicht Ausdünnung auftritt (in der Regel etwa 1 bis 2 min) (3C und 3D).
HINWEIS: Die Progression der Doppelschichtbildungsverfahren kann visuell durch ein Mikroskop gesehen werden und kann durch Strommessung (4) überwacht werden.
- Einstellen der Doppelschichtgröße (~ 250 & mgr; m im Durchmesser), indem die Position des auf dem Aktuator montierten Tröpfchen unter Verwendung des Mikromanipulators. Hinweis: die Doppelschicht Größe visuell durch das Mikroskop abgeschätzt werden. Dieses Verfahren erleichtert es dem Forscher, die Größe der Doppelschicht leicht steuernBewegung der Tröpfchen unter Verwendung der Mikromanipulatoren.
9. dynamische Anregung und MscL Gating
- Sobald der Doppelschicht gebildet hat und stabil ist (dh der Doppelschicht wird nicht brechen oder leitend), stimulieren die Tröpfchen durch das Senden einer Sinussignal mit einem Funktionsgenerator.
- Um die MscL Proteins in die Doppelschicht eingebaut stimulieren senden sinusförmigen Wellenform mit einer 175 & mgr; m Spitze-zu-Spitze-Amplitude, 0,2 Hz Frequenz und Tastverhältnis von 50% an das piezoelektrische Servosteuerung. (Verschiedene Arten von Wellenformen können mit unterschiedlichen Amplituden, Frequenzen und Tastverhältnis gesendet)
10. Verarbeitung und Interpretation der Ergebnisse
- Speichern Sie die aktuellen Messwerte, aufgenommen mit dem Datenerfassungssystem, in .ABF Format. Importieren von Daten (in .ABF-Format) in Matlab unter Verwendung einer Funktion Datei "abfload", dann analysieren und verarbeiten die Daten. Die Datei "abfload" ist kostenlos online verfügbar.
- Schätzung ter die Spannung in der Doppelschicht und die Flächenausdehnung der Tröpfchen unter Verwendung von Videos des Tröpfchens während des vollen Betätigungszyklen, die mit einem entsprechenden Kamera aufgezeichnet wurden.
- Prozess Videos in Matlab, durch Bearbeitung einzelner Rahmen unter Verwendung von Bildverarbeitungstechniken, um den Bereich der Wasser / Öl-Grenzfläche, sowie der Winkel zwischen den Tröpfchen zu bestimmen. Anmerkung: mit einem 2D Bild aus dem Video aufgenommen, detektieren die Wasser-Öl-Grenzfläche (dh die Kante der Tröpfchen) und schätzen dann die Oberfläche durch Drehung.
Ergebnisse
Die Figuren 1 und 2 zeigen die Versuchsanordnung und Einrichtungen verwendet, um die Proteinaktivität im Verlauf der mechanischen Stimulation der Lipiddoppelschichtmembran aufzuzeichnen. Um elektrische Störungen in unsere Messungen zu minimieren, wird die Arbeitsstation innerhalb einer im Labor hergestellten Faradayschen Käfig gelegt, geerdet, um eine Masseverbindung über die Axopatch 200 B-Verstärker.
Bildung einer stabilen isolierenden Lipiddoppelschicht ist ein wichtiger Schritt in dieser Studie. In dieser Anordnung sammelt eine Lipidmonoschicht an der Öl / Wasser-Grenzfläche der wässrigen Tröpfchen in einem Bad aus einem organischen Lösungsmittel getaucht. Wenn Tröpfchen in Kontakt gebracht wird überschüssiges Öl beseitigt, und die gegnerische Lipidmono dünn auf ein Zwei Molekül dicke Lipiddoppelschicht. Die am weitesten verbreitete Technik in Doppelschichtcharakterisierung verwendeten Voltage-Clamp. Mit Spannungsklemmen, wird die Spannung über die Doppelschicht auf einem konstanten Wert gehalten, während der Strom gemessen wird, Fig. 4 schildert einen typischen Echtzeit-Stromaufnahme des ursprünglichen Doppelschichtbildung. Kenntnis der spezifischen Kapazität (~ 0,6 & mgr; F / cm 2) 5 des DPhPC Lipiddoppelschicht, kann der Bereich der gebildeten Doppelschicht berechnet werden. Die Doppelschichtbereich könnte durch Änderung der Position der Tröpfchen (4A) gesteuert werden. Verwendung des piezoelektrischen Aktuators, könnten verschiedene Arten von Wellenformen (sinusförmig, quadratisch, dreieckig, etc.) Bei verschiedenen Frequenzen, Amplituden und Tastverhältnissen an die Tröpfchen horizontal aufgebracht werden und axial oszillieren sie und damit Doppelschichtspannung und die Fläche verändert werden konnte (4B).
Wenn die DIB mechanisch stimuliert wird, während eine konstante DC-Potential über die Membran eine niedrigschwellige (gain-of-function) V23T Mutante MscL erzeugt zuverlässig Aktivitäten, einschließlich vor allem Unter leitenden Zustand und gelegentlich vollständige Öffnung Ereignisse (Abbildung 5) . Diese events sind identisch mit denen erfasst unter Verwendung der Patch-Clamp-Technik aus intakten inneren E. coli Membranen und Liposomen, die mit dem gereinigten V23T MscL rekonstituiert. Die Ergebnisse in 5 zeigen, dass Gating tritt in Antwort auf einen Anstieg in der Spannung, da alle Stromspitzen bei der Spitzenkompression beobachtet. Bei der Spitzenkompression ist die relative Flächenausdehnung der Tröpfchen maximal und daher ist die Spannung an der Grenzfläche maximal.
Alamethicin, einem spannungsgesteuerten Ionenkanal und eine der am besten untersuchten Peptide, erhöht die Durchlässigkeit der Membran, wenn eine Gleichspannung an die Membran 36 angelegt. Die Fähigkeit der Lipiddoppelschicht-Schnittstelle, um Transmembranproteine und Peptide Host wird auch durch Ausführen Spannungsanschnitt aktuellen Aufnahmen mit Alamethicin Peptid getestet. Alamethicin ist mit der Phospholipidlösung zu einer Endkonzentration von 100 ng / ml gemischt. 6 zeigt die Strommessungen unter Spannungsklemme (115 mV). Die Tröpfchen in diesem Experiment sind voneinander um kleine Doppelschicht-Schnittstelle und damit eine höhere Widerstandsfähigkeit und kleinere Kapazität erreichen gezogen. Die Torschaltung Verhalten der Alamethicin Peptid wird durch die diskreten Schritte Strom (Figur 6) gezeigt. Das Histogramm auf der rechten Seite des Diagramms zeigt die Änderungen in der Leitfähigkeit von der Basisebene (0,0962 ns), die im Grunde ist der erste Leitfähigkeitspegel des Kanals selbst.

Abb. 1: Eine schematische die Hauptteile und die Abmessungen der Ölbehälter der Beschreibung Der Ölbehälter ist an der Maschinenhalle an der Virginia Tech gefertigt. Es besteht aus einem maschinell bearbeiteten zylindrischen Acrylröhre auf die Oberfläche einer Acrylfolie verklebt. Die Abmessungen und die Konstruktion kann modifiziert werden, um verschiedene Anwendungen oder mehr als zwei Mikrozubringen./53362/53362fig1large.jpg "Target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
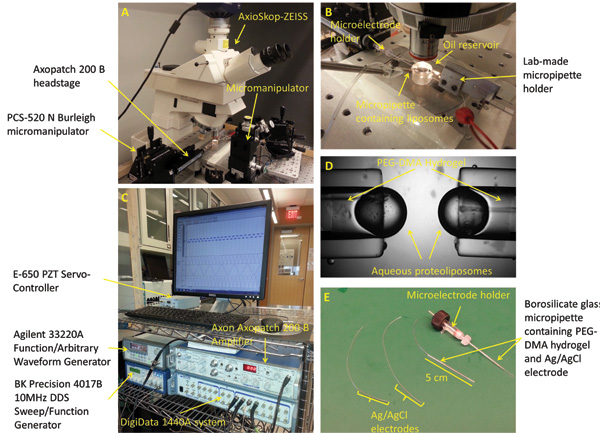
Abb. 2: Versuchsaufbau und Mikropipetten Zubereitung (A) Die Standardarbeitsplatz zur Bildung mechanisch stimulierende und Charakterisierung der Schnittstelle Doppelschichten umfasst ein Mikroskop, 3-Achsen-Manipulatoren, eine Digitalkamera, piezoelektrischen Oszillator, Schwingungsisolation Tisch und einen Faradayschen Käfig (nicht gezeigt). (B) Der Versuchsaufbau besteht aus zwei gegenüberliegenden PEG-DMA Hydrogel gefüllten Mikro horizontal in ein Bad aus Hexadecan Öl positioniert sind. Jeder der Mikropipetten enthält eine Ag / AgCl-Elektrode, um eine elektrische Verbindung bereitzustellen. Eine dritte Mikropipette mit Proteoliposom Lösung gefüllt wird verwendet, um die Tröpfchen an der Spitze der anderen Mikro bilden. (C) Das DIB Stromantwort gemessen werden konnteVerwendung einer Kombination aus dem Pflaster Verstärker und dem rauscharmen Datenerfassungssystem. (D) Eine geschlossene up-Bild, das die wässrigen Tröpfchen an der Spitze der Mikropipetten gebildet. (E) Ag / AgCl-Elektroden, indem die Spitze von zwei 250 um Silberdrähten in Bleiche hergestellt. Die Elektroden werden dann durch zwei Borosilikatglas Kapillaren mit PEG-DMA-Hydrogel, das mit UV-Licht gehärtet wird zur Verfestigung gefüllt zugeführt. Eine gerade Mikroelektrodenhalter mit Stiftstecker wird verwendet, um eine der Mikropipetten auf die heads des Patches Verstärker anschließen.
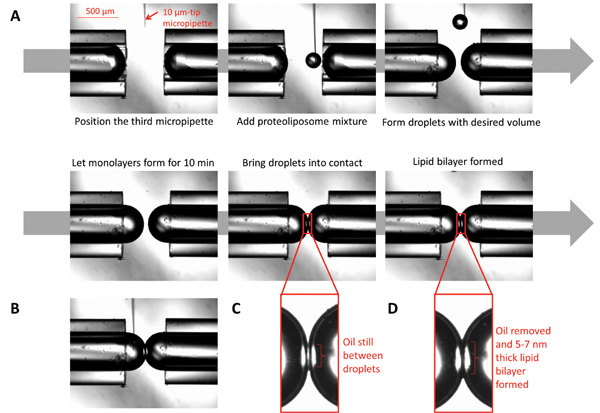
Abb. 3: Bilder, welche die Bildung von Doppelschichten Tröpfchengrenzfläche (A) Eine 10 & mgr; m-Mikropipette mit Proteo gefüllt ist unter dem Mikroskop in der Nähe der Mikropipettenspitzen positioniert ist. Unter Verwendung einer Spritze zu der Mikropipette verbunden ist, verzichtet werden kleine Voluminader Proteoliposomen zu kugelförmigen Tröpfchen auf das gewünschte Volumen zu bilden. Lassen Sie die Monoschicht bilden, indem die Tröpfchen zu zehn Minuten sitzen. Bringt die Tröpfchen in Kontakt; die Doppelschicht bilden, nachdem das gesamte Öl an der Grenzfläche eliminiert wird. (B) Während die Doppelschicht gebildet wird, kann die chemische Zusammensetzung bei beiden Seiten der Grenzfläche durch die Injektion gewünschten Chemikalien unter Verwendung eines mikrofeinen Mikro gesteuert werden. (C) Die Tröpfchen im Augenblick der ersten Berührung. (D) Die Tröpfchen, wenn die Lipid-Doppelschicht gebildet wird.
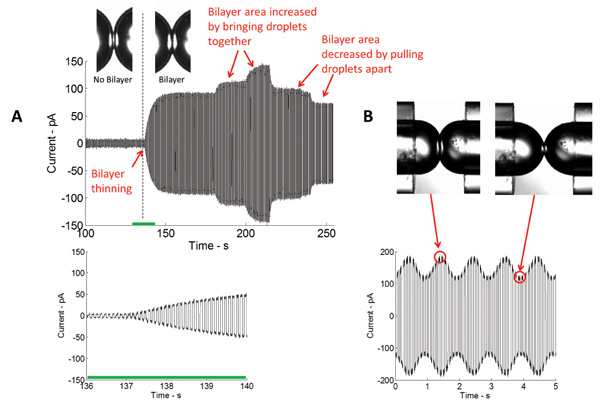
Abbildung 4: Echtzeit-Messungen zeigen, sowohl für den ersten Verdünnung und anschließende Expansion der Schnittstelle (A) Strom im Verlauf der Doppelschicht durch das Anlegen einer Dreiecks elektrischen Potential gemessen.. Der Betrag des gemessenen Stroms ist direkt proportional zu der capaciAbstand und somit der Bereich der Doppelschicht-Schnittstelle. Je näher sich die Tröpfchen zusammengeführt werden, desto größer ist die Fläche der Grenzfläche, und umgekehrt. (B) Bei Anwendung mechanischer Erregung, der Bereich der Doppelschicht-Schnittstelle Zunahmen und Abnahmen bei der gleichen Frequenz wie das Anregungssignal.
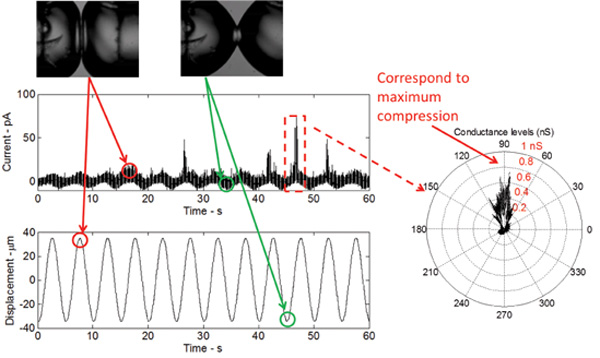
Abb. 5: Echtzeit-Messungen zeigen die Reaktion der Doppelschicht gegen mechanische Anregung als auch die Ansteuerung der V23T Mutante MscL Die Form des Stromantwort ist sinusförmig, was zu einer sinusförmigen Veränderung infolge betrifft in Doppelschicht-Kapazität die Doppelschicht Bereich zu ändern. Die Stromspitzen an der Spitze jedes Zyklus auftritt, geben Teilleitfähigkeit Gating des V23T Mutante. Ein Polardiagramm zeigt an, dass weitere Gating zu Spitzenkompression, die eine Erhöhung der Spannung bei der Doppelschicht-Interface spiegelt auftritt.
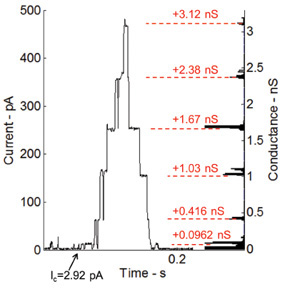
Abb. 6: Aktuelle Messungen unter Spannungsklemme und entsprechende Histogramm der Leitfähigkeitsniveaus für Gating-Aktivität der einge Alamethicin Kanäle Der Gating-Verhalten des Alamethicin Peptid wird durch die diskreten stufenweisen Anstieg der kurzfristigen gezeigt. Die Leitfähigkeitsniveaus entsprechen sehr gut mit früheren Messungen von unserer Arbeitsgruppe an der Virginia Tech 7 durchgeführt.
Diskussion
Mechanosensation bedeutet eine der ersten sensorischen Übertragungswegen, die in lebenden Organismen entwickelt. Mit diesem Phänomen für das Studium und das Verständnis der mechanisch-elektrischen Eigenschaften der DIB, ist ein entscheidender Schritt in Richtung Funktions Anregungen reagierende Materialien. Es geht um die Einbeziehung und Aktivierung eines mechanosensitive Kanal, MscL, in der DIB als mechanoelektrische Wandler und einem Dehnungsmessstreifen zu spannen Erhöhung der Lipid-Doppelschicht-Schnittstelle zu erkennen. Auf einer anderen Note könnte die Funktion der MS Kanäle, durch die Grundmaterialeigenschaften des Lipiddoppelschichten einschließlich der Dicke, intrinsische Krümmung und Kompressibilität geregelt werden. Im Lichte des zuvor erwähnt, stellt die Mikropipette eine Technik hilfreich, da die Forscher die Fähigkeit, MS Kanäle in DIB untersuchen und Einblicke in die Struktur der Lipid-Doppelschicht, wie auch die Lipid-Protein-Wechselwirkungen.
In den vergangenen drei Jahrzehnts, Patch-Clamp war der primäre Methode, um MS-Kanälen zu untersuchen, da sie eine Klemm sowohl Spannung und Anspannung. , Patch-Clamp erfordert jedoch sperrige Ausrüstung und nicht für eine Miniaturisierung, eine Eigenschaft für das Engineering von sensorischen und Umwandlungsvorrichtungen erforderlich geeignet. DIB aufgrund ihrer Einfachheit, Stabilität und Kompaktheit stellen eine geeignete Umgebung, um die Aktivität MscL studieren. Hier haben wir erstrecken vorherigen Fortschritte in den DIB Bildungstechniken, indem sie eine Mikropipette Technik, mit der Fähigkeit, die Größe der Tröpfchen und Doppelschicht-Schnittstelle, die chemische Zusammensetzung von jedem Tröpfchen und die Spannung an der Grenzfläche durch dynamische Stimulation steuern. Die Technik besteht aus Verankerungs wässrigen Tröpfchen, enthaltend Proteoliposomen zu den Spitzen der koaxial gegenüberliegenden Glaskapillaren. Die Tröpfchen werden in ein Bad aus organischem Lösungsmittel gegeben und bei Kontakt gebracht einer Lipiddoppelschicht bildet sich an der Schnittstelle.
Die Mikropipetten sind p angebrachtiezoelectric Oszillatoren ermöglicht die horizontale Verschiebung der Tröpfchen. Dynamisch Komprimieren der Tröpfchen führt zu einer Erhöhung der Grenzflächenspannung an der Wasser-Öl-Grenzfläche und damit eine Erhöhung der Doppelschichtspannung. Zwei wichtige Aspekte zu differenzieren diese Methode von der ähnlichen und vor kurzem veröffentlichten Kontaktdaten Blase Doppelschicht (CBB) Technik 37. Verwendung der Technik hierin dargestellt, wird die Größe der Bilayer kontrollierte Verwendung von Mikromanipulatoren und damit die Volumen der Tröpfchen konstant bleiben, im Gegensatz zu dem CBB-Methode. Darüber hinaus fordert der CBB Technik zur Druckpumpen, die nicht in der in dieser Veröffentlichung macht es einfacher und leichter zu bauen stellten Verfahren notwendig sind.
Wir sind in der Lage, zu integrieren und zu stimulieren bakteriellen MscL erstmals ohne Verwendung eines Patch-Pipette oder chemische Modifikationen 38. Da das System erleichtert die Bildung von robusten asymmetrische Lipid-Doppelschichtmembranen, es ahmt den lIPID Asymmetrie in biologischen Membranen gefunden. Dies erlaubt uns, die Wirkung von gesteuerten Membranzusammensetzung oder Asymmetrie auf die Aktivität MscL studieren. Zusätzlich wird durch Bildverarbeitungstechniken, hilft diese Methode schätzen die Spannung an der Doppelschicht-Schnittstelle. Diese Technik hilft beim Verständnis der Prinzipien der Umwandlung zwischen der Masse und Oberflächenkräfte im DIB erleichtert die Messungen der Grundmembraneigenschaften und verbessert das Verständnis MscL Reaktion auf Spannung Membran.
Obwohl dieses Verfahren führt einen Schritt näher zu einer biomolekularen stimuliresponsive Materialsystems und zu einer anderen physiologischen Umgebung zu MscL untersuchen, gibt es Einschränkungen für das System. Spannung in diesem System kann wegen der Gegenwart der Lipidreservoir in der Form von Liposomen in jedem Tröpfchen, die Spannung an der Öl / Wasser-Grenzfläche zu entlasten neigt geklemmt werden. Daher wird derzeit mechanosensitive Kanäle stimuliert werdenin DIB nur im dynamischen Betrieb. Das Vorhandensein von Luftblasen in dem System beeinflusst die Genauigkeit und Reproduzierbarkeit der Experimente. In der Hydrogele Luftblasen könnten Verlust, wenn die elektrische Verbindung zur Folge haben.
Während wir beschreiben die Verwendung der Mikropipette basiertes Verfahren für die Stimulation der MscL könnte die Technik verwendet, um andere Arten von MS Kanäle zu untersuchen und das Potential hat, die von Forschern verwendet, um eine Vielzahl von Biomolekülen zu untersuchen. Zum Beispiel hat ähnliche Einstellung in unserem Labor verwendet, um die mechanoelektrische Antwort eines Kanals freien Tröpfchengrenzfläche Bilayermembran studieren. Verschiedene Proteine konnte wieder hergestellt werden und aktiviert mit diesen stark kontrollierten Setup unter Berücksichtigung, dass die Rekonstitution Umgebungen jedes Biomolekül variieren. Die in diesem Artikel beschriebenen Verfahren berührt eine wesentlich breitere Anwendung Potenzial, das nur für die Phantasie des Forschers begrenzt.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Forschung in dieser Veröffentlichung berichtet, wird von der Air Force Office of Scientific Research Grund Initiative Statt FA9550-12-1-0464 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter | Corning | 430624 | |
| 1,2-diphytanoy-sn-glycero-3-phosphocholine (DPhPC) | Avanti Polar Lipids | 850356P | Purchased as lyophilized powder |
| 34-gauge microfil | World Precision Instruments | MF24G-5 | |
| 400 mL Centrifuge bottels | ThermoFisher | 3141 | Nalgene |
| Agilent Function/Arbitrary Waveform Generator, 20 MHz | Keysight Technologies | 33220A | |
| Ampicillian | ThermoFisher | BP1760 | ACS Grade |
| Avanti® Mini-Extruder | Avanti Polar Lipids | 610000 | |
| Axio Scope.A1 | Carl Zeiss | - | |
| AxioCam HSm | Carl Zeiss | - | |
| Axopatch 200B Amplifier | Molecular Devices | - | |
| BCA protein assay kit | Pierce | 23225 | |
| BK Precision 4017B 10 MHz DDs Sweep/Function Generator | Digi-Key | BK4017B-ND | |
| Borosilicate Glass Capillaries | World Precision Instruments | 1B100F-4 | |
| Dialysis tubing | 7 Spectra/Por | 132113 | MWCO 8000, 7.5 mm diameter |
| DigiData 1440A system | Molecular Devices | - | |
| DNAse | Sigma-Aldrich | DN25 | |
| DPhPC | Avanti | 850356C | |
| E-625 PZT Servo-Controller | Physik Instrumente | E-526 | |
| FPLC System | Pharmacia Biotech | - | |
| HCl | J.T. Baker | 9535-33 | |
| Hexadecane, 99% | Sigma-Aldrich | 544-76-3 | |
| Homoginizer | Wheaton | 357426 | 15 mL |
| Imidazole | Sigma-Aldrich | I5513 | |
| IPTG | Affymetrix | 17886 | |
| IRGACURE® 2959 | IRGACURE® | 555047962 | |
| Isopore Membrane Filters | EMD Millipore | VCTP02500 | |
| Isopropyl Alcohol | VWR International | BDH1133-4LP | |
| KCl | Sigma-Aldrich | P3911 | ACS Grade |
| KH2PO4 | Mallinckrodt | 7100 | ACS Grade |
| Kimble-Chase | Kontes | 420401-1515 | Flex-Column |
| LED-100 UV Spot Curing System | Electro-Lite, corp. | 81170 | |
| Lysozyme | Sigma-Aldrich | L6876 | |
| Manual Patch-Clamp Micromanipulators | Thorlabs | PCS-520N | |
| MgCl2 | ThermoFisher | M33 | ACS Grade |
| Microelectrode Holder | World Precision Instruments | MEH1S | |
| Micropipette Puller | Sutter Instruments | P-1000 | |
| MOPS, minimum 99.5% titration | Sigma-Aldrich | M1254-100G | |
| N2 Gas | Airgas | UN1066 | |
| NaCl | EMD | SX0420-1 | ACS Grade |
| Ni NTA agarose beads | Qiagen | 1000632 | |
| Optically Clear Cast Acrylic Tube, 2-1/2" OD x 2" ID | McMaster-Carr | 8486K545 | |
| P-601 PiezoMove Flexure-Guided Linear Actuator | Physik Instrumente | P-601 | |
| PAGE gel | Bio-Rad | 456-9033 | |
| Parafilm M® All-Purpose Laboratory Film | Parafilm® | PM999 | |
| Phenylmethylsulfonyl fluoride | Sigma-Aldrich | P7626 | |
| Poly(ethylene glycol)1000 dimethacrylate | Polysciences, Inc. | 15178-100 | |
| Polycarbonate (PCTE) Membrane Filters, Black, 0.4 Micron, 25mm, 100/Pk | Sterlitech Corporation | PCTB0425100 | |
| Potassium Chloride | Sigma-Aldrich | P5405-500G | |
| Powder Free Soft Nitrile Examination Gloves | VWR International | CA89-38-272 | |
| Replacement Gasket 1.0mm | World Precision Instruments | GO1-100 | |
| SDS | Sigma-Aldrich | L5750 | |
| Silver wire | GoodFellow | 147-346-94 | Different diameters could be used depending on the application |
| Sodium Azide | Affymetrix | 21610 | |
| Test tubes | ThermoFisher | 14-961-27 | 12 x 130 mm |
| Tryptone | ThermoFisher | BP1421 | |
| Ultracal 30K | Millipore | UFC803024 | Amicore Ultra 30 MWCO |
| VWR Light-Duty Tissue Wipers | VWR International | 82003-820 | |
| VWR Scientific 50D Ultrasonic Cleaner | VWR International | 13089 | |
| Water Purifier | Barnstead | D11931 | |
| Yeast | ThermoFisher | BP1422 | |
| β-octylglucopyranoside | Anatrace | O311S |
Referenzen
- Montal, M., Mueller, P. Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties. P NATL ACAD SCI USA. 69, 3561-3566 (1972).
- Tsofina, L., Liberman, E., Babakov, A. Production of bimolecular protein-lipid membranes in aqueous solution. Nature. , (1966).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid Bilayer Formation by Contacting Monolayers in a Microfluidic Device for Membrane Protein Analysis. ANAL CHEM. 78, 8169-8174 (2006).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. J AM CHEM SOC. 129, 8650-8655 (2007).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. J AM CHEM SOC. 130, 5878-5879 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nat Nano. 4, 437-440 (2009).
- Sarles, S. A., Stiltner, L. J., Williams, C. B., Leo, D. J. Bilayer formation between lipid-encased hydrogels contained in solid substrates. ACS APPL MATER INTER. 2, 3654-3663 (2010).
- Sarles, S. A., Leo, D. J. Regulated attachment method for reconstituting lipid bilayers of prescribed size within flexible substrates. ANAL CHEM. 82, 959-966 (2010).
- Sarles, S. A. . Physical Encapsulation of Interface Bilayers. , (2010).
- Sarles, S. A., Leo, D. J. Membrane-based biomolecular smart materials. SMART MATER STRUCT. 20, 094018 (2011).
- Sarles, S. A. The use of virtual ground to control transmembrane voltages and measure bilayer currents in serial arrays of droplet interface bilayers. SMART MATER STRUCT. 22, 094023 (2013).
- Sarles, S. A., Leo, D. J. Cell-inspired electroactive polymer materials incorporating biomolecular materials. SPIE Smart Structures and Materials+ Nondestructive Evaluation and Health Monitoring. , 797626 (2011).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130, 5878-5879 (2008).
- Bayley, H., et al. Droplet interface bilayers. MOL BIOSYST. 4, 1191-1208 (2008).
- White, S. H. Analysis of the torus surrounding planar lipid bilayer membranes. BIOPHYS J. 12, 432 (1972).
- Tien, H. T., Ottova, A. L. The lipid bilayer concept and its experimental realization: from soap bubbles, kitchen sink, to bilayer lipid membranes. J MEMBRANE SCI. 189, 83-117 (2001).
- Perozo, E. Gating prokaryotic mechanosensitive channels. NAT REV MOL CELL BIO. 7, 109-119 (2006).
- Kung, C., Martinac, B., Sukharev, S. Mechanosensitive channels in microbes. ANNU REV MICROBIOL. 64, 313-329 (2010).
- Bialecka-Fornal, M., Lee, H. J., DeBerg, H. A., Gandhi, C. S., Phillips, R. Single-cell census of mechanosensitive channels in living bacteria. PLoS ONE. 7, e33077 (2012).
- Levina, N., et al. Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitive channels: identification of genes required for MscS activity. The EMBO Journal. 18, 1730-1737 (1999).
- Chiang, C. -. S., Anishkin, A., Sukharev, S. Gating of the large mechanosensitive channel in situ: estimation of the spatial scale of the transition from channel population responses. BIOPHYS J. 86, 2846-2861 (2004).
- Anishkin, A., Chiang, C. -. S., Sukharev, S. Gain-of-function mutations reveal expanded intermediate states and a sequential action of two gates in MscL. J GEN PHYSIOL. 125, 155-170 (2005).
- Sukharev, S. I., Sigurdson, W. J., Kung, C., Sachs, F. Energetic and Spatial Parameters for Gating of the Bacterial Large Conductance Mechanosensitive Channel, MscL. J GEN PHYSIOL. 113, 525-540 (1999).
- Deplazes, E., Louhivuori, M., Jayatilaka, D., Marrink, S. J., Corry, B. Structural investigation of MscL gating using experimental data and coarse grained MD simulations. PLOS COMPUT BIOL. 8, e1002683 (2012).
- Kubalski, A., Martinac, B. . Bacterial ion channels and their eukaryotic homologs. , (2005).
- Chang, G., Spencer, R. H., Lee, A. T., Barclay, M. T., Rees, D. C. Structure of the MscL homolog from Mycobacterium tuberculosis: a gated mechanosensitive ion channel. Science. 282, 2220-2226 (1998).
- Steinbacher, S., Bass, R., Strop, P., Rees, D. C. Structures of the prokaryotic mechanosensitive channels MscL and MscS. Mechanosensitive Ion Channels, Part A. , 1-24 (2007).
- Sukharev, S., Durell, S. R., Guy, H. R. Structural models of the MscL gating mechanism. BIOPHYS J. 81, 917-936 (2001).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418, 942-948 (2002).
- Betanzos, M., Chiang, C. -. S., Guy, H. R., Sukharev, S. A large iris-like expansion of a mechanosensitive channel protein induced by membrane tension. NAT STRUCT MOL BIOL. 9, 704-710 (2002).
- Corry, B., Jayatilaka, D. Simulation of structure, orientation, and energy transfer between AlexaFluor molecules attached to MscL. BIOPHYS J. 95, 2711-2721 (2008).
- Wang, Y., et al. Single Molecule FRET Reveals Pore Size and Opening Mechanism of MscL. eLife. 3, e01834 (2014).
- Anishkin, A., Akitake, B., Kamaraju, K., Chiang, C., Sukharev, S. Hydration properties of mechanosensitive channel pores define the energetics of gating. J Phys Condens Matter. 22, 454120 (2010).
- Koçer, A., Walko, M., Meijberg, W., Feringa, B. L. A light-actuated nanovalve derived from a channel protein. Science. 309, 755-758 (2005).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. Mechanosensitive Channels Activity in a Droplet Interface Bilayer System. MRS Proceedings. 1621, (2014).
- Fox, R. O., Richards, F. M. A voltage-gated ion channel model inferred from the crystal structure of alamethicin at 1.5-Å resolution. Nature. 300, 325-330 (1982).
- Iwamoto, M., Oiki, S. Contact Bubble Bilayers with Flush Drainage. Sci Rep. 5, (2015).
- Barriga, H. M., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. J R Soc Interface. 11, 20140404 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten