Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von synthetischen Kernschmelzglas
In diesem Artikel
Zusammenfassung
A protocol for the production of synthetic nuclear melt glass, similar to trinitite, is presented.
Zusammenfassung
Realistic surrogate nuclear debris is needed within the nuclear forensics community to test and validate post-detonation analysis techniques. Here we outline a novel process for producing bulk surface debris using a high temperature furnace. The material developed in this study is physically and chemically similar to trinitite (the melt glass produced by the first nuclear test). This synthetic nuclear melt glass is assumed to be similar to the vitrified material produced near the epicenter (ground zero) of any surface nuclear detonation in a desert environment. The process outlined here can be applied to produce other types of nuclear melt glass including that likely to be formed in an urban environment. This can be accomplished by simply modifying the precursor matrix to which this production process is applied. The melt glass produced in this study has been analyzed and compared to trinitite, revealing a comparable crystalline morphology, physical structure, void fraction, and chemical composition.
Einleitung
Concerns over the potential malicious use of nuclear weapons by terrorists or rogue nations have highlighted the importance of nuclear forensics analysis for the purpose of attribution.1 Rapid post-detonation analysis techniques are desirable to shorten the attribution timeline as much as possible. The development and validation of such techniques requires realistic nuclear debris samples for testing. Nuclear testing no longer occurs in the United States and nuclear surface debris from the testing era is not readily available (with the exception of trinitite - the melt glass produced by the first nuclear test at the trinity site) and therefore realistic surrogate debris is needed.
The primary goal of the method described here is the production of realistic surrogate nuclear debris similar to trinitite. Synthetic nuclear melt glass samples which are readily available to the academic community can be used to test existing analysis techniques and to develop new methods such as thermo-chromatography for rapid post-detonation analysis.2 With this goal in mind the current study is focused on producing samples which mimic trinitite but do not contain any sensitive weapon design information. The fuel and tamper components within these samples are completely generic and the comparison to trinitite is based on chemistry, morphology, and physical characteristics. The similarities between trinitite and the synthetic nuclear melt glass produced in this study have been previously discussed.3
The purpose of this article is to outline the details of the production process used at the University of Tennessee (UT). This production process was developed with two key parameters in mind: 1) the composition of material incorporated into nuclear melt glass, and 2) the melting temperature of the material. Methods exist for estimating the melting temperature of glass forming networks4 and these techniques have been employed here, along with additional experimentation to determine the optimal processing temperature for the trinitite matrix.5
Alternative methods for surrogate debris production have been published recently. The use of high power lasers has the advantage of creating sufficiently high temperatures to cause elemental fractionation within the target matrix.6 Porous chromatographic substrates have been used to produce small particles similar to fallout particles using condensed phase methods7. The latter method is most useful for producing particulate debris (nuclear fallout) and has been demonstrated with natural metals. The advantages of the method presented here are 1) simplicity, 2) reproducibility, and 3) scalability (sample sizes can range from tiny beads to large chunks of melt glass). Also, this method is expandable both in terms of production output and variety of explosive scenarios covered, and it has already been demonstrated using radioactive materials. A sample has been successfully activated at the High Flux Isotope Reactor (HFIR) at Oak Ridge National Laboratory (ORNL). Natural uranium compounds were added to the matrix prior to melting and fission products were produced in situ by neutron irradiation.
Methods within the glass making industry and those employed for the purpose of radioactive waste immobilization8 have been consulted in the development of the method presented here. The unique effects of radiation in glasses are of inherent interest9 and will constitute an important area of study as this method is further developed.
The method described below is appropriate for any application where a bulk melt glass sample is desired. These samples most closely resemble the material found near the epicenter of a nuclear explosion. Samples of various sizes can be produced, however, methods employing plasma torches or lasers will be more useful for simulating fine particulate debris. Also, commercial HTFs do not reach temperatures high enough to cause elemental fractionation for a wide range of elements. This method should be employed when physical and morphological characteristics are of primary importance.
Protokoll
Achtung: Die hier skizzierten Prozess beinhaltet die Verwendung von radioaktivem Material (zB Uran-Hexahydrat) und mehrere ätzende Stoffe. Geeignete Schutzkleidung und Ausrüstung verwendet werden soll (einschließlich eines Laborkittel, Handschuhe, Schutzbrille und einer Abzugshaube) während der Probenvorbereitung. Darüber hinaus sollten Laborbereiche für diese Arbeit verwendet regelmäßig auf radioaktive Kontamination überwacht werden.
Anmerkung:. Die chemischen Verbindungen notwendig sind in Tabelle 1 aufgelistet Diese Formulierung wurde von zuvor Prüfung kompositorischen Daten für Trinitit durch Mittelung der Massenanteile für mehrere unterschiedliche Trinitit Proben entwickelt berichteten 10 Die hier ausgewiesenen bestimmt Massenanteile 10 Das "fehlende" Masse.. (die Fraktionen nicht zur Einheit zusammenfassen) vorhanden ist, um eine gewisse Flexibilität beim Hinzufügen von Kraftstoff, Sabotage, und andere Bestandteile zu ermöglichen. Unsere unabhängige Analyse von mehreren Proben Trinitit legt nahe, dass Quarz ist der einzige MineralphaseÜberleben in Trinitit. 5 ist daher der einzige Quarz Mineral in unserer Standard Trinitit Formulierung (STF) enthalten. Obwohl Relikt Körner anderer Mineralien in Trinitit gemeldet, 11 davon sind eher die Ausnahme und nicht die Regel sein. Im Allgemeinen ist die einzige Quarz Mineral im Schmelzglas gefunden. 10,12 Auch ist Quarzsand ein üblicher Bestandteil von Asphalt und Beton, der in der Bildung von städtischen Kernschmelzglas wichtig sein werden.
-4| Gemittelt Trinitit Daten | Standard Trinitit Formulierung (STF) | ||
| Verbindung | Massenanteil | Verbindung | Massenanteil |
| SiO 2 | 6.42x10 -1 | SiO 2 | 6.42x10 -1 |
| Al 2 O 3 | 1.43x10 -1 | Al 2 O 3 | 1.43x10 -1 |
| CaO | 9.64x10 -2 | CaO | 9.64x10 -2 |
| FeO | 1.97x10 -2 | 1.97x10 -2 | |
| MgO | 1.15x10 -2 | MgO | 1.15x10 -2 |
| Na 2 O | 1.25x10 -2 | Na 2 O | 1.25x10 -2 |
| K 2 O | 5.13x10 -2 | KOH | 6.12x10 -2 |
| MnO | 5.05x10 -4 | MnO | |
| TiO 2 | 4.27x10 -3 | TiO 2 | 4.27x10 -3 |
| Gesamt | 9.81x10 -1 | Gesamt | 9.91x10 -1 |
Tabelle 1. Liste der chemischen Verbindungen.
1. Herstellung des STF
Hinweis: Benötigte Ausrüstung umfasst eine Mikrowaage, Metallspachtel, einer keramischen Mörser und Stößel, einer chemischen Abzugshaube, Latexhandschuhe, Laborkittel und Schutzbrille.
- Mischen von nicht-radioaktiven Komponenten
- Erfassen mindestens 65 g Quarzsand (SiO 2), 15 g Al 2 O 3 </ sub> Pulver, 10 g CaO-Pulver, 2 g FeO-Pulver, 2 g MgO-Pulver, 2 g Na 2 O-Pulver, 7 g KOH-Pellets wurden 1 g MnO-Pulver und 1 g TiO 2 -Pulver ( in Tabelle 1 aufgeführten Verbindungen).
- Verwenden Sie einen Mikrowaage und kleine Spachtel, um genau die Massenanteile der einzelnen Verbindungen zu messen, wie in Tabelle 1 aufgeführt. Die besten Ergebnisse vorzubereiten 100 g des nicht-radioaktiven Vorstufen-Matrix auf einmal.
- Verwenden Sie einen Mörser und Stößel zu pulverisieren (auf ~ 10-20 um Größe Granulat) und gründlich mischen, die Verbindungen und bilden eine homogene Pulvermischung, die 64,2 g SiO 2, 14,2 g Al 2 O 3, 9,64 g CaO, 1,97 g FeO, 1,15 g MgO, 1,25 g Na 2 O. 6,12 g KOH, 0,0505 g MnO, und 0,427 g TiO2.
- Rühren der Mischung unter Verwendung einer Kugelmischer, kurz bevor der nächste Schritt gemacht wird.
- Mischen der STF mit Urannitrat-Hexahydrat (UNH)
- Acquire mindestens 1 g UNH.
- Innerhalb einer Abzugshaube, pulverisieren einige UNH Kristalle (mit einem Mörser und Stößel) zu einem feinen Pulver von 1-2 um Körnchen zu bilden.
- Hinzuzufügen 33,75 ug UNH pro Gramm des nicht-radioaktiven Vorstufen-Matrix (dieses Verhältnis zur Simulation eines einfachen Waffe mit einer Ausbeute von 1 Kilotonnen angebracht). 13
- Gründliche Durchmischung der Pulvermischung, einschließlich der UNH, mit einem Mörser und Stößel. Vervollständigen endgültige Mischen kurz vor dem Schmelzschritt.
2. Herstellung von 1-Gramm-Melt Glasproben
Hinweis: Benötigte Ausrüstung umfasst eine HTF bewertet bei 1600 ° C oder höher, hochreine Graphittiegel, langen Edelstahltiegelzange, hitzebeständige Handschuhe und eine Schutzbrille. Hitzebeständige Handschuhe und Augenschutz sollte bei der Einführung oder Entnahme von Proben aus dem Ofen getragen werden. Getönte Schutzbrille (oder Sonnenbrille) sind nützlich, da sie die Blendung aus dem Ofen zu reduzieren.
- Herstellung eines nicht-radioaktiven Probe
- Füllen einer dicken Keramikschale (wie ein Mörtel) mit ~ 100 g reinem Quarzsand und aufrechtzuerhalten bei RT in der Nähe von dem Ort des Ofens, wo die Proben geschmolzen werden.
- Heizen Sie den HTF zu 1.500 ° C.
- Sorgfältig zu messen 1,00 g des nicht-radioaktiven Pulvermischung und legen Sie das Pulver in einem hochreinen Graphittiegel.
- Legen Sie das Tiegel im beheizten HTF (mit einem langen Paar Stahltiegelzange) und Schmelze der Mischung für 30 min.
- Entfernen Sie die Probe (wieder mit Hilfe der Zange) und gießen Sie die geschmolzene Probe in den Mörtel mit Sand gefüllt.
- Lassen Sie die Glasperle für 1-2 Minuten vor dem Umgang mit kühlen.
- Polieren Sie die Wulst zu Rest Sand zu entfernen (falls erforderlich).
- Herstellung eines radioaktiven Probe
- Wiederholen Sie die Schritte 2.1.1 und 2.1.2.
- Sorgfältig zu messen 1,00 Gramm der radioaktiven Pulvermischung (einschließlich UNH) und legen Sie die powd er in einer hochreinen Graphittiegel mit einem separaten Spachtel und Mikrowaage, um Kreuzkontamination zu vermeiden.
- Wiederholen Sie die Schritte 2.1.4 - 2.1.6 oben.
- Überwachen Sie die Gegend rund um den Ofen (mit einem Handstrahlungsdetektor und / oder Swipe-Assays), die für radioaktive Kontamination zu überprüfen.
3. Proben Aktivierung
Hinweis: Die folgenden Gleichungen abgeleitet wurden unter der Annahme der Verwendung von Waffen Grad (angereichert) Uranmetall. Die Mengen der UNH oder Uranoxid müssen nach dem Massenanteil an elementarem Uran und der Ebene 235 U Anreicherung skaliert.
- Aktivierung eines Schmelzglasprobe mit Uranium Fue
- Berechnen Sie den Massenanteil von Uranmetall für die Probe mit der folgenden Gleichung 13 (wobei m U steht für die Uran-Massenanteil und Y für die Waffe Ausbeute) benötigt:
473 / 53473eq1.jpg "/> - Optional: Berechnen Sie den Massenanteil von Sabotage (zB natürliches Uran, Blei, Wolfram) unter Verwendung der folgenden Gleichung: 13
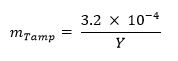
- Berechnung der Sollzahl der Spaltungen in der Probe unter Verwendung der folgenden Gleichung 13 wobei M s die Masse der Probe in Gramm und N f die Zahl der Spaltungen in der Probe während der Bestrahlung erzeugt wird:
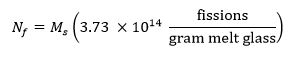
- Berechnen Sie die notwendige Belichtungszeit mit Hilfe der folgenden Gleichung 13 wobei m 235 repräsentiert die 235 U-Massenanteil (Anreicherung) und T irr ist die Bestrahlungszeit in Sekunden:
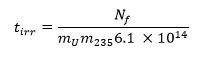
- Bestrahlen die Probe fürt irr Sekunden bei einem thermischen Neutronenfluss von 4,0 x 10 14 n / cm 2 / sec. Zum Beispiel wird eine 60 sec Bestrahlung in Rohrpost 1 (PT-1) HFIR (mit einer thermischen zur Resonanzüberhöhung 35) etwa 1,1 x 10 11 Spaltungen in einer Probe, die 870 ug UNH (äquivalent zu 410 & mgr; g zu erzeugen natürliches Uran oder 3,0 & mgr; g von 235 U). Dies hat für eine 0.433 g Glasperlen entworfen, um eine Schmelzglasprobe von einer Waffe mit einem 0,1 Kilotonnen Ausbeute hergestellt simulieren, erreicht worden. Diese Probe wurde gründlich von Cook et al 14 analysiert.
- Folgen Sie geltenden Sicherheitsprotokolle für die Handhabung der radioaktiven Probe nach der Bestrahlung.
- Berechnen Sie den Massenanteil von Uranmetall für die Probe mit der folgenden Gleichung 13 (wobei m U steht für die Uran-Massenanteil und Y für die Waffe Ausbeute) benötigt:
- Aktivierung eines Schmelzglasprobe mit Plutonium Fuel (Planungsfaktoren)
- Berechnen Sie den Massenanteil von Plutoniummetall für die Probe mit der folgenden Gleichung 13 wobei M Pu Vertre erforderlichts Plutonium Massenanteil und Y für die Waffe Ausbeute:
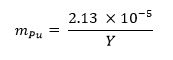
- Wiederholen Sie die Schritte 3.1.2 und 3.1.3 oben.
- Bestimmung der Bestrahlungszeit nötig, um die gewünschte Zahl der Spaltungen in der Schmelzglasprobe erhalten. Diese Zeit hängt von der Zusammensetzung und der Gehalt des Plutoniums sowie Neutronenenergiespektrum abhängen.
- Berechnen Sie den Massenanteil von Plutoniummetall für die Probe mit der folgenden Gleichung 13 wobei M Pu Vertre erforderlichts Plutonium Massenanteil und Y für die Waffe Ausbeute:
Hinweis: Große Sorgfalt sollte beim Umgang mit Plutonium und zusätzliche Analyse erforderlich sein wird genommen werden. Während ich dies schreibe, hat nur Uran, in dem bei UT hergestellt und HFIR bestrahlt synthetischen Schmelzglasproben verwendet.
Ergebnisse
Die nicht-radioaktiven Proben in dieser Studie hervorgebracht haben, um Trinitit verglichen worden und Abbildungen 1-3 zeigen, dass die physikalischen Eigenschaften und die Morphologie sind in der Tat ähnlich. Abbildung 1 zeigt Fotografien, die die Ähnlichkeiten in Farbe und Textur, die auf makroskopischer Ebene beobachtet werden, zu offenbaren. Abbildung 2 zeigt Rasterelektronenmikroskop (SEM) Sekundärelektronen (SE) Bilder, die ähnliche Merkmale im Mikrometerberei...
Diskussion
Hinweis in Bezug auf Schritte 1.2.2 und 1.2.3: Die genaue Höhe der UNH wird je nach Szenario unterschiedlich simuliert. Die Planungs Formeln Giminaro et al. Entwickelt wurden, können verwendet werden, um die entsprechende Masse an Uran für eine gegebene Probe 13, wie im Abschnitt "Sample Aktivierung" von diesem Papier zu wählen. Auch kann Uranoxid (UO 2 oder U 3 O 8) anstelle von UNH verwendet werden, wenn verfügbar, und der Massenanteil von 235 U<...
Offenlegungen
This work was performed under grant number DE-NA0001983 from the Stewardship Science Academic Alliances (SSAA) Program of the National Nuclear Security Administration (NNSA).
Danksagungen
Portions of this study have been previously published in the Journal of Radioanalytical and Nuclear Chemistry.3,13 A patent is pending for this method.
Materialien
| Name | Company | Catalog Number | Comments |
| High Temperature Furnace (HTF) | Carbolite | HTF 18 | 1,800 °C HTF used to melt samples |
| High Temperature Drop Furnace | CM Inc. | 1706 BL | 1,700 °C Drop Furnace used to melt samples |
| Graphite Crucibles | SCP Science | 040-060-041 | 27 ml high purity graphite crucibles (10 pack) |
| Crucible Tongs | Grainger | 5ZPV0 | 26 in., stainless steele tongs for handling crucibles |
| Heat Resistent Gloves | Grainger | 8814-09 | Gloves used to protect hands from heat during sample intro/removal |
| Mortar & Pestle | Fisherbrand | S337631 | 300 ml, Ceramic mortar and pestle for powdering and mixing |
| Micro Balance | Grainger | 8NJG2 | 220 g Cap, high precision scale for measuring powder mass |
| Spatulas | Fisherbrand | 14374 | Metal spatulas for measure small quantities of powder |
| SiO2 | Sigma-Aldrich | 274739-5KG | Quartz Sand CAS Number: 14808-60-7 |
| Al2O3 | Sigma-Aldrich | 11028-1KG | Aluminum Oxide Powder CAS Number: 1344-28-1 |
| CaO | Sigma-Aldrich | 12047-2.5KG | Calcium Oxide Powder CAS Number: 1305-78-8 |
| FeO | Sigma-Aldrich | 400866-25G | Iron Oxide Powder CAS Number: 1345-25-1 |
| MgO | Sigma-Aldrich | 342793-250G | Magnesium Oxide Powder CAS Number: 1309-48-4 |
| Na2O | Sigma-Aldrich | 36712-25G | Sodium Oxide Powder CAS Number: 1313-59-3 |
| KOH | Sigma-Aldrich | 278904-250G | Potasium Hydroxide Pellets CAS Number: 12030-88-5 |
| MnO | Sigma-Aldrich | 377201-500G | Manganese Oxide Powder CAS Number: 1344-43-0 |
| TiO2 | Sigma-Aldrich | 791326-5G | Titanium Oxide Beads CAS Number: 12188-41-9 |
Referenzen
- Carnesdale, A. . Nuclear Forensics: A Capability at Risk (Abbreviated Version). , (2010).
- Garrison, J. R., Hanson, D. E., Hall, H. L. Monte Carlo analysis of thermochromatography as a fast separation method for nuclear forensics. J Radioanal Nucl Chem. 291 (3), 885-894 (2011).
- Molgaard, J. J., et al. Development of synthetic nuclear melt glass for forensic analysis. J Radioanal Nucl Chem. 304 (3), 1293-1301 (2015).
- Fluegel, A. Modeling of Glass Liquidus Temperatures using Disconnected Peak Functions. , (2007).
- Oldham, C. J., Molgaard, J. J., Auxier, J. D., Hall, H. L. Comparison of Nuclear Debris Surrogates Using Powder X-Ray Diffraction. , (2014).
- Liezers, M., Fahey, A. J., Carman, A. J., Eiden, G. C. The formation of trinitite-like surrogate nuclear explosion debris ( SNED ) and extreme thermal fractionation of SRM-612 glass induced by high power CW CO 2 laser irradiation. J Radional Nucl Chem. 304 (2), 705-715 (2015).
- Harvey, S. D., et al. Porous chromatographic materials as substrates for preparing synthetic nuclear explosion debris particles. J Radioanal Nucl Chem. 298 (3), 1885-1898 (2013).
- Hanni, J. B., et al. Liquidus temperature measurements for modeling oxide glass systems relevant to nuclear waste vitrification. J Mater Res. 20 (12), 3346-3357 (2005).
- Weber, W. J., et al. Radiation Effects in Glasses Used for Immobilization of High-Level Waste and Plutonium Disposition. J Mater Res. 12 (8), 1946-1978 (1997).
- Eby, N., Hermes, R., Charnley, N., Smoliga, J. A. Trinitite-the atomic rock. Geol Today. 26 (5), 180-185 (2010).
- Bellucci, J. J., Simonetti, A. Nuclear forensics: searching for nuclear device debris in trinitite-hosted inclusions. J Radioanal Nucl Chem. 293 (1), 313-319 (2012).
- Ross, C. S. . Optical Properties of Glass from Alamogordo, New Mexico. , (1948).
- Giminaro, A. V., et al. Compositional planning for development of synthetic urban nuclear melt glass. J Radional Nucl Chem. , (2015).
- Cook, M. T., Auxier, J. D., Giminaro, A. V., Molgaard, J. J., Knowles, J. R., Hall, H. L. A comparison of gamma spectra from trinitite versus irradiated synthetic nuclear melt glass. J Radioanal Nucl Chem. , (2015).
- Fahey, J., Zeissler, C. J., Newbury, D. E., Davis, J., Lindstrom, R. M. Postdetonation nuclear debris for attribution. Proc Natl Acad Sci U S A. 107 (47), 20207-20212 (2010).
- Bellucci, J. J., Simonetti, A., Koeman, E. C., Wallace, C., Burns, P. C. A detailed geochemical investigation of post-nuclear detonation trinitite glass at high spatial resolution: Delineating anthropogenic vs. natural components. Chem Geol. 365, 69-86 (2014).
- Donohue, P. H., Simonetti, A., Koeman, E. C., Mana, S., Peter, C. Nuclear Forensic Applications Involving High Spatial Resolution Analysis of Trinitite Cross-Sections. J Radioanal Nucl Chem. , (2015).
- Eaton, G. F., Smith, D. K. Aged nuclear explosive melt glass: Radiography and scanning electron microscope analyses documenting radionuclide distribution and glass alteration. J Radioanal Nucl Chem. 248 (3), 543-547 (2001).
- Kersting, A. B., Smith, D. K. . Observations of Nuclear Explosive Melt Glass Textures and Surface Areas. , (2006).
- . . IAEA Safeguards Glossary. , (2001).
- Glasstone, S., Dolan, P. . Effects of Nuclear Weapons. , (1977).
- Carney, K. P., Finck, M. R., McGrath, C. A., Martin, L. R., Lewis, R. R. The development of radioactive glass surrogates for fallout debris. J Radioanal Nucl Chem. 299 (1), 363-372 (2013).
- Molgaard, J. J., Auxier, J. D., Hall, H. L. A Comparison of Activation Products in Different Types of Urban Nuclear Melt Glass. , (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten