Method Article
Vergleichende Analyse von Human Growth Hormone im Serum Mit SPRi, Nano-SPRi und ELISA-Assays
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorgeschlagene Arbeits beurteilt die diagnostische Potential der direkten und verstärkten Oberflächenplasmonresonanz-Bildgebung (SPRi) Assays, insbesondere für den Nachweis von rekombinantem Human-Wachstumshormon in Stachelhumanserum, durch Vergleichen SPRi führt direkt mit im Handel erhältlichen Enzym-linked Immunosorbent Assay (ELISA) kit.
Zusammenfassung
Empfindliche und selektive Methoden zum Nachweis von humanem Wachstumshormon (hGH) über einen weiten Konzentrationsbereich (hohe 50-100 ng ml - 1 und Mindestmengen von 0,03 ng ml - 1) im zirkulierenden Blut sind wichtig als variable Ebenen kann zeigen veränderte Physiologie. Beispielsweise können Wachstumsstörungen im Kindesalter auftretenden durch Messen Niveaus an hGH im Blut diagnostiziert werden. Auch der Missbrauch von rekombinanten hGH im Sport stellt nicht nur eine ethische Frage es stellt auch schwerwiegende gesundheitliche Gefahren für die Täter. Eine beliebte Strategie zur Messung hGH Missbrauch, beruht auf dem Nachweis des Verhältnisses von 22 kDa hGH Gesamt hGH als nicht 22 kDa endogenen fallen nach exogene rekombinante hGH (rhGH) Verabreichung. Oberflächen-Plasmon-Resonanz-Tomographie (SPRi) ist ein analytisches Werkzeug, das direkte (markerfreie) Überwachung und Visualisierung von biomolekularen Wechselwirkungen können durch die Aufnahme Änderungen des Brechungs index angrenzend an die Sensoroberfläche in Echtzeit. Im Gegensatz dazu ist die am häufigsten verwendete kolorimetrische Methode, Enzyme-linked Immunosorbent Assay (ELISA) verwendet Enzym-markierten Nachweis-Antikörper zur indirekten Messung der Analytkonzentration nach der Zugabe eines Substrats, das eine Farbänderung hervorruft. Um die Nachweisempfindlichkeit zu erhöhen, nutzt verstärkt SPRi einen Sandwich-Assay-Format und in der Nähe von Infrarot-Quantenpunkten (QDs), um die Signalstärke zu erhöhen. Nach der direkten SPRi Detektion von rekombinantem rhGH in Stachelhumanserum wird die SPRi Signal durch die sequentielle Injektion von Nachweisantikörper mit Nahinfrarot-QP (Nano SPRi) beschichtet amplifiziert. In dieser Studie wurde das diagnostische Potential der direkten und amplifiziert SPRi zum Messen rhGH in Humanserum versetzt und im direkten Vergleich mit den Fähigkeiten eines kommerziell erhältlichen ELISA-Kits bestimmt.
Einleitung
Menschliches Wachstumshormon (hGH) ist ein 191-Aminosäuren-Peptid (22 kDa) durch die Hirnanhangdrüse produziert und direkt in den Blutstrom freigesetzt. Wechselwirkungen zwischen dem Hypothalamus Peptid Wachstumshormon-freisetzendes Hormon (GHRH) und Somatotropin induzieren pulsatilen Sekretionen von hGH. Als Ergebnis HGH variieren von Höhen in den 50-100 ng / ml bis Tiefs in der 0,03 ng / ml-Bereich 1. Mangel oder Überschuss an hGH im Körper kann eine Vielzahl von abnormalen physiologischen Symptome hervorrufen. Beispielsweise kann überschüssige Niveaus von HGH zu Gigantismus 2 und 3 Diabetes führen kann. Abgereichertes HGH verursachen niedrigen Blutzuckerspiegel bei Neugeborenen und schwache Knochendichte und Depression bei Erwachsenen 4.
Die Verabreichung des rekombinanten Form von hGH (rhGH) verbessert die Muskelmasse bei gleichzeitiger Reduzierung des Körperfetts. Als solches wurde diese Substanz das Mittel der Wahl für den professionellen und Amateur-Sportler, wie es körperliche Kraft, die eine adv verleiht verbessertantage im Leistungssport. rhGH wird von der Welt-Anti-Doping-Agentur (WADA) 5,6 und viel Aufwand von internationalen Forschern hat sich auf die Entwicklung Tests, die seine Anwesenheit oder anabole Wirkung erkennen kann konzentriert wurde gesperrt.
Enzyme-linked Immunosorbent Assay (ELISA) ist die bevorzugte Methode für die Bestimmung von hGH in Vollblut 7. Zwar ist ELISA eine zuverlässige Technik mit guter Empfindlichkeit und Selektivität, ist es relativ zeit- und arbeitsintensiv. Ferner nennt ELISA für die indirekte Detektion von hGH durch Verwendung enzymatischen Tags. Im Gegensatz dazu, Oberflächenplasmonresonanz (SPR) erlaubt den Nachweis von hGH direkt ohne die Verwendung von Etiketten in Echtzeit. Das Detektionsprinzip hinter SPR beinhaltet eine Erfassungsoberfläche, die aus einem Prisma, das mit einer dünnen Metallschicht (Gold oder Silber) überzogen ist; wenn ein monochromatisches polarisiertes Licht mit der Metalloberfläche in Wechselwirkung tritt, werden als "Oberflächenplasmonen" generiert. Die Bindung eines Analytenan einen Oberflächenrezeptor auf der Metalloberfläche immobilisiert beeinflusst die Resonanzbedingungen, was zu einer verschobenen Resonanz Dip, die dann auf die Konzentration des Analyten korreliert werden kann. SPR-Biosensoren sind jetzt im Handel erhältlich, die eine Echtzeit-Label freie Technik, um biomolekulare Bindungsereignisse und biochemische Reaktionen 8-10 Überwachung bieten. In jüngerer Zeit SPRi wurde als Antwort auf den Bedarf zum Multiplexen entwickelt (dh Überwachung mehrerer Bindungsereignisse gleichzeitig), die nicht in der klassischen SPR-Biosensoren möglich war. Somit hat SPRi als Werkzeug mehrere Bindungsereignisse gleichzeitig überwachen taucht. Strom SPRi Systeme basieren auf der mikroskopischen Abbildung einer Oberfläche, die mit Licht in einem bestimmten Winkel und der Wellenlänge 10 angeregt wird, berechnet. Das Bild wird dann auf eine ladungsgekoppelte Einrichtung (CCD) erfasst.
Bisher gibt es ein paar SPR basierenden Assays entwickelt, um zu erkennen hGH 11-14. Eine besondere StrategieAls Isoform Methode 15 bekannt ist, beruht auf dem Nachweis des Verhältnisses von 22 kDa hGH Gesamt hGH, die als nicht-22-kDa endogenen fallen nach exogene rhGH Verabreichung. Kurzem de Juan-Franco et al. 11, auf die Entwicklung eines SPR basierenden Immun zum selektiven Nachweis des 22 kDa und 20 kDa-hGH-Isoformen in humanen Serumproben berichtet. Spezifisch für jede Isoform monoklonalen Antikörper wurden direkt auf den Goldsensor gleichzeitig ermöglicht die Messung beider Isoformen in einer einzigen Injektion mit einer Nachweisgrenze von 0,9 ng ml -1 immobilisiert. Alternativ SPR verwendet wurde, um Antikörper mit hoher Spezifität an hGH 13 screenen. Wenn die Konzentration des Zielanalyten unterGrenze des SPRi Systems Nachweis (16-19 v dokumentiertarious Arten von Analyten und Oberflächen.
In dieser Arbeit wurde die analytische Potential des SPRi und Nano SPRi Biosensoren untersucht, insbesondere für den Nachweis von rhGH in Stachelhumanserum und Vergleich seiner Erkennungsfähigkeit direkt ELISA. Die folgenden Parameter werden überprüft und berücksichtigt werden: Erfassungszeit, Empfindlichkeit, kinetische Profil, Reproduzierbarkeit und Spezifität.
Protokoll
1. Herstellung von Lösungen und Protein-Proben für SPRi
- Vorbereitung 100 ml Niedrigsalz phosphatgepufferter Kochsalzlösung (PBS), die 10 mM Phosphat, 150 mM Natriumchlorid und pH 7,4.
- Vorbereitung 50 ml Hochsalz PBS-Lösung, die 10 mM Phosphat, 750 mM Natriumchlorid und pH 7,4.
- Vorbereitung 5 ml 10 mM Natriumacetat.
- Bereiten Sie eine Bestandsaufnahme der 5 mg / ml Rinderserumalbumin (BSA) in PBS niedrigen Salzlösung verdünnt.
- Wird eine Stammlösung des rekombinanten humanen Wachstumshormons (rhGH) bei einer Konzentration von 1 ug / ml in PBS niedrigen Salzlösung.
- Stammlösungen von Anti rhGH und negativer Kontrollantikörper bei einer Konzentration von 100 ug / ml.
2. Bereiten Sie SPRi Chip für Antikörper Array
- Den Chip durch Beschallung in 120 ml stabilisierte Piranha-Lösung (3: 1 konzentrierter Schwefelsäure zu 30% Wasserstoffperoxid) 90 Minuten bei 50 ° C und folgen durch Spülenund Ultraschallbehandlung mit Wasser für 5 min. Dann spülen Chip mit Ethanol und mit Stickstoff trocken-Stream.
- Setzen Sie die Goldchip in einem UV / Ozon-Kammer für 30 Minuten, um alle Verunreinigungen zu entfernen.
- In 150 mg von 11-Mercaptoundecansäure zu 20 ml Ethanol in einem Reagenzglas, das einen Rührstab und eine Rohrkappe enthält.
- Zeigen Chip im Reagenzglas und Mikrowellenröhre / Chip bei 50 W und 50 ° C für 5 min.
- Spülen-Chip mit Ethanol und genießen in Ethanol für 5 min.
- Folgen Sie von einer Spülung mit Wasser und in Wasser einweichen für 5 min.
- In 150 mg 1-Ethyl-3- (3-dimethylaminopropyl) carbodiimid bis 20 ml Wasser in einem Reagenzglas, das einen Rührstab und eine Rohrkappe enthält. Mikrowellen-Chip, wie in Schritt 2.4.
- Spülen Chip mit Wasser und in Wasser einweichen für 5 min.
- In 150 mg N-Hydroxysuccinimid in 20 ml Wasser in einem Reagenzglas, das einen Rührstab und eine Rohrkappe enthält. Mikrowellen-Chip, wie in Schritt 2.4.
- Spülen Chip mit Wasser und in Wasser einweichen für 5 min.
- Prepare 250 uM Polyethylenglykol (PEG 800 Da) in 20 ml Wasser in einem Reagenzglas, das einen Rührstab und eine Rohrkappe enthält. Mikrowellen-Chip, wie in Schritt 2.4.
Anmerkung: In der Mikrowelle PEG800 auf der Oberfläche des Sensors wird als Blockierschritt zu verhindern unspezifische Bindung von Serumproteinen und Quantenpunkt Komplexe später im Experiment verwendeten durchgeführt. Dies wird durch PEG800 Reaktion mit nicht-besetzten blanken Goldstellen auf dem Chip erreicht. - Spülen Chip mit Wasser und in Wasser einweichen für 5 min.
- Bereiten Sie 15 ug / ml von Anti-rhGH-Antikörperlösung und negative Kontroll Lösung von anti-Immunglobulin G (anti-IgG) und fügen Sie 10 ul jeder Antikörperlösung zu einem gut in der 384-Well-Platte.
- Gestalten Sie das Fleckenmuster in der Microarrayers (4 x 7 Quadranten für jede Probe) und Spot-Chip mit Antikörpern unter Verwendung eines 500 & mgr; m Teflon gekippt Stift.
- Inkubieren spotted Chip 2 h lang bei RT und unter einer feuchten Atmosphäre von 75% oder mehr.
- Spülen Sie und genießen Chip in Wasser5 Minuten. Dann trockene Chip mit Stickstoffstrom.
3. SPRi Experiment Setup- und Blockieren
- Initialisieren Sie das Gerät und wählen Sie Verzeichnis. Wählen Sie Echtzeit-Kamera und starten Sie die Spritzenpumpe mit 1 ml / min für 10 ml entgastem Wasser. Legen Chip in das Gerät und halten Einspritzen von Wasser, bis alle Luftblasen entfernt werden.
- Nach dem Spülen Chip mit 10 ml Wasser, startet die Bildaufnahme, und folgen Sie durch Umschalten der Puffer geringer Salz PBS und lassen Sie sie in 1 ml 5 ml und dann langsame Fließgeschwindigkeit bis zu 20 & mgr; l für 20 Minuten laufen / min / min .
- Wählen Sie das kontrastreiche Bild, das die immobilisierten Antikörper auf dem Chip gesichtet zeigt.
- Wählen und definieren Sie die 400 um einzelne, runde Flecken, die den immobilisierten Antikörpern.
- Nachdem das Instrument verfolgt die Plasmon-Kurven, wählen Sie einen Arbeitswinkel, der die höchste Steigung in den Reflektivitätskurven hat.
- Fließt ein Laufpuffer bei 20 & mgr; l / min niedriger sAlt PBS durch das System, bis das Signal von allen ausgewählten Spots stabilisiert.
- Laden der BSA (100 ug / ml) in Pufferlösung in die Probenschleife (150 ul) mit dem Einspritzventil in der Ladeposition. Schaltet dann das Ventil in die Einspritzposition, um die Lösung zu der Durchflusszelle zu injizieren.
Anmerkung: BSA injiziert, um kovalent an das Amin-reaktive Oberfläche zu binden, wird die verbleibende nicht gebundene BSA die Oberfläche über Pufferspülung abzuwaschen. - Injizieren 150 ul einer Lösung aus 10 mM Natriumacetat, über die Oberfläche und folgen durch eine 150 & mgr; l Injektion von hohen Salz PBS.
- Injizieren 150 ul Ethanolamin (1 mM), das Amin reaktive Oberfläche zu deaktivieren.
- Injizieren 150 ul 10 mM Natriumacetat, um die Oberfläche zu waschen.
- Dann schaltet der Laufpuffer in PBS mit 50 ug / ml BSA bei einer Fließgeschwindigkeit von 250 ul / min für insgesamt 5 ml.
Anmerkung: 50 ug / ml BSA zu dem Laufpuffer zusätzliche Sperrung des sur hinzugefügtFläche durch nicht-kovalent besetzen die nicht-spezifischen Stellen und dies wird durchgeführt, um weiter zu verringern unspezifische Bindung von Serumproteinen an die Oberfläche. - Ändern Flussrate bis 5 & mgr; l / min und lassen Sie es 20 Minuten lang stabilisieren.
4. SPRi Nachweis von Human Growth Hormone
- Vorbereitung einer Lösung aus einem festgelegten Konzentration von rhGH (30.000 pg / ml, 250 pg / ml; 25 pg / ml, 2,5 pg / ml und 0,25 pg / ml) in 10% Serum und in PBS, das 1 mg / ml BSA verdünnt.
- Vorbereitung einer 2: 1-Lösung durch Zugabe von 1 & mgr; l Biotin-markierten anti-rhGH Nachweis-Antikörper (6 & mgr; M) bis 3 & mgr; l Streptavidin in einem 0,5 ml Mikrozentrifugenröhrchen überzogen nahen Infrarotquantenpunkten (1 uM) und Inkubation für 30 min für eine effektive Kopplungs .
- Injizieren 150 ul des hGH versetzt Humanserum-Lösung in der Injektionsschleife. Dies führt zu einer starken Zunahme des Signals, gefolgt von einem langsamen Rückgang der unspezifisch gebundenen Serum Abspülen der Oberfläche.
- Sobald das Zeichenal stabilisiert, Waschen der Oberfläche mit einer Lösung von 450 mM Natriumchlorid zu dem Laufpuffer zugegeben.
- Verdünnen der Lösung des anti-rhGH Nachweisantikörper und Quantenpunkte auf eine Konzentration von 10 nM (2: 1) mit Laufpuffer (PBS mit 50 ug / ml BSA) und die Injektion in die Flußzelle.
5. SPRi Datenanalyse
Anmerkung: Nach der Injektion des rhGH versetzt Humanserum und Quantenpunktverstärker eine Steigerung Reflexionsänderung tritt aufgrund der verstärkten Verschiebung der Plasmonen Kurven. Dies führt zu einem Differenzbild, das eine Graustufenbild in Korrelation zu dem Signal auf dem Chip.
- Importieren Sie die Daten in ein Datenanalyseprogramm. Zeichnen Sie die SPRi Signal (% Reflexionsvermögen) gegen die Zeit (en) und bestimmen den Unterschied zwischen der anti-rhGH und negativen Kontrollantikörper-Spots nach dem hohen Salzwäsche.
6. ELISA-Protokoll (Tag 1)
- Bewahren Sie alle Assaykomponenten in die rhGH ELISA Kit bei 2-8 ° C. Dazu gehört auch die anti-rhGH-Antikörper beschichtet Well-Platten, Standards (0-5) in Schafserum, Kontrollen (1 & 2) in Humanserum, Konjugat-Puffer, (200x) Waschpuffer, TMB Chromogen (Tetramethylbenzidin) und Stopp-Reagenz.
- Setup die Reagenzien und folgen Sie den Verfahren, wie sie in der kommerziellen ELISA-Kit-Protokoll beschrieben.
- Erstens kann der anti-rhGH-Antikörper beschichtet 96 Vertiefungen auf RT vor dem Öffnen der Folienverpackung zu wärmen.
- Entfernen Sie dann die gewünschte Anzahl von 8-Well-Streifen für einen Assay und verschließen Sie die Folienverpackung und die restlichen Vertiefungen und bei 2-8 ° C.
- Vorbereitung von Standard durch Rekonstitution in 2 ml destilliertem Wasser für Standard # 0, in 1 ml destilliertem Wasser für Standards (1-5) und in 1 ml destilliertem Wasser für die Steuerelemente (1 & 2). Unten ist eine Tabelle mit den entsprechenden Konzentrationen der Standards und Kontrollen (Tabelle 1):
| Standards | Konzentration (ng / ml) |
| 0 | 0 |
| 1 | 0,17 |
| 2 | 0.94 |
| 3 | 2.63 |
| 4 | 10.4 |
| 5 | 26,9 |
| Control # 1 | 1,22 ± 0,33 ng / ml |
| Control # 2 | 4,97 ± 1,25 ng / ml |
Tabelle 1. Die Konzentrationen der Standards und Kontrollen im Handel erhältlichen ELISA-Kit enthalten.
- Vorbereitung der Proben, die der rhGH Hormon in 10% Humanserum bei den folgenden Konzentrationen (Tabelle 2) besteht aus:
| Beispiel | Konzentration (ng / ml) |
| 1 | 0,025 |
| 2 | 0,2 |
| 3 | 0,5 |
| 4 | 2.5 |
| 5 | 10 |
| 6 | 30 |
Tabelle 2 Konzentrationen der rhGH-Proben in 10% Serum hergestellt.
- In 50 ul jeder Standard, Kontrolle und Probe in jede Vertiefung (dreifach). Versiegeln Sie die Vertiefungen pipettieren und mit den Standards, Kontrollen und Proben rhGH O / N bei 4 ° C unter leichtem Schütteln.
7. ELISA-Protokoll (Tag 2)
- Die Platte aus dem Shaker und lassen Sie ihn auf Raumtemperatur (15-20 min), bevor es mit dem Test fortfahren zu wärmen.
- Entfernen Sie den Anti-rhGH-HRP, Konjugat-Puffer, Waschpuffer (200x), Chromogen TMB (Tetramethylbenzidin), eined Stoppreagenz aus dem Kühlschrank nehmen und Erwärmen auf RT.
- Vorbereitung der Reagenzien: (laut Herstellerangaben)
- Verdünnen Sie die Anti-rhGH-HRP 40x mit dem Konjugat-Puffer. Bereiten Sie den Waschpuffer durch Verdünnung von 200x mit destilliertem Wasser.
- In 50 ul Anti-rhGH-HRP-Konjugat in jedes Well, versiegeln die Brunnen und Inkubation bei RT für 30 min unter leichtem Schütteln.
- Dekantiert man die Lösung aus den Vertiefungen und die Platte umdrehen und tippen trocken auf ein saugfähiges Gewebe. Dann fügen Sie 200 ul Waschpuffer in jede Vertiefung.
- Dekantiert man die Waschlösung und tippen Trocken auf ein saugfähiges Gewebe. Wiederholen Sie diesen Schritt 3 mal.
- 100 l Chromogen in jede Vertiefung innerhalb von 15 Minuten nach dem Waschschritt. Inkubation für 30 min bei RT im Dunkeln unter leichtem Schütteln. Die Lösungen drehen von farblos nach blau.
- 100 l des Stop-Reagenz in jedes Well. Die Lösungen drehen von blau nach gelb. Unmittelbar, lesen the Extinktion jeder Vertiefung bei 450 nm mit einem Mikroplatten-Reader.
- Zeichnen Sie die Standardkurve für die vorgesehenen Standards (0-5). Dann plotten die optische Dichte des rhGH in 10% Serumproben gegen die Konzentration jeder Probe.
Ergebnisse
Die Leistung SPRi und Nano SPRi (SPRi Verwendung der NanoEnhancers) wurde mit ELISA für den Nachweis von rhGH in einer komplexen Umgebung verglichen. Die Unterschiede im Aufbau dieser Methoden werden hier kurz beschrieben. Für SPRi (direkter Nachweis, Abbildung 1), wird der Capture-Antikörper auf der Oberfläche immobilisiert und dann die Probe injiziert und die Bindung des Analyten an die Sensoroberfläche direkt in Echtzeit und markierungsfreie Weise gemessen. Jedoch mit Nano-SPRi (Abbildung 1), nachdem der Analyt bindet an die Sensorfläche, eine aufeinanderfolgende Injektion mit Quantenpunkten mit Nachweis-Antikörper beschichtet ist, um das Signal zu verstärken SPRi gefolgt.
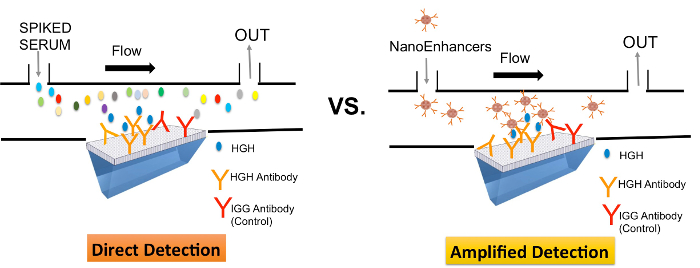
Abbildung 1 ist eine schematische Darstellung, die im Direktmodus (SPRi) und verstärkt-mode (Nano-SPRi) der Nachweis von rhGH in c rude Proben. Liganden (rhGH oder IgG-spezifischen Antikörpern) wurden in einem Array-Format auf der SPRi Biochip immobilisiert. Zielprotein (rhGH) versetzt in Humanserum an die Sensoroberfläche eingebracht werden direkt erfasst (SPRi) und der Reihe nach markiert mit NanoEnhancers (Nano-SPRi). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Wie für ELISA wurden die Mikrotiterplatten ankommen bereits Einfangantikörper vor, funktionalisiert und dann Probe eingeführt wird, die Analyten von Interesse binden. Nachweisantikörper eingeführt wird, gefolgt von der Substratzugabe. Die optische Dichte bei 450 nm gemessen. In dieser Studie wurde ein kommerzieller ELISA-Kits (2) zum Messen rhGH versetzt in 10% Humanserum.
8 / 53508fig2.jpg "/>
Figur 2 Eine schematische Darstellung des ELISA-Testverfahren. rhGH Protein (blaue Ovale) wird in die Vertiefungen, die mit monoklonalen Antikörpern (gelb), spezifisch für rhGH vor, eine funktionalisierte eingeführt. Unspezifische Wechselwirkungen werden durch Spülen der Vertiefungen mit Waschpuffer, gefolgt von der Einführung eines Nachweisantikörper mit Meerrettich-Peroxidase (HRP, violett) vorab funktionalisierten eliminiert. Die Lösung wird in der Farbe nach der Zugabe des Substrats Tetramethylbenzidin (TMB, Gold) zu ändern. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Figur 3 zeigt die Titrationskurve von rhGH in 10% Humanserum, und wird gegen die erhaltenen OD bei 450 nm aufgetragen. Eine gute lineare Reaktion beobachtet, und die Nachweisgrenze bestimmt wurde 1 ng / ml liegen. Der Koeffizient der variation (CV) betrug 6,5% was auf eine gute Reproduzierbarkeit.
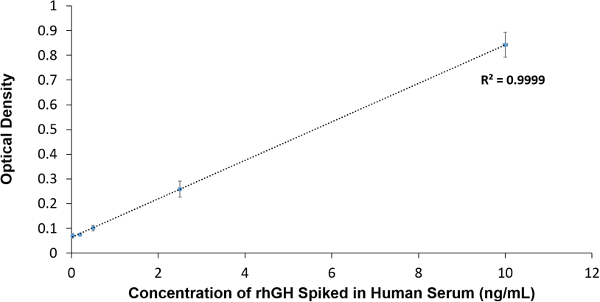
Abbildung 3. ELISA-Daten-Analyse. Die Konzentration von rhGH versetzt im Serum gegen die erhaltenen OD bei 450 nm aufgetragen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Als nächstes wurde der Nachweis von rhGH in Humanserum aufgestockt mit SPRi beurteilt. Direkten Nachweis von rhGH führte mit der entsprechenden Konzentrationsgradienten-Kurve (Abbildung 4), stellt jeder Punkt des Durchschnittswertes des Reflexionsunterschied von drei SPRi Kinetikkurven für jede Konzentration berechnet. Die Nachweisgrenze (LOD) wurde festgestellt, 3,61 ng / ml. Die SPRi direkten Nachweis Assay war in hohem Maße reproduzierbar wie die CV des Assayswar nur 4,1%.
Figur 4. Direkte SPRi Nachweis von hGH in 10% Humanserum versetzt. Das sich ergebende normalisierte SPRi kinetische Stück nach der Injektion verschiedener Mengen von hGH versetzt in Humanserum gefolgt von der Injektion eines Hochsalzpuffer (gestrichelte vertikale Linie) zur Entfernung nicht spezifische Wechselwirkungen. Ein Konzentrationsgradienten Kurve, die die Bindung von verschiedenen Mengen an hGH in menschlichem Serum auf die Sensorfläche, die mit biotinyliertem hGH-spezifischen-Antikörper vorab funktionalisierten wurde versetzt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Um die Empfindlichkeit des Biosensors SPRi zu erhöhen, NanoEnhancers (QDs vorab funktionalisierten mit Detektionsantikörper) der Reihe nach inauf der Sensoroberfläche, um das Vorhandensein von rhGH markieren eingeführt versetzt im Humanserum. Nach Subtraktion des Hintergrunds wurden die NanoEnhancers Lage, den Biosensor Gang bis zu 7,9% zu verstärken, jedoch mit minimaler Signalwechsel (Immunoglobulin G (IgG) -spezifischen Antikörpers, 0,38% Änderung der Reflexionsfähigkeit; Abbildung 5 auf kontrollierte Regionen von Interesse Bildgebung. die Sensorfläche ergab, dass nur Regionen von Interesse, die rhGH-spezifische Antikörper immobilisiert haben Erfahrung den größten Kontraständerung erhärten direkt mit der kinetischen Sensorgramm Antwort.
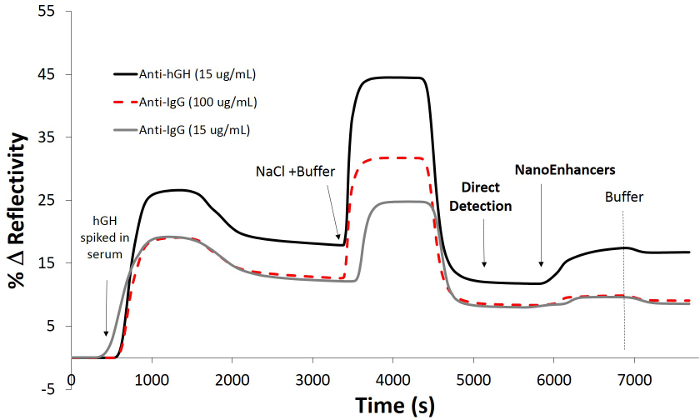
Figur 5. Detektion von rhGH unter Verwendung eines Sandwich-Assay versetzt in 10% Humanserum. SPRi kinetische Stück nach der Injektion von rhGH (30 ng / ml) in Puffer (10 mM PBS, 150 mM Natriumchlorid, pH = 7,4) auf eine vorge funktionalisierten Chip mit 11-Mercaptoundecansäure / rhGH-spezifischen Antikörper und Kontroll-IgG-Antikörper anschließend mit BSA, gefolgt von der Zugabe von Nachweis-Antikörper-beschichteten Quantenpunkte (NanoEnhancers) gesperrt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Um die Durchführbarkeit des Nano-SPRi Biosensor zu demonstrieren, wurde der Messbereich von rhGH in rohem Proben beurteilt. Einen erweiterten Arbeitsbereich von 30.000 pg / ml bis 0,25 pg / ml ergab sich als Reaktion auf die Zugabe von NanoEnhancers (Abbildung 6). Es ist erwähnenswert, dass jeder Punkt auf der Titrationskurve von drei unabhängigen Experimenten gemittelt. Folglich wird die untere Nachweisgrenze wurde berechnet und betrug 9,20 pg / ml, und der Variationskoeffizient betrug 20%.
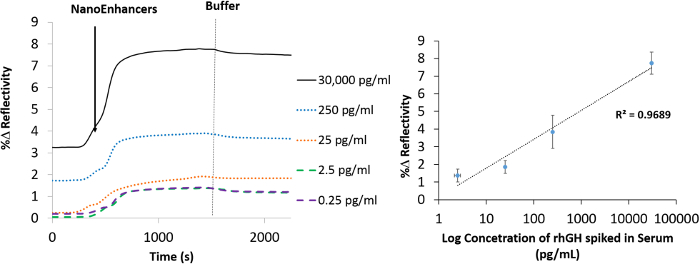
Figur 6.Nano-SPRi Nachweis von hGH versetzt in humanem Serum. Normalized SPRi kinetische Plot Darstellung hGH_specific_Anti-QDs-verstärktes Signal für die menschliche Serumproben gespickt mit verschiedenen Konzentrationen von hGH. Eine vertikale gestrichelte Linie (grau) den Einspritzzeitpunkt des Laufpuffers. (b) Ein Konzentrationsgradient Kurve, die die Bindung von NanoEnhancers (hGH_specific_Anti-QP) nach der Injektion verschiedener Mengen von hGH versetzt in Humanserum an die Sensoroberfläche, die mit 11-Mercaptoundecansäure / hGH-spezifischer Antikörper vorab funktionalisierten wurde. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
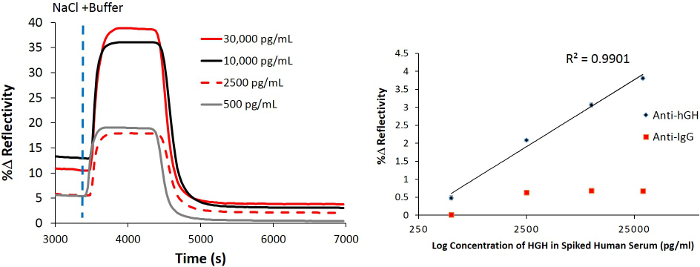
Als nächstes wurde die Veränderung, die in dem SPR-Reflexionsgradkurve in Abhängigkeit von der Konzentration auftritt zwischen dem direkten und dem NanoEnhancer Bioassay-Methode (Figur 7) verglichen. Für die direkte deSchutztechnik zwischen 25 und 0,25 pg / ml, das Signal begonnen, Plateau und das ist nicht überraschend, da diese Konzentrationen liegen unter dem LOD von 3 ng / ml (Abbildung 7). Ebenso für das verstärkte Technik Konzentrationen unterhalb der Nachweisgrenze von 9,2 pg / ml-Signal begonnen, Plateaus und zeigte praktisch keine Veränderung.
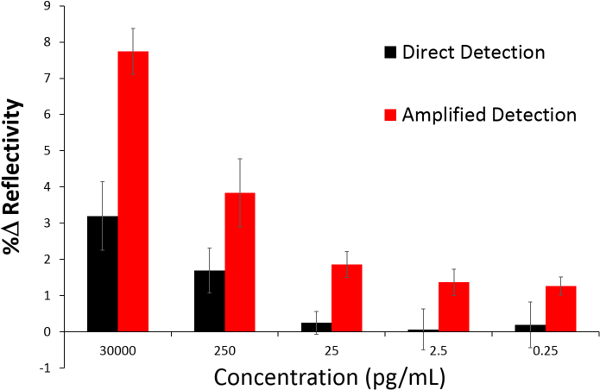
Figur 7. Eine vergleichende Analyse der SPRi mit Nano-SPRi. Das Balkendiagramm zeigt die prozentuale Veränderung der Reflexionsfähigkeit (% R) nach der Einführung von rhGH versetzt in Humanserum (direkter Nachweis), gefolgt von der Injektion von NanoEnhancers (verstärkten Erfassungs) von 30.000 pg / ml, 250 pg / ml, 25 pg / ml, 2,5 pg / ml und 0,25 pg / ml. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Dank der Spezifität der Nano SPRi Biosensor beurteilt. Insulin-like growth factor-1 (IGF-1) versetzt in Humanserum wurde als Kontrolle injiziert da hGH stimuliert die Sekretion von IGF-1 durch den Wachstumshormon-Rezeptor auf der Hepatozyten-Membran. Nach der Injektion von IGF-1 im Serum wurden die NanoEnhancers nacheinander injiziert und das SPR-Signal als Reaktion keinerlei spezifische Bindung (Figur 8) zeigen. Wenn jedoch rhGH versetzt in Serumprobe wurde zu der gleichen Stelle mit rhGH Antikörper funktionalisierten injiziert wurde Signalverstärkung beobachtet. Im Ergebnis hat der Nano SPRi Plattform ausgezeichnete Spezifität und Selektivität für rhGH demonstriert.
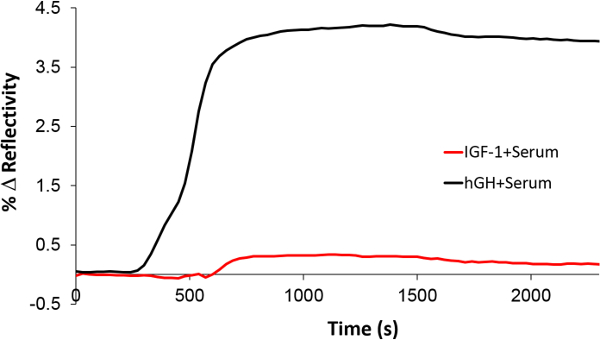
Abbildung 8. Beurteilung der Nano-SPRi Selektivität gegen rhGH. Die Nano-Biosensor SPRi Reaktion nach der Injektion von rhGH (schwarz) und IGF-1 (rot) in sgebückt Serum. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Eine Korrelationsanalyse wurde unter Verwendung des Pearson-Korrelationskoeffizienten, um die Korrelation zwischen der Signalintensität und SPRi ELISA Werte der optischen Dichte (Figur 9) zu bestimmen. Ein p-Wert <0,01 wurde als signifikant angesehen. Wie in diesem Graph gezeigt ist, gibt es eine gute Korrelation zwischen den rhGH Ebenen spiked menschlichen Serum durch SPRi und ELISA gemessen. Der R-Wert war 0,9263 9 verschiedenen Proben.
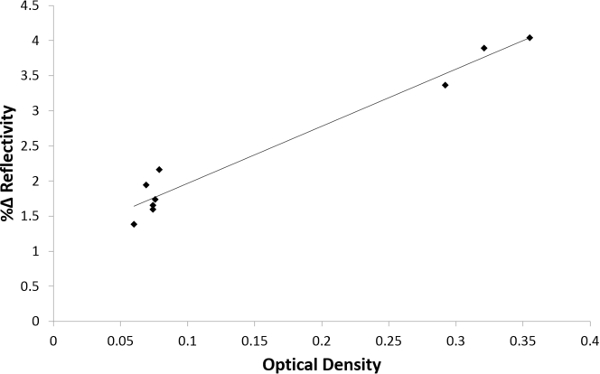
Abbildung 9. Pearson Korrelationsanalyse zwischen ELISA und Nano-SPRi. Das Grundstück korreliert Nano-SPRi Signalintensität (y-Achse) mit ELISA optische Dichte (x-Achse) Werte. (Pearsauf Korrelationskoeffizient n = 9, r = 0,9263, p = 0,00000183). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Die Gleichgewichts-Dissoziationskonstante (K D) wurde unter Verwendung des GraphPad-Software für ELISA bestimmt. Die berechnete K D -Wert betrug etwa 79 nM (Tabelle 3). Die auf (K a) und aus (K d) Raten konnte durch ELISA bestimmt werden. Unter Verwendung der Datenanalyse-Software, führte jedoch die direkte Detektionsmethode mit K D -Wert von 23 pM mit der Molekularmasse von 22 kDa, die einem Molekül entspricht rhGH. Die Ein- und Ausschaltzeiten Raten wurden berechnet auf 6,1 x10 7 M -1 s -1 und 1,33 x 10 -3 s -1, betragen. Dies bedeutet, dass von Natur aus 0,13% des rhGH und Antikörper-Komplexe Zerfall pro Sekunde. Wie für die einmplified SPRi Experiment wurde eine insgesamt stärkere Wechselwirkung zwischen NanoEnhancers und rhGH als berechnete Bindungsaffinität beobachtet wurde bestimmt zu 4,3 pM. Darüber hinaus wurde eine stärkere Assoziationsrate für NanoEnhancers und rhGH als Capture-Antikörper beobachtet / rhGH jedoch die Dissoziationsgeschwindigkeit legt nahe, dass 0,26% der NanoEnhancer / rhGH / Capture Antikörper Zerfall pro Sekunde.
| Verfahren | K D (Affinity) | K a (An-Rate) | K d (off-rate) | LOD |
| ELISA | 79,45 x 10 -9 M | N / A | N / A | 1 ng / ml |
| SPRi | 23,2 x 10 -12 M | 6,1 x 10 7 M -1 s -1 | 1,33 x10 -3 s -1 | 3.61 ng / ml |
| Nano-SPRi | 4,33 x 10 -12 M | 7,54 x10 8 M -1 s -1 | 2,62 x10 -3 s -1 | 0,0092 ng / ml |
Tabelle 3. Voll kinetische Analyse der Daten. Bewertung der Affinität, On-und Off-Rate Rate der Antikörperantworten mit GraphPad (ELISA) und Datenanalyse-Software (SPRi und Nano-SPRi). Die Bestimmung der Avidität mit der Molekularmasse von 22 kDa, die einem Molekül entspricht rhGH wurde gewählt. Die Nachweisgrenzen wurden für alle drei Studien mit Hilfe von Excel ermittelt.
Diskussion
Unregelmäßige HGH, ein natürlich vorkommendes Hormon, haben zu zahlreichen medizinischen Störungen, die menschliche Wachstum und Entwicklung beeinflussen verbunden. Darüber hinaus wird die exogene Verabreichung von rhGH üblicherweise von Sportlern verwendet werden, auch wenn es verboten ist, als Dotierungsmittel, um ihre Leistung zu verbessern. Herausforderungen bei der Aufdeckung von rhGH Missbrauch Ergebnis aus der Schwierigkeiten bei der Unterscheidung exogene hGH aus endogenen Form. Als solches ist das gültige genehmigte Technik zum Erfassen exogene hGH beruht auf der Messung des Verhältnisses der 22 kDa-hGH-Isoform in Verbindung mit den 20 kDa-Isoform. Da die Isoform Testanforderungen für die Messung von mehreren hGH-Isoformen gleichzeitig innerhalb einer kurzen Zeitspanne in einem weiten Konzentrationsbereich daher als wir die SPRi Plattform als perfekte Ergänzung. Darüber hinaus endogenen hGH Niveau schwanken zu einem sehr niedrigen Niveau (0,03 ng / ml) in den Blutkreislauf muss daher das Detektionssystem in der Lage, diesen Bereich bequem mit hohem sp messenecificity. Als Ergebnis haben wir auch in dieser Studie das Potenzial von Nano-SPRi als diagnostisches Werkzeug für hGH untersucht und verglichen sie direkt mit SPRi und der klassischen Immunoassay ELISA.
Basierend auf den Ergebnissen dieser Studie, ist der Hauptvorteil der SPRi und Nano-SPRi Verfahren, dass rhGH-Konzentrationen können zu einer schnelleren Weise im Vergleich zu den mehr konventionellen Methode ELISA gemessen werden. Ein Standard-Laufzeit für die Messung rhGH Niveaus in einer Probe mit dem direkten Nachweisverfahren wurde 1 h, während die Nano-SPRi benötigt 2 Stunden durch die zusätzlichen Schritte im Prozess. Insgesamt mit SPRi und Nano SPRi Experimenten vor der Injektion einer Probe, einem Kalibrierungsschritt ist sehr empfehlenswert. Darüber hinaus ist die Injektion einer Rohprobe wie Humanserum Ergebnisse in einigen nicht-spezifischen Wechselwirkungen als Ergebnis ist es wichtig, eine hohe Salzwaschpuffer zu injizieren, um nur spezifische Wechselwirkungen zu offenbaren. Es ist auch erwähnenswert, dass ein Waschschritt ist absolut notwendig,nach der Einführung der Sperrmoleküle an die Sensoroberfläche, um ungebundene Moleküle zu entfernen. Wie für ELISA Zeiterfordernisse sind viel größer (~ 16-18 h) für die Analyse einer Probe. Eine längere Inkubationszeit erforderlich ist als die Empfindlichkeit des Assays ist speziell für diese Studie verbessert, da der Schwerpunkt auf die untere Nachweisgrenze zu vergleichen.
Die Wahl der Oberflächenchemie von einer Anwendung zur anderen variieren, und dies könnte als eine Einschränkung des SPRi Technik realisiert werden. In dieser Studie wurde eine Vielzahl und Kombination von chemischen Linkern und Sperrmoleküle bewertet, um die richtige Kombination, um eine optimale Bindungseffizienz von rhGH zur Sensoroberfläche zu beobachten erzielen. Zum Beispiel wird in dieser Studie wurde die Kombination von BSA und PEG diente auch zur Minimierung nicht-spezifischer Interaktionen. Jedoch in einer früheren Studie 17, wobei die Einfangliganden war Aptamere, PEG allein diente als beste Sperr Molekül. Die Variablendaß beeinflussen Bindungseffizienz des Analyten an den Liganden sind auch abhängig von pH-Wert, Puffer und Temperatur. Daher ist bei jeder Anwendung, müssen diese Variablen optimiert werden. Darüber hinaus ist es wichtig, den optimalen Spotting Konzentration des Liganden auf die Chipoberfläche zu bestimmen. Eine Titration Experiment mit einem Konzentrationsbereich von immobilisierten Liganden ist vor Einleitung der Studie durchgeführt. Wie für ELISA, ein entscheidender Schritt in dem Verfahren war es, den Waschpuffer aus den Vertiefungen durch Antippen des Mikrodekantieren, da dies gewährleistet übrig gebliebenen keine Restflüssigkeit. Entfernen der Pufferwasch mit Pipette nicht ausreichend war, wie jede Restflüssigkeit eingemischt mit dem Signallese der Zielstichprobe.
In Bezug auf Empfindlichkeit ist ELISA (1 ng / ml) vergleichbar SPRi (3,61 ng / ml) aber nano-SPRi (9,20 pg / ml) verbessert die Empfindlichkeit um drei Größenordnungen, wodurch die Messungen an den unteren biologischen Ebenen der rhGH 0,03 ng / ml. Wie wir bereits berichtet 16,17, wird die Signalverstärkung durch den NanoEnhancers verliehen einem Massenlasteffekt und die starke Kopplung, die Goldschicht Nanostrukturen zwischen NIR Fluorophore und Vermehrungsoberflächenplasmonen existiert zurückzuführen. Obwohl, fügt Nano-SPRi einen zusätzlichen Schritt der Prozedur, kann dieses Maß an Sensibilität die Anwendungen der SPRi Technologie in verschiedenen Verkaufsstellen erweitern.
SPRi bietet Wissenschaftlern eine umfassende kinetische Profil (K D, K a und K d) von Antikörper / rhGH Interaktion wohin ELISA kann nur Affinitätswerte zu melden. Der Variationskoeffizient (CV) unter 10% lag für SPRi (4,1%) und ELISA (6,5%), was auf eine gute Reproduzierbarkeit. Der ELISA und SPRi Affinitätswerte sind unterschiedlich, weil die Capture-Antikörper auf dem Sensorchip immobilisiert ist verschieden von Antikörpern im ELISA 96-well-Platte immobilisiert sind. Wie für Nano-SPRi eine höhere CV-Wert (20%) beobachtet. Es gibt mehrere Parameter, die als eine Quelle von erro beitragenrs für CV Bestimmung. Beispielsweise mit dem Nano-SPRi Experiment eine viel geringere Konzentration des Analyten gemessen wird, die Zugabe von NanoEnhancers fügt einen weiteren Schritt des Verfahrens und das Experiment wurde manuell durchgeführt. Eine sehr gute Korrelation zwischen der Nano-SPRi und ELISA zum Nachweis von rhGH in Stachelhumanserum gelöst. Schließlich kann ELISA eine zuverlässige Technik jedoch das Verfahren selbst ist zeitaufwendig, was es schwierig macht, in Situationen, in Echtzeitüberwachung und Multiplexen erfordert zu verwenden, wie es der Fall bei hGH macht. Darüber hinaus ist eine weitere attraktive Eigenschaft, die nicht direkt in dieser Studie, die SPRi bietet über ELISA untersucht wurde, ist die Möglichkeit, Hunderte von Wechselwirkungen gleichzeitig in Echtzeit zu messen. Daher in der Zukunft, werden Nano-SPRi Verfahren beurteilt, um mehrere Biomarker gleichzeitig in Echtzeit (Multiplexing) im Serum bei verschiedenen Konzentrationen vorhanden ist, um sein Potenzial als eine tragfähige klinische Diagnose-Tool zu prüfen, zu detektieren.
Offenlegungen
M.G. Sandros is a consultant for Horiba Scientific. She has received honoraria for participation in oral presentations from: Horiba Scientific and Syngenta. The authors have no other relevant affiliations or financial involvement with any organization or entity with a financial interest in or financial conflict with the subject matter or materials discussed in the manuscript apart from those disclosed. No writing assistance was utilized in the production of this manuscript
Danksagungen
NanoManufacturing Innovation Consortium for funding support.
Materialien
| Name | Company | Catalog Number | Comments |
| Somatotropin Growth Hormone (GH1) capture antibody | Acris Antibodies | DM1015 | |
| Bovine Serum Albumin | Fisher Bioreagents | BP671-10 | |
| Biotin labeled Somatotropin Growth Hormone (GH1) detection antibody | Acris Antibodies | AM09304BT-N | |
| 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide | TCI America | D1601 | |
| Ethanolamine | Acros Organics | 141-43-5 | |
| Ethanol | Fisher Chemicals | BP2818-4 | |
| Human HGH ELISA Kit | invitrogen | KAQ1081 | |
| Human Serum | Sigma Aldrich | H4522 | |
| Rabbit IgG Antibody | Sigma Aldrich | I5006 | |
| 11-mercaptoundecanoic acid | Sigma Aldrich | 450561 | |
| Nanostrip | Cyantek | ||
| N-hydroxysuccinimide | Sigma Aldrich | 130672 | |
| Phosphate Buffer Saline | Invitrogen | 00-3002 | |
| Polyethylene glycol (800 Da) | Sigma Aldrich | 729108 | |
| Recombinant Human Growth Hormone | Calbiochem | 869008 | |
| Sodium Acetate | Sigma Aldrich | 127-09-3 | |
| Sodium Chloride | Fisher Chemicals | 7647-14-5 | |
| Streptavidin coated near infrared quantum dots | Life Technologies | Q10171MP | |
| UV/Ozone Procleaner | Bioforce Nanosciences | ||
| Microwave reactor | CEM Corporation | Discover system | |
| SPRi-Arrayer | LabNext Xactll Microarray System | ||
| SPR biochip | HORIBA | ||
| SPRi-Lab+ | HORIBA | ||
| Synergy Mx Multimode Microplate reader | BioTek | ||
| ScrubberGen | HORIBA | Data Analysis software |
Referenzen
- Popii, V., Baumann, G. Laboratory measurement of growth hormone. Clinica Chimica Acta. 350 (1-2), 1-16 (2004).
- Higham, C. E., Trainer, P. J. Growth hormone excess and the development of growth hormone receptor antagonists. Exp Physiol. 93 (11), 1157-1169 (2008).
- Sönksen, P., Salomon, F., Cuneo, R. Metabolic effects of hypopituitarism and acromegaly. Horm Res. 36, 27-31 (1991).
- Molitch, M., et al. Evaluation and Treatment of Adult Growth Hormone Deficiency: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 91 (5), 1621-1634 (2006).
- . . The World Anti-Doping Code: The 2015 Prohibited List International Standard. , (2015).
- . . The 2014 prohibited list world anti-doping code. , (2014).
- Langkamp, M., Weber, K., Ranke, M. B. Human growth hormone measurement by means of a sensitive ELISA of whole blood spots on filter paper. Growth Horm IGF Res. 18 (6), 526-532 (2008).
- Rich, R. L., Myszka, D. G. Survey of the year 2007 commercial optical biosensor literature. J Mol Recognit. 21 (6), 355-400 (2008).
- Homola, J. Present and future of surface plasmon resonance biosensors. Anal Bioanal Chem. 377 (3), 528-539 (2003).
- Hoa, X. D., Kirk, A. G., Tabrizian, M. Toward Integrated Surface Plasmon Resonance Biosensors: A Review of Recent Progress. Biosens Bioelectron. 23 (2), 151-160 (2007).
- de Juan-Franco, E., Rodrìguez-Frade, J. M., Mellado, M., Lechuga, L. M. Implementation of a SPR immunosensor for the simultaneous detection of the 22K and 20K hGH isoforms in human serum samples. Talanta. 114, 268-275 (2013).
- de Juan-Franco, E., Caruz, A., Pedrajas, J. R., Lechuga, L. M. Site-directed antibody immobilization using a protein A-gold binding domain fusion protein for enhanced SPR immunosensing. Analyst. 138 (7), 2023-2031 (2013).
- Du, H., et al. Immunological screening and characterization of highly specific monoclonal antibodies against 20 kDa hGH. Bioanalysis. 4 (17), 2161-2168 (2012).
- Treviño, J., Calle, A., Rodrìguez-Frade, J. M., Mellado, M., Lechuga, L. M. Surface plasmon resonance immunoassay analysis of pituitary hormones in urine and serum samples. Clin Chim Acta. 403 (1-2), 56-62 (2009).
- Wu, Z., Bidlingmaier, M., Dall, R., Strasburger, C. J. Detection of doping with human growth hormone. Lancet. 353 (9156), 895 (1999).
- Malic, L., Sandros, M. G., Tabrizian, M. Designed biointerface using near-infrared quantum dots for ultrasensitive surface plasmon resonance imaging biosensors. Anal. Chem. 83 (13), 5222-5229 (2011).
- Vance, S. A., Sandros, M. G. Zeptomole Detection of C-Reactive Protein in Serum by a Nanoparticle Amplified Surface Plasmon Resonance Imaging Aptasensor. Sci. Rep. 4 (5129), 1-7 (2014).
- Uludag, Y., Tothill, I. E. Cancer biomarker detection in serum samples using surface plasmon resonance and quartz crystal microbalance sensors with nanoparticle signal amplification. Anal. Chem. 84 (14), 5898-5904 (2012).
- Špringer, T., Homola, J. Biofunctionalized gold nanoparticles for SPR-biosensor-based detection of CEA in blood plasma. Anal Bioanal Chem. 404 (10), 2869-2875 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten