Method Article
High Content Screening-Analyse die toxikologischen Wirkungen von gefährlichen und potenziell gefährlichen Inhaltsstoffe (HPHC) zur Bewertung
In diesem Artikel
Zusammenfassung
The objective of the study was to assess the biological impact of 15 cigarette smoke constituents using a combination of an impedance-based real time cell analyzer and a high-content screening (HCS)-based platform for toxicological assessment in vitro. This study provides information on effective doses, toxicity and modes of action of the tested compounds.
Zusammenfassung
Zigarettenrauch (CS) ist ein wichtiger Risikofaktor für Herz-Kreislauf- und Lungenerkrankungen. Da CS ist ein komplexes Aerosol mehr als 7.000 Chemikalien , die 1 es die Beiträge der einzelnen Bestandteile zu seiner Gesamttoxizität zu bewerten ist eine Herausforderung. Toxikologische Profile der einzelnen Bestandteile sowie Gemische können jedoch in vitro hergestellt werden, durch Hochdurchsatz-Screening - Tools anwenden, die die Profilierung von gefährlichen und potenziell gefährlichen Inhaltsstoffe (HPHCs) von Tabakrauch zu ermöglichen, wie sie in der US - amerikanischen Food and Drug definiert Administration (FDA). 2
Für eine erste Einschätzung, ein impedanzbasierten Instrument wurde für eine Echtzeit, markierungsfreie Beurteilung der Verbindung der Toxizität verwendet. Das Instrument zeigt beruht auf Zelladhäsion, Lebensfähigkeit und Morphologie, die alle zusammen einen Überblick über den Zellstatus bereitzustellen. Ein dimensionsloser Parameter, Zellenindex genannt, wird für die Quantifizierung verwendet. Eine Reihe von difdene Färbeprotokollen wurde für eine Fluoreszenz-Imaging-basierte Untersuchung und eine HCS-Plattform verwendet wurde entwickelt, weitergehende Informationen über die Art der Zytotoxizität von jedem HPHC ausgelöst zu gewinnen.
Von den 15 getesteten Bestandteile wurden nur fünf ausgewählt für HCS-basierte Analyse , da sie eine berechenbare LD 50 (<20 mm) registriert. Dazu gehörten 1-aminonaphtalene, Arsen (V), Chrom (VI), Crotonaldehyd und Phenol. Auf der Grundlage ihrer Wirkung in dem HCS, 1-aminonaphtalene und Phenol kann mitochondriale Dysfunktion zu induzieren, identifiziert werden, und zusammen mit Chrom (VI) als genotoxisch basierend auf der Histon H2AX Phosphorylierung erhöht. Crotonaldehyd wurde als oxidativen Stress Induktor und Arsen als Stress-Kinase-Weg-Aktivator identifiziert.
Diese Studie zeigt , dass eine Kombination von impedanzbasierten und HCS Technologien zur in vitro Bewertung der CS Bestandteile ein robustes Werkzeug zur Verfügung stellt.
Einleitung
Toxikologische Risikobewertung hat sich auf die Verwendung von Tiermodellen historisch verlassen, die zwar grundlegend in den Lebenswissenschaften, auch mit Mängeln wie inkonsistent Übersetzbarkeit auf den Menschen und der hohen Kosten verbunden ist. Darüber hinaus hat es eine zunehmende Anstrengungen zu finden Alternativen zu Tierversuchen in den Geist der "3R" 2 (Replacement, Reduction und Refinement). Dieser Aufwand hat sich in den letzten Jahren beschleunigt, nicht nur wegen der jüngsten Fortschritte wie Hochdurchsatztechniken und Systembiologie, aber wegen der Regelung ebenfalls die Verwendung von Tierversuchen beschränken, insbesondere in der Europäischen Union.
Die Komplexität der zellulären Signalwegen die Reaktion auf toxische Beleidigungen Regelung macht es offensichtlich, dass einzelne toxikologische Endpunkte werden nicht ausreichen, um die toxikologische Grundlage bestimmter Verbindungen zu beschreiben. Hierzu wird das Zusammenspiel von Hunderten von in Wechselwirkung proteins an ein biologisches Netz beitragen wird ebenfalls berücksichtigt werden müssen. Um die Wirkung von Giften in diesen Netzwerken zu studieren, ein System Toxikologie Ansatz kombiniert mit phänotypischen Mittel- und Hochdurchsatz-Screening-Assays ist nützlich Potenzen zu schließen und gleichzeitig die weitere Informationen über die Wirkungsweise der einzelnen Noxen bereitzustellen.
In dieser Studie verwendeten wir HCS als ein leistungsfähiges Screening-Tool, das aus einem automatisierten Mikroskop und einer biologischen Softwareanwendung zusammengesetzt ist, die, zu verarbeiten und zu analysieren Bilddaten aus den spezifischen fluoreszenzbasierten zellulären Assays können erwerben. Dies ermöglicht eine visuelle Veränderungen innerhalb einer Zelle in einer einzelnen Zelle oder subzellulären Ebene quantifiziert werden, und viele Parameter gleichzeitig zu analysieren. 3 beispielsweise DNA - Doppelstrangbrüche wurden auf Antikörper-Basis Identifizierung von Histon H2AX Phosphorylierung ausgewertet und reaktive Sauerstoffspezies (ROS) wurden unter Verwendung eines zell perm quantifizierteable Superoxid-empfindlichen Farbstoff.
Da Epithelzellen der Lunge die erste biologische Barriere gegen inhalativen Noxen darstellen, einschließlich Zigarettenrauch, verwendeten wir primären bronchialen Epithelzellen als in - vitro - Modell die Wirkung von HPHCs von der US - amerikanischen Food and Drug Administration veröffentlicht zu profilieren. 4 Dieses Manuskript eine Folge ist -bis auf einer früheren Studie 5 , bei dem man die biologische Wirkung einer unterschiedlichen Untergruppe von HPHCs ausgewertet.
Im Rahmen unserer Workflow - Zytotoxizität in vitro zu beurteilen, zunächst wir die Potenzen einer Auswahl von 15 HPHC des ausgewertet, eine Impedanz-basierte Echtzeit - Zellanalyse (RTCA) System , das uns Dosisbereiche, geeignet für die anschließende HCS zu etablieren erlaubt Analyse (Abbildung 1). Eine toxikologische HCS Beurteilung wurde dann neun multiparametrisches Endpunkte zellulärer Toxizität durchgeführt unter Verwendung von jeweils zu zwei Zeitpunkten überwacht werden (4 und 24 h). Die Marker verwendet wurden , indikativ für mitochondriale Toxizität, DNA - Schäden, Stresskinase, reaktive Sauerstoffspezies (ROS), Glutathion (GSH) -Gehalt, Caspase 3 bis 7 - Aktivität, Cytochrom C Freisetzung und Zellmembranpermeabilität, wie in Tabelle 1 beschrieben.
Unser Ansatz ermöglicht Identifizierung und Charakterisierung der Wirkung von Zigarettenrauchbestandteile durch dosis- und zeitabhängige Probenahme. Letztlich ergibt sich daraus eine In - vitro - Toxizitätsprofil für jeden HPHC. Multi-omics Ansätze können auch verwendet werden, um die HCS-Analyse ergänzen. Dies würde schließlich auch ein tieferes Verständnis für die Auswirkungen auf die Zellsignalisierung und / oder Transkriptionsebene.
Protokoll
1. Die Ernte normalen humanen bronchialen Epithelzellen (NHBEs)
- Vorwärmen des Zellkulturmediums (bronchiale epitheliale Zellwachstumsmedium-ergänztem Medium), das HEPES, Trypsin und Trypsin-Neutralisationslösung (TNS) im Wasserbad bei 37 ° C.
- Ernten Sie die Zellen, wenn 80% der Einmündung erreicht ist.
HINWEIS: Die folgenden NHBE Zellkulturbedingungen Impfen kann optimal Einmündung eingesetzt werden, bei unbeschichtetem T75-Flaschen zu erhalten, die mit 20 ml Medium:- Samen 1 x 10 6 Zellen für 3-Tage - Kultur, 0,5 x 10 6 Zellen für 4-Tage - Kultur und 0,25 x 10 6 Zellen für die 5-Tage - Kultur. Ändern Medium alle 2 Tage, wenn die Zellen in Kultur sind Nährstoffe zu aktualisieren. Kulturzellen bei 37 ° C und 5% CO 2.
- Entfernen Sie den Überstand aus dem Kolben (n) und fügen Sie HEPES die Zellen zu waschen (z. B. 3 ml für einen 75 cm 2 Kolben). Drehen Sie jeden Kolben, der die Zellschicht mit dem HEPES-Sol zu deckenution.
- Entfernen Sie die HEPES - Lösung und fügen Trypsin - Lösung (z. B. 3 ml für einen 75 cm 2 Kolben). Drehen Sie den Kolben, der die Zellschicht mit Trypsin-Lösung abzudecken.
- Inkubieren des Kolbens für 5 min bei 37 ± 2 ° C. Monitor-Zellablösung unter dem Mikroskop und, falls erforderlich, Inkubation länger und vorsichtig den Kolben tippen alle verbleibenden anhaftenden Zellen zu lösen.
- In TNS , um die Reaktion zu stoppen (z. B. 3 ml für einen 75 cm 2 Kolben) und übertragen Sie die Zellsuspension in ein 15 - ml - Tube.
- Zentrifugieren Sie die Zellsuspension bei 300 × g für 5 min.
- Überstand verwerfen und resuspendiere das Zellpellet in 10 ml frischem Medium, sanft um eine homogene Zellsuspension zu ergeben, gemischt wird.
- Filtern Sie die Zellsuspension durch ein 100 & mgr; M Zelle Sieb Aggregate zu entfernen und die Zellen zu zählen. Hinweis: In unserem Labor ein elektrisches Feld Multi-Channel-Zellzählsystem wurde verwendet, um präzise und konsequent die viabl bewertene-Zellen-Nummer.
2. Echtzeit Zelle Analyzer (RTCA) -basierte Dosisfindungs (DRF)
HINWEIS: Ein impedanzbasierte Messsystem wurde verwendet, um: 1) bewerten Verbindung Toxizität, 2) wählen Sie Verbindungen weiter durch HCS untersucht werden, und 3) wählen geeignete Dosierung für HCS. Die NHBE Zellen in den RCTA Platten werden durch Zugabe von 25 ul Testverbindungsverdünnungen bis 100 & mgr; l Medium in jeder Vertiefung dosiert. Daher werden alle Testlösungen mit dem 5fachen (5x) der gewünschten Endkonzentration hergestellt.
- Seeding NHBE Zellen
- Programm das Gerät die Anzahl und Dauer der Impedanzmessungen zu definieren. In dieser Studie wurden die Daten alle 15 min 48 h aufgezeichnet (von 24 Stunden ± 2 Stunden vor und 24 Stunden nach der die Zellen mit Testmitteln Dosierung).
- Messen Sie die Platte Hintergrund durch Pipettieren 50 ul vorgewärmte Medium in jede Vertiefung einer 96-Well-Platte RTCA. Hinweis: Dieser Schritt stellt eine technische Anforderungfür das Instrument, das Medium elektrischen Widerstand zu berechnen, die dann als Referenzbasis für den zellbasierten Berechnung verwendet wird.
- Bereiten Sie eine Zellsuspension in einer Konzentration von 144.000 Zellen / ml (± 5%) und 50 & mgr; l Zellsuspension hinzufügen (7.200 Zellen / Well) in jede Vertiefung der Platte RTCA, in dem 50 & mgr; l / Vertiefung Medium bereits für Instrumenten Hintergrund aufgenommen Messung.
- Lassen Sie die Zellen für 30 Minuten bei Raumtemperatur halten, bevor sie in die RTCA-Station einsetzen (die homogene Verteilung der Zellen zu verbessern). Inkubieren der Platten in der RTCA RTCA Wiege in dem Inkubator (37 ° C und 5% CO 2) und beginnen , die Daten für die nächsten 24 ± 2 Stunden vor der Dosierung der Aufnahme.
- Verdünnungen von HPHCs und Positivkontrollen
- Positive Kontrolle Dilution
- Verdünnen Sie die Staurosporine Stammlösung (10 mM) 1:10 in DMSO (siehe Tabelle 3) und mit 5 ul der dilution bis 195 & mgr; l Medium, das eine 5-fach-Arbeitslösung zu erhalten.
- HPHC Dilution
- Auflösen / verdünnen jedes HPHC im Fahrzeug (Tabelle 2) , um eine 1 M Stammlösung zu erzeugen. Verdünnen Sie jede HPHC Stammlösung 1:10 in Medium, das eine 100 mM Lösung zu erzeugen.
- Generieren Sie die "Verbindung Masterplatte" durch eine fünfstufige 01.10 serielle Verdünnung Durchführung mit Medium + 10% Fahrzeug die 5x Arbeitslösungen (Abbildung 2) zu erhalten. Anmerkung: Letztendlich werden die letzten Dosen sein: 0,2 uM, 2 uM, 20 uM, 0,2 mM, 2 mM, 20 mM. Auch bereiten die Dosis 0, entspricht das einzige Fahrzeug, in diesem Schritt.
- Dosing
- Pause das RTCA Instrument und öffnen Sie die Wiege der Platte zu entfernen.
- Entfernen Sie die Platte und legen Sie sie in der RTCA Plattentemperatur Werkzeug (entworfen, um die Temperatur der RTCA Platte während des experimentellen Verfahren außerhalb des RTCA zu stabilisierenStation) zu vermeiden, dass die Zellen Kühlung, die die Impedanzmessung auswirken könnte.
- In 25 ul 5x Lösung von der "Verbindung Masterplatte" , um Zellen in dreifacher Ausfertigung Beibehaltung der gleichen Dosierung , um wie in der Verbindung Masterplatte (höchste Dosis in der oberen Reihe und Fahrzeugsteuerung in der Zeilennummer 7) (Abbildung 2). Sie nicht die bestehende (100 ul) Zellkulturmedium zu entfernen.
- In 25 ul 5x positive Kontrolllösung zu den Zellen in der unteren Reihe (halbrechts) ohne Ausbau bestehender Kulturmedium. Zugeben von 25 & mgr; l Medium zu den Zellen in der untersten Zeile (Halb links), ohne bestehende Zellkulturmedium zu entfernen.
- Verschließen Sie die Platte mit Plattenversiegelung. Legen Sie die Platte zurück in die RTCA Wiege und verriegeln. Restart - Daten für die gewünschte Belichtungszeit - Aufzeichnung (z. B., 24 h). Anmerkung: Die Verwendung dieser Abdichtungsfolie wird empfohlen, eine mögliche Kontamination zu vermeiden, auch gut zu Well Kreuzkontamination.
- Datenanalyse RTCA und LD 50 Berechnung
- Export-Rohdaten als Text (TXT) oder Excel-Datei (.xls). Hinweis: Die Datei, die alle Informationen über die Plattenlayout enthalten (Verbindungen, Dosen und auch Position). Raw Zellindexwerte werden in einer 96-Well-Format (Mirroring Platte gut Verteilung) organisiert und sind für alle Zeitpunkte, an denen die Aufnahme aufgetreten vorgesehen. Der Wert an der Position i in der 96 - Well - Platte zum Zeitpunkt t wird durch CI t (i) bezeichnet.
- Identifizieren als Normierungs Referenz die aktuelle Zeitpunkt vor der Dosierung für jede Position i in der 96 - Well - Platte (beispielsweise Zell Index bei 23 h 50 min 00 sec bei Position i, CI t (i) = 23: 50: 00 = CI Ref (i)). Hinweis: Diese Informationen müssen mit Anmerkungen versehen werden, wenn die Dosierung durchgeführt wird.
- Dividieren, auf eine gut Basis, jedes Mal, Punktwerte durch die Normalisierung Referenz alle Werte an der Dosierstation Zeit zu normalisieren. Der normierte Wert bei positioni in der 96 - Well - Platte zum Zeitpunkt t wird durch NCI t (i) bezeichnet , und wird somit durch NCI t (i) = CI t (i) / CI Ref (i) für alle t definiert.
- Berechnen der Fläche unter der Kurve (AUC) bei 24 Stunden nach der Dosierung für jeden Abtastwert i (i Position in der 96-Well-Platte), einschließlich der Positionen für positive Kontrolle und Fahrzeug.
- Besorgen Sie sich die AUC an Position i durch Addition der Flächen jedes Rechtecks erhalten wird, jedes Rechteck zwischen zwei Zeitpunkten bezeichnet mit t k und t l (t k l) ist; Berechnen jedes Rechteck Bereich mit x = t l x * y unter Verwendung - t k der Abstand zwischen zwei Zeitpunkten und y der Mittelwert der Aktivität der beiden Zeitpunkte sein (y = (NCI tk (i) + NCI tl (i)) / 2).
Hinweis: Die AUC bei 24 Stunden nach der Verabreichung für die Position i von AUC bezeichnet wird (i). Da alle Bedingungen in dreifachen Vertiefungen plattiert ist der Mittelwert der drei Werte verwendet.
- Besorgen Sie sich die AUC an Position i durch Addition der Flächen jedes Rechtecks erhalten wird, jedes Rechteck zwischen zwei Zeitpunkten bezeichnet mit t k und t l (t k l) ist; Berechnen jedes Rechteck Bereich mit x = t l x * y unter Verwendung - t k der Abstand zwischen zwei Zeitpunkten und y der Mittelwert der Aktivität der beiden Zeitpunkte sein (y = (NCI tk (i) + NCI tl (i)) / 2).
- Normalisieren Sie die Werte der folgenden Gleichung:
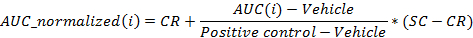
wo ich die Position in der 96 - Well - Platte ist für die AUC bei 24 Stunden nach der Verabreichung wurde berechnet,
Das Fahrzeug ist der Median der AUC - Werte für die Fahrzeug Vertiefungen auf einer Platte bei 24 Stunden nach der Dosierung,
Positive Kontrolle ist der Median der AUC - Werte für die positiven Kontrollvertiefungen auf einer Platte bei 24 Stunden nach der Dosierung,
CR ist das gewünschte mittlere normierte Wert für das Fahrzeug (0%), und
SC ist der gewünschte mittlere normalisierte Wert für die Positivkontrollen (-100%)
HINWEIS: Am Ende dieser Stufe wird ein Datensatz erhalten, der für jede Position enthält, i in der 96-Well-Platte, einer Konzentration ci (in logarithmischen Einheiten), die mit der Probe in Position enthalten angewendet wird / well i und der entsprechenden normalisierte AUC bei 24 Stunden nach der Dosierung AUC_normalized (i). - Plot und passen die (c i, AUC_normalized (i)) -Werten eine 4-Parameter Hill Gleichung. Wenn möglich, berechnen auch LD 50.
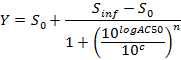
wobei Y = AUC_normalized,
Nulltätigkeits - S 0 = Aktivitätslevel bei Null Konzentration der Testverbindung,
Unendliche Tätigkeit S inf = Aktivitätsniveau bei unendlicher Konzentration,
AC50 = Konzentration , bei der Aktivität 50% der maximalen Pegel erreicht,
Hill - Koeffizient n = Maß für die Steigung bei AC50 und
c = Konzentration in logarithmischen Einheiten auf die Werte auf der x-Achse der Dosis-Wirkungskurve Stück entspricht.
HINWEIS: AC50 entspricht LD 50 (Zytotoxizität - Assays). Es ist ein Maß für die Wirkungsstärke, wo niedrige Werte eine hohe Wirksamkeit zeigen.
- Positive Kontrolle Dilution
3. Messung toxikologischen Wirkungen von HCS
HINWEIS: Es wurden insgesamt neun Mehr parametrischer Marker der Toxizität, gruppiert in sechs verschiedenen Assays werden unter Verwendung des HCS - Plattform (Tabelle 1) gemessen. Basierend auf der RTCA die Lebensfähigkeit der Zellen Analyse (Abschnitt 2) der Dosisbereich der einzelnen Bestandteile definiert und eine Dosis 3R4F Referenz ist ebenfalls enthalten. Die Referenzdosis ist auf die Menge an HPHC in der Rauch von einem Stock von der Referenz Zigarette 3R4F gleichwertig.
- Seeding NHBE Zellen
- Bereiten Sie eine Zellsuspension bei 120.000 Zellen / ml (± 5%) und in den jede Vertiefung einer 96-Well-Platte HCS 100 ul Zellsuspension (12.000 Zellen / Vertiefung). Bereiten genug Platten für die Bewertung aller Assays (Zytotoxizität, DNA-Schäden, Stress Kinase, ROS, GSH-Gehalt und Apoptosis) und Zeitpunkte (4 und 24 h).
- Lassen Sie die HCS-Platten bei Raumtemperatur für 30 min Zellen zu ermöglichen, Brunnen zu befestigen und dann Inkubation bei 37 ° C und 5% CO 2 für 24 ± 2 Stunden vor der Dosierung.
- Die Verdünnung von HCHPs und Positivkontrollen
HINWEIS: Die NHBE Zellen in den HCS-Platten wird durch Zugabe von 25 ul Testprobenlösungen auf 100 ul Medium bereits in jedem gut dosiert werden. Daher werden alle Dosen in 5x die gewünschte endgültige Konzentration.- Positive Kontrollen Verdünnung (Positive Kontrolle Plate)
- Dispense 40 ul Stammlösung von jeder positiven Kontrolle (siehe Tabelle 3) in Spalte # 2 (4a, Brunnen in rot schraffiert). Dispense 20 ul Fahrzeug in Spalten # 3 und # 5 (4a, Brunnen in hellblau schattiert) und 40 ul Fahrzeug in Spalte # 4 (4a, Brunnen in hellblau hinterlegt).
- Zurückzuziehen 12 ul aus den Vertiefungen in Spalte # 2, verzichtet werden sie zu den Vertiefungen in Spalte # 3 und mischen (4b)Für jede positive Kontrollverbindung bis zu einer endgültigen Reihenverdünnung mit 3 Dosen (d1, d2, und d3) und Fahrzeug (V) weiter (Figur 4c) erhalten wird. Um die positive Steuerplatte erzeugen, bereiten eine Verdünnung von 1:40 von Verbindungen in Medien (4d).
- HPHC Verdünnung (Verbindung Master - Plate)
Hinweis: Die gewählte Dosisbereiche von HPHCs für HCS sind in Tabelle 2 aufgeführt.- Verdünnte jede HPHC Stammlösung (1 M) 1:10 in Medium für eine Konzentration von 100 mM. Führen Sie Verdünnungen mit 10% Fahrzeug unter Verwendung von Medium die ausgewählten 5x die Dosis für jeden HPHC zu erhalten.
- Positive Kontrollen Verdünnung (Positive Kontrolle Plate)
- Dosing
- In 25 ul 5x Lösungen aus der Verbindung Masterplatte zu den Zellen in dreifacher Ausfertigung Beibehaltung der gleichen Dosierung , um wie in der Verbindung Masterplatte (höchste Dosis in der oberen Reihe und Fahrzeugsteuerung in der Zeilennummer 7) (Abbildung 5). Entfernen Sie nicht die eESTEHENDE (100 ul) Zellkulturmedium.
- Zugeben von 25 & mgr; l 5x - Lösung aus der positiven Kontrollplatte zu den Zellen in der unteren Reihe die gleiche Dosierung Reihenfolge wie in der positive Steuerplatte Aufrechterhaltung (Abbildung 5). Sie nicht die bestehende (100 ul) Zellkulturmedium zu entfernen. Hinweis: Jeder Test eine bestimmte positive Kontrolle hat; siehe Tabelle 3. Inkubieren der Platte bei 37 ° C und 5% CO 2 für die gewünschte Belichtungszeit (4 oder 24 h).
- Die Färbung
- Vorbereitung für alle Assays
- Vorwärmen des Waschpuffer (PBS) Lösungen bei 37 ° C.
- Bereiten Sie die Fixierungslösung (4% Formaldehydlösung) Zugabe 10,81 ml 37% Formaldehyd zu 89,19 ml Waschpuffer und vorwärmen es bei 37 ° C.
- Bereiten Sie die Permeabilisierung Puffer von 10 ml 10x Permeabilisierung Puffer Zugabe zu 90 ml Waschpuffer und vorwärmen es bei 37 ° C.
- Bereiten Sie die Blocking Puffer durch 10 ml 10fach Zugabe von Puffer auf 90 ml Waschpuffer und vorwärmen es bei 37 ° C blockiert.
- Pre-warm das Zellkulturmedium bei 37 ° C.
- Entfernen Sie die HCS-Platten aus dem Inkubator, sobald die 4 und 24 Stunden Belichtungszeiten erreicht werden und die folgenden spezifischen Protokolle für jeden Test.
- Zytotoxizitätstest
- Eine ausreichende Volumen (V) der Live-Zellfärbung Lösung gemäß der folgenden Formel ist: Volumen des Mediums (& mgr; l) V = 50 x W x 1,2 (W Anzahl der Vertiefungen)
- Verdünnen Sie die Mitochondria Farbstoff in der Live Cell Färbelösung nach Lieferanten Anweisung. Verdünnen Sie die Membranpermeabilität Farbstoff in der Live Cell Färbelösung nach Lieferanten Anweisung.
- In 50 ul Live Cell Färbelösung zu jeder Vertiefung der Platte (n), "Zytotoxizitätstest". NICHT Zellkulturmedium zu entfernen und für 30 min bei 37 ° C, 5% CO inkubieren 2.
- vorsichtig absaugen, das Medium und Farblösung und mit 100 ul / Vertiefung der Fixierungslösung in jede Vertiefung, dann inkubieren Platte (n) für 20 Minuten bei Raumtemperatur im Dunkeln.
- vorsichtig absaugen Fixierungslösung und waschen Sie einmal mit 100 & mgr; l / Well Puffer waschen.
- Entfernen Waschpuffer und fügen 100 ul / Vertiefung 1x Permeabilisierung Puffer in jede Vertiefung und Inkubation für 10 Minuten bei Raumtemperatur im Dunkeln.
- Absaugen Permeabilisierung Puffer und Waschplatte zweimal mit 100 ul / Vertiefung Waschpuffer.
- Absaugen Waschpuffer und 100 ul für 15 Minuten bei Raumtemperatur im Dunkeln in jede Vertiefung und inkubieren 1x Blockierungspuffer hinzufügen.
- Bereiten Sie ein ausreichendes Volumen (V) der primären Antikörperlösung nach folgender Formel: Volumen der Blockierungspuffer (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen). Verdünnen Sie die anti-Cytochrom C-Antikörper (Maus) 1: 250 in primären Antikörperlösung.
- Absaugen blockiert ein Pufferd zu jeder Vertiefung 50 ul / Vertiefung primärer Antikörper-Lösung hinzufügen und 60 Minuten lang bei Raumtemperatur im Dunkeln inkubiert.
- Eine ausreichende Volumen (V) des sekundären Antikörpers und Reaktor Lösung gemäß der folgenden Formel: Volumen Blockierungspuffer (& mgr; l) V = 50 x W x 1,2 (W Anzahl wells). Verdünne die anti-Maus-Antikörper 1: 500 in sekundärem Antikörper und Reaktorlösung. Verdünnen Sie die Kern Farbstoff 1: 1000 in sekundären Antikörper und Reaktor Lösung.
- Absaugen Primärantikörperlösung und Waschplatte dreimal mit 100 & mgr; l / Vertiefung Waschpuffer die Platte Reiniger.
- Absaugen Waschpuffer und 50 ul hinzufügen / Vertiefung sekundären Antikörper und Reaktorlösung in jede Vertiefung der Platte (n) und für 60 Minuten bei Raumtemperatur im Dunkeln inkubiert.
- Absaugen sekundären Antikörper und Reaktorlösung und Waschplatte dreimal mit 100 & mgr; l / Vertiefung Waschpuffer die Platte Reiniger. 100 l / well Waschpuffer. Platte (n) ist (sind) jetztbereit, auf dem HCS-Leser ausgewertet werden.
- DNA - Schäden Assay
- vorsichtig absaugen, das Medium von den Platten mit "DNA-Schäden".
- Führen Sie die gleichen Schritte wie in der Folge beschrieben: 3.4.2.4 - 3.4.2.8. Man beachte, dass während des Schritts nur Medium entfernt 3.4.2.4 in diesem Fall ist.
- Bereiten Sie ein ausreichendes Volumen (V) der primären Antikörperlösung nach folgender Formel: Volumen der Blockierungspuffer (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen)
- Verdünnen Sie die anti-Phospho H2AX Antikörper (Maus) 1: 2000 in Primärantikörperlösung.
- Führen Sie den gleichen Schritt wie in 3.4.2.10 beschrieben.
- Eine ausreichende Volumen (V) des sekundären Antikörpers und Reaktor Lösung gemäß der folgenden Formel: Volumen Blockierungspuffer (& mgr; l) V = 50 x W x 1,2 (W Anzahl der Vertiefungen)
- Verdünne die anti-Maus-Antikörper 1: 500 in sekundärem Antikörper und Reaktorlösung.
- Verdünnen Sie die Nuclear Farbstoff 1: 1000 in sekundären Antikörper und Reaktor Lösung.
- Führen Sie die gleichen Schritte wie in der Folge beschrieben: 3.4.2.12-3.4.2.14.
- Stress - Kinase - Assay
- vorsichtig absaugen das Medium von jeder der Platten bezeichnet "Stress-Kinase".
- Führen Sie die gleichen Schritte wie in der Folge beschrieben: 3.4.2.4 - 3.4.2.8. Man beachte, dass während des Schritts nur Medium entfernt 3.4.2.4 in diesem Fall ist.
- Bereiten Sie ein ausreichendes Volumen (V) der primären Antikörperlösung nach folgender Formel: Volumen der Blockierungspuffer (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen)
- Verdünnen Sie die anti-Phospho cJun- Antikörper (Kaninchen) 1: 200 in primären Antikörperlösung.
- Führen Sie den gleichen Schritt wie in 3.4.2.10 beschrieben.
- Eine ausreichende Volumen (V) des sekundären Antikörpers und Reaktor Lösung gemäß der folgenden Formel: Volumen Blockierungspuffer (& mgr; l) V = 50 x W x 1,2 (W Anzahl der Vertiefungen)
- Verdünnen Sie die Anti-Kaninchen-Antikörper 1: 500 in sekundären Antikörper und Reaktor Lösung.
- Verdünnen Sie die Kern Farbstoff 1: 1000 in sekundären Antikörper und Reaktor Lösung.
- Führen Sie die gleichen Schritte wie in der Folge beschrieben: 3.4.2.12-3.4.2.14.
- ROS - Assay
- Bereiten Sie ein ausreichendes Volumen (V) von Live Cell Färbelösung nach folgender Formel: Volumen der Mittel (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen).
- Verdünnen Sie die ROS Farbstoff in Live Cell Färbelösung nach Anbieter Anweisung
- Verdünnen Sie die Kern Farbstoff 1: 1000 in Live Cell Anfärbung Solution.3.4.5.4) werden 50 & mgr; l Live Cell Färbelösung zu jedem Well-Platten mit "ROS"; NICHT Zellkulturmedien zu entfernen und für 30 Minuten bei Raumtemperatur im Dunkeln inkubiert.
- vorsichtig absaugen, das Medium und Farblösung und Waschplatte dreimal mit 100 & mgr; l / Vertiefung Medium.
- Saugen Sie das Medium, 100 _6; l / well Fixierungslösung zu jeder Vertiefung und die Platte bei Raumtemperatur im Dunkeln für 20 min inkubieren.
- vorsichtig absaugen Fixierungslösung und Waschplatte dreimal mit 100 & mgr; l / Well Puffer waschen.
- 100 l / well Waschpuffer. Platte (n) ist (sind) nun bereit.
- Bewerten Sie die Platte auf dem HCS-Leser innerhalb 1 Stunde.
- GSH - Gehalt Assay
- Bereiten Sie ein ausreichendes Volumen (V) der Live Cell Nuclear Färbelösung nach folgender Formel: Volumen der Mittel (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen).
- Verdünnen Sie die Kernfarbstoff (Far Red) 1: 1000 in Live Cell Kernanfärbung Solution.3.4.6.3). In 50 ul Live Cell Kernanfärbung Lösung in jede Vertiefung der Platten mit "GSH-Gehalt". NICHT Zellkulturmedien zu entfernen und für 30 min bei 37 ° C, 5% CO 2 inkubieren.
- Bereiten Sie ein ausreichendes Volumen (V) von Live Cell GSH Färbelösung nach demfolgende Formel: Volumen HBSS (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen)
- Verdünnen Sie die GSH-Farbstoff in Live Cell GSH Färbelösung nach Lieferanten Anweisungen.
- vorsichtig absaugen, das Medium und die Kernfärbung Lösung und waschen Platte dreimal mit 100 ul / Vertiefung Medium.
- Absaugen Medium und fügen 100 ul / Vertiefung von Live Cell GSH Färbungslösung in jede Vertiefung der Platte (n).
- Inkubieren für 10 min bei Raumtemperatur im Dunkeln. Platte (n) ist (sind) nun bereit.
- Bewerten Platte (n) auf dem HCS Reader innerhalb 1 Stunde.
- Apoptosis Assay
- Bereiten Sie ein ausreichendes Volumen (V) von Live Cell Färbelösung nach folgender Formel: Volumen der Mittel (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen).
- Verdünnen Sie die Caspase-Farbstoff 1: 300 in Live Cell Färbelösung.
- Entfernen von Zellkulturmedien, fügen Sie 50 ul Live Cell Färbungslösung in jede Vertiefung von ter Platte (n) , "Apoptosis" , und für 30 min bei 37 ° C, 5% CO 2 inkubieren.
- Bereiten Sie ein ausreichendes Volumen (V) der Live Cell Nuclear Färbelösung nach folgender Formel: Volumen der Fix-Lösung (ul) V = 50 x W x 1.2 (W Anzahl der Brunnen).
- Verdünnen Sie die Kern Farbstoff 1: 1000 in Live Cell Nuclear Färbelösung.
- Entfernen Sie die Live-Zellfärbung Lösung, 100 ul / Vertiefung von Live Cell Kernanfärbung Lösung in jede Vertiefung der Platte (n) und Inkubation für 30 Minuten bei Raumtemperatur im Dunkeln.
- Saugen Sie das Fixiermittel / Kernfarbstofflösung und Waschplatte (n) dreimal mit 100 & mgr; l / Well Puffer waschen.
- 100 l / well Waschpuffer. Platte (n) ist (sind) nun bereit.
- Bewerten Platte (n) auf dem HCS-Leser.
- Vorbereitung für alle Assays
- Datenanalyse HCS
- Export-Rohdaten als Excel-Datei (.xls). Hinweis: Raw Zellindexwerte werden in einer 96-Well Form organisiertbei (Mirroring Platte gut Verteilung) und sind für alle Endpunkte zu einem bestimmten Zeitpunkt nach der Verabreichung zur Verfügung gestellt.
- Normalisieren Sie die Werte der folgenden Gleichung:
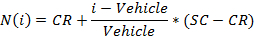
wobei i die gemessene Rohsignal Wert eines Brunnens,
Fahrzeug ist der Mittelwert der gemessenen Signalwerte für die Fahrzeug Vertiefungen auf einer Platte,
CR ist das gewünschte mittlere normierte Wert für das Fahrzeug (0%), und
SC ist der gewünschte mittlere normalisierte Wert für die positiven Kontrollen (100),
HINWEIS: Am Ende dieser Stufe wird ein Datensatz erhalten, der für jede Position enthält, i in der 96 - Well - Platte, eine Konzentration c i (in logarithmischen Einheiten), die auf die Probe in Position enthalten angewendet wurde / well i und ihre entsprechende normierte Signal N (i). - Plot und passen die (c i, N (i)) - Werte , um einen 4-Parameter Hill - Gleichung.
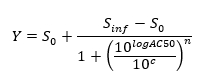
wo Nulltätigkeits - S 0 = Aktivitätslevel bei Null Konzentration der Testverbindung,
Unendliche Tätigkeit S inf = Aktivitätsniveau bei unendlicher Konzentration,
AC50 = Konzentration , bei der Aktivität 50% der maximalen Pegel erreicht,
Hill - Koeffizient n = Maß für die Steigung bei AC50 und
c = Konzentration in logarithmischen Einheiten auf die Werte auf der x-Achse der Dosis-Wirkungskurve Stück entspricht.
HINWEIS: AC50 ist ein Maß der Wirksamkeit, wenn niedrige Werte eine hohe Wirksamkeit zeigen.
Ergebnisse
RTCA
Da die HCS - Endpunkte nicht informativ sein wird , wenn keine toxische Wirkung festgestellt wird, sind solche Verbindungen nicht zeigen verminderte Lebensfähigkeit der Zellen bis zur höchsten Konzentration in der RCTA nicht durch HCS (3b getestet, c, d, g, k, l, m , p). Verbindungen zeigt verminderte Lebensfähigkeit der Zellen bei nur der höchsten Konzentration (Abbildung 3e, o) sind auch für die HCS abgewählt. Schließlich sind nur die Bestandteile mit einem berechenbaren LD 50 (<20 mM) werden für die weitere Analyse HCS (3a, f, h, j, n) ausgewählt. HPHCs die oben genannten Kriterien erfüllen, sind: 1-aminonaphtalene, Arsen (V), Chrom (VI), Crotonaldehyd und Phenol.
HCS
Als Qualitäts-Check (QC), sind positive Kontrollen first analysiert, dass Färbeverfahren, um sicherzustellen, richtig ausgeführt wird. Repräsentative Bilder von Positivkontrolle behandelten Zellen werden in 6 gezeigt. Die Datenwerte werden auf die Fahrzeug normalisierten wie zuvor beschrieben. Keine Dosis-Wirkungskurven werden dargestellt als nur drei Dosen getestet werden und nicht alle drei Dosen werden bei jedem Zeitpunkt betrachtet. Die Positivkontrollkonzentrationen ausgewählt werden (basierend auf früheren Versuchen, Daten nicht gezeigt), so dass geeignete Antworten für jeden Endpunkt sowohl auf 4 Stunden und 24 Stunden beobachtet werden. Insbesondere Dosen 1 und 2 werden verwendet, um die Wirkung bei 4 h zu bewerten, während die Dosen 2 und 3 werden verwendet, um die Wirkung bei 24 Stunden auszuwerten. Die Platten werden verworfen, wenn keine Antwort für die positive Kontrolle Dosen beobachtet wird. Man beachte, dass für alle Endpunkte, außer mitochondrialen Membranpotentials und GSH-Gehalt wird eine Erhöhung der Signalintensität erwartet.
Alle Verbindungen, mit Ausnahme von Phenol, führte zu einer nekrotischen Phäno Typ, basierend auf erhöhte Permeabilität der Zellmembran (7a, f, h, l). 1-aminonaphtalene, Chrom (VI), Crotonaldehyd und Phenol wurden als genotoxisch basierend auf erhöhte Phosphorylierung von Histon H2AX (7e, j, n, p) identifiziert. Phenol und 1-aminonaphtalene wurden zu induzieren starke mitochondriale Dysfunktion (7b, o) gefunden, die mit 1-aminonaphtalene, führte zu einer erhöhten Freisetzung von Cytochrom C (Abbildung 7c). Der Nachweis von erhöhten Caspase 3/7 Aktivität zur Verfügung gestellt Nachweis von apoptotischen Ereignisses auf Chrom-Exposition. Oxidativer Stress Induktion (ROS oder GSH) wurde auch bei der Behandlung mit 1-aminonaphtalene nachgewiesen, Crotonaldehyd und Phenol (7d, m, q). Schließlich induziert Arsen Zellstress durch die erhöhte Phosphorylierung des Transkriptionsfaktors cJun (Figur 7G) zeigten als.
Last / 53987 / 53987fig1.jpg "/>
Abbildung 1. Verbindung Tox-Profiler - Workflow. A) Schematische Darstellung des Workflow folgte in dieser Studie. Zunächst wurde eine Dosis-Entfernungsmessung durchgeführt , die RTCA - Plattform unter Verwendung von geeigneten Dosen zu wählen für nachfolgende HCS die substanzspezifischen Toxizitätsprofile. B) Experimentelles Design der Studie zu charakterisieren. 24 Stunden nach dem Aussäen wurden die Zellen dosiert und Impedanzwerte kontinuierlich über die folgenden 24 Stunden überwacht, während HCS Endpunkte untersucht wurden 4 und 24 Stunden nach der Dosierung. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
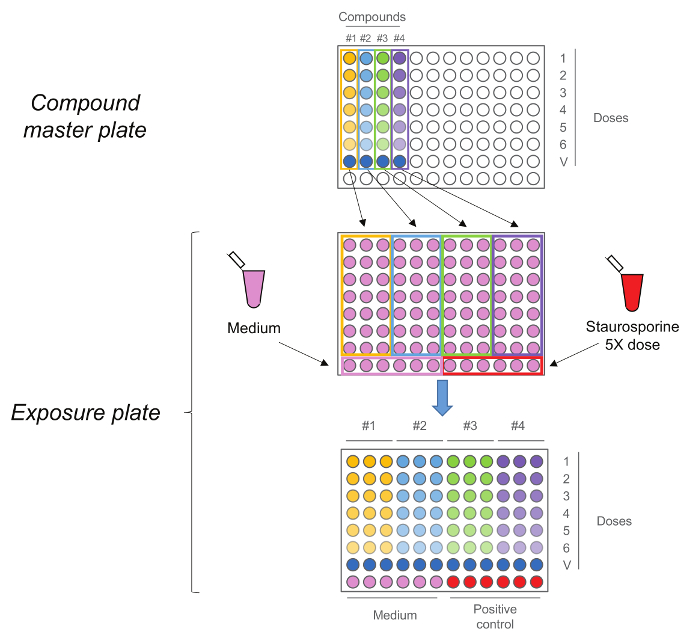
Abbildung 2. RTCA Belichtungsplatte. Compound Masterplatte zuerst durch die Durchführung einer fünfstufigen 01.10 serielle Verdünnung erzeugt wird. Jede Verbindung,die Fahrzeugsteuerung einschließlich (Dosis 0) wird dann mit Medium und Staurosporin als Kontrollen in dreifacher Ausfertigung an die Belichtungsplatte zusammenaddiert. Beachten Sie, dass die Dosen - Sequenz bei der Übertragung beibehalten wird, höchsten Dosen in Zeilennummer 1 sind , während Fahrzeugsteuerungen sind in der Reihe Nummer 7 eine größere Version dieser Figur zu sehen Bitte hier klicken.
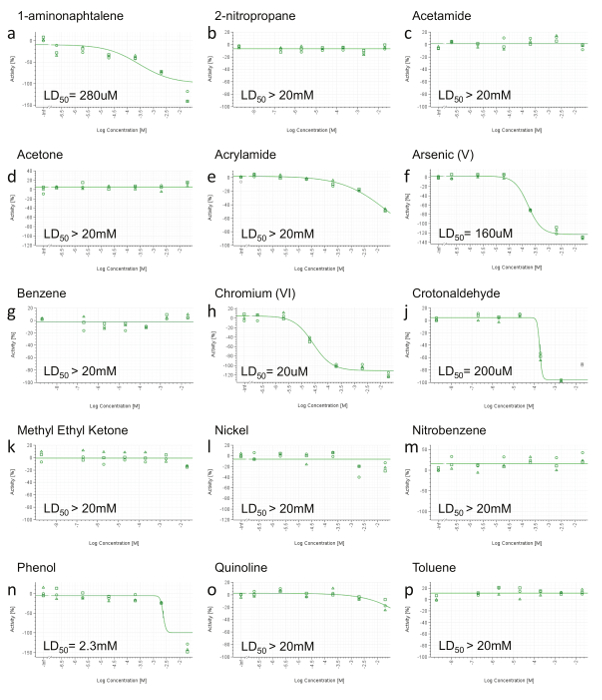
Figure 3. Repräsentative RTCA Zell Viability Ergebnisse. A) 1-aminonaphtalene, b) 2-nitropropan, c) acetamid, d) Aceton, e) acrylamid, f) Arsen (V), g) benzol, h) Chrom (VI) , j) Crotonaldehyd, k) Methylethylketon, l) Nickel (II), m) Nitrobenzol, n) Phenol, o) Chinolin, p) Toluol. Bei 24 Stunden nach der Dosierung, die Fläche unter der Kurve (AUC) wurde für jede Dosis berechnet (einschließlich positive Kontrolle und Fahrzeug) und normalisiert in einem Bereich von 0 bis -100% Wirkung (y-Achse), wobei 0 die Aktivität widerspiegelt das Fahrzeug und -100 der positiven Kontrolle. Die Werte wurden dann aufgetragen und ausgestattet , um eine Vier-Parameter - Hill - Gleichung und, wenn möglich, LD 50 berechnet wurde. Die Konzentrationen werden auf einer logarithmischen Skala ausgedrückt (x-Achse). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
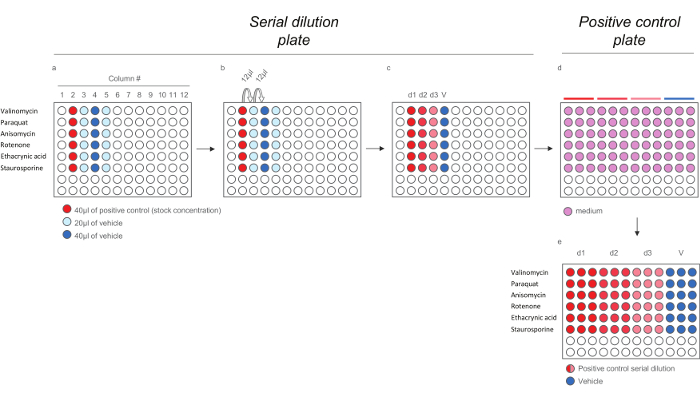
Abbildung 4. Verdünnungsschema für Positivkontrolle Verbindungen für HCS - Assays. A) Die Zugabe von Positivkontrollen und vezeug an die serielle Verdünnungsplatte. b) Serielle Verdünnung der positiven Kontrollen. c) 200X positive Kontrollen Dosen. de) Verdünnung der 200x positiven Kontrollen Dosen in Medium (01.40) , um die positive Steuerplatte zu erzeugen , um die 5 - fach - Dosen enthalten. Beachten Sie, dass jede Dosis wird in dreifacher Ausführung verdünnt , um das endgültige Layout in der Belichtungsplatte zu reflektieren). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
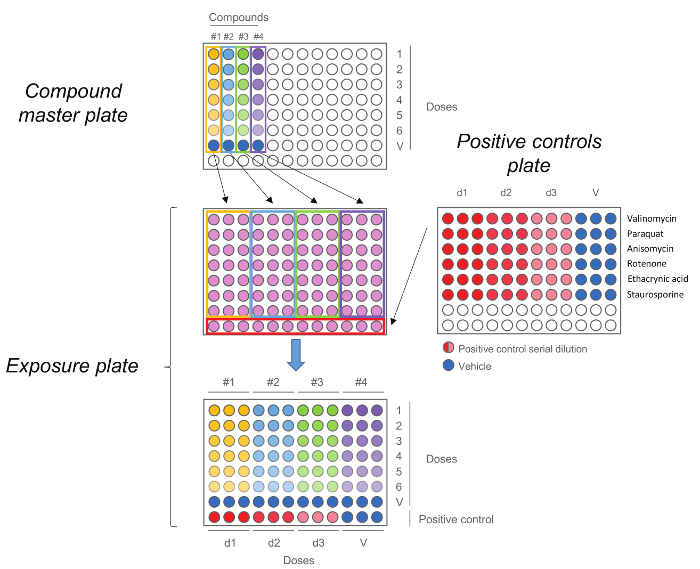
Abbildung 5. HCS Belichtungsplatte. Compound Masterplatte zuerst durch die Durchführung einer fünfstufigen Verdünnung erzeugt wird. Jede Verbindung, einschließlich der Fahrzeugsteuerung (Dosis 0) wird dann in dreifacher Ausführung zu der Belichtungsplatte zusammen mit den positiven Kontrollen hinzugefügt. Beachten Sie, dass die Dosen, um bei der Übertragung beibehalten wird,höchsten Dosen sind in der Zeile Nummer 1 , während Fahrzeugsteuerungen in Zeilennummer 7. sind hier Bitte klicken um eine größere Version dieser Figur zu sehen.
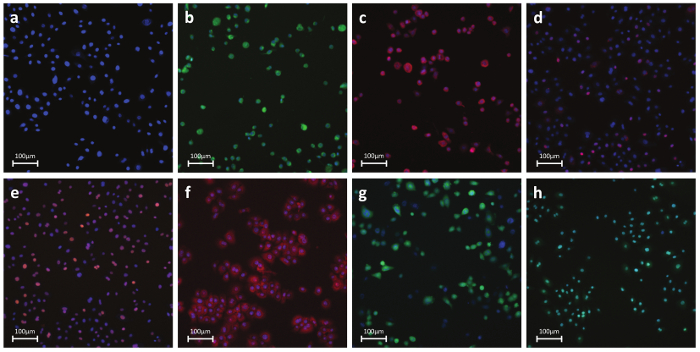
Abbildung 6. Repräsentative Fluorescent Fotos von Antikörper- oder Dye-gefärbten Zellen a) Kernparameter - Nuclear Farbstoff. Ein durchlässiges Farbstoff, der in lebenden oder fixierten Zellen an DNA bindet. Dieser Fleck wird verwendet , um einzelne Zellen zu identifizieren , die Kernregion Kennzeichnung b) Nekrosen - Permeabilität der Zellmembran Farbstoff. Farbstoff-basierte Erkennung von Zellmembranintegrität. Reagenz ist intrinsisch undurchlässig für die Zellmembran. Während Nekrose, wird die Membran durchlässig und der Farbstoff in die Zelle und bindet an DNA eine starke Fluoreszenz s Herstellung. ignal c) Apoptosis - Cytochrome C: Antikörper-basierte Erkennung von Cytochrom C Freisetzung, einem bekannten Markenzeichen der frühen Apoptose. Nach der Induktion der Apoptose wird Cytochrom c aus den Mitochondrien freigesetzt und diffundiert in den Kern d) DNA Damage - pH2AX:.. Antikörper-basierte Detektion der Phosphorylierung von Histon H2AX, ein wohlbekanntes Merkmal der Doppelstrang - DNA - Brüche e) Stress Kinase - cJun-. Antikörper-basierte Erkennung von Phosphorylierung an Ser-73 von cJun-, einem bekannten Markenzeichen der zellulären Stress f) Oxidativer Stress - DHE: Farbstoff-basierte Erkennung von Superoxid - Radikalen. Dihydroethidium selbst fluoresziert im Zytoplasma blau , während die oxidierte Form Ethidium- auf DNA - Einlagerungs rot fluoresziert g) GSH - MBCL. Farbstoffbasis Nachweis freier GSH - Moleküle. MBCL reagiert mit GSHerzeugen ein hoch fluoreszierendes Produkt h) Apoptosis - Caspase 3/7 Aktivierung:. Dye-basierte Erkennung von Caspase 3/7 Aktivität. Reagenz ist nicht fluoreszierend mit einer Vier-Aminosäure-Peptid, das die DNA-Bindung hemmt. Bei der Caspase-3/7 Aktivierung wird das Peptid ermöglicht den Farbstoff gespalten, um DNA zu binden und eine helle, fluorogene Reaktion erzeugen. Panels bh positive Kontrolle behandelten Zellen zeigen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
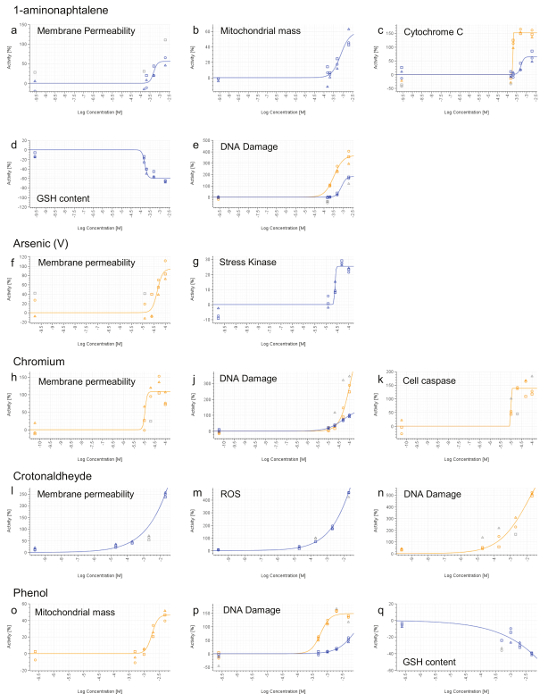
Abbildung 7. Repräsentative Ergebnisse HCS. 1-aminonaphtalene (ae), Arsen (V) (f und g), Chrom (VI) (hk), Crotonaldehyd (ln) und Phenol (OQ). 4 Stunden (blaue Linie) und24 hr (orange Linie) Signale wurden für jede Dosis und normiert auf die Fahrzeugaktivität (0%) berechnet. Werte, die nicht in Kurvenanpassung Berechnungen enthalten sind grau dargestellt. Die Konzentrationen werden auf einer logarithmischen Skala ausgedrückt (x-Achse). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Probe | Endpoint # | Biologische Endpunkt | Zellkompartiments | der Ausgabe |
| Zytotoxizität | 1 | Mitochondriale Masse 6 | Zytoplasma | Spot-Durchschnitt Bereich |
| 2 | Mitochondriale Membranpotential 6 | Zytoplasma | Punkt mittlere Intensität | |
| 3 | Cytochrome C-Release 7 | Kern | Durchschnittliche Intensität | |
| 4 | Zellmembranpermeabilität 8 | Kern | Durchschnittliche Intensität | |
| DNA-Schäden | 5 | Phospho-H2AX 9 | Kern | Durchschnittliche Intensität |
| Stress-Kinase | 6 | Phospho-cJun- 10 | Kern | Durchschnittliche Intensität |
| ROS | 7 | ROS 11 | Kern | Durchschnittliche Intensität |
| GSH-Gehalt | 8 | GSH 12 | Zytoplasma | Punkt mittlere Intensität |
| Apoptosis | 9 | Caspase 3 13 | Zytoplasma | Punkt mittlere Intensität |
Tabelle 1. Liste der HCS einssays und Endpunkte.
| Fahrzeug | RTCA Dosen (uM) | LD 50 | HCS Dosen | |||||||||||
| Die Lebensfähigkeit der Zellen ausgewählten (uM) | 3R4F (nM) | |||||||||||||
| 1-Aminonaphtalene | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | 280 & mgr; M | 2000 | 500 | 200 | 150 | 0,27 | |
| 2-nitropropan | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acetamide | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Aceton | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acrylamide | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Arsen (V) | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | 160 & mgr; M | 200 | 100 | 50 | 25 | 0,17 | |
| Benzol | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Chrom (VI) | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | 20 & mgr; M | 100 | 50 | 20 | 10 | 0,06 | |
| Crotonaldehyd | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | 200 & mgr; M | 20.000 | 2000 | 200 | 20 | 2000 | |
| Methyl-Ethyl Ketone | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | >20 mM | ||||||
| Nickel | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| nitrobenzol | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Phenol | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | 2300 & mgr; M | 5000 | 2000 | 1000 | 500 | 240 | |
| Chinolingelb | EtOH | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Toluol | Wasser | 20.000 | 2000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
Tabelle 2. Liste der getesteten HPHC Verbindungen mit Relative LD 50 bei 24 Stunden der Behandlung. Die Verbindungen für HCS - Analyse ausgewählt werden orange markiert und getesteten Dosierungen sind ebenfalls angegeben. Die 3R4F Dosis ist auf die Menge des Bestandteils in der Rauch von einem Stock von der Referenz Zigarette 3R4F gleichwertig.
| Probe | Verbindung | Stammlösung | Lösungsmittel | Dosis (s) (uM) | ||
| Zellengesundheit | Staurosporin | 10 mM | DMSO | 50 | ||
| Zytotoxizität | Valinomycin | 10 mM | DMSO | 50 | 20 | 5 |
| DNA-Schäden | Paraquat | 100 mM | DMSO | 500 | 200 | 50 |
| Stress-Kinase | Anisomycin | 2 mM | DMSO | 10 | 4 | 1 |
| ROS | Rotenon | 200 mM | DMSO | 1000 | 400 | 100 |
| GSH-Gehalt | Ethacrynsäure | 200 mM | DMSO | 1000 | 400 | 100 |
| Apoptosis | Staurosporin | 40 mM | DMSO | 200 | 50 | 20 |
Tabelle 3. Liste der positiven Kontrollen und Konzentrationen für jeden Test verwendet.
Diskussion
Der Bedarf an Alternativen zu Tierversuchen und für neue Hochdurchsatz-Testmethoden wurden in den vergangenen Jahren viel diskutiert. Dies hat Wissenschaftler und Regulierungsbehörden geführt alternative Methoden für Standardtoxizitätstests zu untersuchen, zellulären Assays verwendet, die die Physiologie der Zielgewebe eng imitieren. In dieser Studie haben wir die Anwendbarkeit der Kombination eines Echtzeit-Zell Analysator (RTCA) mit einem hohen Gehalt Screening (HCS) Plattform demonstriert die Wirkung der Exposition auf einzelne CS Bestandteile auf die menschliche Lungenepithelzellen zu beurteilen. Diese Einstellung könnte analog Zytotoxizität durch verschiedene andere Luftschadstoffe, Schwebeteilchen und Nanopartikel induziert zu bewerten angewendet. Des Weiteren können die erhaltenen Ergebnisse mit denen von Whole-Genome Transcriptomics und Berechnungsmethoden auf kausale biologischen Netzwerken basieren angepasst werden. Wie bereits berichtet, erlaubt dieser Ansatz uns Daten über molekulare Weg zu erhärtenStörung bei CS Exposition 5 mit HCS - Endpunkte, auch phänotypisch diese Weg Störungen Adressierung.
Als Flussdiagramm - Assay bietet Echtzeit - Zellanalyse die Lebensfähigkeit der Zellen bezogenen Informationen in einer dosis- und zeitabhängige Auflösung, die eine bessere Entscheidungsfindung ermöglicht , die Dosis und die Belichtungszeit Punkt für Downstream - Analyse 14 günstig sein kann. Das Prinzip des Analysators beruht auf Veränderungen in der elektrischen Impedanz von den Zellen erzeugt, wie sie befestigen und die Ausbreitung auf einer Oberflächenkultur und mit einer Goldmikroelektrode bedeckt. Die Impedanz wird in einen dimensionslosen Parameter mit dem Namen zell Index umgewandelt, die verwendet werden können, die Zelladhäsion zu überwachen, Verstreuen, Morphologie und letztlich die Lebensfähigkeit der Zellen. Obwohl diese Technik bietet keine Informationen über zytotoxische Mechanismen, seine Empfindlichkeit Erkennung von morphologischen zellulären Veränderungen auch bei sehr niedrigen Dosen, bei denen ermöglicht die HCS nicht informativ ist (Daten nicht gezeigt). Basierend auf Previous Experimenten haben wir festgestellt, dass RTCA Methodik bei niedrigeren Dosen im Vergleich morphologischer Veränderungen zu erkennen in der Lage, die HCS-Endpunkte.
Nach anfänglichen Screening mit der Echtzeit-Zellanalyse wurde eine HCS-Plattform zu gewinnen, weitergehende Informationen über die Art der Zytotoxizität von jedem HPHC ausgelöst verwendet. Das Panel HCS-Assay erlaubt HPHCs gegenüber ihren möglichen Auswirkungen auf die zellulären Kompartimenten / Organellen sowie zum Profil wie für den auslösenden Genotoxizität oder oxidativen Stress zu identifizieren. Die Analyse zeigte deutliche Profile, wobei die ausgewählten HPHCs Zytotoxizität in NHBE Zellen induzieren. Im Allgemeinen sind alle Verbindungen mit Ausnahme Phenol wurden gefunden Nekrose bei den höchsten getesteten Dosen zu induzieren. In Übereinstimmung mit einer möglichen Rolle bei der Krebsentwicklung 1-aminonaphtalene induzierte Phosphorylierung von H2AX als Marker für Genotoxizität, relea jedoch die HCS-Panel auch unbedeckten Aktivität dieses HPHC in der mitochondrialen Toxizität Auslesung (Masse erhöht und Cytochrom Cse) und oxidativer Stress (GSH Erschöpfung). In ähnlicher Weise, wie zuvor beschrieben, wurde Phenol identifiziert mitochondriale Dysfunktion zu induzieren, und die DNA-Schäden sowie GSH Verarmungs verursachen. Chrom (VI), einer der klassifizierten Verbindungen als Gruppe I Karzinogene und Crotonaldehyd wurden auch beide als genotoxisch, insbesondere Chrom (VI) auch induzierte Apoptose (Caspase-Kaskade Aktivierung) und Crotonaldehyd identifiziert verursachte ROS erhöht. Schließlich Arsen (V) wurde gefunden cJun-Phosphorylierung zu induzieren, die ein Marker für Stress Kinase-Signalweg-Aktivierung ist.
In dieser Studie verwendeten wir NHBE Zellen als Modell für Lungen Epithelzellen in vitro. Unter Verwendung dieser Zellen in einer HCS-Einstellung ist beispiellos und ermöglichte die Untersuchung eines breiteren Spektrums von Endpunkten, einschließlich Genotoxizität und oxidativen Stress-Marker. Sowohl mit lebenden Zellen und feste Zellfärbung Ansätze wurden innerhalb unserer Protokolle beschrieben, die Flexibilität der gesamten Technik zu demonstrieren. in fAkt, die gleichen Protokolle können auf eine breitere Palette von Zielen angewandt werden, die durch die Verwendung eines Fluoreszenzfarbstoffes oder Antikörper behandelt werden können. Für die erfolgreiche Durchführung der Live Färbeprotokollen ist es wichtig, die Reaktionszeit zu beachten, da einige der Farbstoffe eine begrenzte Halbwertszeit und das Fluoreszenzsignal haben kann abnehmen, bevor die Bilderfassung abgeschlossen ist. Es ist auch wichtig zu bedenken, dass, wenn eine andere Zelltyp verwendet wird, werden alle Färbebedingungen sollte, als die optimale Farbstoffkonzentration und der Inkubationsdauer kann unterschiedlich sein neu bewertet werden.
In der aktuellen Papier haben wir ein Szenario beschrieben, in dem nur fünf Verbindungen, bei denen mit dem HCS-Methodik untersucht. das zuvor beschriebene Plattenlayout bedenkt, wurden sie über zwei verschiedene Plattensätze für eine Gesamtzahl von 24 Platten (6 Assays und 2 Zeitpunkte) .Die Anzahl der Platten könnte auch erhöht, wodurch die gleichzeitige Screening mehrerer Verbindungen ermöglicht dosierende oder die invessuchung von mehreren Endpunkten. Bevor Sie dies tun, sollte man jedoch berücksichtigen, dass bestimmte Endpunkte (GSH und ROS) erfordern eine sofortige Erfassung, und als Folge, die Dosierung der Platten sollte in einer gestaffelten Art und Weise durchgeführt werden, um den Erwerb der vorherigen Platte zu ermöglichen. Auf der anderen Seite, eine feste Zellfärbung Protokoll stellt einen Vorteil, wenn die Platten gestapelt werden kann, das Protokoll zu jedem Schritt nach der Fixierung zu unterbrechen, für den Abschluss des Färbeverfahrens zu einem späteren Zeitpunkt. Dieser Ansatz, zum Beispiel, würde der Bediener mit der Zeit bieten alle lebenden Zellen Färbeplatten abzuschließen, ohne die Datenqualität zu beeinträchtigen.
Um den Arbeitsablauf zu optimieren, indem die Anzahl der Platten abnimmt, wäre es auch möglich sein, mehrere Endpunkte miteinander zu multiplexen. Zum Beispiel in diesem Zusammenhang DNA-Schäden und Stress-Kinase könnte zusammen einfach Sekundär unter Verwendung von zwei mit Fluorochromen Antikörper untersucht werden, in verschiedenen c emittierendenanäle e xistieren. Die kontinuierliche Weiterentwicklung der HCS-Plattform, einschließlich vollautomatischen Zellaussaat, Verbindungsverdünnung, Dosieren und Färbung, sowie das Hinzufügen neuer Endpunkte wird weiter die Fähigkeit der HCS-Plattform als ein leistungsfähiges Profilierungswerkzeug erweitern für HPHCs auf epithelialen und anderen Zelltypen .
Offenlegungen
Alle Autoren sind Mitarbeiter von Philip Morris International. Philip Morris International ist die einzige Quelle für die Finanzierung und Sponsor dieses Projekts.
Danksagungen
Die Autoren möchten sich Karsta Luettich und Grégory Vuillaume für ihre Überprüfung des Manuskripts danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Cellomics ArrayScan VTI HCS Reader | Thermo | N01-0002B | |
| xCelligence RTCA MP | ACEA | 05331625001 | |
| Screener (HCS) | Genedata | NA | |
| CASY counter TTC | Roche | 05 651 719 001 | |
| e-Plates VIEW 96 | ACEA | 06 472 451 001 | |
| RTCA Frame 96 | ACEA | 05232392001 | |
| RTCA Cardio Temperature Tool | ACEA | 2801171 | |
| Plate sealer breathseal | Greiner bio-one | 676051 | |
| Normal Human Bronchial Epithelial cells (NHBE) | Lonza | CC-2540 | non-smoking 60-year-old Caucasian male donor |
| BEGM BulletKit | Lonza | CC-3170 | Warm at 37 °C before use |
| ReagentPack Subculture Reagents kit | Lonza | CC-5034 | Warm at 37 °C before use |
| Penicillin/Streptomycin (100x) | Corning | 30-002-CI | |
| Easy Flask filter cap 75 cm2 | Thermo Scientific | 12-565-349 | |
| 96 well assay plate black | Corning | 3603 | |
| Hoechst 33342 | Fisher Scientific | PI-62249 | |
| Draq5 (For Far Red Nuclear Staining) | Biostatus | DR50200 | |
| Mitochondrial Dye: MitoTracker Red CMXRos | Life technologies | M-7512 | |
| Mitochondrial Dye: MitoTracker Red CM-H2XRos | Life technologies | M-7513 | |
| ROS Dye: Dihydroethidium | Sigma | D7008 | |
| ROS Dye: CellROX | Life technologies | C10422 | |
| ROS Dye: MitoSOX | Life technologies | M36008 | |
| GSH Dye: Monochlorobimane | Sigma | 69899 | Toxic |
| GSH Dye: Monobromobimane | Life technologies | M-1378 | Toxic |
| Membrane permeability Dye: YO-PRO-1 | Life technologies | Y3603 | Irritating |
| Membrane permeability Dye: TO-PRO-1 | Life technologies | T3602 | Irritating |
| Membrane permeability Dye: TOTO-1 | Life technologies | T3600 | Irritating |
| Caspase Dye: Cellevent Caspase 3/7 green | Life technologies | C10423 | Irritating |
| Anti-Cytochrome C antibody (Mouse) | Thermo | MA5-11823 | |
| Anti-phospho-c-Jun antibody (Mouse) | Thermo | MA5-15889 | |
| Anti-phospho-H2AX antibody (Mouse) | Thermo | MA1-2022 | |
| Goat anti-Mouse IgG DyLight 650 | Abcam | ab96878 | |
| 10x permeabilization buffer | Fisher | 8408400 | |
| 4% Formaldehyde solution | Sigma | F1635 | Toxic |
| 10x blocking buffer | Fisher | 8408500 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Hanks' Balanced Salt solution | Sigma | H8264 | |
| Staurosporine | Sigma | S4400 | Toxic |
| Valinomycin | Sigma | V0627 | Toxic |
| Paraquat | Sigma | 36541 | Toxic |
| Anisomycin | Sigma | A9789 | Toxic |
| Ethacrynic acid | Sigma | E4754 | Toxic |
| 1-Aminonaphthalene | Sigma | 34390 | Toxic |
| 2-Nitropropane | Sigma | 130265 | Toxic |
| Acetamide | Sigma | 695122 | Toxic |
| Acetone | Sigma | 650501 | Toxic |
| Acrylamide | Sigma | A9099 | Toxic |
| Arsenic (V) | Sigma | A6756 | Toxic |
| Benzene | Sigma | 12540 | Toxic |
| Chromium (VI) | Sigma | 216623 | Toxic |
| Crotonaldehyde | Sigma | 262668 | Toxic |
| Methyl ethyl ketone | Sigma | 34861 | Toxic |
| Nickel | Sigma | 203866 | Toxic |
| Nitrobenzene | Sigma | 48547 | Toxic |
| Phenol | Sigma | P5566 | Toxic |
| Quinoline | Sigma | 241571 | Toxic |
| Toluene | Sigma | 34866 | Toxic |
Referenzen
- Rodgman, A., Perfetti, T. A. The chemical components of tobacco and tobacco smoke. , CRC Press. Boca Raton, FL. (2013).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen, London. (1959).
- Zock, J. M. Applications of high content screening in life science research combinatorial chemistry & high throughput screening. Comb. Chem. High. Throughput. Screen. 132 (9), 870-876 (2009).
- US Food and Drug Administration. Harmful and potentially harmful constituents in tobacco products and tobacco smoke; established list, federal register. , 20034-20037 (2012).
- Gonzalez-Suarez, I. Systems Biology Approach for Evaluating the Biological Impact of Environmental Toxicants in Vitro. Chem. Res. Toxicol. 27 (3), 367-376 (2014).
- Camilleri-Broet, S., Vanderwerff, H., Caldwell, E., Hockenbery, D. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp. Cell. Res. 239 (2), 277-292 (1998).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates and apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. Double strand breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273 (10), 5858-5868 (1998).
- Westwick, J. K., Weitzel, C., Minden, A., Karin, M., Brenner, D. A. Tumor necrosis factor α stimulates AP-1 activity through prolonged activation of the c-jun kinase. J. Biol. Chem. 269 (42), 26396-26401 (1994).
- Bindokas, V. P., Jordán, J., Lee, C. C., Miller, R. J. Superoxide production in rat hippocampal neurons: selective imaging with hydroethidine. J. Neurosci. 16 (4), 1324-1336 (1996).
- Barhoumi, R., Bailey, R. H., Burghardt, R. C. Kinetic analysis of glutathione in anchored cells with monochlorobimane. J. Cytometry. 19 (3), 226-234 (1994).
- Huang, T. C., Lee, J. F., Chen, J. Y. Pardaxin an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 Cells. Mar. Drugs. 9 (10), 1995-2009 (2011).
- Bao, S., Knoell, D. L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am. J. Physiol. Lung Cell Mol. Physiol. 291 (6), L1132-L1141 (2006).
- Xia, M., et al. Compound Cytotoxicity Profiling Using Quantitative High-Throughput Screening. Environ Health Perspect. 116 (3), 284-291 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten