Method Article
Análise alto teor de triagem para avaliar os efeitos toxicológicos de Constituintes nocivas e potencialmente prejudiciais (HPHC)
Neste Artigo
Resumo
The objective of the study was to assess the biological impact of 15 cigarette smoke constituents using a combination of an impedance-based real time cell analyzer and a high-content screening (HCS)-based platform for toxicological assessment in vitro. This study provides information on effective doses, toxicity and modes of action of the tested compounds.
Resumo
A fumaça do cigarro (CS) é um importante fator de risco para doenças cardiovasculares e pulmonares. Porque CS é um aerossol complexo contendo mais de 7.000 produtos químicos 1 é um desafio para avaliar as contribuições de componentes individuais para a sua toxicidade geral. Perfis toxicológicos dos componentes individuais, bem como misturas podem ser no entanto estabelecida in vitro, através da aplicação de alta through-colocar ferramentas de rastreio, que permitem a caracterização dos componentes nocivos e potencialmente prejudiciais (HPHCs) da fumaça do tabaco, tal como definido por os EUA Food and Drug Administration (FDA) 2.
Para uma avaliação inicial, um instrumento baseado em impedância foi usado para um tempo real de avaliação, sem rótulo de toxicidade do composto. O instrumento de leitura depende de adesão celular, viabilidade e morfologia que todos juntos fornecem uma visão geral do status celular. Um parâmetro adimensional, denominado índice de celular, é usado para a quantificação. Um conjunto de difprotocolos de coloração dife- foi desenvolvido para uma investigação baseada em imagens de fluorescência e uma plataforma de HCS foi utilizado para obter informações mais detalhadas sobre o tipo de citotoxicidade provocada por cada HPHC.
Dos 15 componentes testados, apenas cinco foram seleccionados para análise baseia-HCS em que registada uma calculável LD 50 (<20 mM). Estes incluíram 1-aminonaphtalene, Arsénio (V), cromo (VI), Crotonaldeído e fenol. Com base no seu efeito na HCS, 1-aminonaphtalene e fenol pode ser identificada para induzir disfunção mitocondrial, e, em conjunto com crómio (VI) como genotóxico com base no aumento da fosforilação da histona H2AX. Crotonaldeído foi identificado como um indutor de estresse oxidativo e arsênico como um ativador de quinase via do estresse.
Este estudo demonstra que uma combinação de tecnologias baseadas em impedância e HCS fornece uma ferramenta robusta para a avaliação in vitro dos constituintes CS.
Introdução
Avaliação do risco toxicológico tem historicamente se baseou na utilização de modelos animais que, embora fundamental nas ciências da vida, também estão ligados com deficiências tais como tradutibilidade inconsistentes para os seres humanos e de alto custo. Além disso, tem havido um esforço crescente para encontrar alternativas à experimentação animal no espírito de "Os 3Rs" 2 (substituição, redução e refinamento). Este esforço tem sido acelerado nos últimos anos, não só por causa dos avanços recentes, como técnicas de alto rendimento e abordagens de biologia de sistemas, mas também por causa da legislação que restringe o uso de testes em animais, especialmente na União Europeia.
A complexidade das vias de sinalização celulares que regulam a resposta a insultos tóxicos torna evidente que o uso de parâmetros toxicológicos individuais não serão suficientes para descrever a base toxicológico de determinados compostos. Para isso, a interação de centenas de interagir proteins que contribuem para uma rede biológica também terão de ser tomadas em consideração. Para estudar o efeito de agentes tóxicos nessas redes, uma abordagem toxicologia sistema combinado com médio fenotípicas e ensaios de rastreio de alto rendimento é útil para inferir potências e, ao mesmo tempo, proporcionar mais informação sobre o mecanismo de acção de substâncias tóxicas individuais.
Neste estudo, utilizou-HCS como uma ferramenta de rastreio poderoso, o qual é composto por um microscópio automatizado e uma aplicação de software biológico, que pode adquirir, processar e analisar os dados de imagem obtidos a partir de ensaios celulares com base em fluorescência específica. Isto permite alterações visuais dentro de uma célula a ser quantificado, a uma única célula ou nível subcelular, e muitos parâmetros a serem analisados simultaneamente. 3 Por exemplo, o ADN quebras de cadeia dupla foram avaliados usando uma identificação à base de anticorpo da fosforilação da histona H2AX e espécies reactivas de oxigénio (ROS) foram quantificados utilizando uma célula-permsuperóxido eable corante sensível.
Como as células epiteliais pulmonares representam a primeira barreira biológica contra tóxicos inalados, incluindo o fumo do cigarro, utilizamos células epiteliais brônquicas primárias como um modelo in vitro para traçar o perfil do efeito da HPHCs publicados pelos Estados Unidos Food and Drug Administration. 4 Este manuscrito é um follow -up em um estudo anterior 5 em que se avaliou o impacto biológico de um subconjunto diferente de HPHCs.
Como parte do nosso fluxo de trabalho para avaliar a citotoxicidade in vitro, inicialmente avaliou as potências de uma seleção de 15 HPHC de, através de uma análise celular em tempo real baseado em impedância do sistema (RTCA) que nos permitiu estabelecer doses-ranges, adequados para HCS subsequente análise (Figura 1). A avaliação toxicológica HCS foi depois conduzida utilizando nove pontos de extremidade de multi-paramétricos de toxicidade celular, cada monitorizada em dois pontos de tempo (4 e 24 h). Os marcadores utilizados foram indicativos de toxicidade mitocondrial, danos no ADN, o stress quinase, espécies reactivas de oxigénio (ROS), o teor de glutationa (GSH), a caspase 3 - actividade de 7, a libertação do citocromo C e permeabilidade da membrana celular, como descrito na Tabela 1.
A nossa abordagem permitiu a identificação e a caracterização do efeito de constituintes do fumo do cigarro através de amostragem da dose e dependente do tempo. Em última análise, isso produziu um perfil toxicológico in vitro para cada HPHC. abordagens multi-genómica também pode ser usado para complementar ainda mais a análise de HCS. Isto iria finalmente também fornecer uma compreensão mais profunda dos efeitos na sinalização celular e / ou do nível de transcrição.
Protocolo
1. As células epiteliais brônquicas de colheita normal humana (NHBEs)
- Pré-aquecer o meio de cultura celular (crescimento de células epiteliais meio suplementado com meio brônquica), o HEPES, tripsina e tripsina de solução neutralizante (TNS) no banho de água a 37 ° C.
- Colher as células quando 80% de confluência é atingido.
NOTA: A seguinte cultura de células NHBE semeando condições podem ser usadas para obter óptima confluência em frascos T75 revestidos com 20 ml de meio:- Semente 1 x 10 6 células para a cultura de 3 dias, 0,5 x 10 6 células para a cultura de 4 dias e 0,25 x 10 6 células para cultura de 5 dias. Mudança de meio a cada 2 dias, quando as células estão em cultura para refrescar nutrientes. Células de cultura a 37 ° C e 5% de CO 2.
- Retirar o sobrenadante do frasco (s) e adicionar HEPES para lavar as células (por ex., 3 ml para um frasco de 2 75 centímetros). Rodar cada frasco para cobrir a monocamada de células com o Sol HEPESution.
- Remover a solução de HEPES e adicionar uma solução de tripsina (por exemplo., 3 ml para um frasco de 2 75 centímetros). Rodar o balão para cobrir a monocamada de células com uma solução de tripsina.
- Incubar o balão durante 5 minutos a 37 ± 2 ° C. Monitorar desprendimento de células ao microscópio e, se necessário, incubar mais tempo e bata suavemente o frasco para liberar quaisquer células unidas restantes.
- Adicionar TNS para parar a reacção (por ex., 3 ml para um frasco de 75 centímetros 2) e transferir a suspensão de células para um tubo de 15 ml.
- Centrifugar a suspensão de células a 300 x g durante 5 min.
- Descartar o sobrenadante e ressuspender o sedimento celular em 10 ml de meio fresco, misturando suavemente para se obter uma suspensão de células homogéneas.
- Filtra-se a suspensão de células através de um coador de células de 100 uM para remover agregados e contar as células. Nota: No nosso laboratório um sistema de contagem de células no campo eléctrico multi-canal foi usado para avaliar com precisão e de forma consistente o viablnúmero de células e.
2. Tempo real celular Analyzer (RTCA) à base Dose Faixa Finding (DRF)
NOTA: Um sistema de medição baseado em impedância foi usada para: 1) avaliar toxicidade do composto, 2) selecione compostos a ser investigada pelos HCS e 3) selecionar doses apropriadas para HCS. As células NHBE nas placas RCTA são doseados por adição de 25 ul de diluições do composto de ensaio a 100 ul de meio presente em cada poço. Portanto, todas as soluções de teste são preparados a 5 vezes (5x) a concentração final desejada.
- As células NHBE semeadura
- Programar o instrumento para definir o número ea duração das medidas de impedância. Neste estudo, os dados foram registados a cada 15 minutos durante 48 horas (24 horas de ± 2 horas antes e 24 horas após a dosagem as células com agentes de teste).
- Medir o fundo da placa por pipetagem de 50 ul de meio de pré-aquecido a cada poço de uma placa de 96 poços RTCA. Nota: Esta etapa representa um requisito técnicopara o instrumento para calcular a resistência eléctrica forma que é então utilizado como uma referência de base para o cálculo à base de células.
- Prepara-se uma suspensão de células a uma concentração de 144.000 células / ml (± 5%) e adicionar a suspensão de células a 50 uL (7.200 células / poço) a cada poço da placa de RTCA em que 50 uL / poço de meio já foi adicionado para o fundo do instrumento medição.
- Deixe as células aderir durante 30 min à temperatura ambiente antes da sua colocação no suporte RTCA (para melhorar a distribuição homogénea das células). Incubar as placas RTCA no berço RTCA na incubadora (37 ° C e 5% de CO 2) e começar a gravar os dados para a próxima 24 ± 2 horas antes da dosagem.
- Diluições de HPHCs e controles positivos
- Controle Positivo Diluição
- Dilui-se a solução estoque Estaurosporina (10 mM) 1:10 em DMSO (ver Tabela 3) e adicionam-se 5 uL da dilution a 195 ul de meio para se obter uma solução de trabalho de 5x.
- HPHC diluição
- Dissolver / diluir cada HPHC no veículo (Tabela 2) para gerar uma solução estoque 1M. Dilui-se cada solução de estoque HPHC 1:10 em meio para gerar uma solução de 100 mM.
- Gerar a "placa mestra composto" através da realização de um passo de cinco 01:10 diluição em série usando o meio + 10% de veículo para se obter as soluções de trabalho 5x (Figura 2). Nota: Em última análise, as doses finais serão: 0,2 uM, 2 uM, 20 uM, 0,2 mM, 2 mM, 20 mM. Também preparar a dose de 0, correspondente ao único veículo, neste passo.
- dosagem
- Pausar o instrumento RTCA e abrir o berço para remover a placa.
- Remover a placa e colocá-lo na ferramenta de temperatura da placa de RTCA (concebidos para estabilizar a temperatura da placa RTCA durante os procedimentos experimentais fora da RTCAestação) para evitar o arrefecimento das células, o que poderia influenciar a medição da impedância.
- Adicionar 25 ul de 5x solução da "placa composto mestre" de células, em triplicado, mantendo a mesma ordem de dosagem como na placa mestre composto (dose mais elevada na linha superior e o veículo de controlo na linha número 7) (Figura 2). Não retire o meio de cultura celular existente (100 mL).
- Adicionar 25 ul da solução de controlo positivo para as células 5x da linha inferior (metade direita) sem necessidade de remover o meio de cultura existente. Adicionar 25 ul de meio de às células na fila inferior (metade esquerda) sem necessidade de remover o meio de cultura celular existente.
- Selar a placa com placa selante. Coloque a placa de volta no berço RTCA e bloqueá-lo. Dados reiniciar a gravação para o tempo de exposição desejado (por exemplo., 24 h). Nota: O uso desta película selante é recomendado para evitar a contaminação potencial, incluindo a contaminação cruzada bem-a-poço.
- Análise de Dados RTCA e LD 50 Cálculo
- dados brutos de exportação como um texto (.txt) ou arquivo do Excel (.xls). Nota: O arquivo conterá todas as informações sobre o layout da placa (compostos, doses e posição bem). valores de índice de células Raw são organizados em uma (distribuição bem placa espelhamento) 96 formato bem e estão disponíveis para todos os pontos de tempo em que a gravação ocorreu. O valor na posição i na placa de 96 poços no tempo t é indicado pela CI t (i).
- Identificar-se como uma normalização referência ao último ponto de tempo antes da dosagem para cada posição i na placa de 96 poços (por exemplo, índice celular em 23 h 50 min 00 seg na posição I, Cl T (I) = 23: 50: 00 = IC Ref (i)). Nota: Esta informação deve ser anotada quando a dosagem é realizada.
- Divide, sobre uma base bem, cada vez que os valores dos pontos de referência de normalização para normalizar todos os valores no momento da dosagem. O valor normalizado na positioni na placa de 96 poços no tempo t é indicado pela NCI T (i) e é, assim, definida pela NCI T (i) = CI t (I) / IC Ref (I) para todos os t.
- Calcula-se a área sob a curva (AUC) às 24 h pós-dose para cada amostra I (posição I, na placa de 96 poços), incluindo as posições de controlo positivo e do veículo.
- Obter a AUC na posição i é obtida pela soma das áreas de cada rectângulo, sendo cada rectângulo entre dois pontos de tempo indicado pelo t k e t L (t K l); calcular cada área rectângulo usando x * y com x = t L - T k sendo a distância entre dois pontos de tempo e sendo y a média da actividade dos dois pontos de tempo (Y = (TK NCI (i) + NCI TL (i)) / 2).
Nota: A AUC às 24 h pós-dose para a posição I é denotada por AUC (i). Como todas as condições são plaqueadas em poços em triplicado a média dos três valores é usado.
- Obter a AUC na posição i é obtida pela soma das áreas de cada rectângulo, sendo cada rectângulo entre dois pontos de tempo indicado pelo t k e t L (t K l); calcular cada área rectângulo usando x * y com x = t L - T k sendo a distância entre dois pontos de tempo e sendo y a média da actividade dos dois pontos de tempo (Y = (TK NCI (i) + NCI TL (i)) / 2).
- Normalizar os valores utilizando a seguinte equação:
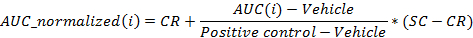
onde i é a posição na placa de 96 poços para o qual a AUC foi calculada às 24 horas pós-dosagem,
O veículo é a média dos valores de AUC para os poços de uma placa de veículo sobre a 24 horas pós-dosagem,
O controlo positivo é a média dos valores de AUC para os poços de controlo positivo, uma placa a 24 horas pós-dosagem,
CR é o valor normalizado médio pretendido para o veículo (0%), e
SC é o valor normalizado médio desejado para os controlos positivos (-100%)
NOTA: No final deste passo, um conjunto de dados é obtida que contém, para cada posição i na placa de 96 poços, um IC concentração (em unidades logarítmicas) que é aplicada à amostra contida na posição / poço I e os seus correspondentes AUC normalizado às 24 horas pós-dose AUC_normalizEd (I). - Enredo e ajustar a (c i, AUC_normalized (i)) -Valores usando uma equação 4-parâmetros Hill. Quando possível, também calculam LD 50.
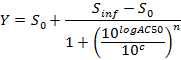
em que Y = AUC_normalized,
Nível 0 = Atividade Zero Atividade S na concentração zero de composto de teste,
Nível inf = Atividade infinita Atividade S na concentração infinito,
AC50 = Concentração à qual a actividade atinge 50% do nível máximo,
Coeficiente de Hill n = Medida da inclinação em AC50, e
C = Concentração, em unidades logarítmicas que correspondem aos valores no eixo dos x da curva de dose-resposta trama.
NOTA: AC50 corresponde a DL 50 (ensaios de citotoxicidade). É uma medida de potência, onde valores baixos indicam alta potência.
- Controle Positivo Diluição
3. Medir toxicológicos Efeitos por HCS
NOTA: Um total de nove marcadores multi-paramétricos de toxicidade, agrupados em seis ensaios diferentes, são mensurados usando a plataforma de HCS (Tabela 1). Com base na análise de viabilidade celular RTCA (Seção 2) a gama de doses de cada componente é definido e uma dose de referência 3R4F também está incluído. A dose de referência é equivalente à quantidade de HPHC presente na fumaça de um pedaço de madeira do 3R4F cigarro de referência.
- As células NHBE semeadura
- Prepara-se uma suspensão celular a 120.000 células / ml (± 5%) e adicionar a suspensão de células de 100 uL a cada poço de uma placa de 96 poços HCS (12.000 células / poço). Prepare pratos suficientes para a avaliação de todos os ensaios (citotoxicidade, danos no DNA, estresse quinase, ROS, conteúdo GSH e apoptose) e timepoints (4 e 24 h).
- Deixar as placas HCS à temperatura ambiente durante 30 min para permitir que as células para anexar a poços e então incubar a 37 ° C e CO2 a 5% durante 24 ± 2 horas antes da dosagem.
- Diluição de HCHPs e controles positivos
NOTA: As células NHBE nas placas HCS será doseada por adição de 25 uL de soluções de amostra de teste de 100 ul de meio já presente em cada poço. Portanto, todas as doses são preparadas a 5x a concentrao final desejada.- Os controlos positivos Diluição (Controle Positivo Plate)
- Pipetar 40 ul de solução de estoque de cada um controlo positivo (ver Tabela 3) na coluna # 2 (Figura 4a, poços sombreados a vermelho). Dispensar 20 l de veículo em colunas # 3 e # 5 (Figura 4A, poços sombreados em azul claro) e 40 ul de veículo na coluna # 4 (Figura 4a, poços sombreados em azul claro).
- Retirar 12 mL dos poços na coluna # 2, dispensar-se aos poços em coluna # 3 e misturar (Figura 4b), Continuar até uma diluição em série final com 3 doses (D1, D2, e D3) e veículo (V) para cada composto de controlo positivo é obtido (Figura 4c). Para gerar a placa de controlo positivo, preparar uma diluição de 1:40 de compostos em meios (Figura 4d).
- HPHC Diluição (Composto Placa Mestre)
NOTA: As gamas de dose seleccionadas de HPHCs para HCS estão listados na Tabela 2.- Dilui-se cada solução de estoque HPHC (1 M) a 1:10 em meio para uma concentração de 100 mM. Efectuar diluições usando meio com veículo de 10% para se obter as doses 5x seleccionados para cada HPHC.
- Os controlos positivos Diluição (Controle Positivo Plate)
- dosagem
- Adicionar 25 ul de soluções de 5x a partir da placa mestre composto para as células, em triplicado, mantendo a mesma ordem de dosagem como na placa mestre composto (dose mais elevada na linha superior e o veículo de controlo na linha número 7) (Figura 5). Não remova o eCTUAIS (100 uL) de meio de cultura de células.
- Adicionar 25 ul de 5x solução a partir da placa de controlo positivo para as células na fila inferior mantendo a mesma ordem de dosagem como na placa de controlo positivo (Figura 5). Não retire o meio de cultura celular existente (100 mL). Nota: Cada ensaio tem um controle positivo específico; ver Quadro 3. Incubar a placa a 37 ° C e 5% de CO 2 durante o tempo de exposição desejado (4 ou 24 h).
- coloração
- Preparação para todos os ensaios
- Pré-aqueça o tampão de lavagem (PBS) soluções a 37 ° C.
- Preparar a solução de fixação (solução de formaldeído a 4%) a adição de 10,81 ml de formaldeído a 37% para 89,19 ml de tampão de lavagem e pré-aquecido a 37 ° C.
- Preparar o tampão de permeabilização através da adição de 10 ml de 10x tampão de permeabilização de 90 ml de tampão de lavagem e pré-aquecido a 37 ° C.
- Prepare o Blocking tampão por adição de 10 ml de 10x tampão de bloqueio a 90 ml de tampão de lavagem e pré-aquecido a 37 ° C.
- Pré-aquecer o meio de cultura celular a 37 ° C.
- Retirar as placas do incubador HCS uma vez que os tempos de 4 e 24 horas de exposição são alcançados e executar as seguintes protocolos específicos para cada ensaio.
- Ensaio de citotoxicidade
- Preparar um volume suficiente (V) Solução de coloração de células vivas de acordo com a fórmula seguinte: volume de meio (ul) v = 50 W x 1,2 x (W número de poços)
- Diluir o corante mitocôndrias na Solução de células vivas de coloração de acordo com as instruções do fornecedor. Diluir o corante de membrana permeabilidade na Solução de células vivas de coloração de acordo com as instruções do fornecedor.
- Adicionar 50 ul de solução de coloração de células vivas em cada poço da placa (s) designado "Ensaio de citotoxicidade". NÃO remover o meio de cultura de células e incubar durante 30 min a 37 ° C, 5% de CO 2.
- Suavemente aspirar a solução de meio e de coloração e adicionar 100 uL / poço de solução de fixação a cada poço, depois incubar placa (s) durante 20 min à temperatura ambiente no escuro.
- Aspirar cuidadosamente solução de fixação e lavar uma vez com 100 ul / poço de tampão de lavagem.
- Remover o tampão de lavagem e adicionar / tampão de permeabilização bem 1x 100 ul a cada poço e incubar durante 10 min à temperatura ambiente no escuro.
- Aspirar tampão de permeabilização e Lavar a placa duas vezes com 100 ul / poço de tampão de lavagem.
- Aspirar o tampão de lavagem e adicionar 100 ul de 1x tampão de bloqueio a cada poço e incubar durante 15 min à temperatura ambiente no escuro.
- Preparar um volume suficiente (V) da solução primária Anticorpo de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços). Diluir o anticorpo C anti-citocromo (mouse) 1: 250 em Antibody Solution primária.
- Aspirar um tampão de bloqueioD Adicionar 50 uL / poço de anticorpo solução primária a cada poço e incubar durante 60 min à temperatura ambiente no escuro.
- Preparar um volume suficiente (V) do anticorpo secundário e solução nuclear de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços). Dilui-se o anticorpo anti-rato a 1: 500 em solução de anticorpo secundário e nuclear. Dilui-se o corante nuclear 1: 1.000 em Solução de anticorpo secundário e nuclear.
- Aspirar o anticorpo primário solução e lavagem da placa três vezes com 100 ul / poço de tampão de lavagem utilizando o lavador de placas.
- Aspirar o tampão de lavagem e adicionar 50 uL / poço de solução de anticorpo secundário e nuclear para cada poço da placa (s) e incubar durante 60 min à temperatura ambiente no escuro.
- Aspirar o anticorpo secundário e solução nuclear e placa de lavagem três vezes com 100 ul / poço de tampão de lavagem utilizando o lavador de placas. Adicionam-se 100 ul / poço de tampão de lavagem. Plate (s) é (são) agorapronto para ser avaliado no leitor HCS.
- DNA Ensaio danos
- Aspirar cuidadosamente o meio das placas designadas "dano ao DNA".
- Siga as mesmas etapas conforme descrito na seqüência: 3.4.2.4 - 3.4.2.8. Note-se que neste exemplo, apenas meio é removido durante o passo 3.4.2.4.
- Preparar um volume suficiente (V) da solução primária Anticorpo de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços)
- Diluir o anticorpo anti-H2AX fosfo (mouse) 1: 2.000 em Antibody Solution primária.
- Execute o mesmo passo como descrito no 3.4.2.10.
- Preparar um volume suficiente (V) do anticorpo secundário e nuclear solução de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços)
- Dilui-se o anticorpo anti-rato a 1: 500 em solução de anticorpo secundário e nuclear.
- Dilui-se a NucleaR corante 1: 1.000 em Solução de anticorpo secundário e nuclear.
- Execute os mesmos passos descritos em sequência: 3.4.2.12-3.4.2.14.
- Estresse Kinase Assay
- Suavemente aspirar o meio a partir de cada uma das placas designadas "stress Cinase".
- Siga as mesmas etapas conforme descrito na seqüência: 3.4.2.4 - 3.4.2.8. Note-se que neste exemplo, apenas meio é removido durante o passo 3.4.2.4.
- Preparar um volume suficiente (V) da solução primária Anticorpo de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços)
- Dilui-se a anticorpo anti-fosfo cJun (coelho) 1: 200 em solução primária do anticorpo.
- Execute o mesmo passo como descrito no 3.4.2.10.
- Preparar um volume suficiente (V) do anticorpo secundário e nuclear solução de acordo com a seguinte fórmula: Volume de tampão de bloqueio (ul) v = 50 W x 1,2 x (W número de poços)
- Dilui-se o anticorpo anti-coelho a 1: 500 em solução de anticorpo secundário e nuclear.
- Dilui-se o corante nuclear 1: 1.000 em Solução de anticorpo secundário e nuclear.
- Execute os mesmos passos descritos em sequência: 3.4.2.12-3.4.2.14.
- ROS Assay
- Preparar um volume suficiente (V) Solução de coloração de células vivas de acordo com a fórmula seguinte: volume de meio (ul) v = 50 W x 1,2 x (W número de poços).
- Diluir o corante ROS em células vivas Coloração Solution acordo com as instruções do fornecedor
- Dilui-se o corante nuclear 1: 1000 em células vivas Coloração Solution.3.4.5.4) Adicionar 50 ul da solução de coloração de células vivas para cada placas de poços designados "ROS"; NÃO remover os meios de cultura de células e incubar durante 30 min à temperatura ambiente no escuro.
- Suavemente aspirar a solução de meio e de coloração e lavá placa três vezes com 100 ul / poço meio.
- Aspirar o meio, adicione 100 _6; l / poço solução de fixação a cada poço e incubar placa durante 20 minutos à temperatura ambiente no escuro.
- Aspirar cuidadosamente solução de fixação e placa de lavar três vezes com 100 ul / poço de tampão de lavagem.
- Adicionam-se 100 ul / poço de tampão de lavagem. Plate (s) é (são) agora está pronto.
- Avaliar a placa no leitor de HCS dentro de 1 hora.
- GSH Composição Teor
- Preparar um volume suficiente (V) de células vivas Nuclear Coloração Solução de acordo com a fórmula seguinte: volume de meio (ul) v = 50 W x 1,2 x (W número de poços).
- Diluir o corante Nuclear (Far Red) 1: 1.000 em células vivas Nuclear Coloração Solution.3.4.6.3). Adicionar 50 ul de células vivas Nuclear coloração da solução a cada poço das placas designadas "conteúdo de GSH". NÃO remover os meios de cultura de células e incubar durante 30 min a 37 ° C, 5% de CO 2.
- Preparar um volume suficiente (V) de células vivas GSH Solução de coloração de acordo com aseguinte fórmula: Volume de HBSS (ul) V = 50 x W x 1.2 (W Número de poços)
- Diluir o corante GSH em células vivas GSH Coloração solução de acordo com as instruções do fornecedor.
- Suavemente aspirar a solução de coloração nuclear e médio e Lavar a placa três vezes com 100 ul / poço meio.
- Aspirar o meio e adicionar 100 uL / poço de células vivas GSH coloração da solução a cada poço da placa (s).
- Incubar durante 10 minutos à temperatura ambiente no escuro. Plate (s) é (são) agora está pronto.
- Avaliar placa (s) no Leitor de HCS dentro de 1 hora.
- Ensaio de apoptose
- Preparar um volume suficiente (V) Solução de coloração de células vivas de acordo com a fórmula seguinte: volume de meio (ul) v = 50 W x 1,2 x (W número de poços).
- Diluir o corante Caspase 1: 300 em células vivas Coloração Solution.
- Remover o meio de cultura de células, adicionar 50 ul de solução de coloração de células vivas em cada poço de tele placa (s) designado "apoptose" e incubar durante 30 min a 37 ° C, 5% de CO 2.
- Preparar um volume suficiente (V) de células vivas Nuclear Coloração Solução de acordo com a fórmula seguinte: Volume de solução de correcção (ul) v = 50 W x 1,2 x (W número de poços).
- Diluir o corante Nuclear 1: 1.000 em células vivas Nuclear Coloração Solution.
- Remover a solução de coloração de células vivas, adiciona-se 100 ul / poço de células vivas Nuclear coloração da solução a cada poço da placa (s) e incubar durante 30 min à temperatura ambiente no escuro.
- Aspirar a solução corante fixador / nuclear e lavar placa (s) três vezes com 100 ul / poço de tampão de lavagem.
- Adicionam-se 100 ul / poço de tampão de lavagem. Plate (s) é (são) agora está pronto.
- Avaliar placa (s) no leitor HCS.
- Preparação para todos os ensaios
- Análise de Dados HCS
- dados brutos de exportação como arquivo do Excel (.xls). Nota: os valores de índice de células Raw são organizados em uma forma de 96 poçosem (de distribuição bem placa espelhamento) e estão disponíveis para todos os pontos finais em um determinado ponto de tempo após a administração.
- Normalizar os valores usando a seguinte equação:
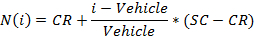
onde i é o valor do sinal medido em bruto de um poço,
O veículo é a média dos valores de sinal medidos para os poços do veículo sobre uma placa,
CR é o valor normalizado médio pretendido para o veículo (0%), e
SC é o valor normalizado médio desejado para os controlos positivos (100),
NOTA: No final deste passo, um conjunto de dados é obtida que contém, para cada posição i na placa de 96 cavidades, uma concentração de C, (em unidades logarítmicas) que foi aplicada à amostra contida na posição / poço I e os seus normalizado correspondente sinal N (I). - Enredo e ajustar a (c i, N (i)) - valores usando uma equação 4-parâmetros Colina.
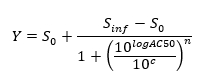
onde Zero Atividade S nível 0 = Actividade na concentração zero de composto de teste,
Nível inf = Atividade infinita Atividade S na concentração infinito,
AC50 = Concentração à qual a actividade atinge 50% do nível máximo,
Coeficiente de Hill n = Medida da inclinação em AC50, e
C = Concentração, em unidades logarítmicas que correspondem aos valores no eixo dos x da curva de dose-resposta trama.
NOTA: AC50 é uma medida de potência, onde valores baixos indicam alta potência.
Resultados
RTCA
Porque os pontos finais HCS não será informativa quando nenhum efeito tóxico é detectada, os compostos não mostram diminuição da viabilidade celular até à concentração máxima no RCTA não são testados por HCS (Figura 3b, c, d, G, K, L, M , p). Os compostos que apresentam diminuição da viabilidade celular em apenas a mais alta concentração (Figura 3e, o) são também desmarcada para HCS. Finalmente, apenas os constituintes com um LD 50 calculável (<20 mM) são seleccionadas para posterior análise HCS (Figura 3a, f, h, j, n). HPHCs que satisfazem os critérios acima são: 1-aminonaphtalene, Arsénio (V), cromo (VI), Crotonaldeído e fenol.
HCS
Como uma verificação de qualidade (QC), os controlos positivos são fiprimeiro analisados para assegurar que o processo de coloração é realizada corretamente. Imagens representativas de células tratadas com o controlo positivo são mostrados na Figura 6. Os valores de dados são normalizados ao veículo, como descrito anteriormente. Sem curvas de resposta à dose são representados como apenas três doses são testadas e não todas as três doses são considerados em cada ponto de tempo. A dose de controlo positivos são seleccionada (com base em experiências anteriores, dados não mostrados), de modo que as respostas apropriadas são observados para cada parâmetro em ambos 4 horas e 24 horas. Em doses particulares 1 e 2 são usados para avaliar o efeito em 4 horas, enquanto as doses 2 e 3 são usados para avaliar o efeito às 24 h. As placas são descartados se nenhuma resposta for observada para as doses de controlo positivo. Note-se que para todos os terminais, excepto o potencial de membrana mitocondrial e conteúdo de GSH, é esperado um aumento da intensidade de sinal.
Todos os compostos, com exceção de Fenol, induziu uma pheno necrótica tipo, com base no aumento da permeabilidade da membrana celular (Figura 7a, F, H, L). 1-aminonaphtalene, crómio (VI), Crotonaldeído e fenol foram identificados como sendo genotóxicos baseado no aumento da fosforilação da histona H2AX (Figura 7e, j, n, p). Fenol e 1-aminonaphtalene foram encontrados para induzir a disfunção mitocondrial grave (Figura 7b, o) que, com 1-aminonaphtalene, levou a um aumento da liberação de citocromo C (Figura 7c). A detecção de um aumento da actividade da caspase 3/7 fornecida evidência de evento de apoptose por exposição crómio. Indução de estresse oxidativo (ROS ou GSH) também foi detectada após tratamento com 1-aminonaphtalene, Crotonaldeído e fenol (Figura 7d, m, q). Finalmente, o arsénio induz o stress celular, como demonstrado pelo aumento da fosforilação do factor de transcrição cJun (figura 7g).
carga / 53987 / 53987fig1.jpg "/>
Figura 1. Composto Tox-Profiler fluxo de trabalho. A) Representação esquemática do fluxo de trabalho seguido neste estudo. Em primeiro lugar, uma determinação de dose-gama foi realizada utilizando a plataforma RTCA para seleccionar as doses apropriadas para a subsequente HCS para caracterizar os perfis de toxicidade específica de composto. B) Desenho experimental do estudo. 24 horas após a semeadura, as células foram dosados e valores de impedância continuamente monitorada durante as 24 horas seguintes, enquanto HCS endpoints foram investigados 4 e 24 horas após a dosagem. Por favor clique aqui para ver uma versão maior desta figura.
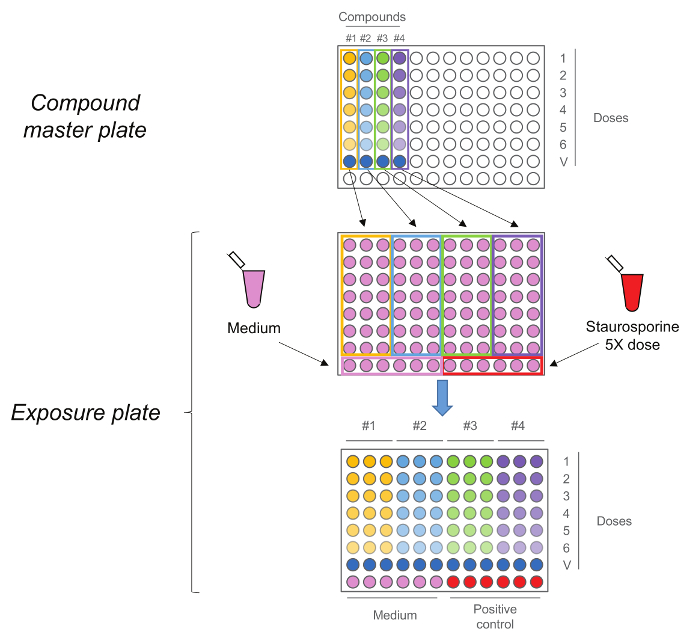
Figura 2. RTCA Placa de Exposição. Placa Composto mestre é gerado pela primeira vez por executar uma de cinco etapas 01:10 série de diluição. Cada composto,incluindo o controlo de veículo (dose 0) são então adicionados em triplicado à placa de exposição em conjunto com o meio e estaurosporina como controlos. Note-se que as doses sequência é mantida após a transferência, doses mais altas estão em linha número 1, enquanto comandos do veículo estão em linha número 7. Por favor clique aqui para ver uma versão maior desta figura.
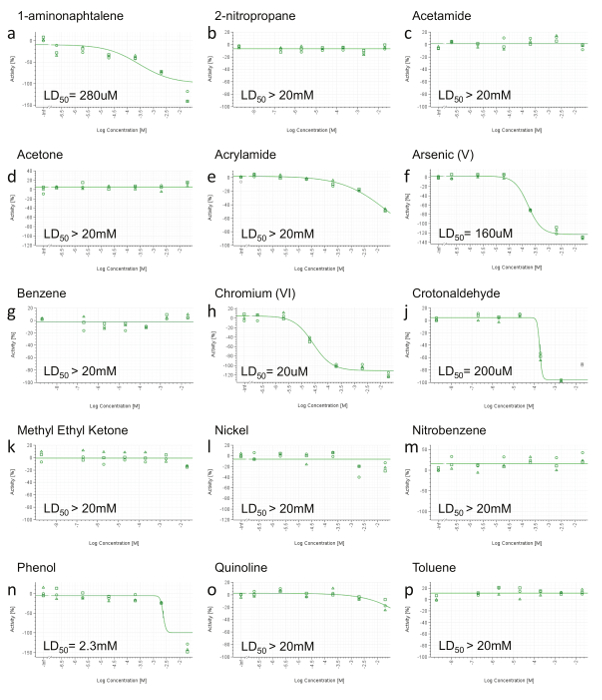
Figura 3. Representante RTCA viabilidade celular Resultados. A) 1-aminonaphtalene, b) 2-nitropropano, c) acetamida, d) de acetona, e) acrilamida, f) arsênio (V), g) benzeno, h) de crómio (VI) , j) crotonaldeído, k) metil etil cetona, l) Nickel (II), m), nitrobenzeno, n) fenol, o) quinolina, p) Adicionou-se tolueno. Em 24 horas após a administração, a área sob a curva (AUC) foi calculada para cada dose (incluindo o controlo positivo e do veículo) e normalizado numa gama de 0 a actividade -100% (eixo y), em que 0 reflecte a actividade de o veículo e -100 do controlo positivo. Os valores foram então representados graficamente e ajustados utilizando uma equação de Hill de quatro parâmetros e, quando possível, LD50 foi calculada. As concentrações são expressas em uma escala log (eixo-x). Por favor clique aqui para ver uma versão maior desta figura.
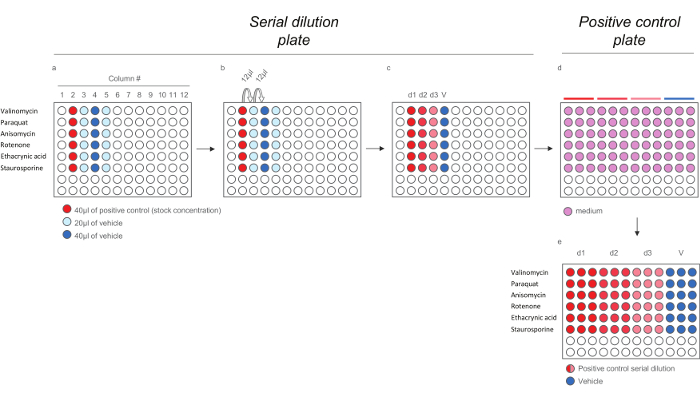
Figura 4. Esquema de diluição para o controlo positivo Compostos para HCS Os ensaios. A) Adição de controlos positivos e veculo para a placa de diluição em série. b) A diluição em série dos controlos positivos. c) 200X controlos positivos doses. DE) Diluição dos 200x doses controlos positivos em meio (1:40) para gerar a placa de controlo positivo contendo as doses 5x. Note-se que cada dose é diluído em triplicado para refletir o layout final na placa de exposição). Por favor clique aqui para ver uma versão maior desta figura.
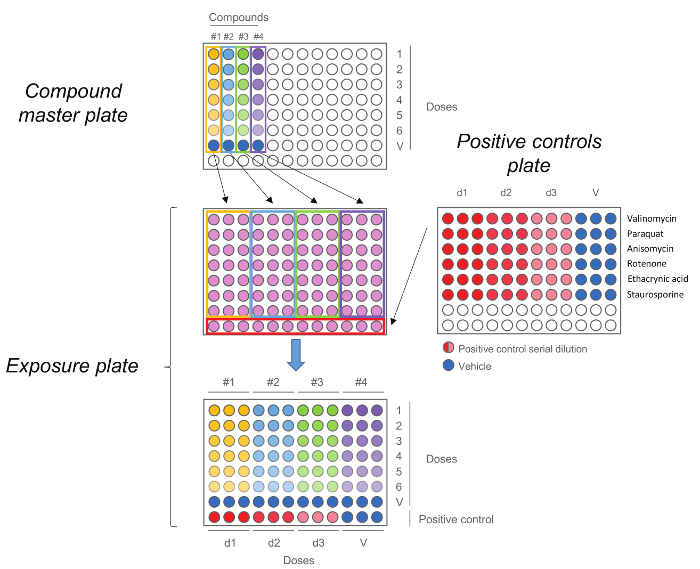
Figura 5. HCS Placa de Exposição. Placa Composto mestre é gerado pela primeira vez por realização de uma diluição de cinco etapas. Cada composto, incluindo o controlo de veículo (dose 0) são então adicionados em triplicado à placa de exposição em conjunto com os controlos positivos. Note que a ordem doses é mantido após a transferência,doses mais elevadas são em número da linha 1 enquanto comandos do veículo estão em linha número 7. Por favor clique aqui para ver uma versão maior desta figura.
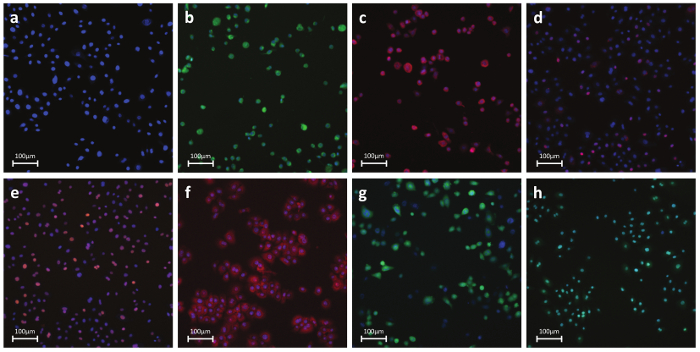
Figura 6. Representante fluorescentes Fotos de anticorpo-ou Dye-manchados Cells a) Parâmetros nucleares - corante Nuclear:. Um corante permeável que se liga ao DNA em células vivas ou fixas. Esta mancha é usada para identificar células individuais de rótulos, a região nuclear b) Necrose - corante permeabilidade da membrana celular:. A detecção à base de corantes de integridade da membrana celular. Reagente é intrinsecamente impermeável à membrana celular. Durante a necrose, a membrana torna-se permeável e o corante entra na célula e liga-se ao ADN produzindo um forte fluorescente s. ignal c) A apoptose - citocromo C: detecção baseada em anticorpo da libertação de citocromo C, uma característica bem conhecida da apoptose precoce. Após a indução de apoptose, citocromo c é libertado a partir da mitocôndria e difunde-se para o núcleo d) de danos de ADN - pH2AX:.. Detecção baseada em anticorpo da fosforilação de H2AX histona, uma característica bem conhecida de quebras duplas ADN de cadeia e) Tensão Quinase - cJun:. detecção baseada em anticorpo da fosforilação em Ser-73 de cJun, uma característica bem conhecida de stress celular f) O stress oxidativo - DHE: detecção à base de corantes de radicais superóxido. -Se Dihydroethidium fluorescente azul no citoplasma, enquanto a forma de etídio oxidado fluorescência vermelha em cima do DNA intercalação g) GSH - mBcl:. Detecção de base de corantes de moléculas de GSH livres. mBcl reage com a GSHgerar um produto altamente fluorescente h) A apoptose - Caspase 3/7 activação:. detecção de base de corantes de 3/7 atividade caspase. Reagente é não fluorescente com um péptido de quatro aminoácidos que inibe a ligação ao ADN. Após a activação de caspase-3/7, o péptido é clivado permitindo que o corante se ligar a ADN e produzir uma resposta brilhante, fluorogénico. Painéis BH mostra células tratadas com controlo positivo. Por favor clique aqui para ver uma versão maior desta figura.
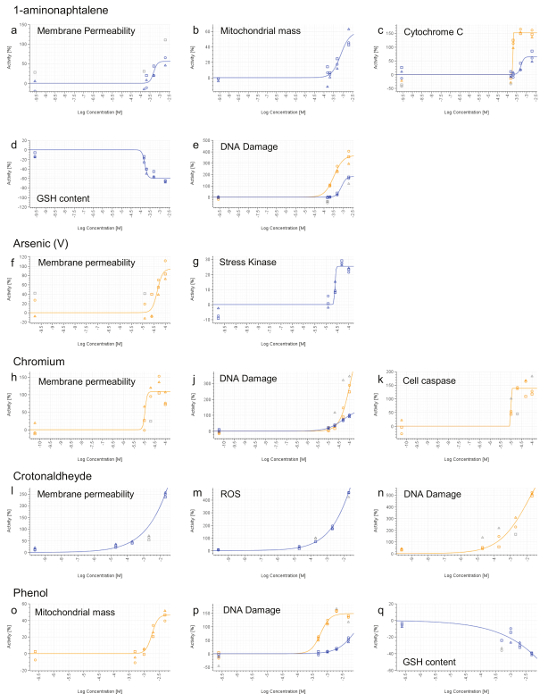
Figura 7. Representante HCS Resultados. 1-aminonaphtalene (ae), Arsénio (V) (F e G), cromo (VI) (hk), Crotonaldeído (ln) e fenol (OQ). 4 h (linha azul) e24 h (linha laranja) sinais foram calculados para cada dose e normalizada para a actividade de veículo (0%). Valores que não estão incluídos na curva cálculos de montagem são mostradas em cinza. As concentrações são expressas em uma escala log (eixo-x). Por favor clique aqui para ver uma versão maior desta figura.
| Ensaio | Endpoint # | endpoint biológica | compartimento celular | recurso de saída |
| citotoxicidade | 1 | Massa mitocondrial 6 | Citoplasma | Mancha área média |
| 2 | Potencial de membrana mitocondrial 6 | Citoplasma | intensidade média local | |
| 3 | liberação do citocromo C 7 | Núcleo | intensidade média | |
| 4 | Permeabilidade da membrana celular 8 | Núcleo | intensidade média | |
| Dano ao DNA | 5 | fosfo-H2AX 9 | Núcleo | intensidade média |
| Kinase estresse | 6 | fosfo-cJun 10 | Núcleo | intensidade média |
| ROS | 7 | ROS 11 | Núcleo | intensidade média |
| conteúdo de GSH | 8 | GSH 12 | Citoplasma | intensidade média local |
| apoptose | 9 | Caspase 3 13 | Citoplasma | intensidade média local |
Tabela 1. Lista de HCS umssays e endpoints.
| Veículo | doses RTCA (uM) | LD 50 | doses HCS | |||||||||||
| Viabilidade celular-seleccionado (uM) | 3R4F (nM) | |||||||||||||
| 1-Aminonaphtalene | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 280? M | 2.000 | 500 | 200 | 150 | 0,27 | |
| 2-nitropropano | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acetamide | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Acetona | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| acrilamida | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Arsénio (V) | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 160 uM | 200 | 100 | 50 | 25 | 0,17 | |
| Benzeno | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| O crómio (VI) | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 20 uM | 100 | 50 | 20 | 10 | 0,06 | |
| crotonaldeído | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 200 uM | 20.000 | 2.000 | 200 | 20 | 2.000 | |
| Metil-etil-cetona | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | >20 mM | ||||||
| Níquel | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| nitrobenzeno | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Fenol | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | 2.300? M | 5.000 | 2.000 | 1.000 | 500 | 240 | |
| quinolina | EtOH | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
| Tolueno | água | 20.000 | 2.000 | 200 | 20 | 2 | 0,2 | > 20 mM | ||||||
Tabela 2. Lista de compostos HPHC testados com o LD Relativa 50 às 24 horas de tratamento. Os compostos selecionados para análise HCS são destacados em laranja e doses testadas também são dadas. A dose 3R4F é equivalente à quantidade de constituinte presente na fumaça de um pedaço de madeira do 3R4F cigarro de referência.
| Ensaio | Composto | Solução stock | Solvente | Dose (s) (uM) | ||
| Viabilidade celular | estaurosporina | 10 mM | DMSO | 50 | ||
| citotoxicidade | valinomicina | 10 mM | DMSO | 50 | 20 | 5 |
| Dano ao DNA | paraquat | 100 mM | DMSO | 500 | 200 | 50 |
| Kinase estresse | anisomicina | 2 mM | DMSO | 10 | 4 | 1 |
| ROS | rotenone | 200 mM | DMSO | 1.000 | 400 | 100 |
| conteúdo de GSH | ácido etacrínico | 200 mM | DMSO | 1.000 | 400 | 100 |
| apoptose | estaurosporina | 40 mM | DMSO | 200 | 50 | 20 |
Tabela 3. Lista de controlos positivos e concentrações utilizadas para cada ensaio.
Discussão
As necessidades de alternativas à experimentação animal e para novas abordagens de teste de alto rendimento têm sido amplamente discutido nos últimos anos. Isso levou os cientistas e autoridades reguladoras para investigar métodos alternativos para os testes de toxicidade padrão, utilizando ensaios celulares que imitam de perto a fisiologia dos tecidos-alvo. Neste estudo, demonstrámos a aplicabilidade da combinação de um analisador de células em tempo real (RTCA) com uma plataforma de alto teor de triagem (HCS) para avaliar o impacto da exposição aos componentes individuais CS em células epiteliais do pulmão humano. Esta configuração pode ser aplicada de forma análoga para avaliar a citotoxicidade induzida por vários outros poluentes transportados pelo ar, partículas transportadas pelo ar, e nanopartículas. Além disso, os resultados obtidos podem ser combinados com os de transcriptomics todo o genoma e métodos computacionais baseados em redes biológicas causais. Como relatado anteriormente, esta abordagem permitiu-nos para corroborar os dados sobre caminho molecularperturbação após exposição CS 5 com endpoints HCS, abordando estas perturbações via também fenotipicamente.
Como um ensaio de fluxograma, análise de células em tempo real fornece informação relacionada com a viabilidade celular em uma resolução dose e tempo-dependente, que permite uma melhor tomada de decisão que a dose e ponto de tempo de exposição pode ser favorável para a análise a jusante 14. O princípio do analisador depende de alterações na impedância eléctrica produzida pelas células que atribuem e espalhada sobre uma superfície de cultura bem coberto com um microeléctrodo de ouro. A impedância é convertido num parâmetro adimensional denominada célula-índice, que pode ser usado para monitorar a adesão celular, espalhamento, morfologia e, finalmente, a viabilidade celular. Embora esta técnica não fornece informação sobre os mecanismos citotóxicos, a sua sensibilidade permite a detecção de mudanças morfológicas celulares, mesmo em doses muito baixas em que o HCS não é informativo (dados não mostrados). Com base na PREVIexperimentos ous, observamos que a metodologia RTCA é capaz de detectar alterações morfológicas em doses mais baixas em comparação com os endpoints HCS.
Seguindo triagem inicial com o analisador de células em tempo real, uma plataforma HCS foi utilizado para obter informações mais detalhadas sobre o tipo de citotoxicidade provocada por cada HPHC. O painel de ensaio HCS permitido ao perfil HPHCs para seu potencial impacto sobre compartimentos celulares / organelas, bem como para identificar aqueles provocando genotoxicidade ou estresse oxidativo. A análise revelou perfis distintos em que as HPHCs selecionados induzem citotoxicidade nas células NHBE. Em geral, todos os compostos, excepto Fenol, foram encontrados para induzir a necrose nas doses testadas mais elevadas. Consistente com um potencial papel no desenvolvimento do cancro 1-aminonaphtalene fosforilação induzida de H2AX como um marcador para a genotoxicidade, no entanto, o painel HCS também descoberto actividade deste HPHC na leitura da toxicidade mitocondrial (massa aumentada e citocromo C releaSE) e estresse oxidativo (depleção de GSH). Da mesma forma, como anteriormente descrito, o fenol foi identificado para induzir disfunção mitocondrial, e causar danos no DNA, bem como o esgotamento de GSH. Crómio (VI), um dos compostos classificados como cancerígenos grupo I, e Crotonaldeído também foram ambos identificados como genotóxica, em particular, o cromo (VI) também induziu apoptose (caspase ativação em cascata) e Crotonaldeído causou aumento da geração de ROS. Finalmente arsênio (V), foi encontrada para induzir cJun fosforilação que é um marcador de activação da via cinase de stress.
Neste estudo, utilizou-se células NHBE como um modelo para as células epiteliais do pulmão in vitro. Usando essas células em um ambiente HCS é sem precedentes e permitiu a investigação de uma gama mais ampla de endpoints, incluindo marcadores de genotoxicidade e estresse oxidativo. Ambos células vivas e abordagens de coloração de células fixadas foram descritos nos nossos protocolos, que demonstra a flexibilidade da técnica geral. na fato, os mesmos protocolos pode ser aplicado a uma ampla gama de alvos, que pode ser endereçado pela utilização de qualquer corante fluorescente ou um anticorpo. Para a execução com sucesso dos protocolos de coloração vivo, é importante respeitar o tempo de incubação, como alguns dos corantes têm uma meia-vida limitada e o sinal de fluorescência pode diminuir antes da aquisição de imagem está completado. É também importante ter em conta que, se um tipo de célula diferente é utilizado, todas as condições de coloração devem ser reavaliados, como a concentração de corante óptima e o tempo de incubação pode ser diferente.
No presente trabalho, descrevemos um cenário em que apenas cinco compostos em que rastreados com a metodologia HCS. Considerando-se a disposição da placa anteriormente descrita, eles foram doseados mais de dois conjuntos diferentes de placas para um total de 24 placas (6 ensaios e 2-pontos de tempo) .O número de placas também pode ser aumentado, permitindo deste modo para o rastreio simultâneo de mais compostos ou os investigação de mais pontos de extremidade. Antes de o fazer, no entanto, deve-se tomar em consideração que certos pontos de extremidade (GSH e ROS) requerem aquisição imediata, e, como consequência, a dosagem das placas deve ser executada de forma escalonada para permitir a aquisição da placa anterior. Por outro lado, usando um protocolo de coloração de células fixadas representa uma vantagem que as placas podem ser empilhadas, interrompendo o protocolo em qualquer passo, após a fixação, para a conclusão do processo de coloração, numa fase posterior. Esta abordagem, por exemplo, que proporcionam ao operador o tempo para concluir todas as placas de coloração celular ao vivo, sem comprometer a qualidade dos dados.
Para optimizar ainda mais o fluxo de trabalho através da diminuição do número de placas, seria também possível multiplexar ponto de extremidade mais juntos. Por exemplo, neste danos DNA contexto e estresse Kinase puderam ser investigadas em conjunto simplesmente usando anticorpo secundário dois com fluorocromos que emitem em diferentes channels. O desenvolvimento contínuo da plataforma HCS, incluindo a semeadura totalmente automatizado de células, diluição do composto, de dosagem e de coloração, assim como a adição de novos pontos de extremidade irá expandir ainda mais a capacidade da plataforma de HCS como uma ferramenta de perfil poderosa para HPHCs sobre epiteliais e outros tipos de células .
Divulgações
Todos os autores são funcionários da Philip Morris International. Philip Morris International é a única fonte de financiamento e patrocinador deste projeto.
Agradecimentos
Os autores gostariam de agradecer Karsta Luettich e Grégory Vuillaume para a sua revisão do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Cellomics ArrayScan VTI HCS Reader | Thermo | N01-0002B | |
| xCelligence RTCA MP | ACEA | 05331625001 | |
| Screener (HCS) | Genedata | NA | |
| CASY counter TTC | Roche | 05 651 719 001 | |
| e-Plates VIEW 96 | ACEA | 06 472 451 001 | |
| RTCA Frame 96 | ACEA | 05232392001 | |
| RTCA Cardio Temperature Tool | ACEA | 2801171 | |
| Plate sealer breathseal | Greiner bio-one | 676051 | |
| Normal Human Bronchial Epithelial cells (NHBE) | Lonza | CC-2540 | non-smoking 60-year-old Caucasian male donor |
| BEGM BulletKit | Lonza | CC-3170 | Warm at 37 °C before use |
| ReagentPack Subculture Reagents kit | Lonza | CC-5034 | Warm at 37 °C before use |
| Penicillin/Streptomycin (100x) | Corning | 30-002-CI | |
| Easy Flask filter cap 75 cm2 | Thermo Scientific | 12-565-349 | |
| 96 well assay plate black | Corning | 3603 | |
| Hoechst 33342 | Fisher Scientific | PI-62249 | |
| Draq5 (For Far Red Nuclear Staining) | Biostatus | DR50200 | |
| Mitochondrial Dye: MitoTracker Red CMXRos | Life technologies | M-7512 | |
| Mitochondrial Dye: MitoTracker Red CM-H2XRos | Life technologies | M-7513 | |
| ROS Dye: Dihydroethidium | Sigma | D7008 | |
| ROS Dye: CellROX | Life technologies | C10422 | |
| ROS Dye: MitoSOX | Life technologies | M36008 | |
| GSH Dye: Monochlorobimane | Sigma | 69899 | Toxic |
| GSH Dye: Monobromobimane | Life technologies | M-1378 | Toxic |
| Membrane permeability Dye: YO-PRO-1 | Life technologies | Y3603 | Irritating |
| Membrane permeability Dye: TO-PRO-1 | Life technologies | T3602 | Irritating |
| Membrane permeability Dye: TOTO-1 | Life technologies | T3600 | Irritating |
| Caspase Dye: Cellevent Caspase 3/7 green | Life technologies | C10423 | Irritating |
| Anti-Cytochrome C antibody (Mouse) | Thermo | MA5-11823 | |
| Anti-phospho-c-Jun antibody (Mouse) | Thermo | MA5-15889 | |
| Anti-phospho-H2AX antibody (Mouse) | Thermo | MA1-2022 | |
| Goat anti-Mouse IgG DyLight 650 | Abcam | ab96878 | |
| 10x permeabilization buffer | Fisher | 8408400 | |
| 4% Formaldehyde solution | Sigma | F1635 | Toxic |
| 10x blocking buffer | Fisher | 8408500 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma | D8537 | |
| Hanks' Balanced Salt solution | Sigma | H8264 | |
| Staurosporine | Sigma | S4400 | Toxic |
| Valinomycin | Sigma | V0627 | Toxic |
| Paraquat | Sigma | 36541 | Toxic |
| Anisomycin | Sigma | A9789 | Toxic |
| Ethacrynic acid | Sigma | E4754 | Toxic |
| 1-Aminonaphthalene | Sigma | 34390 | Toxic |
| 2-Nitropropane | Sigma | 130265 | Toxic |
| Acetamide | Sigma | 695122 | Toxic |
| Acetone | Sigma | 650501 | Toxic |
| Acrylamide | Sigma | A9099 | Toxic |
| Arsenic (V) | Sigma | A6756 | Toxic |
| Benzene | Sigma | 12540 | Toxic |
| Chromium (VI) | Sigma | 216623 | Toxic |
| Crotonaldehyde | Sigma | 262668 | Toxic |
| Methyl ethyl ketone | Sigma | 34861 | Toxic |
| Nickel | Sigma | 203866 | Toxic |
| Nitrobenzene | Sigma | 48547 | Toxic |
| Phenol | Sigma | P5566 | Toxic |
| Quinoline | Sigma | 241571 | Toxic |
| Toluene | Sigma | 34866 | Toxic |
Referências
- Rodgman, A., Perfetti, T. A. The chemical components of tobacco and tobacco smoke. , CRC Press. Boca Raton, FL. (2013).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen, London. (1959).
- Zock, J. M. Applications of high content screening in life science research combinatorial chemistry & high throughput screening. Comb. Chem. High. Throughput. Screen. 132 (9), 870-876 (2009).
- US Food and Drug Administration. Harmful and potentially harmful constituents in tobacco products and tobacco smoke; established list, federal register. , 20034-20037 (2012).
- Gonzalez-Suarez, I. Systems Biology Approach for Evaluating the Biological Impact of Environmental Toxicants in Vitro. Chem. Res. Toxicol. 27 (3), 367-376 (2014).
- Camilleri-Broet, S., Vanderwerff, H., Caldwell, E., Hockenbery, D. Distinct alterations in mitochondrial mass and function characterize different models of apoptosis. Exp. Cell. Res. 239 (2), 277-292 (1998).
- Li, P., et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates and apoptotic protease cascade. Cell. 91 (4), 479-489 (1997).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. Double strand breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273 (10), 5858-5868 (1998).
- Westwick, J. K., Weitzel, C., Minden, A., Karin, M., Brenner, D. A. Tumor necrosis factor α stimulates AP-1 activity through prolonged activation of the c-jun kinase. J. Biol. Chem. 269 (42), 26396-26401 (1994).
- Bindokas, V. P., Jordán, J., Lee, C. C., Miller, R. J. Superoxide production in rat hippocampal neurons: selective imaging with hydroethidine. J. Neurosci. 16 (4), 1324-1336 (1996).
- Barhoumi, R., Bailey, R. H., Burghardt, R. C. Kinetic analysis of glutathione in anchored cells with monochlorobimane. J. Cytometry. 19 (3), 226-234 (1994).
- Huang, T. C., Lee, J. F., Chen, J. Y. Pardaxin an antimicrobial peptide, triggers caspase-dependent and ROS-mediated apoptosis in HT-1080 Cells. Mar. Drugs. 9 (10), 1995-2009 (2011).
- Bao, S., Knoell, D. L. Zinc modulates cytokine-induced lung epithelial cell barrier permeability. Am. J. Physiol. Lung Cell Mol. Physiol. 291 (6), L1132-L1141 (2006).
- Xia, M., et al. Compound Cytotoxicity Profiling Using Quantitative High-Throughput Screening. Environ Health Perspect. 116 (3), 284-291 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados