Method Article
Die Erzeugung von Unreife, Ältere und Tolerogene Dendritischen Zellen mit unterschiedlichen Metabolic Phänotypen
In diesem Artikel
Zusammenfassung
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
Zusammenfassung
Immunantwort resultiert aus einem komplexen Zusammenspiel zwischen dem Antigen unspezifische angeborene Immunsystem und das Antigen spezifisch adaptive Immunsystem. Das Immunsystem ist ein ständiges Gleichgewicht bei der Aufrechterhaltung Toleranz gegenSelbstMolekülen und schnell auf Pathogene zu reagieren. Dendritische Zellen (DCs) sind leistungsfähige professionelle Antigen-präsentierende Zellen, die das angeborene Immunsystem an das adaptive Immunsystem verknüpft und die adaptive Reaktion zwischen Selbst und Nicht-Selbst balancieren. Je nach Reife Signale können unreife dendritische Zellen selektiv in immunogene oder tolerogen DCs zu unterscheiden stimuliert werden. Immunogene dendritische Zellen bereitzustellen Proliferationssignale zu Antigen-spezifischen T-Zellen für die klonale Expansion; während tolerogenen Toleranz regulieren dendritischen Zellen durch Antigen-spezifische T-Zell-Deletion oder klonalen Expansion von regulatorischen T-Zellen. Aufgrund dieser einzigartigen Eigenschaft, sind stark dendritischen Zellen nach als therapeutische Mittel für Krebs und Autoimmun dise gesuchtAses. Dendritische Zellen können mit spezifischen Antigenen in vitro und injiziert in den menschlichen Körper zu montieren , eine spezifische Immunantwort sowohl immunogen und tolerogenen geladen werden. Diese Arbeit stellt ein Mittel in vitro aus Monozyten, unreifen Monozyten - abgeleiteten dendritischen Zellen (MoDCs), tolerogen und reifen MoDCs zu erzeugen , die in Oberflächenmarker Ausdruck, Funktion und Stoffwechsel-Phänotypen unterscheiden.
Einleitung
DC wurde zuerst von Paul Langerhans'schen (Langerhans - Zellen) im späten neunzehnten Jahrhundert beschrieben , wie durch Jolles 1 und gekennzeichnet durch Ralph Steinman und Zanvil Cohn 1973 verwiesen , die sie als professionelle Antigen präsentierende Zellen 2 erkannt. DCs sind im peripheren Blut und in den meisten Geweben des Körpers, besonders reichlich in Geweben zu finden, die der äußeren Umgebung ausgesetzt sind, wie beispielsweise der Haut (vorliegend als Langerhans-Zellen) und in den Auskleidungen der Nase, Lungen, Magen und Darm, die ermöglichen, sie extrinsische Antigene zu begegnen. Unreife DCs haben endocytic Fähigkeit aber eine relativ geringe Kapazität T - Zellen 3 zu stimulieren. Unreife DCs exprimieren verschiedene Mustererkennungsrezeptoren (PRR) , dass der Fang pathogen-associated molecular patterns (PAMPs) oder Schaden-associated molecular patterns (Damps) 4. Die Aktivierung Gefahrensignale treiben Reifung in Richtung immunogene DCs während Selbst Moleküle führen zu T-Zell-unresponsiveness und Apoptose 5. Immunogene DCs werden durch die Hochregulierung von MHC - Molekülen und costimulatorischen Oberflächenmoleküle und ihre Fähigkeit zum Primen naiven T - Zellen 6,7 charakterisiert.
Unreife DCs können auch in Richtung einer Treg-Induktion oder tolerogen Zustand als Reaktion auf Vitamin D3 - Metabolit 1a, 25 (O) 2 D 3 und bestimmten Immunsuppressiva wie Interleukin-10 (IL-10), Dexamethason und Rapamycin 8-9 fällig werden. Tolerogen DCs sind durch ihre Expression von immunoreceptor Tyrosin-basierte inhibitorische Motive (ITIMs), die Oberflächenrezeptoren und Liganden charakterisiert. Die Signaltransduktion von ITIMs enthält ILT Familienmitglieder, ILT3 und ILT4 in tolerogen DCs hemmen alloproliferation und fahren Foxp3 + Treg Expansion 10,11. Diese einzigartigen Eigenschaften von tolerogen DCs führen zu ihrer tiefen Potenz in vivo, nämlich die Fähigkeit , dauerhaft Toleranz gegenüber transplantierten allogenen Transplantaten zu induzieren und suppress die Entwicklung von Autoimmunerkrankungen. Tolerogenen DCs können daher als Subtyp von reifen DCs polarisierten angesehen werden, die bei der Hemmung der Immunaktivierungsfunktion.
Derzeit gibt es zwei allgemeine Untergruppen von dendritischen Zellen in humanem peripherem Blut: plasmazytoiden DCs und myeloide DCs 12. Zirkulieren DCs sind selten konstituierenden auf weniger als 2% der Leukozyten im menschlichen Blut und dies stellt eine Schwierigkeit auf die Isolierung von einer entsprechenden Anzahl von DCs ihre immunregulatorischer Funktionen zu untersuchen. Zur Überwindung dieses Problems, Monozyten differenziert DCs werden als in vitro Modell für die Untersuchung der dendritischen Zellfunktion verwendet. Diese in - vitro - DCs haben ähnliche Rezeptoren und Funktionen im Vergleich zu in - vivo - DCs. Detaillierter Vergleich von in - vivo - DCs und in vitro erzeugte monozytenabgeleitete DCs (MoDCs) werden von anderen Laboratorien untersucht 13, 14, 15. Es wird auch berichtet, dass MoDCs und CD1c + DCs waren äquivalent zu Antigen - präsentierenden und induziert T - Zell - Funktion 15.
In diesem Papier beschreiben wir ein Verfahren zur unreifen MoDCs aus Monozyten im peripheren Blut zu erzeugen und sie dann in immunogen und tolerogen DCs differenzieren. Diese Monozyten abgeleitete dendritische Zellen (MoDCs) sind durch ihre Oberflächenmarker, Zytokin-Profil, immunregulatorischer Funktionen und metabolischer Zustände charakterisiert. Immunogen und tolerogen erzeugen dendritische Zellen unterschiedliche Zytokine, die entweder allogenen T-Zellen oder regulatorischen T-Zellen in den Ausbau der zur Folge haben. In diesem Papier wird Zytokin Profilierung mit Systemen unter Verwendung von Multiplex-Technologie ausgeführt. Das Wachstumsmedium der Zellen mit Antikörper immobilisiert farbcodierten Kügelchen inkubiert und in einem kompakten Analysator lesen. Metabolic Staaten von DCs verwenden extrazellulären Fluss Analysatoren analysiert, die Sauerstoffverbrauchsrate zu messen, ein Indikator für die Zellatmung und extrazelluläre Ansäuerung Rate, die glykolytischen reflektiertFlußmittel in dendritischen Zellen. Die Messung dieser Bioenergetik Raten liefert ein Mittel, um die Änderungen in den Zellstoffwechsel, die in dendritischen Zellen die Entwicklung und Funktion von entscheidender Bedeutung sind zu verfolgen.
Protokoll
Diese Forschung wurde von der Institutional Review Board (NUS-IRB - 10-250) zugelassen.
1. Isolation von peripheren mononukleären Blutzellen (PBMCs)
- Herstellung von Reagent
- Bereiten PBS / EDTA: Phosphat-gepufferte Salzlösung (PBS) und ergänzt mit 2 mM Ethylendiamintetraessigsäure (EDTA). Sterilisieren dieser Lösung durch Filtration durch einen 0,2 um-Filter. Anmerkung PBS / EDTA bei 4 ° C und erwärme auf Raumtemperatur vor dem Gebrauch zu lagern.
- Bereiten Färbepuffer: phosphatgepufferter Kochsalzlösung (PBS) Ergänzung mit 2% fötalem Rinderserum (FBS), 10 mM 4- (2-Hydroxyethyl) -1-piperazinethansulfonsäure (HEPES) und 2 mM Ethylendiamintetraessigsäure (EDTA). Sterilisieren dieser Lösung durch Filtration durch einen 0,2 um-Filter.
- Sammeln Sie Blut von Blut Cone
Hinweis: Der Blut Kegel enthält weiße Blutkörperchen Komponenten nach Platte gesammeltletpheresis aus dem Krankenhaus. Wenn Blut in Heparin oder EDTA-Röhrchen gesammelt, verdünnte Blut mit PBS in 1: 1-Verhältnis und gehen Sie zu Schritt 1.3 umgesetzt; wenn Leukozytenmanschette empfangen wird, verdünnen Leukozytenmanschette mit PBS in Verhältnis 1: 2 und gehen Sie zu Schritt 1.3 umgesetzt.- Geschnitten, um die beiden Enden des Kegels Blut zu erlauben, in eine 50 ml Röhre ausströmen. Beachten Sie, dass der Kegel in der Regel 10 ml Blut enthält.
- Verwenden Sie ein stumpfes Ende Spritze mit 30 ml PBS / EDTA den Kegel zu waschen und in einem 50-ml-Röhrchen zu sammeln.
- Verdünnte Blut weiter mit PBS / EDTA zu einem Endvolumen von 80 ml.
- Isolierung von PBMCs durch Dichtezentrifugation 16
- Aliquotieren 15 ml Ficoll jeweils bis zu 4 neue 50-ml-Röhrchen.
- Verwenden Sie eine 25 ml serologische Pipette 20 ml verdünntes Blut hinzuzufügen über die Ficoll-Schicht. Beachten Sie die 50-ml-Röhrchen in einem 45 Winkel zu halten und darauf achten, nicht der Inter stören.
- Zentrifugieren Sie die Röhrchen bei 805 xg ohne Bremse für 30 min, 20 ° C.
- Entferne dasPlasmaschicht und den Ring von PBMCs sammeln knapp unterhalb der Plasmaschicht mit einer Pasteur-Pipette liegen. Kombinieren Sie vier Röhren von PBMCs in zwei 50-ml-Röhrchen. Hinweis zu vermeiden, dass die transparente Schicht unterhalb der PBMCs zu sammeln.
- Hinzufügen PBS / EDTA zu einem Endvolumen von 50 ml pro Röhrchen von PBMCs und Zentrifuge bei 548 xg mit Bremsen für 10 min, 20 ° C.
- Absaugen Überstand und Pellet in jedem Röhrchen mit 25 ml Färbepuffer und verbinden sich in einem 50 ml Röhrchen.
- Zentrifuge bei 367 xg mit Bremsen für 5 min, 4 ° C.
- Absaugen Überstand und Pellet mit 10 ml Färbepuffer.
2. Monozyten Anreicherung durch magnetische Trennung 17
- Bestimmen Sie Cell Number
- Nehmen Sie 20 ul PBMC Zellsuspension und mischen sich mit 20 ul Trypanblau die Anzahl der lebenden Zellen zu zählen, mit cytometer.
- Centrifuge Zellsuspension bei 367 · g mit Bremsenfür 10 min, 4 ° C.
- Absaugen Überstand vollständig und resuspendieren Zellpellet in einer Konzentration von 10 7 Zellen pro 80 & mgr; l Färbepuffer.
- Magnetische Labeling
- In 20 ul CD14 Microbeads pro 10 7 Zellen, gut mischen und Inkubation für 15 min bei 2 - 8 ° C.
- Waschen Sie die Zellen durch Zugabe von 1 ml Färbepuffer pro 10 7 Zellen und Zentrifugation bei 367 xg mit Bremsen für 10 min, 4 ° C.
- Absaugen Überstand vollständig und resuspendieren Zellpellet in einer Konzentration von 10 7 Zellen pro 50 & mgr; l Färbepuffer.
- Magnetic Separation
- Verwenden mittlerer Größe Spalte für maximal 2 x 10 8 Zellen insgesamt.
Hinweis: Wählen eines geeigneten Spalte und des Separators entsprechend der Anzahl der Gesamtzellen und der Zahl der CD14 + -Zellen in dem Datenblatt empfohlen. - Platzieren Säule in das Magnetfeld ofa geeigneten Abscheider und Kolonne herzustellen, indem man mit 500 & mgr; l Färbepuffer Spülen.
- Pipette Zellsuspension auf Spalte und unmarkierten Zellen zu sammeln, die mit einem 15-ml-Röhrchen durch die Säule passieren.
- Ersetzen Sie eine neue 15-ml-Röhrchen unter Säule und Waschsäule 3-mal mit 500 ul Färbepuffers. Stellen Sie sicher, dass die Spalte Reservoir vor dem Hinzufügen neuer Färbepuffers zwischen Wäschen leer ist.
- Entfernen Sie Spalte aus dem Separator und legen Sie es auf einem frischen 15-ml-Tube.
- Pipette 1 ml Färbepuffer auf die Säule. spülen Sie sofort die magnetisch markierten Zellen, indem Sie den Kolben drücken und in die Säule (im Kit enthalten).
- Wiederholen Sie die Schritte 2.3.2 bis 2.3.6 der eluierten Fraktion unter Verwendung von auf einer neuen Spalte die Reinheit der CD14 + Zellen zu erhöhen. Beachten Sie, dass die Perlen werden aus den Zellen automatisch in der Kultur während der Stufe 3.2 freigegeben.
- Verwenden mittlerer Größe Spalte für maximal 2 x 10 8 Zellen insgesamt.
3. Differenzierung dendritischer Zellen zu unterschiedlichen Aktivierungs STates
- Herstellung von Reagenz (Endotoxinwert weniger als 0,1 EU / ml in allen Reagenzien zu sein)
- Bereiten Zellkulturmedium: RPMI 1640, ergänzt mit 10% fötalem Rinderserum (FBS), 1% nicht-essentielle Aminosäuren (NEAA) und 0,05 mM 2-Mercaptoethanol (2ME). Sterilisieren dieser Lösung durch Filtration durch einen 0,2 um-Filter.
- Bereiten Zytokine: Rekonstitution IL-4 und GM-CSF in Zellkultur-Wasser auf eine Konzentration von 0,25 mg / ml unter aseptischen Bedingungen. Aliquotieren Zytokine in 200 & mgr; l-Mikrozentrifugenröhrchen und bei -80 ° C.
- Bereiten Sie Vitamin D3 Lager: Rekonstitution Vitamin D3 in Zellkultur-Wasser zu einer Konzentration von 100 mM unter aseptischen Bedingungen. Aliquotieren Vitamin D3 in 1,5 ml Mikrozentrifugenröhrchen und bei -20 ° C.
- Bereiten Sie Dexamethason Lager: Rekonstitution Dexamethason in Zellkultur-Wasser zu einer Konzentration von 10 mM unter aseptischen Bedingungen. Aliquotieren dexamethasOne in 1,5 ml Mikrozentrifugenröhrchen und bei -20 ° C.
- Bereiten LPS: Rekonstitution Lipopolysaccharide (LPS) in Zellkultur-Wasser auf eine Konzentration von 1 mg / ml unter aseptischen Bedingungen. Aliquotieren LPS in 1,5 ml Mikrozentrifugenröhrchen und bei -20 ° C.
- Erzeugung unterschiedlicher MoDCs
- Seed 4 Sätze von CD14 + Monocyten in einer Konzentration von 0,3 bis 0,5 x 10 6 / ml Zellkulturmedium , ergänzt mit 200 ng / ml GM-CSF und 200 ng / ml IL-4 in 6 - Well - Platten. Beachten Sie, dass dies Tag 0 und das Volumen des Mediums in jeder 6 Vertiefungen beträgt 2 ml.
- Inkubiere Zellen in Gewebekultur - Inkubator bei 37 ° C mit 5% CO 2.
- Entfernen 850 ul Medium aus der Kultur am Tag 4 und Zentrifuge bei 300 × g für 5 min, 4 ° C. Überstand entfernen und Pellet in 1 ml Zellkulturmedium, das 2x von (200 ng / ml GM-CSF und 200 ng / ml IL-4). Fügen Sie diese Zellmischung zurückzu der Kultur. Man beachte, dass 2x Konzentration zugegeben für GM-CSF und IL-4 wird 1x werden, wenn die 1 ml Medium wieder in die Kultur gegeben.
- 1 & mgr; l von Vitamin D3 Lager und 1 ul von Dexamethason Lager pro ml Medium zu zwei der Sätze an Tag 5 bis tolerogen MoDCs erzeugen. Man beachte, dass die Endkonzentration von Vitamin D3 100 nM Dexamethason und 10 nM; Zugabe von GM-CSF und IL-4 nicht an Tag 5 erforderlich.
- In 200 ng / ml GM-CSF und 200 ng / ml IL-4 an alle Sätze an Tag 6.
- 1 & mgr; g / ml LPS zu einem der behandelten Sätze mit nur GM-CSF und IL-4 an Tag 6 zu reifen MoDCs erzeugen.
- 1 & mgr; g / ml LPS zu einem Satz der tolerogen MoDCs am Tag 6 nach LPS-tolerogen MoDCs erzeugen.
- Ernte der verschiedenen Arten von MoDCs am Tag 7 durch Spülen Kulturschale mit PBS, EDTA für die Durchflusszytometrie oder anderen Untersuchungen. Beachten Sie, dass nur nicht-adhärenten Zellen geerntet werden. Beachten Sie, dass prozentuale Ausbeute von CD14 + Mono - Cytes für unreife MoDCs, reifen MoDCs, tolerogen MoDCs und LPS-tolerogen DCs sind etwa 90%, 50%, 60% bzw. 60% und variiert zwischen Blutspendern und FBS viel.
4. Durchflusszytometrie
- Zelloberflächenmarker Charakterisierung auf MoDCs
- Trennen Zellen aus Kulturschale durch Pipettieren. Waschen Sie die Zellen einmal mit PBS / EDTA und resuspendieren Zellen in einer Konzentration von 5 x 10 5 Zellen pro 50 & mgr; l Färbepuffer in 1,5 ml Mikrozentrifugenröhrchen.
- Inkubieren 0,5 x 10 6 Zellen Aliquots mit PerCP-konjugiertem HLADR (1: 100), PE-konjugierten CD80 (1:50), PE-konjugierten CD83 (01.25), PE-konjugierten CD86 (1:50), APC- konjugierten CD11c (1:50), PE-konjugierten CD14 (1:50) und PE-konjugiertem BDCA3 (1:50) und APC-konjugiertem ILT3 (01.25) in der Dunkelheit für 30 min bei 4 ° C. Isotyp-PerCP konjugierten MAb (1:20), PE-konjugierten MAb (1,11), APC-konjugierte MAb (1,11) als negative Kontrollen dienen.
- Erfassen die Expressionsniveaus der Oberflächenmarker eines Durchflusszytometers 18 verwendet wird .
- Die Analyse der Mitochondrien Membranpotential von MoDCs
- Vorbereitung Stammlösung von 1 mM Red Chloromethyl-X-rosamine (CMXRos) durch Zugabe von 94,1 & mgr; l Dimethylsulfoxid (DMSO) pro 50 ug lyophilisierte Red CMXRos.
- Inkubieren Sie 2 x 10 5 MoDCs mit 100 nM Red CMXRos in 1 ml Hanks Balanced Salt Solution (HBSS) für 30 min bei 37 ° C in 15 ml Röhrchen.
- 2 ml PBS / EDTA zu den Zellen und Zentrifuge bei 300 × g für 5 min, Raumtemperatur. Wiederholen 2 mal. Überstand absaugen und resuspendieren Zellpellet in 300 ul PBS, EDTA, 2% FCS für die Durchflusszytometrie-Analyse. Beachten Sie PE-Kanal zu verwenden, um Red CMXRos Signal zu analysieren.
- Marker Charakterisierung von T-Zellen
- Inkubiere 50 ul 1,2 x 10 6 CFSE-markierten allo CD4 + T-Zellen (generiert ausSchritt 5.6) mit PerCP-konjugiertem CD3 (1: 200), PE / Cy7-konjugiertes CD4 (1: 400) und APC / Cy7-konjugierten CD25 (1: 100) in der Dunkelheit für 30 min bei 4 ° C. Stain T-Zellen eines kommerziellen Kits mit Foxp3-Alexa Fluor 647 (1:50) im Dunkeln für 1 Stunde bei Raumtemperatur verwendet wird.
5. Alloreaktion Studies
- Bereiten 5 mM Stammlösung von Carboxyfluoresceinsuccinimidylester (CFSE) von 18 & mgr; l DMSO Zugabe CFSE zu lyophilisiert, gemäß dem Protokoll des Herstellers.
- Reinige CD4 + T-Zellen aus PBMCs
- Bestimmen der Zellzahl von 20 & mgr; l von PBMC Zellsuspension zu nehmen und mit 20 ul Trypanblau mischen, um die Anzahl der lebenden Zellen zu zählen ein Zytometer verwenden.
- Centrifuge Zellsuspension bei 367 · g mit Bremsen für 10 min, 4 ° C.
- Absaugen Überstand vollständig und resuspendieren Zellpellet in einer Konzentration von 5 x 10 7 Zellen pro 1 ml Färbepuffer in einem 5 ml polystyrene Rohr.
- Human CD4 + T - Zell - Anreicherung Cocktail bei 50 & mgr; l / ml Zellen. Gut mischen und bei Raumtemperatur (15 - 25 ° C) für 10 min.
- Vortex magnetischen Teilchen für 30 Sekunden und fügen magnetischen Teilchen bei 100 & mgr; l / ml Zellen. Gut mischen und bei Raumtemperatur für 5 min.
- Hinzufügen Färbepuffer zu der Zellsuspension bis zu einem Gesamtvolumen von 2,5 ml. Mischen Sie die Zellen in das Röhrchen durch vorsichtiges Pipettieren auf und ab 2 - 3 mal. Das Röhrchen wird in den Magneten und Inkubation für 5 min.
- Invert-Magnet mit Schlauch und dekantiert die Suspension (enthält T-Zellen) in eine neue 5 ml Polystyrolröhrchen.
- Bestimmen die Zellzahl und inkubieren 1,2 x 10 6 CD4 + T-Zellen mit 5 & mgr; M CFSE in 1 ml PBS für 20 min bei 37 ° C, vor Licht geschützt.
- Hinzufügen fünfmal der ursprünglichen Färbung Volumen Zellkulturmedium (hergestellt nach Schritt 3.1.1) zu den Zellen und Inkubation für 5 min.
- Zentri- fugalkrUGE bei 300 xg für 5 min, 4 ° C und Pellet in Zellkulturmedium in einer Konzentration von 2 x 10 5 pro 75 & mgr; l.
- Hinzufügen , 75 ul 2 x 10 5 CFSE-markierten CD4 + T-Zellen zu jeder MODC Kultur , die 75 & mgr; l Zellkulturmedium mit 0, 2,5 x 10 3, 5 × 10 3, 10 x 10 3, 20 x 10 3 und 40 x 10 3 MoDCs in 96 - Well - U-Bodenplatten. Kultur für 6 Tage in Gewebekultur - Inkubator bei 37 ° C mit 5% CO 2.
- Ernte durch Pipettieren CD4 + T-Zellen in 15 - ml - Röhrchen und Zentrifuge bei 300 xg für 5 min, 4 ° C. Sammeln Überstand für Zytokin-Analyse und resuspendieren Zellpellet in 2 ml PBS / EDTA und Zentrifuge bei 300 × g für 5 min bei 4 ° C.
6. Cytokinanalyse 19
- Sammeln von Überständen Alloreaktion Studien, wie in Schritt 5.5 beschrieben.
- Herstellung von Reagenz für Human Zytokin / Chemokine Magnetische Panel-Analyse
- Zur Herstellung von Flasche Antikörper-immobilisierten Kügelchen für die einzelnen Fläschchen mit Perlen Mischen (im Kit enthalten), Wirbel für 1 min. In 60 ul von jedem Antikörper Wulst Fläschchen in die Mischflasche (im Kit enthalten) und bringen Sie zu einem endgültigen Volumen von 3 ml mit Bead Diluent (mitgeliefert).
- Für die Herstellung von Qualitätskontrollen, Rekonstitution Qualitätskontrolle 1 und Qualitätskontrolle 2 (im Lieferumfang enthalten) mit 250 & mgr; l entsalztes Wasser.
- Für die Herstellung der Waschpuffer verdünnen 30 ml 10x Waschpuffer (im Kit enthalten) mit 270 ml entsalztem Wasser.
- Für die Herstellung von humanen Zytokin Standard Rekonstitution das menschliche Zytokin-Standard (im Lieferumfang enthalten) mit 250 & mgr; l entsalztes Wasser ein 10.000 pg / ml-Konzentration zu geben.
- In 50 ul 10.000 pg / ml humanen Zytokin-Standard zu 200 ul Puffer Assay (im Kit enthalten) in einem 1,5 ml Mikrozentrifugenröhrchen 2000 pg / ml Arbeitsstandard zu machen. Dann werden 50 & mgr; l von 2000 pg / ml humanen Zytokin-Standard zu 200 ul Puffer Assay (im Kit enthalten) in einem 1,5 ml Mikrozentrifugenröhrchen 400 pg / ml Arbeits Standard zu machen.
- Dann werden 50 & mgr; l von 400 pg / ml humanen Zytokin-Standard zu 200 ul Puffer Assay (im Kit enthalten) in einem 1,5 ml Mikrozentrifugenröhrchen 80 pg / ml Arbeits Standard zu machen. Dann werden 50 & mgr; l von 80 pg / ml menschlichem Zytokin-Standard 200 ul Puffer Assay (im Kit enthalten) in einem 1,5 ml Mikrozentrifugenröhrchen 16 pg / ml Arbeits Standard zu machen.
- Dann werden 50 & mgr; l von 16 pg / ml humanen Zytokin-Standard zu 200 ul Puffer Assay (im Kit enthalten) in einem 1,5 ml Mikrozentrifugenröhrchen 3,2 pg / ml Arbeits Standard zu machen. 0 pg / ml Arbeits Standard nur 200 ul Assay-Puffer in einem 1,5 ml Mikrozentrifugenröhrchen.
- Pre nasse Filterplatte (im Lieferumfang enthalten) durch Pipettieren von 200 ul Assaypuffer (mitgeliefert) in jede Vertiefung des FiltersTeller. Siegel und legen Sie die Filterplatte auf einem Plattenschüttler für 10 Minuten bei Raumtemperatur.
- Absaugen Assay-Puffer und 25 ul jeder Standard oder Qualitätskontrolle in die Vertiefungen hinzuzufügen.
- Zugeben von 25 & mgr; l Zellkulturmedium (hergestellt nach Schritt 3.1.1) an den Hintergrund, Standards und Kontrollvertiefungen.
- In 25 ul Assay-Puffer zu den Probenvertiefungen und fügen Sie 25 ul der Probe in die entsprechenden Probenvertiefungen.
- Vortex die Mischflasche Antikörper-immobilisierten Kügelchen enthält, und fügen Sie 25 ul der gemischten Perlen in jede Vertiefung. Dichtungsplatte und Inkubation unter Rühren auf einem Plattenschüttler über Nacht bei 4 ° C.
- Aspirieren Flüssigkeit und Waschplatte 2 mal durch Zugabe von 200 ul / Vertiefung Waschpuffer und die Flüssigkeit abgesaugt.
- In 25 ul Nachweis-Antikörper (mitgeliefert) in jede Vertiefung. Siegel und Inkubation unter Rühren auf einem Plattenschüttler für 1 Stunde bei Raumtemperatur.
- In 25 ul Streptavidin-Phycoerythrin (provided) in jede Vertiefung der 25 ul Nachweis-Antikörper enthält. Siegel und Inkubation unter Rühren auf einem Plattenschüttler für 30 Minuten bei Raumtemperatur.
- Aspirieren Flüssigkeit und Waschplatte als 6,8 in Schritt beschrieben.
- In 150 ul / Vertiefung Hüllflüssigkeit zu allen Vertiefungen und resuspendieren Perlen auf einem Plattenschüttler für 5 min.
- Detect Fluoreszenzintensität von Kügelchen mit einem 3D - System unter Verwendung von 20. Analysieren Sie die mittlere Fluoreszenzintensität Daten unter Verwendung eines Fünf - Parameter - log-logistische Kurvenanpassung Methode zur Berechnung der Zytokin / Chemokine Konzentrationen in den Proben 21.
7. Echtzeit-Rate Sauerstoffverbrauch (OCR) und extracellular Ansäuerungsgeschwindigkeit (ECAR) Messungen
- Herstellung von Reagenz / Materialien
- Bereiten Sie OCR-Medium: Assay-Medium, ergänzt mit 25 mM Glucose und 1 mM Natriumpyruvat (pH 7,35). Sterilisieren dieser Lösung durch Filtration durch einen 0,2 um-Filter. Beachten Sie, dass dieses Medium ist prepared ohne FBS, weil Komponenten in FBS komplex und variieren von einem viel zu Anthere viel.
- Bereiten Sie ECAR Medium: Basismedium mit 2 mM L-Glutamin (pH 7,35). Sterilisieren dieser Lösung durch Filtration durch einen 0,2 um-Filter. Beachten Sie, dass dieses Medium ohne Bicarbonat, Glucose, Pyruvat und FBS hergestellt wird. Beachten Sie, dass FBS Pufferkapazität und stören die ECAR Lesung hat.
- Bereiten Sie Verbindungen für OCR-Messungen: Resuspendieren Oligomycin mit 630 & mgr; l OCR Medium 100 uM Stammlösung zu machen und mit OCR-Medium auf 16 & mgr; M verdünnt Konzentration zu arbeiten. Resuspendieren carbonyl Cyanid 4- (trifluormethoxy) phenylhydrazons (FCCP) mit 720 & mgr; l OCR Medium 100 uM Stammlösung zu machen und mit OCR-Medium bis 4,5 uM verdünnte Konzentration zu arbeiten. Resuspendieren Rotenon / Antimycin A mit 540 & mgr; l OCR Medium zu machen, 50 & mgr; M Stammlösung und verdünnt mit OCR-Medium bis 10 & mgr; M Arbeitskonzentration.
- BereitenVerbindungen für ECAR Messungen: Resuspendieren Glucose mit 3 ml ECAR Medium 100 mM Stammlösung zu machen und zu 80 mM Arbeitskonzentration zu verdünnen. Resuspendieren Oligomycin mit 720 & mgr; l von ECAR Medium 100 uM Stammlösung zu machen und verdünnter Konzentration auf 18 mM zu arbeiten. Resuspendieren 2-deoxy-D-glucose mit 1,5 ml Medium ECAR 1,000 mM Stammlösung herzustellen.
- Jeweils 200 ul Kalibrant in jede Vertiefung der Kassette und lagern bei 37 ° C ohne CO 2 einen Tag vor der Messungen.
- Echtzeit - OCR Measurements
- Ernte MoDCs und resuspendieren jede Art von MoDCs in OCR - Medium bei einer Konzentration von 60 x 10 3 pro 150 ul Medium OCR.
- Seed 60 x 10 3 Zellen / Vertiefung in einer poly-D-Lysin-beschichtete 96-Well - Flachbodenplatte und Inkubieren in einem nicht-CO 2 Inkubator für 1 Stunde bei 37 ° C. Zur Kenntnis nehmen, für 1 h 50 ul von 50 ng / ml Poly-D-Lysin zur Beschichtung der Platte zu verwenden und wasche mitsteriles Wasser. Halteplatte trocken für 2 h bei Raumtemperatur vor dem Gebrauch.
- Pipettieren von 25 & mgr; l OCR Medium in Injektionsanschluss A für alle Vertiefungen; 25 & mgr; l OCR Medium 16 uM Oligomycin in Injektionsöffnung B für alle Vertiefungen enthält; 25 & mgr; l OCR Medium für alle Vertiefungen 4,5 uM (FCCP) in Injektionsöffnung C für alle Vertiefungen und 25 & mgr; l OCR-Medium mit 10 mM Rotenon / Antimycin A in Injektionsöffnung D enthält. Beachten Sie, dass die endgültige gut Konzentration für Oligomycin ist 2 uM, FCCP 0,5 uM und Rotenon / Antimycin A ist 1 & mgr; M.
- Legen Sie die Platte in der extrazellulären Fluss Analyzer und führen Sie eine komplette OCR-Studie mit allen MoDCs gleichzeitig in vier aufeinander folgenden Phasen: Basalatmung (nach Mittelinjektion von Port A), mitochondriale Komplex V Hemmung (nach Arzneimittelinjektion von Port B), maximale Atmungs Induktion (nach Drogeninjektion von Port C) und Elektronentransportkette Hemmung (nach Arzneimittel von Port D) 22. Beachten Sie, dass es 3 cycles in zwischen den Injektionen und 6 min Intervall zwischen den Messungen.
- Echtzeit - Messungen ECAR
- Ernte MoDCs und resuspendieren jede Art von MoDCs in ECAR Medium bei einer Konzentration von 60 x 10 3 pro 150 ul ECAR Medium.
- Seed 6 x 10 4 Zellen / Vertiefung in einer poly-D-Lysin-beschichtete 96-Well - Flachbodenplatte und Inkubieren in einem nicht-CO 2 Inkubator für 1 Stunde bei 37 ° C.
- Je 25 ul ECAR Medium in Injektionsanschluss A für alle Vertiefungen; 25 ul ECAR Medium 10 mM Glucose in Injektionsöffnung B für alle Vertiefungen enthält; 25 ul ECAR Medium 18 & mgr; M Oligomycin in Injektionsöffnung C enthält, die für alle Vertiefungen und 25 & mgr; l OCR-Medium, enthaltend 1,000 mM 2-deoxy-D-glucose in Injektionsöffnung D für alle Vertiefungen. Beachten Sie, dass die endgültige Konzentration gut für Glukose 10 uM ist, Oligomycin 2 uM und 2-deoxy-D-glucose ist 100 mM.
- Legen Sie die Platte in der extrazellulären Fluss Analyzer und führen einkomplette ECAR Studie mit allen MoDCs gleichzeitig in vier aufeinander folgenden Phasen: Basalatmung (nach Mittelinjektion von Port A), Glykolyse Induktion (nach Arzneimittelinjektion von Port B), maximale Glykolyse Induktion (nach Arzneimittelinjektion von Port C) und Glykolyse Hemmung (nach Medikament von Port D) 22.
- Analysieren statistischen Unterschiede one-way ANOVA mit Tukey mehrere Vergleich post-Test.
Ergebnisse
Monozyten Reinigung und Dendritische Zelldifferenzierung
Monocyten wurden aus PBMCs durch Dichtezentrifugation von peripherem Blut (1A), gefolgt von CD14 + positive Selektion magnetische Trennung gereinigt (1B) und kultiviert in vollständigem Medium in Gegenwart von GM-CSF und IL-4 unreifen dendritischen Zellen zu erhalten ( 2A). Die Zugabe von Vitamin D3 und Dexamethason Post GM-CSF und IL-4 führte zur Differenzierung von unreifen MoDCs in tolerogen MoDCs (2B). LPS wurde zugegeben Reifung von unreifen MoDCs zu induzieren MoDCs (2C) und tolerogenen MoDCs reifen wurden mit LPS stimulierte Resistenz gegen Reifung zu verifizieren (2D). Die Blutproben in dieser Arbeit wurden von gesunden Spendern mit früheren erhalten informiertZustimmung.
MODC Charakterisierung
Oberflächenmarker Charakterisierung durch Durchflusszytometrie
Analyse von DC Oberflächenmarker zeigten , dass reife MoDCs die höchsten Reifemarker HLA-DR, CD83 und CD86 im Vergleich zu LPS behandelten tolerogen MoDCs, tolerogen MoDCs und unreif MoDCs (Abbildung 3) zum Ausdruck gebracht. Diese Ergebnisse zeigten, dass tolerogen MoDCs bis zur Reifung resistent waren, im Vergleich zu unreifen MoDCs nach der LPS-Stimulation. Darüber hinaus angezeigt tolerogen MoDCs und tolerogen MoDCs erhöhte-LPS behandelten Expression von CD14, BDCA3 (CD141) und Immunoglobulin-like-Transkript (ILT) 3 im Vergleich zu unreifen und reifen MoDCs. Die tolerogen MoDCs , die wir erzeugt hier steht im Einklang mit früheren Berichten 23.
Funktionelle Charakterisierung von MoDCs
MoDCs für die Reifung induziert werden immunogen und Release Zytokine, die die Proliferation von CD4 + T-Zellen zu fördern. Wir untersuchten die Immunogenität der verschiedenen MODC Subtypen durch die Proliferation von cokultiviert T-Zellen zu messen. Tolerogen MoDCs waren schwach immunogen im Vergleich zu reifen MoDCs, wie durch niedrige alloproliferation von CD4 + T-Zellen (4A) gezeigt. Tolerogen MoDCs zeichnen sich durch ihre niedrigen IFN-Γ, niedrige IL-12p40 und hohe IL-10 Zytokin - Produktion in Alloreaktion Co-Kulturen mit CD4 + T-Zellen (4B) aus. Darüber hinaus stieg die Zahl der tolerogen MoDCs in Co-Kulturen von reifen MoDCs induzierten allospezifischer CD4 + T-Zellen zu erhöhen , die Frequenz von CD25 hohe Foxp3 + regulatorische T-Zellen (4C).
Analyse der mitochondrialen AktivitätRed CMXRos wird verwendet, um die mitochondriale Aktivität zu reflektieren die mitochondriale Membranpotential Ebenen in MoDCs zu analysieren. Tolerogenen MoDCs beobachtet höhere mitochondriale Aktivität zu haben , verglichen mit den anderen MODC differenziert Subtypen (5A). Als nächstes wird die Rate des mitochondrialen Sauerstoffverbrauchs (OCR) für die verschiedenen Subtypen MODC unter Verwendung eines Bioanalyzer beurteilt. OCR-Messungen erlauben hochauflösende Einblicke auf das metabolische Profil, die Bereitstellung von Informationen, einschließlich, jedoch nicht zu Basalatmung, Ersatzatemkapazität, Protonen-Leck und nicht-mitochondriale Atmung beschränkt. Die Messung der OCR ein Mittel, um die Fähigkeit von Zellen auf Stress zu reagieren, zu beurteilen. Die Zellen werden metabolisch durch die Zugabe von drei verschiedenen Verbindungen in Folge gestört. Die erste Injektion ist Oligomycin (ATP-Kuppler), die komplexe V der Elektronentransportkette hemmt (ETC), die ATP-Synthese hemmt. Dieser Schritt unterscheidet sich der Sauerstoffanteil für die ATP-Synthese und den Prozentsatz an verbrauchtem Sauerstoff verbraucht Protonenleck über die innere Mitochondrienmembran überwinden. Die zweite Einspritzung ist FCCP (ETC Beschleuniger), die durch den Transport von Wasserstoffionen durch die Membran der Mitochondrien statt durch den Protonenkanal Complex V. Der Zusammenbruch des mitochondrialen Membranpotentials führt zu einem schnellen Verbrauch von Energie und Sauerstoff ATP-Synthese stört, ohne die Erzeugung von ATP. FCCP Behandlung kann die Ersatzatmungsfähigkeit von Zellen zu berechnen. Wartung von Ersatzatemkapazität unter Stressbedingungen ist entscheidend für das Überleben der Zelle. Diese Kapazität wird durch mehrere Faktoren bestimmt, einschließlich der Verfügbarkeit von Substrat und Funktionsfähigkeit der in der ETC. beteiligten Enzyme Die dritte Injektion ist eine Kombination von Rotenon, einem Complex I Inhibitor und Antimycin A, a Complex III-Inhibitor. Diese Kombination abschaltet mitochondriale Atmung und OCR beobachtet als Ergebnis beeinträchtigt die Funktion der Mitochondrien (5C) zu verringern. Tolerogen MoDCs zeigte eine höhere basale OCR Niveau als reife MoDCs (5D). Darüber hinaus tolerogen, LPS-tolerogen und unreif MoDCs zeigte Ersatzatemkapazität erhöht im Vergleich zu reifen MoDCs (5E).
Metabolic Charakterisierung von MoDCs
Weil Milchsäure und Protonen von Zellen während des Glycolyse freigesetzt werden, analysierten wir die glykolytische Aktivität von MoDCs durch eine Echtzeit - Analyse der Geschwindigkeit der extrazellulären Ansäuerung (ECAR) (6B) durchgeführt wird . In Gegenwart von Glucose, erhöhte sich die Glykolyse-Rate aller MoDCs mit der basalen Stufe verglichen mitreifen MoDCs höhere glycolytic Rate als unreif MoDCs aufweisen (Abbildung 6D). Tolerogen und unreif MoDCs zeigten höhere maximale Glykolyse (induziert durch in Gegenwart von Glucose Oligomycin) im Vergleich mit LPS behandelten MoDCs (6B). Die Glykolyse - Kapazität von tolerogen und unreif MoDCs war höher als reife MoDCs (6E). Im Gegensatz zu ihren hohen glykolytischen Rate, glycolytic Reserve war die niedrigste in reifen MoDCs (6F).
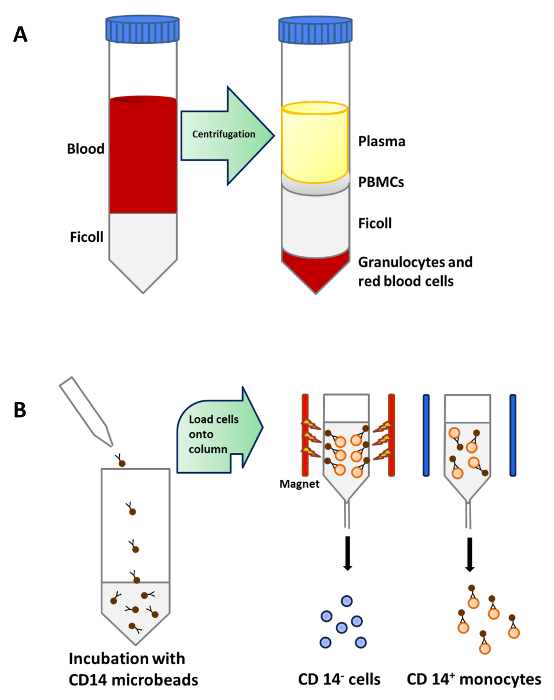
Abb . 1: Monozyten Reinigung aus dem peripheren Blut (A) 25 ml Blut wird vorsichtig auf 15 ml Ficoll geschichtet pro 50 ml - Röhrchen vor dem Zentrifugieren. PBMCs werden in einer Schicht unterhalb Plasma nach Dichtezentrifugation konzentriert. (B) PBMCs mit Microbeads inkubiert , die conj sind ugated für die menschliche CD14 - Antikörper (Isotyp: Maus IgG2a) monoklonal. und dann auf eine Säule , die im Magnetfeld eines Separator platziert CD14 + Monozyten zu isolieren Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
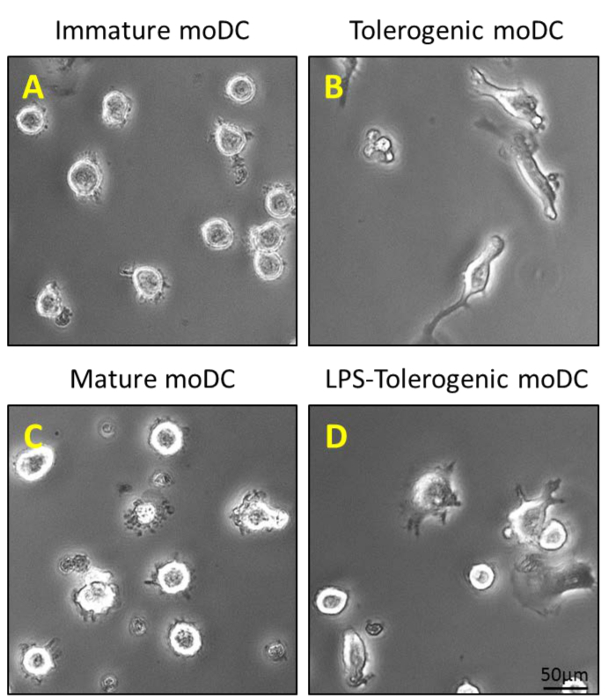
Abbildung 2: Morphologische Charakterisierung von MoDCs. (A) 200 ng / ml GM-CSF und IL-4 wird zu gereinigtem CD14 + Monozyten am Tag 0, 4 und 6 zu unreif MoDCs erzeugen; und (B) einen zusätzlichen Schritt der Stimulierung mit 100 nM Vitamin D3 und 10 nM Dexamethason an Tag 5 erzeugt tolerogenen MoDCs. Immature MoDCs und tolerogenen MoDCs werden mit 1 & mgr; g / ml LPS stimuliert an Tag 6 zu erzeugen , (C) reifen MoDCs und (D) LPS-Toleranz induzierende MoDCs.TGP: //www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
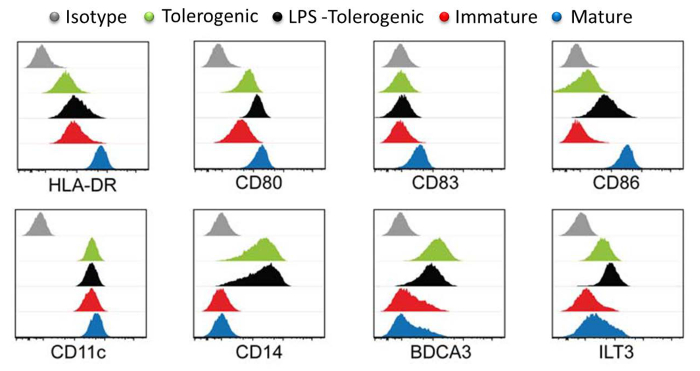
Abbildung 3:. Oberflächenmarkierungs - Charakterisierung durch Durchflusszytometrie Expression von Oberflächenmarkern HLA-DR, CD80, CD83, CD86, CD11, CD14, BDCA3 und LT3 in tolerogen (grün), LPS-tolerogen (schwarz), unreifen (rot), reifen (blau) MoDCs. Isotypkontrollen sind grau dargestellt. Einzel Histogramm für jeden Zelltyp ist mit Y-Achsen-Zellzahl gegenüber der X-Achse log Fluorophor Intensität und überlagert dargestellt. Alle Histogramme sind repräsentativ für vier unabhängigen Experimenten. Diese Zahl wurde von J Immunol 194 (11) modifiziert, 5174-5186, doi: 10,4049 / jimmunol.1303316 (1. Juni 2015). Abgebildet und mit Copyright - Erlaubnis veröffentlicht. Urheberrecht 2015. Die American Association ofImmunologen, Inc. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
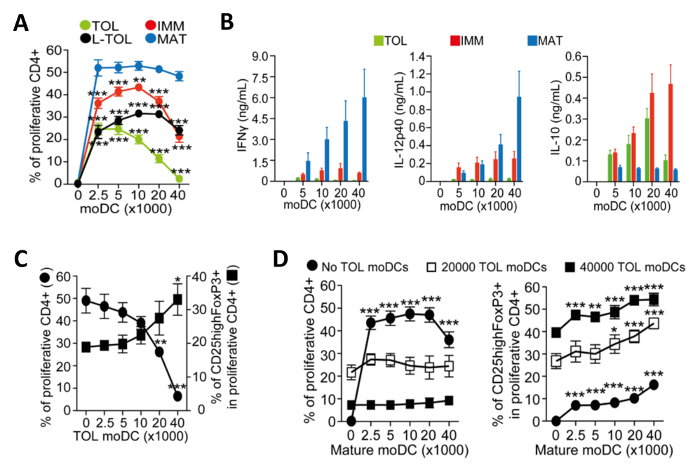
Abbildung 4: Funktionelle Charakterisierung von MoDCs. (A) Quantifizierung der alloproliferation Frequenz von CD4 + T-Zellen , induziert durch Co-Kultur mit zunehmender Zahl von tolerogenen (TOL; grün), LPS-Toleranz induzierende (L-TOL; schwarz), unreifen (IMM; rot) und reifen (MAT ; blau) MoDCs. Die Daten wurden von vier unabhängigen Experimenten zusammengelegt werden; Mittelwert + SEM Statistische Unterschiede zwischen allen MoDCs im Vergleich zu reifen MoDCs von Zwei-Wege - ANOVA mit Dunnett mehrere Vergleich Post-Test. (B) Zytokin - Analyse von IFN-Γ (links), IL-12p40 (Mitte) und Il- analysiert wurden 10 (rechter Bereichl) in Überständen von Alloreaktionen zwischen CD4 + T-Zellen co-kultiviert mit Zahlen von entweder tolerogen (grün), unreifen (rot) oder reifen (blau) MoDCs erhöhen. Die Daten wurden aus sechs unabhängigen Experimenten zusammengelegt werden; Mittelwert ± SEM (C) CD4 + T-Zellen alloproliferation und regulatorischen T-Zellen Expansion induziert durch Co-Kultur mit reifen MoDCs in Gegenwart von Zahlen von tolerogen MoDCs erhöhen. Linke Y-Achse, die Frequenz von CD4 + T-Zellproliferation. Rechte Y-Achse, die Häufigkeit der CD25 Foxp3 + Hoch gated Zellen auf proliferative CD4 + T-Zellen. Die Daten wurden aus drei unabhängigen Experimenten gepoolt; Mittelwert ± SEM Statistische Unterschiede zwischen Gegenwart gegen Abwesenheit von tolerogen MoDCs durch Einweg-ANOVA mit Dunnett Mehrfachvergleich nach dem Test. (D) CD4 + T-Zellen alloproliferation (links) und die Häufigkeit der CD25highFoxP3 + Zellen (rechts) , induziert durch Ko- analysiert wurden Kultur mit tolerogen MoDCsin Gegenwart von Zahlen von reifen MoDCs erhöhen. Die Daten wurden von zwei auf drei unabhängigen Experimenten zusammengelegt werden; Mittelwert ± SEM Statistische Unterschiede zwischen dem Vorhandensein gegen Abwesenheit von reifen MoDCs von Zwei-Wege-ANOVA mit Dunnett mehrere Vergleich Post-Test analysiert. Diese Zahl wurde von J Immunol 194 (11) modifiziert, 5174-5186, doi: 10,4049 / jimmunol.1303316 (1. Juni 2015). Abgebildet und erneut veröffentlicht mit urheberrechtliche Genehmigung. Urheberrecht 2015. Die American Association of Immunologen, Inc. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
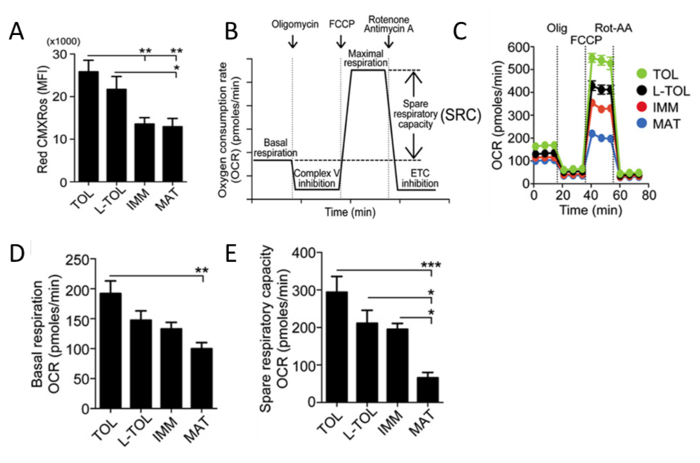
Abbildung 5: Analyse der mitochondrialen Aktivität von MoDCs. (A) Stufen der mitochondrialen Membranpotentials (Red CMXRos) in MoDCs wurden von f erhaltenniedrige Zytometrie Analyse. Die Daten von vier unabhängigen Experimenten wurden gepoolt. Mittelwert ± SEM (B) Schematische Darstellung eines Echtzeit - mitochondrialen Atmung. OCR-Analyse von Basalatmung beginnt und nach der Zugabe von Oligomycin (Komplex V Hemmung), FCCP (maximale Atmungs Induktion) und Rotenon / Antimycin eine Mischung (Elektronentransportkette [ETC] Hemmung). Die mitochondriale SRC (maximale basalen von maximal Atmung subtrahiert) von der OCR - Kurve abgeleitet. (C) Repräsentative kinetische Untersuchung der Mitochondrien OCR (pmol / min) in tolerogen (TOL, grün), LPS-tolerogen (L-TOL, schwarz) unreife (IMM, rot) und reifen (MAT, blau) MoDCs unter Verwendung aufeinanderfolgende Zugabe von Oligomycin (Olig), FCCP und Rotenon / Antimycin A (rot-AA). (D) OCR Quantifizierung der Basalatmung von MoDCs und ( E) ersparen Atemkapazität von MoDCs. Die Daten wurden aus fünf unabhängigen Experimenten gepoolt. Mittelwert ± SEM. Diese Zahl wurde von J Immunol 194 (11) modifiziert, 5174-5186, doi: 10,4049 / jimmunol.1303316 (1. Juni 2015). Abgebildet und erneut veröffentlicht mit urheberrechtliche Genehmigung. Urheberrecht 2015. Die American Association of Immunologen, Inc. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
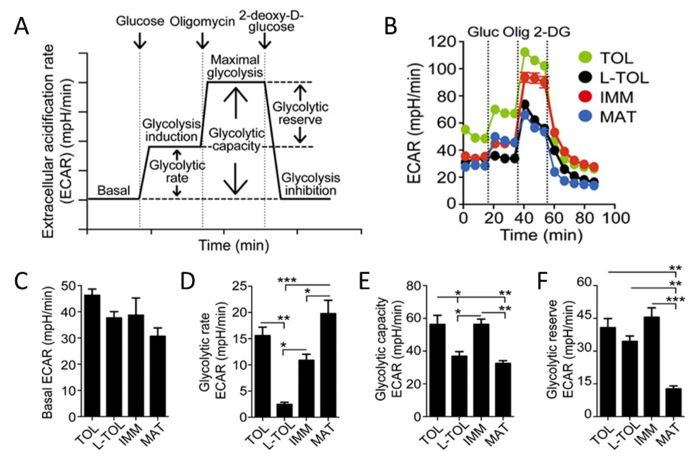
Abbildung 6: Metabolic Charakterisierung von MoDCs. (A) Schematische Darstellung von Echtzeit - Glykolyse. ECAR Analyse geht von basal ECAR, in dem die Zellen in glucosefreiem Medium durch Zugabe von Glucose (Glykolyse Induktion) inkubiert, gefolgt wurden, Oligomycin (die Glykolyse und komplex V Hemmung maximal Zelle induziert) und schließlich 2-deoxy-D- Glucose(Glykolyse Hemmung). Glykolytische Rate (Glykolyse Induktion für die basale ECAR subtrahiert), glykolytischen Kapazität (maximale Glykolyse für die basale ECAR subtrahiert) und glykolytische Reserve (maximale Glykolyse Glykolyse Induktion subtrahiert) werden aus der ECAR Kurve abgeleitet. (B) Repräsentative kinetische Untersuchung der Glykolyse-abhängige ECAR (mPH / min) in tolerogen (TOL, grün), LPS-tolerogen (L-TOL, schwarz), unreife (IMM, rot) und reifen (MAT, blau) MoDCs durch aufeinanderfolgende Zugabe von Glukose (Gluc) verwenden, Oligomycin (Olig) und 2-DG. (C) Die Balken zeigen die basale ECAR Ebenen (D) glycolytic Rate (E) glykolytischen Kapazität, und (F) glycolytic Reserve von MoDCs. Die Daten wurden aus drei unabhängigen Experimenten gepoolt; bedeuten 6 SEM. Statistische Unterschiede wurden durch Einweg-ANOVA mit Tukey mehrere Vergleich Post-Test analysiert. Diese Zahl wurde von J Immunol 194 (11) modifiziert, 5174-5186, doi: 10,4049 / jimmunol.1303316 (1. Juni 2015). Abgebildet und erneut veröffentlicht mit urheberrechtliche Genehmigung. Urheberrecht 2015. Die American Association of Immunologen, Inc. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Dieses Papier beschreibt ein Verfahren zur Erzeugung von Monozyten unreif MoDCs, tolerogen MoDCs und reifen MoDCs. Die wesentlichen Schritte dieses Protokolls sind im Detail in den folgenden Abschnitten diskutiert. Es ist wichtig zu beachten, dass die menschliche periphere Blut als Ausgangsmaterial in diesem Protokoll verwendet wird, und allgemeine Vorsichtsmaßnahmen für den menschlichen Blutbehandlung durchgeführt werden sollte. Obwohl es technisch möglich ist , 24 beim Menschen DCs aus Knochenmark ableiten, die in vitro Differenzierung von DC in peripheren Blut - Zellen ist bevorzugt wegen der Verfügbarkeit von peripheren Blut im Vergleich zu Knochenmark. Unter den gefundenen Zellen im peripheren Blut, hämatopoetische CD34 + Stammzellen und Monozyten werden für die in vitro Erzeugung von DCs verwendet. Hämatopoetische CD34 + Stammzellen kultiviert werden , mit GM-CSF und TNF-α CD1a + und CD14 + Subsets herzuleiten, die dann weiter in Langerhans'schen differenziertähnliche Zellen und dendritische Zellen. Umgekehrt sind Monozyten, kultiviert in GM-CSF und IL-4 zu unreifen MoDCs erzeugen. Verschiedene Protokolle sind für die Anreicherung von Monozyten aus peripherem Blut verwendet werden; beispielsweise durch Festhalten an Kunststoffschalen, Schlämmen und Isolierungs - Kits 25, 26 Die Vorteile der Adhärenz Protokoll minimalen Schäden an Zellen und relativ kostengünstig aber Zell Reinheit könnte beeinträchtigt werden. und ein zusätzlicher Schritt ist erforderlich, um die Zellen für weitere Experimente zu lösen. Elutriation ist eine Technik, die Zellen auf der Basis ihrer Größe und Dichte trennt. Die Vorteile Eluierung sind die Lebensfähigkeit der Zellen und Monozyten können leicht für weitere Experimente verwendet werden; aber diese Technik wird durch die Verfügbarkeit eines Elutriators und die Unfähigkeit beschränkt auf verschiedene Populationen von Zellen (T-Zellen und Monozyten) mit ähnlichen Parametern Sedimentation abzutrennen. Im Handel erhältliche Isolation Kits magnetischen Mikrokügelchen verwenden entweder positiv zu wählen odernegativ auf die monozytäre Bevölkerung aus. Einige Protokolle sind auf Monozyten Isolation vorbelastet mit der negativen Selektion als die isolierten Monozyten bleiben "unberührt" (nicht durch Markierungen oder Mikrokügelchen gebunden). In diesem Protokoll wurden CD14 Perlen positive select humanen Monozyten aus PBMCs verwendet. CD14 fehlt eine cytoplasmatische Domäne und die Bindung von Antikörper an CD14 nicht Signaltransduktion auslösen. Darüber hinaus werden die Mikrokügelchen aus Monozyten nach Kultivierung lösen und somit nicht den Differenzierungsprozess nicht behindert. Darüber hinaus äußerte sich CD14 stark auf den meisten Monozyten und schwach auf Neutrophilen und einigen myeloischen dendritischen Zellen, damit diese Methode der Isolation führt zu einer höheren Zell Reinheit als die anderen Verfahren 17.
Blutmonozyten können in DCs oder Makrophagen und das Schicksal von Monozyten hängt stark von der Zytokin-Umgebung unterschieden werden. In dieser Arbeit werden MoDCs durch Zugabe von Granulozyten-Makrophagen-Kolonie-stimulierender Faktor (GM erzeugten-CSF) Und Interleukin 4 (IL-4) an humanen peripheren Blutmonozyten. GM-CSF ist für Monocyten Überleben erforderlich, und IL-4 übt eine inhibierende Aktivität auf die Makrophagendifferenzierung; und die kombinatorische Zugabe von GM-SCSF und IL-4 an Monozyten führen zu einem höheren Anteil an unreifen MoDCs im Vergleich zu einzelnen Zytokin 27. Es gibt andere Protokolle , die MoDCs durch Zugabe von Tumornekrosefaktor alpha (TNF-α), Interferon alpha (IFN-α) und Interleukin 13 (IL-13) an peripheren Blutmonozyten 28, 29, 30 erzeugen. Die Kombination von GM-CSF und IL-4 wurde in den 1990er Jahren optimiert und jetzt ein anerkanntes Protokoll, das DCs Kunststoff unreif differenziert in immunogene oder tolerogen MoDCs und polarisiert in Th1, Th2 oder Th17 Förderung MoDCs erzeugt.
Immature MoDCs werden in tolerogene MoDCs durch die Zugabe von Vitamin D3 und Dexamethason unterschieden. Es gibt verschiedene Protokolle tolerogenen DCs beispielsweise zu erzeugen, übernuclear factor-kappa B (NF-kB) Hemmung, β-Catenin - Aktivierung, Vitamin D3, Dexamethason und Rapamycin 31, 32, 33, 34, 35, 9, 36, 37. Obwohl sowohl Vitamin D3 allein und Dexamethason wurden eine tolerogene Wirkung auf DCs, die Kombination von Vitamin D 3 und Dexamethason ergeben eine stärkere Unterdrückung von alloproliferation als wenn einzelne Arzneimittel verwendet werden zum Induzieren berichtet. Daher wurde das bestehende Protokoll zur Erzeugung von tolerogenen DCs auf eine Kombination von Vitamin D 3 und Dexamethason modifiziert. Dieses Verfahren wird zur Zeit für die menschliche tolerogen DCs mit einem therapeutischen Nutzen als Modell akzeptiert. Es ist auch wichtig zu beachten, dass die rekonstituierte Vitamin D3 und Dexamethason eine kurze Haltbarkeit haben.
In diesem Protokoll wurde als DC-Reifung Induktor Lipopolysaccharide (LPS) zugegeben. Unreife MoDCs können auch pro-inflammatorischen Cocktail mit bis zur Reifung induziert werden:(TNF-α), Interleukin 1 beta (IL-1β), Interleukin 6 (IL-6) und Prostaglandin E2) oder pro-inflammatorischen Cytokinen (TNF-α und Interferon gamma (IFN-Γ)). Pro-inflammatorische Cocktail erzeugt reife MoDCs mit hoher kostimulatorischen und Migrationsfunktionen aber sie produzieren relativ geringe Mengen an IL-12 38. TNF-α oder IFN-Γ allein ist nicht in der Lage , eine stabile dendritischen Phänotyp 39 zu induzieren. LPS stimuliert Toll-like-Rezeptor 4 (TLR4), vermittelt die Aktivierung von NF-kB und Mitogen-aktivierte Proteinkinasen (MAPKs) DC-Reifung zu induzieren. DC-Reifung, induziert durch LPS zeigt eine Hochregulierung der DC Reifungsmarkern (CD83, CD86, HLA-DR) und auch auf die Herstellung von IL-12p70 geführt. Darüber hinaus kann dieser Schritt weiter mit TLR3-Agonisten zu paaren LPS modifiziert werden, um reife DCs für die klinische Krebsimpfstoffe produzieren. In diesem Papier werden tolerogen DCs gezeigt auf LPS-Behandlung bis zur Reifung resistent. Diese halb reifen wie DCs nicht immunogen sind und nicht release pro-inflammatorischen Zytokinen 40.
Die Grenzen dieses Protokolls liegen im Differenzierungsprozess. Der Prozess dauert 8 Tage ab Tag 0 bis Tag 7, die eine Schwierigkeit stellt in Hochdurchsatzanalysen angepasst werden. Eine Änderung im Protokoll erforderlich, um den Differenzierungsprozess noch ergeben eine hohe Zahl von lebensfähigen DCs in den verschiedenen Staaten zu verkürzen. Zweitens werden die DCs durch Zugabe von Zytokinen in diesem Protokoll erzeugt und diese Zytokine keine DC Population für längere Zeit aufrechtzuerhalten. Außerdem sind Cytokine in Konzentrationen verwendet , viel höher als in vivo und in vorgespannte Entwicklung von Wegen zur Folge haben könnte, die in vivo DCs physiologisch nicht identisch sind. Beispielsweise in vitro - Kulturen von DC - Vorstufen wurden GM-CSF reagieren gezeigt, die für den normalen DC Differenzierung in vivo 41 kein wesentliches Cytokin. Trotzdem kann Zytokinstimulation ein nützliches Verfahren zur Genbewerten hohe Anzahl von DC in vitro für Experimente. Die Fähigkeit, diese Zellen von diesem Protokoll auf andere Analysen, wie beispielsweise Immunfluoreszenzfärbung, Durchflusszytometrie, Allo Reaktionsstudien und Stoffwechseluntersuchungen erhöht die Brauchbarkeit dieses Verfahrens erzeugten zu unterziehen. Diese in - vitro - DCs dienen als ein gutes Modell , um die Kenntnisse der DC Entwicklung, Reifung und Antigenpräsentation zu verbessern , die bisher nur schwer mit den seltenen Anzahl von in - vivo - DCs zu tun.
DCs Fähigkeit immunologischer Toleranz gegenüber Immunität regulieren macht sie zu attraktiven Kandidaten in Therapeutika gegen Krebs und Autoimmunerkrankungen , 42, 43, 44, 45. Immunogene DCs in diesem Protokoll erzeugt wird, kann verwendet werden, um die Impfung Wirksamkeit gegen Infektionskrankheiten und Tumoren verbessern; während tolerogen DCs können unerwünschte T zu steuern Zellreaktionen verwendet werden und Ablehnungen nach der Transplantation zu verhindern. Die komplizierteBalance zwischen Immunität und Toleranz hängt enorm auf DC Differenzierungsstatus. DC Differenzierung ist eine koordinierte zelluläre Programm, das durch mehrere Signalwege und metabolische Schicksal bestimmt wird. Verschiedene Differenzierungszuständen von DC unterscheiden sich in der bioenergetischen und Biosynthese Bedürfnisse; erfordern zum Beispiel aktivierte DCs energischer metabolischen Anpassungen wichtig für das Überleben und die Migration zum Ruhezustand zu DCs verglichen. Es ist wichtig, dass Vitamin D3, Dexamethason und Rapamycin zu beachten sind für ihre Fähigkeit bekannt tolerogenen DCs zu induzieren, wurden beschrieben DC Metabolismus zu beeinflussen. In dieser Arbeit wurden die energetische Metabolismus von MoDCs aus verschiedenen Differenzierungszuständen charakterisiert unter Verwendung von extrazellulären Fluss Analysatoren und tolerogenen MoDCs zeigte die höchste metabolische Plastizität und LPS-induzierte Reifung diese Plastizität verringert. Anabolen Stoffwechsel unterstützt DCs Reifung während kataboler Stoffwechsel Einflüsse tolerogen DC 46 fungiert. Die DCserzeugt wird, kann von diesem Protokoll verwendet werden, um zu beurteilen, ob die Stoffwechselzustand von DCs Veränderung der Schlüssel zur Modifizierung Immunität und Toleranz in der Therapie halten. Abschließend präsentierten wir ein Protokoll für die Erzeugung von unreifen, tolerogen und reifen MoDCs entscheidend für DCs 'immunregulierenden Funktionen zu studieren.
Offenlegungen
Open access fees for this article were provided by, Agilent Technologies.
Danksagungen
Diese Arbeit wurde von der Agentur für Wissenschaft, Technologie und Reasearch Kernfinanzierung (bis JEC) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 mL centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 mL falcon tube | Falcon | 352096 | PBMC isolation |
| 50 mL falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 mL Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
Referenzen
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten