Method Article
Generazione di Immaturo, matura e tollerogenico dendritiche cellule con differenti fenotipi metabolica
In questo articolo
Riepilogo
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
Abstract
i risultati di risposta immune da una complessa interazione tra il sistema immunitario innato antigene non specifici e l'antigene specifico sistema immunitario adattativo. Il sistema immunitario è un equilibrio costante nel mantenere la tolleranza di auto-molecole e reagire rapidamente agli agenti patogeni. Le cellule dendritiche (DC) sono potenti cellule professionali presentanti l'antigene che collegano il sistema immunitario innato per il sistema immunitario adattativo e bilanciano la risposta adattativa tra sé e non sé. A seconda dei segnali di maturazione, le cellule dendritiche immature possono essere selettivamente stimolati a differenziarsi in cellule dendritiche immunogenico o tolerogeniche. cellule dendritiche immunogenico forniscono segnali di proliferazione di cellule T antigene-specifiche per l'espansione clonale; mentre le cellule dendritiche tolerogeniche regolano tolleranza antigene-specifica delezione di cellule T o l'espansione clonale delle cellule T regolatorie. A causa di questa proprietà unica, le cellule dendritiche sono molto richiesti come agenti terapeutici per il cancro e dise autoimmuniAS. Le cellule dendritiche possono essere caricati con antigeni specifici in vitro e iniettate nel corpo umano per montare una risposta immunitaria specifica sia immunogenica e tollerogenica. Questo lavoro presenta un mezzo per generare in vitro da monociti, cellule dendritiche monociti immaturo derivati (moDCs), tollerogenico e moDCs maturi che si differenziano per l'espressione marcatore di superficie, la funzione e fenotipi metabolici.
Introduzione
DC è stato descritto da Paul Langerhans (cellule di Langerhans) alla fine del XIX secolo come riferimento da Jolles 1 e caratterizzato da Ralph Steinman e Zanvil Cohn nel 1973 che li ha riconosciuti come cellule presentanti l'antigene professionali 2. DC si trovano nel sangue periferico e nel maggior parte dei tessuti del corpo, particolarmente abbondante nei tessuti che sono esposti all'ambiente esterno come la pelle (presente come cellule di Langerhans) e nei rivestimenti del naso, polmoni, stomaco e dell'intestino che consentono loro di incontrare gli antigeni estrinseci. Immaturo DC dispone di funzionalità endocitico ma relativamente bassa capacità di stimolare le cellule T 3. Immaturo DC esprimono vari recettori pattern recognition (PRR) che cattura i modelli associati ai patogeni molecolari (PAMPs) o modelli molecolari di danno-associato (smorza) 4. Attivazione segnali di pericolo di auto maturazione verso DC immunogenico mentre auto-molecole determinano unresponsivene cellule Tss e apoptosi 5. DC immunogenici si caratterizzano per l'up-regolazione delle molecole MHC e molecole di superficie co-stimolazione e la loro capacità di cellule T naive primi 6,7.
Immaturo DC può anche essere maturato verso uno stato Treg che inducono o tollerogenico in risposta alla vitamina D3 metabolita 1a, 25 (O) 2 D 3 e di alcuni agenti immunosoppressori come l'interleuchina-10 (IL-10), desametasone e rapamicina 8-9. DC tollerogenico si caratterizzano per la loro espressione di motivi basati su inibitori della tirosin-immunoreceptor (ITIMs) contenenti recettori di superficie e leganti. Trasduzione del segnale di ITIMs contenenti familiari ILT, ILT3 e ILT4 nei PVS tolerogeniche inibire alloproliferation e guidare l'espansione Foxp3 + Treg 10,11. Queste proprietà uniche di DC tolerogeniche portano alla loro profonda potenza in vivo, cioè la capacità di indurre la tolleranza durevole per innesti allogenici trapiantati e supprEss lo sviluppo di malattie autoimmuni. Tollerogenico DC può essere visto quindi come un sottotipo di cellule dendritiche mature polarizzato che funzionano nella inibizione di attivazione immunitaria.
Attualmente, ci sono due sottoinsiemi generali di cellule dendritiche in sangue periferico umano: le DC plasmacitoidi e mieloidi DC 12. DC circolanti sono rari costituendo a meno del 2% dei leucociti nel sangue umano e questo pone una difficoltà per l'isolamento di un numero adeguato di DC per studiare le loro funzioni immunomodulanti. Per superare questo problema, monociti differenziati DC sono utilizzati come un modello in vitro per lo studio della funzione delle cellule dendritiche. Queste cellule dendritiche in vitro hanno recettori e funzioni simili rispetto a DC in vivo. Confronto dettagliato dei PVS in vivo e in vitro monociti derivati da cellule dendritiche generate (moDCs) sono indagato da altri laboratori 13, 14, 15. Si segnala inoltre che moDCs e CD1c + DC erano equivalenti a presentanti l'antigene e inducendo la funzione delle cellule T 15.
In questo articolo, si descrive un metodo per generare moDCs immaturi da monociti del sangue periferico e poi differenziarsi in cellule dendritiche immunogenico e tolerogeniche. Queste cellule dendritiche derivate da monociti (moDCs) sono caratterizzate da marcatori di superficie, il profilo di citochine, le funzioni immunomodulanti e stati metabolici. cellule dendritiche immunogenico e tolerogeniche producono diverse citochine che provocano l'espansione di entrambi cellule T allogeniche o cellule T regolatorie. In questo lavoro, citochina profilatura viene eseguita con sistemi che utilizzano la tecnologia multiplex. terreno di coltura di cellule vengono incubate con codice colore perline anticorpo immobilizzato e leggere in un analizzatore compatto. stati metabolici di DC vengono analizzati utilizzando gli analizzatori di flusso extracellulari che misurano tasso di consumo di ossigeno, un indicatore della respirazione cellulare, e il tasso di acidificazione extracellulare che riflette glycolyticflusso in cellule dendritiche. La misurazione di questi tassi di bioenergetica fornisce un mezzo per monitorare i cambiamenti nel metabolismo cellulare, che sono di vitale importanza per lo sviluppo delle cellule dendritiche e la funzione.
Protocollo
Questa ricerca è stato approvato dal Institutional Review Board (IRB NUS-10-250).
1. Isolamento di cellule mononucleate del sangue periferico (PBMC)
- Preparazione del reagente
- Preparare PBS / EDTA: soluzione salina tamponata con fosfato (PBS) e integrare con 2 mM acido etilendiamminotetraacetico (EDTA). Sterilizzare questa soluzione mediante filtrazione attraverso un filtro da 0,2 micron. Nota per memorizzare PBS / EDTA a 4 ° C e calda a temperatura ambiente prima dell'uso.
- Preparare buffer di colorazione: soluzione salina tamponata con fosfato (PBS) integratore con siero fetale bovino 2% (FBS), 10 mM 4- (2-idrossietil) -1-acido piperazineethanesulfonic (HEPES) e 2 mM di acido etilendiamminotetraacetico (EDTA). Sterilizzare questa soluzione mediante filtrazione attraverso un filtro da 0,2 micron.
- Raccogliere il sangue dal sangue Cone
Nota: Il cono sangue contiene bianche componenti cellulari del sangue raccolti dopo piattoletpheresis dall'ospedale. Se il sangue viene raccolto in tubi di eparina o EDTA, diluire il sangue con PBS in rapporto 1: 1 e passare al punto 1.3; se viene ricevuto buffy coat, diluire buffy coat con PBS in rapporto 1: 2 e passare al punto 1.3.- Tagliare le due estremità del cono per permettere al sangue di fluire in un tubo da 50 ml. Si noti che il cono di solito contiene 10 ml di sangue.
- Utilizzare una siringa estremità smussata contenente 30 ml di PBS / EDTA per lavare il cono e raccogliere in un tubo da 50 ml.
- Diluire il sangue ulteriormente con PBS / EDTA ad un volume finale di 80 ml.
- Isolamento di PBMC dalla densità centrifugazione 16
- Aliquota 15 ml Ficoll ciascuno a 4 nuove provette da 50 ml.
- Utilizzare una pipetta 25 ml sierologico per aggiungere 20 ml di sangue diluito su tutto lo strato di Ficoll. Prendere atto per tenere il tubo da 50 ml a 45 e fare attenzione a non disturbare l'interfase.
- Centrifugare le provette a 805 xg senza freni per 30 min, 20 ° C.
- Rimuovi ilstrato di plasma e raccogliere l'anello di PBMC che si trovano appena al di sotto dello strato di plasma con una pipetta Pasteur. Combina quattro tubi di PBMC in due provette da 50 ml. Nota per evitare di raccogliere lo strato trasparente sotto il PBMC.
- Aggiungere PBS / EDTA ad un volume finale di 50 ml per tubo di PBMC e centrifugare a 548 xg con freni per 10 min, 20 ° C.
- Aspirare il surnatante e risospendere pellet in ciascun tubo con 25 ml di tampone colorazione e si combinano in un tubo da 50 ml.
- Centrifugare a 367 xg con freni per 5 min, 4 ° C.
- Aspirare il surnatante e pellet risospendere con 10 ml di tampone colorazione.
2. monociti Arricchimento da Magnetic Separation 17
- Determinare numero di cellule
- Prelevare 20 ml di sospensione cellulare PBMC e mescolare con 20 ml di trypan blu per contare il numero di cellule vive usando citometro.
- sospensione cellulare centrifugare a 367 xg con freniper 10 min, 4 ° C.
- Aspirare pellet surnatante completamente e risospendere cellule ad una concentrazione di 10 7 cellule per 80 microlitri di tampone colorazione.
- Etichettatura magnetica
- Aggiungere 20 ml di microsfere CD14 per 10 7 cellule, mescolare bene e incubare per 15 minuti a 2-8 ° C.
- Lavare le cellule aggiungendo 1 ml di tampone di colorazione per 10 7 cellule e centrifugare a 367 xg con freni per 10 min, 4 ° C.
- Aspirare pellet surnatante completamente e risospendere cellule in una concentrazione di 10 7 cellule per 50 ml di tampone colorazione.
- Separazione magnetica
- Utilizzare colonna di medie dimensioni per un massimo di 2 x 10 8 cellule totali.
Nota: scegliere una colonna e separatore appropriato in base al numero di cellule totali e il numero di cellule CD14 + raccomandati nella scheda tecnica. - Posizionare colonna nel campo magnetico oFa adatto separatore e preparare colonna risciacquando con 500 ml di buffer di colorazione.
- sospensione cellulare Pipetta su colonna e raccogliere le cellule non marcate che passano attraverso la colonna con una provetta da 15 ml.
- Sostituire un nuovo tubo da 15 ml sotto la colonna e lavare colonna 3 volte con 500 ml di buffer di colorazione. Assicurarsi che il serbatoio colonna è vuota prima di aggiungere nuovo buffer colorazione tra un lavaggio.
- Rimuovere colonna dal separatore e posizionarlo su una nuova provetta 15 ml.
- Pipettare 1 ml di tampone colorazione sulla colonna. Immediatamente scovare le cellule magneticamente marcate con fermezza spingendo lo stantuffo (fornito nel kit) nella colonna.
- Ripetere i punti 2.3.2 a 2.3.6 utilizzando la frazione eluita su una nuova colonna per aumentare la purezza delle cellule CD14 +. Si noti che le perline saranno rilasciati dalle cellule in coltura automaticamente durante la fase 3.2.
- Utilizzare colonna di medie dimensioni per un massimo di 2 x 10 8 cellule totali.
3. La differenziazione delle cellule dendritiche di diverso attivazione STates
- Preparazione del reagente (Endotossina livello deve essere inferiore a 0,1 EU / ml in tutti i reagenti)
- Preparare terreno di coltura cellulare: RPMI 1640 integrato con il 10% di siero fetale bovino (FBS), 1% non-aminoacidi essenziali (NEAA) e 0,05 mm 2-mercaptoetanolo (2ME). Sterilizzare questa soluzione mediante filtrazione attraverso un filtro da 0,2 micron.
- Preparare citochine: ricostituire IL-4 e GM-CSF in acqua di grado coltura cellulare ad una concentrazione di 0,25 mg / ml in condizioni asettiche. citochine Aliquota in 200 microlitri provette da microcentrifuga e conservare a -80 ° C.
- Preparare la vitamina D3 magazzino: ricostituire la vitamina D3 in acqua grado coltura cellulare ad una concentrazione di 100 mm in condizioni asettiche. Aliquota vitamina D3 in provette da 1,5 ml microcentrifuga e conservare a -20 ° C.
- Preparare desametasone magazzino: ricostituire desametasone in acqua grado coltura cellulare ad una concentrazione di 10 mm in condizioni asettiche. aliquota dexamethasone in provette da 1,5 ml microcentrifuga e conservare a -20 ° C.
- Preparare LPS: ricostituire Lipopolisaccaridi (LPS) in acqua di grado coltura cellulare ad una concentrazione di 1 mg / ml in condizioni asettiche. LPS aliquote in provette da 1,5 ml microcentrifuga e conservare a -20 ° C.
- Generazione di diverse moDCs
- Seme 4 serie di monociti CD14 + in concentrazione 0,3 - 0,5 x 10 6 / ml di mezzo di coltura cellulare integrato con 200 ng / ml di GM-CSF e 200 ng / ml di IL-4 in 6 pozzetti. Si noti che questo è il giorno 0 e il volume di mezzo in ogni 6 e è di 2 ml.
- Incubare le cellule in coltura tissutale incubatore a 37 ° C con 5% di CO 2.
- Rimuovere 850 microlitri di terreno dalla coltura al giorno 4 e centrifugare a 300 xg per 5 min, 4 ° C. Aspirare il surnatante e risospendere pellet in 1 ml di mezzo di coltura cellulare contenente 2x (200 ng / ml di GM-CSF e 200 ng / ml di IL-4). Aggiungere questa miscela di cellule indietroalla cultura. Si noti che la concentrazione 2x aggiunto per GM-CSF e IL-4 diventerà 1x quando è aggiunto il 1 ml di mezzo indietro nella cultura.
- Aggiungere 1 ml di vitamina D3 magazzino e 1ml di desametasone magazzino per ml di terreno a due dei gruppi al giorno 5 per generare moDCs tolerogeniche. Si noti che la concentrazione finale di vitamina D3 è 100 nM e desametasone è 10 nM; aggiunta di GM-CSF e IL-4 non è richiesto il giorno 5.
- Aggiungere 200 ng / ml di GM-CSF e 200 ng / ml di IL-4 per tutti i set il giorno 6.
- Aggiungere 1 ug / ml di LPS ad uno dei gruppi trattati con solo GM-CSF e IL-4 a 6 giorni per generare moDCs maturi.
- Aggiungere 1 mg / ml di LPS di una delle serie di moDCs tolerogeniche al 6 ° giorno di generare LPS-tolerogeniche moDCs.
- Raccogliere i diversi tipi di moDCs a 7 giorni da vampate di calore piatto cultura con PBS, EDTA per citometria a flusso o di altri studi. Si noti che le cellule non aderenti solo vengono raccolte. Prendere atto che il rendimento percentuale dal CD14 + MONOCYtes per moDCs immaturi, moDCs maturi, moDCs tolerogeniche e DC LPS-tolerogeniche sono circa il 90%, 50%, 60% e 60%, rispettivamente, e varia tra i donatori di sangue e di FBS sacco.
4. Citometria a Flusso
- Superficie cellulare marcatore Caratterizzazione su moDCs
- Staccare le cellule dal piatto di cultura pipettando. Lavare le cellule una volta con PBS / EDTA e risospendere le cellule in una concentrazione di 5 x 10 5 cellule per 50 ml di tampone colorazione in 1,5 ml provetta.
- Incubare 0,5 x 10 6 aliquote di cellule con PerCP coniugato HLA-DR (1: 100), CD80 PE-coniugato (1:50), PE-coniugato CD83 (1,25), PE-coniugato CD86 (1:50), APC- CD11c coniugato (1:50), CD14 PE-coniugato (1:50) e BDCA3 PE-coniugato (1:50) e APC-coniugato ILT3 (1,25) al buio per 30 minuti a 4 ° C. Isotipo-abbinato PerCP-suo anticorpo monoclonale (1:20), PE-suo anticorpo monoclonale (1,11), APC-suo anticorpo monoclonale (1,11) servirà come controlli negativi.
- Rilevare i livelli di espressione dei marcatori di superficie utilizzando un citofluorimetro 18.
- Analisi dei mitocondri potenziale di membrana di moDCs
- Preparare soluzione madre di 1 mm Rosso Chloromethyl-X-rosamine (CMXRos) con l'aggiunta di 94,1 ml di dimetilsolfossido (DMSO) per 50 mg di liofilizzato Red CMXRos.
- Incubare 2 x 10 5 moDCs con 100 nM Red CMXRos in 1 ml di soluzione di Hank salina bilanciata (HBSS) per 30 minuti a 37 ° C in 15 ml tubo.
- Aggiungere 2 ml di PBS / EDTA di cellule e centrifugare a 300 xg per 5 minuti a temperatura ambiente. Ripetere 2 volte. Aspirare il surnatante e pellet cellulare risospendere in 300 ml di PBS, EDTA, 2% FCS per citometria a flusso. Prendere atto di utilizzare il canale PE per analizzare il segnale rosso CMXRos.
- Marker Caratterizzazione di cellule T
- Incubare 50 ml di 1,2 x 10 6 CFSE marcato allo CD4 + T-cellule (generata dapunto 5.6) con PerCP-coniugato CD3 (1: 200), PE / Cy7 coniugato CD4 (1: 400) e CD25 APC / Cy7 coniugato (1: 100) al buio per 30 minuti a 4 ° C. Stain cellule T utilizzando un kit commerciale con Foxp3-Alexa Fluor 647 (1:50) al buio per 1 ora a temperatura ambiente.
5. Studi Alloreaction
- Preparare 5 mM soluzione madre di carbossifluoresceina succinimidyl ester (CFSE) con l'aggiunta di 18 ml di DMSO a liofilizzato CFSE, secondo il protocollo del produttore.
- Purificare CD4 + T-cellule da PBMC
- Determinare il numero di cellule prendendo 20 ml di sospensione cellulare PBMC e mescolare con 20 ml di trypan blu per contare il numero di cellule vive usando un citometro.
- sospensione cellulare centrifugare a 367 xg con freni per 10 min, 4 ° C.
- Aspirare pellet surnatante completamente e risospendere cellule in una concentrazione di 5 x 10 7 cellule per 1 ml di tampone colorazione in un polysty 5 mltubo di rene.
- Aggiungere T CD4 + Cellula umana arricchimento cocktail a 50 ml / ml cellule. Mescolare bene e incubare a temperatura ambiente (15 - 25 ° C) per 10 minuti.
- particelle magnetiche Vortex per 30 secondi e aggiungere particelle magnetiche a 100 l / cellule ml. Mescolare bene e incubare a temperatura ambiente per 5 min.
- Aggiungere buffer di colorazione alla sospensione cellulare ad un volume totale di 2,5 ml. Mescolare le cellule nel tubo delicatamente pipettando su e giù 2 - 3 volte. Posizionare il tubo nel magnete e incubare per 5 min.
- Capovolgere magnete con tubo e decantare la sospensione (contiene cellule T) in un nuovo 5 ml provetta di polistirene.
- Determinare il numero di cellule e incubare 1,2 x 10 6 + CD4 T-cellule con 5 micron CFSE in 1 ml di PBS per 20 minuti a 37 ° C, al riparo dalla luce.
- Aggiungere cinque volte il volume colorazione originale del terreno di coltura cellulare (preparato secondo punto 3.1.1) alle cellule e incubare per 5 min.
- centrifuge a 300 xg per 5 min, 4 ° C e risospendere pellet in terreno di coltura ad una concentrazione di 2 x 10 5 per 75 microlitri.
- Aggiungere 75 ml di 2 x 10 5 CFSE etichettati + CD4 T-cellule di ogni cultura MODC contenente 75 ml di terreno di coltura cellulare con 0, 2,5 x 10 3, 5 x 10 3, 10 x 10 3, 20 x 10 3 e 40 x 10 3 moDCs in 96 piatti ben U-bottom. Cultura per 6 giorni in coltura tissutale incubatore a 37 ° C con 5% di CO 2.
- Harvest pipettando CD4 + T-cellule in tubo da 15 ml e centrifugare a 300 xg per 5 min, 4 ° C. Raccogliere il surnatante per l'analisi citochine e pellet cellulare risospendere in 2 ml di PBS / EDTA e centrifugare a 300 xg per 5 minuti a 4 ° C.
6. citochine Analisi 19
- Raccogliere surnatanti provenienti da studi alloreaction come descritto al punto 5.5.
- Preparazione del reagente for Human citochine / ChemokinAnalisi del pannello magnetico e
- Per la preparazione di una bottiglia di perline di anticorpi immobilizzati per i singoli flaconi di perline di miscelazione (incluso nel kit), vortex per 1 min. Aggiungere 60 ml da ogni flaconcino anticorpi tallone alla bottiglia di miscelazione (incluso nel kit) e portare a un volume finale di 3 ml con Bead diluente (in dotazione).
- Per la preparazione dei controlli di qualità, ricostituiscono Controllo Qualità 1 e controllo qualità 2 (incluso nel kit) con 250 ml di acqua deionizzata.
- Per la preparazione di tampone di lavaggio, diluire 30 ml di tampone di lavaggio 10X (incluso nel kit) con 270 ml di acqua deionizzata.
- Per la preparazione di citochina umana standard, ricostituire lo standard citochina umana (incluso nel kit) con 250 ml di acqua deionizzata per dare un 10.000 pg di concentrazione / ml.
- Aggiungere 50 ml di 10.000 pg / ml standard di citochina umana di 200 ml di tampone del saggio (fornito nel kit) in una provetta da 1,5 ml microcentrifuga per rendere 2,000 pg / ml campione di lavoro. Trasferimento 50 ml di 2.000 pg / ml standard di citochina umana di 200 ml di tampone del saggio (fornito nel kit) in una provetta da 1,5 ml microcentrifuga per fare 400 pg / ml standard di lavoro.
- Trasferimento 50 ml di 400 pg / ml standard di citochina umana di 200 ml di tampone del saggio (fornito nel kit) in una provetta da 1,5 ml microcentrifuga per fare 80 pg / ml standard di lavoro. Trasferimento 50 ml di 80 pg / ml di serie citochina umana di 200 ml di tampone del saggio (fornito nel kit) in una provetta da 1,5 ml microcentrifuga per fare 16 pg / ml standard di lavoro.
- Trasferimento 50 ml di 16 pg / ml di serie citochina umana di 200 ml di tampone del saggio (fornito nel kit) in una provetta da 1,5 ml microcentrifuga per fare 3,2 pg / ml standard di lavoro. 0 pg / ml di lavoro deve solo 200 ml di tampone in una provetta da 1,5 ml microcentrifuga.
- piatto pre bagnato filtro (incluso nel kit) pipettando 200 ml di tampone del saggio (in dotazione) in ciascun pozzetto del filtropiatto. Sigillare e posizionare la piastra filtro su un agitatore per 10 min a temperatura ambiente.
- Aspirare tampone del saggio ed aggiungere 25 ml di ogni standard o controllo di qualità nei pozzetti appropriati.
- Aggiungere 25 ml di terreno di coltura cellulare (preparato secondo passo 3.1.1) per lo sfondo, gli standard e pozzetti di controllo.
- Aggiungere 25 ml di tampone ai pozzetti dei campioni e aggiungere 25 ml di campione nei pozzetti dei campioni appropriati.
- Vortex la bottiglia di miscelazione contenente microsfere di anticorpi immobilizzati e aggiungere 25 ml di perline misti in ogni pozzetto. Sigillare piastra e incubare agitando su un agitatore notte a 4 ° C.
- Aspirare piastra del fluido e lavare 2 volte con l'aggiunta di 200 pl / pozzetto di tampone di lavaggio e aspirare il liquido.
- Aggiungere 25 ml di anticorpi di rilevamento (in dotazione) in ciascun pozzetto. Sigillare e incubare agitando su un agitatore per 1 ora a temperatura ambiente.
- Aggiungere 25 ml di streptavidina ficoeritrina (provided) in ciascun pozzetto contenente 25 ml di anticorpi di rilevamento. Sigillare e incubare agitando su un agitatore per 30 minuti a temperatura ambiente.
- Aspirare piastra del fluido e lavare come descritto al punto 6.8.
- Aggiungere 150 ml / pozzetto di liquido guaina a tutti i pozzetti e perline risospendere su un agitatore per 5 minuti.
- Rilevare intensità di fluorescenza di perline usando un sistema 3D 20. Analizzare i dati medi di intensità fluorescenti utilizzando un metodo curva di raccordo log-logistico cinque parametri per calcolare le concentrazioni di citochine / chemochine nei campioni 21.
7. in tempo reale consumo di ossigeno Rate (OCR) e extracellulare acidificazione tariffe (ECAR) Misure
- Preparazione del reagente / Materiali
- Preparare media OCR: terreno di coltura integrato con 25 mM di glucosio e di 1 mm piruvato di sodio (pH 7,35). Sterilizzare questa soluzione mediante filtrazione attraverso un filtro da 0,2 micron. Prendere atto che questo mezzo è prepared senza FBS perché i componenti di FBS sono complessi e variano da un lotto di antere sacco.
- Preparare medio ECAR: Base media integrato con 2 mM L-glutammina (pH 7,35). Sterilizzare questa soluzione mediante filtrazione attraverso un filtro da 0,2 micron. Prendere atto che questo mezzo viene preparato senza bicarbonato, glucosio, piruvato e FBS. Si noti che FBS ha una capacità di buffering e interferirà con la lettura ECAR.
- Preparare composti per le misure OCR: Risospendere oligomicina con 630 ml di mezzo di OCR per fare 100 micron soluzione stock e diluire con il mezzo OCR a 16 micron concentrazione di lavoro. Risospendere carbonile cianuro 4- (trifluorometossi) fenilidrazone (FCCP) con 720 ml di mezzo di OCR per fare 100 micron soluzione stock e diluire con il mezzo OCR a 4,5 micron concentrazione di lavoro. Risospendere rotenone / antimicina A con 540 ml di mezzo di OCR per fare 50 mM di soluzione e diluire con il mezzo OCR a 10 micron concentrazione di lavoro.
- Prepararecomposti per misure ECAR: Risospendere Glucosio con 3 ml di terreno ECAR per fare 100 mM soluzione madre e portare a 80 mm concentrazione di lavoro. Risospendere oligomicina con 720 ml di medio ECAR per fare 100 micron soluzione stock e portare a 18 mm concentrazione di lavoro. Risospendere 2-deossi-D-glucosio con 1,5 ml di terreno ECAR per rendere 1.000 soluzione madre mm.
- Pipettare 200 ml di calibrante in ogni pozzetto della cartuccia e conservare a 37 ° C senza CO 2 un giorno prima misurazioni.
- In tempo reale OCR Misure
- Harvest moDCs e risospendere ogni tipo di moDCs in terreno OCR ad una concentrazione di 60 x 10 3 per 150 ml di mezzo OCR.
- Seme 60 x 10 3 cellule / pozzetto in una piastra di fondo 96 pozzetti piatta poli-D-lisina rivestite e incubare in un incubatore non CO 2 per 1 ora a 37 ° C. Prendere atto di utilizzare 50 ml di 50 ng / ml di poli-D-lisina per rivestire la piastra per 1 ora e lavare conacqua sterile. Mantenere monodisco a secco per 2 ore a temperatura ambiente prima dell'uso.
- Pipettare 25 ml di media OCR nella porta di iniezione A per tutti i pozzetti; 25 ml di media OCR contenente 16 mM di oligomicina nel foro di iniezione B per tutti i pozzetti; 25 ml di media OCR contenente 4,5 mM di (FCCP) a iniezione indiretta C per tutti i pozzetti e 25 medie OCR ml contenente 10 mM rotenone / antimicina A nel foro di iniezione D per tutti i pozzetti. Si noti che la concentrazione e finale per oligomicina è di 2 micron, FCCP è di 0,5 micron e rotenone / antimicina A è 1 micron.
- Mettere piatto in analizzatore di flusso extracellulare ed eseguire uno studio completo OCR con tutti moDCs contemporaneamente in quattro fasi consecutive: respirazione basale (dopo l'iniezione del mezzo dal porto di A), l'inibizione V complesso mitocondriale (dopo l'iniezione di droga dal porto B), la massima induzione di respirazione (dopo iniezione di droga dal porto di C) e l'inibizione della catena di trasporto degli elettroni (dopo il farmaco dal porto D) 22. Prendere atto che ci sono 3 cycles tra iniezioni e 6 intervallo minimo tra le misurazioni.
- In tempo reale ECAR Misure
- Harvest moDCs e risospendere ogni tipo di moDCs in terreno ECAR ad una concentrazione di 60 x 10 3 a 150 ml di mezzo ECAR.
- Seme 6 x 10 4 cellule / pozzetto in una piastra di fondo 96 pozzetti piatta poli-D-lisina rivestite e incubare in un incubatore non CO 2 per 1 ora a 37 ° C.
- Pipettare 25 ml di media ECAR nella porta di iniezione A per tutti i pozzetti; medio ECAR 25 ml contenente 10 mM di glucosio nel foro di iniezione B per tutti i pozzetti; medio ECAR 25 ml contenente 18 mM di oligomicina nel foro di iniezione C per tutti i pozzetti e 25 ml di media OCR contenente 1.000 mm 2-deossi-D-glucosio nel foro di iniezione D per tutti i pozzetti. Si noti che la concentrazione e finale per il glucosio è di 10 micron, oligomicina è di 2 micrometri e 2-deossi-D-glucosio è di 100 mm.
- Mettere piatto in analizzatore di flusso extracellulare ed eseguire unstudio completo ECAR con tutti moDCs contemporaneamente in quattro fasi consecutive: respirazione basale (dopo l'iniezione del mezzo dal porto di A), l'induzione glicolisi (dopo l'iniezione di droga dal porto B), la massima induzione glicolisi (dopo l'iniezione di droga dal porto di C) e l'inibizione della glicolisi (dopo droga dal porto D) 22.
- Analizzare differenze statistiche utilizzando ANOVA con un Tukey confronto multiplo post-test.
Risultati
Monociti Purificazione e dendritiche cellule differenziazione
I monociti sono stati purificati da PBMC dalla densità centrifugazione del sangue periferico (Figura 1A), seguita da CD14 + selezione positiva separazione magnetica (Figura 1B) e coltivate in terreno completo in presenza di GM-CSF e IL-4 per ottenere cellule dendritiche immature ( Figura 2A). L'aggiunta di vitamina D3 e desametasone alberino GM-CSF e IL-4 portato alla differenziazione delle moDCs immaturi in moDCs tolerogeniche (Figura 2B). LPS è stato aggiunto per indurre la maturazione di moDCs immaturi per maturare moDCs (Figura 2C) e moDCs tolerogeniche sono state stimolate con LPS per verificare la resistenza alla maturazione (Figura 2D). I campioni di sangue utilizzati in questo lavoro sono stati ottenuti da donatori sani con precedente informaticonsenso.
MODC Caratterizzazione
Surface Marker Caratterizzazione mediante citometria a flusso
L'analisi dei marcatori di superficie DC ha mostrato che moDCs mature esprimono i più alti livelli di markers di maturazione HLA-DR, CD83 e CD86 rispetto al moDCs tolerogeniche LPS-trattati, moDCs tolerogeniche e moDCs immaturi (Figura 3). Questi risultati hanno dimostrato che moDCs tolerogeniche erano resistenti alla maturazione rispetto ai moDCs immaturi seguenti stimolazione LPS. Inoltre, LPS-trattato moDCs tolerogeniche e moDCs tolerogeniche visualizzata aumentata espressione di CD14, BDCA3 (CD141) e immunoglobulina simile trascrizione (ILT) 3 rispetto al moDCs immaturi e maturi. Le moDCs tolerogeniche che abbiamo generato qui è coerente con precedenti relazioni 23.
Caratterizzazione funzionale di moDCs
moDCs indotte per la maturazione diventano immunogenico e rilasciano citochine che favoriscono la proliferazione di cellule CD4 + T-cellule. Abbiamo valutato l'immunogenicità dei diversi sottotipi MODC misurando la proliferazione delle cellule T co-coltura. MoDCs tollerogenico erano scarsamente immunogenico rispetto al moDCs maturi, come mostrato da un basso alloproliferation di CD4 + T-cellule (Figura 4A). MoDCs tollerogenico si caratterizzano per il loro basso IFN-Γ, basso IL-12p40, e di alta IL-10 la produzione di citochine in alloreaction co-colture con CD4 + T-cellule (Figura 4B). Inoltre, allospecific aumento del numero di moDCs tolerogeniche in co-culture di moDCs maturi indotta CD4 + T-cellule aumentato la frequenza di alta Foxp3 + cellule T regolatorie CD25 (Figura 4C).
Analisi delle attività mitocondrialeRed CMXRos viene utilizzato per riflettere l'attività mitocondriale di analizzare i mitocondriale potenziali livelli di membrana in moDCs. Sono stati osservati moDCs tollerogenico di avere una maggiore attività mitocondriale rispetto agli altri sottotipi MODC differenziati (Figura 5A). Successivamente, il tasso di consumo di ossigeno mitocondriale (OCR) è valutata per i diversi sottotipi MODC utilizzando un Bioanalyzer. misurazioni OCR permettono intuizioni ad alta risoluzione al profilo metabolico, che fornisce informazioni incluso ma non limitato alla respirazione basale, la capacità respiratoria di riserva, perdita di protone e la respirazione non mitocondriale. La misurazione di OCR fornisce un mezzo per valutare la capacità delle cellule di rispondere allo stress. Le cellule sono metabolicamente perturbati mediante l'aggiunta di tre diversi composti in successione. La prima iniezione è Oligomycin (ATP accoppiatore), che inibisce complesso V della catena di trasporto degli elettroni (ETC), inibendo la sintesi di ATP. Questo passaggio distingue la percentuale di ossigeno consumato per la sintesi di ATP e la percentuale di ossigeno consumato per superare protoni perdita attraverso la membrana mitocondriale interna. La seconda iniezione è FCCP (ETC acceleratore) che interrompe la sintesi di ATP trasportando ioni idrogeno attraverso la membrana mitocondriale anziché attraverso il canale protone V. Complesso Il crollo del potenziale di membrana mitocondriale porta ad un rapido consumo di energia e ossigeno, senza generazione di ATP. trattamento FCCP può essere usato per calcolare la capacità respiratoria di riserva di cellule. Mantenimento della capacità respiratoria di riserva in condizioni di stress è fondamentale per la sopravvivenza delle cellule. Questa capacità è determinata da diversi fattori, compresa la disponibilità di substrato e capacità funzionale degli enzimi coinvolti nella ECC La terza iniezione è una combinazione di Rotenone, un Complex I Inhibitor, e Antimicina A, un complesso III inibitore. Questa combinazione spegne respirazione mitocondriale e OCR è osservato a diminuire a causa della ridotta funzione mitocondriale (Figura 5C). MoDCs tollerogenico visualizzati più alti livelli basali di OCR moDCs maturi (Figura 5D). Inoltre, tollerogenico, LPS-tollerogenico e moDCs immaturi ha mostrato un aumento della capacità respiratoria di riserva rispetto a moDCs maturi (Figura 5e).
Caratterizzazione metabolica di moDCs
Poiché l'acido lattico e protoni vengono rilasciati dalle cellule durante glicolisi, abbiamo analizzato l'attività glicolitica di moDCs mediante un'analisi in tempo reale della velocità di acidificazione extracellulare (ECAR) (Figura 6B). In presenza di glucosio, la glicolisi di tutti moDCs aumentata rispetto alla fase basale, conmoDCs maturi che presentano il più alto tasso di glicolisi moDCs immature (Figura 6D). Tollerogenico e moDCs immaturi esposte superiore glicolisi massima (indotta da oligomicina in presenza di glucosio) rispetto a moDCs LPS-trattati (Figura 6b). La capacità glicolitica di moDCs tolerogeniche e immaturi era superiore moDCs maturi (Figura 6 sexies). In contrasto con il loro alto tasso di glicolisi, riserva glicolitico è stato il più basso in moDCs maturi (Figura 6F).
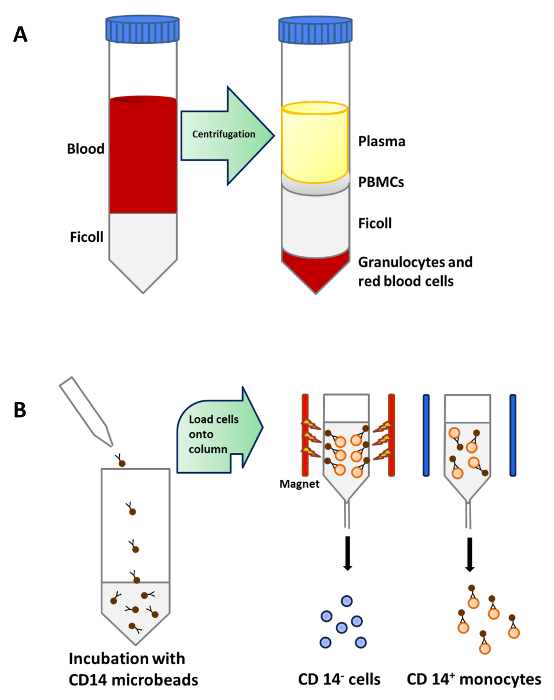
Figura 1:. Purificazione monociti del sangue periferico (A) 25 ml di sangue è attentamente stratificato su 15 ml di Ficoll per tubo da 50 ml prima della centrifugazione. PBMC sono concentrate in un livello sottostante plasma dopo centrifugazione densità. (B) PBMC sono incubate con microsfere che sono conj ugated agli anticorpi monoclonali CD14 umani (isotipo: IgG2a del mouse). e poi caricato su una colonna che si trova nel campo magnetico di un separatore per isolare CD14 + monociti Cliccate qui per vedere una versione più grande di questa figura.
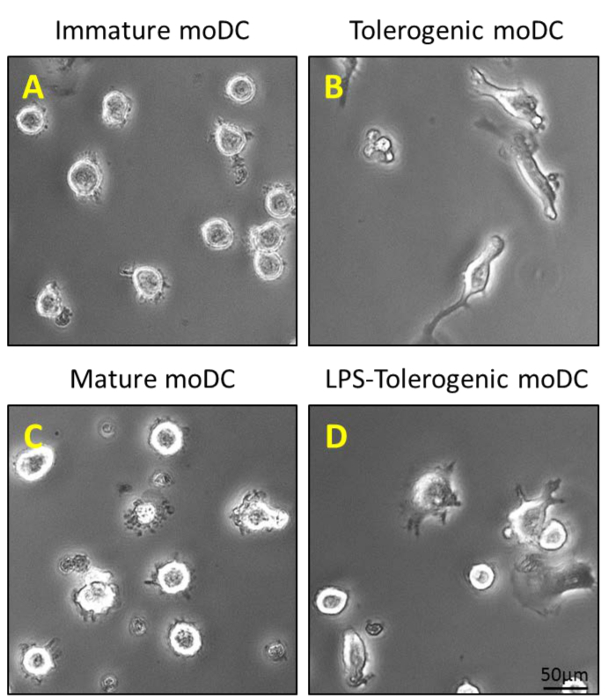
Figura 2: caratterizzazione morfologica di moDCs. (A) 200 ng / ml di GM-CSF e IL-4 è aggiunto monociti CD14 + purificate al giorno 0, 4 e 6 per generare moDCs immaturi; e (B) un ulteriore passaggio di stimolazione con 100 nM vitamina D3 e 10 nM desametasone il giorno 5 genera moDCs tolerogeniche. MoDCs immaturi e moDCs tolerogeniche vengono stimolati con 1 mg / ml LPS il giorno 6 di generare (C) moDCs maturare e moDCs (D) LPS-tolerogeniche.TTP: //www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
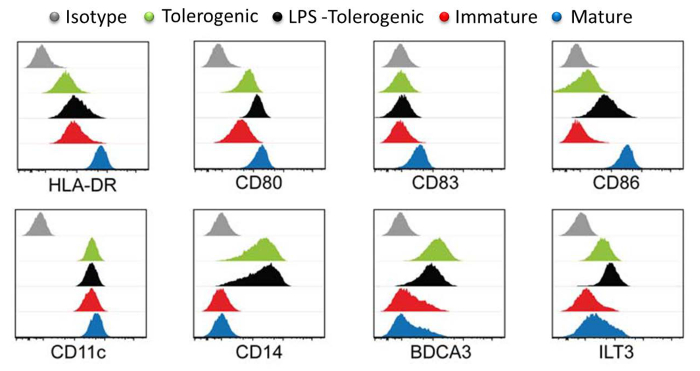
Figura 3:. Surface Marker Caratterizzazione mediante citometria di flusso livelli di espressione di marcatori di superficie HLA-DR, CD80, CD83, CD86, CD11, CD14, BDCA3 e LT3 a tollerogenico (verde), LPS-tolerogeniche (nero), immaturo (rosso), maturo (blu) moDCs. controlli isotipo sono mostrati in grigio. istogramma individuale per ogni tipo di cellula è tracciata con conta delle cellule asse Y contro log asse X di intensità fluoroforo e sovrapposti. Tutti gli istogrammi sono rappresentativi di quattro esperimenti indipendenti. Questa cifra è stata modificata dal J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 giugno 2015). Riprodotto e ripubblicato con il permesso di copyright. Copyright 2015. L'American Association ofImmunologi, Inc. Si prega di cliccare qui per vedere una versione più grande di questa figura.
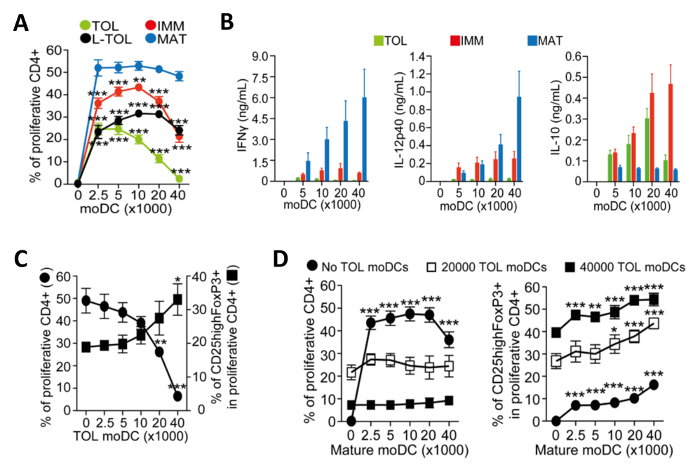
Figura 4: caratterizzazione funzionale di moDCs. (A) Quantificazione di frequenza alloproliferation di CD4 + T-cellule indotte da co-coltura con un numero crescente di tollerogenico (TOL, verde), LPS-tollerogenico (L-TOL, nero), immaturo (IMM, rosso) e maturo (MAT ; blu) moDCs. I dati sono stati pool da quattro esperimenti indipendenti; significare differenze statistiche + SEM tra tutti moDCs rispetto moDCs maturi sono stati analizzati da ANOVA a due vie con Dunnett confronto multiplo post-test. (B) analisi di citochine di IFN-Γ (pannello di sinistra), IL-12p40 (pannello centrale) e Il- 10 (riquadro a destral) nei supernatanti da alloreactions tra CD4 + T-cellule co-coltura con un numero crescente di una tollerogenico (verde), immaturo (rosso) o blu) moDCs (maturi. I dati sono stati raggruppati da sei esperimenti indipendenti; media ± SEM alloproliferation + (C) cellule T CD4 e regolamentare l'espansione di cellule T indotta dalla co-coltura con moDCs maturi in presenza di un numero crescente di moDCs tolerogeniche. Sinistra asse Y, la frequenza di CD4 + proliferazione T-cellule. Destra asse Y, la frequenza di CD25 alta Foxp3 + cellule gated sul proliferativa CD4 + T-cellule. I dati sono stati riuniti da tre esperimenti indipendenti; media ± SEM differenze statistiche tra presenza contro l'assenza di moDCs tolerogeniche sono stati analizzati da una via ANOVA con Dunnett confronto multiplo post-test. (D) alloproliferation + CD4 T-cell (a sinistra) e la frequenza di cellule CD25highFoxP3 + (Destra) indotta da co- cultura con moDCs tolerogenichein presenza di un numero crescente di moDCs maturi. I dati sono stati riuniti da due a tre esperimenti indipendenti; media ± SEM differenze statistiche tra la presenza contro l'assenza di moDCs maturi sono stati analizzati da ANOVA a due vie con Dunnett confronto multiplo post-test. Questa cifra è stata modificata dal J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 giugno 2015). Riprodotto e ripubblicato con il permesso d'autore. Copyright 2015. L'American Association of immunologi, Inc. Si prega di cliccare qui per vedere una versione più grande di questa figura.
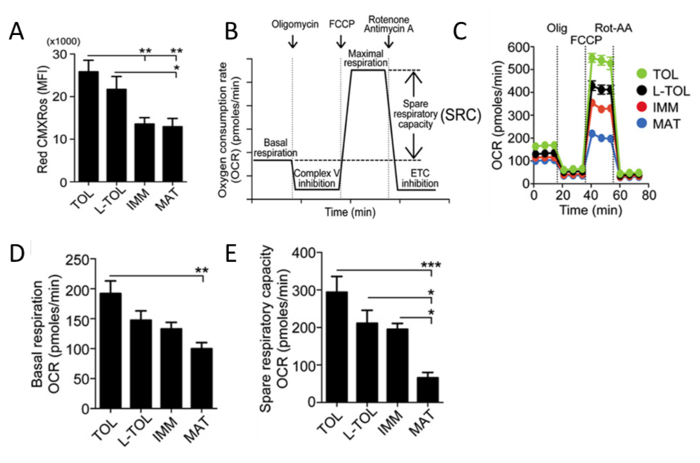
Figura 5: Analisi di mitocondriale attività di moDCs. (A) I livelli di potenziale di membrana mitocondriale (Red CMXRos) in moDCs sono stati ottenuti da fanalisi di citometria basso. I dati di quattro esperimenti indipendenti sono stati riuniti. Media ± SEM (B) Rappresentazione schematica di una respirazione mitocondriale tempo reale. analisi OCR partendo dalla respirazione basale e dopo l'aggiunta di oligomicina (inibizione complesso V), FCCP (massima induzione respirazione), e rotenone / antimicina Una miscela (catena di trasporto degli elettroni inibizione [ETC]). Il mitocondriale SRC (basale massima sottratto respirazione massima) è derivato dalla curva OCR. (C) Rappresentante studio cinetico di mitocondri OCR (pmol / min) a tollerogenico (TOL, verde), LPS-tollerogenico (L-TOL, nero) , immaturo (IMM, rosso) e maturo (MAT, blu) moDCs utilizzando sequenziale aggiunta di oligomicina (Olig), FCCP, e rotenone / antimicina A (Rot-AA). (D) OCR quantificazione della respirazione basale di moDCs e ( E) risparmia capacità respiratoria di moDCs. I dati sono stati riuniti da cinque esperimenti indipendenti. Media ± SEM. Questa cifra è stata modificata dal J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 giugno 2015). Riprodotto e ripubblicato con il permesso d'autore. Copyright 2015. L'American Association of immunologi, Inc. Si prega di cliccare qui per vedere una versione più grande di questa figura.
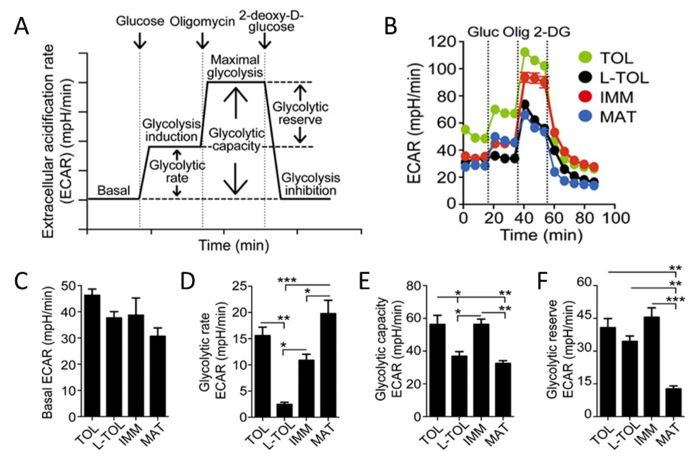
Figura 6: Caratterizzazione metabolica di moDCs. (A) Rappresentazione schematica di tempo reale glicolisi. analisi ECAR parte da ECAR basale, in cui le cellule sono state incubate in terreno senza-glucosio seguire l'aggiunta di glucosio (induzione glicolisi), oligomicina (che induce glicolisi cellule massima inibizione complesso V), e infine 2-deossi-D- glucosio(Inibizione glicolisi). Glicolisi (induzione glicolisi sottratto per ECAR basale), la capacità glicolitico (glicolisi massima sottratto per basale ECAR), e riserva glicolitico (glicolisi massima sottratto per l'induzione glicolisi) sono derivati dalla curva ECAR. (B) Rappresentante studio cinetico della glicolisi-dipendente ECAR (mph / min) a tollerogenico (TOL, verde), LPS-tollerogenico (L-TOL, nero), immaturo (IMM, rosso), e maturo (MAT, blu) moDCs utilizzando sequenziale aggiunta di glucosio (Gluc), oligomicina (Olig), e 2-DG. Bars (C) mostrano livelli basali ECAR (D) glicolisi (e) capacità glicolisi, e (F) riserva glicolitico di moDCs. I dati sono stati riuniti da tre esperimenti indipendenti; significare 6 SEM. Le differenze statistiche sono stati analizzati mediante ANOVA con Tukey confronto multiplo post-test. Questa cifra è stata modificata dal J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 giugno 2015). Riprodotto e ripubblicato con il permesso d'autore. Copyright 2015. L'American Association of immunologi, Inc. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
Questo documento descrive un metodo per generare da monociti moDCs immaturi, moDCs tolerogeniche e moDCs maturi. I passi importanti in questo protocollo sono discussi in dettaglio nei paragrafi successivi. È importante notare che il sangue periferico umano è utilizzato come materiale di partenza in questo protocollo e le precauzioni universali per la manipolazione del sangue umano dovrebbe essere praticata. Anche se è tecnicamente possibile ricavare DC dal midollo osseo nell'uomo 24, in vitro DC differenziazione da cellule presenti nel sangue periferico è preferito a causa della disponibilità di sangue periferico rispetto al midollo osseo. Tra le cellule che si trovano nel sangue periferico, cellule e monociti CD34 + staminali ematopoietiche sono comunemente utilizzati per la generazione in vitro delle cellule dendritiche. CD34 + ematopoietiche cellule staminali sono coltivate con GM-CSF e TNF-α per derivare sottoinsiemi CD1a + e CD14 +, che vengono poi ulteriormente differenziate in Langerhanscome le cellule e cellule dendritiche. Viceversa, monociti sono coltivate in GM-CSF e IL-4 per generare moDCs immaturi. Diversi protocolli sono utilizzati per l'arricchimento dei monociti da sangue periferico; per esempio, con l'adesione a piatti di plastica, elutriation e kit di isolamento 25, 26 I vantaggi del protocollo aderenza sono minimo danno alle cellule e relativamente redditizio tuttavia cella purezza potrebbe essere compromessa.; e un passaggio aggiuntivo è necessaria per staccare le cellule per ulteriori esperimenti. Elutriation è una tecnica che separa le cellule in base alla loro dimensione e la densità. I vantaggi di elutriation sono vitalità cellulare e monociti possono essere usati facilmente per ulteriori esperimenti; Tuttavia questa tecnica è limitata dalla disponibilità di un elutriatore e l'impossibilità di separare differenti popolazioni di cellule (cellule T e monociti) con parametri sedimentazione simili. In commercio kit di isolamento disponibili utilizzano microsfere magnetiche per selezionare sia positivo oselezionare negativamente la popolazione monocitica. Alcuni protocolli sono prevenuto verso l'isolamento dei monociti utilizzando la selezione negativa come i monociti isolati restano "intatti" (non è vincolata da marcatori o microsfere). In questo protocollo, perline CD14 positivi sono stati usati per selezionare i monociti umani da PBMC. CD14 manca di un dominio citoplasmatico e vincolante di anticorpi CD14 non attiva la trasduzione del segnale. Inoltre, le microsfere si staccano dai monociti dopo coltura e quindi non ostacolare il processo di differenziazione. Inoltre, CD14 è fortemente espresso sulla maggior monociti e debolmente sui neutrofili e alcune cellule dendritiche mieloidi, quindi questo metodo di isolamento risultati in maggiore purezza cella rispetto agli altri metodi 17.
monociti del sangue possono essere differenziati in DC o macrofagi e il destino dei monociti dipende in gran parte l'ambiente di citochine. In questo lavoro, moDCs sono generati con l'aggiunta di fattore stimolante le colonie di granulociti-macrofagi (GM-CSF) E interleuchina 4 (IL-4) per monociti del sangue periferico umano. GM-CSF è necessaria per la sopravvivenza monociti e IL-4 esercita un'attività inibitoria sulla differenziazione dei macrofagi; e la combinatoria aggiunta di GM-SCSF e IL-4 per monociti cedere una maggiore percentuale di moDCs immaturi rispetto al citochina individuale 27. Ci sono altri protocolli che generano moDCs aggiungendo fattore di necrosi tumorale alfa (TNF-α), interferone alfa (IFN-α) e Interleuchina 13 (IL-13) di monociti del sangue periferico 28, 29, 30. La combinazione di GM-CSF e IL-4 è stato ottimizzato nel 1990 e ora un protocollo riconosciuto che genera DC immature plastica differenziate in moDCs immunogenico o tolerogeniche e polarizzate in Th1, Th2 o Th17 moDCs promuovono.
moDCs immaturi vengono differenziate in moDCs tolerogeniche con l'aggiunta di vitamina D3 e desametasone. Ci sono diversi protocolli per generare cellule dendritiche tolerogeniche per esempio, tramitefattore-kappa B nucleare (NF-kB) inibizione, l'attivazione β-catenina, vitamina D3, desametasone e Rapamicina 31, 32, 33, 34, 35, 9, 36, 37. Sebbene sia la vitamina D3 e desametasone da solo sono stati segnalati per indurre un effetto tollerogenico sulle DC, la combinazione di vitamina D3 e desametasone risultato in una maggiore soppressione di alloproliferation rispetto a quando si utilizzano singoli farmaci. Pertanto, il protocollo esistente per la generazione di tollerogenica DC è stato modificato per una combinazione di vitamina D3 e desametasone. Questo metodo è attualmente in fase accettata come modello per DC tolerogeniche umani con un programma di utilità terapeutica. E 'anche importante notare che la vitamina D3 ricostituito e desametasone hanno una breve durata.
In questo protocollo, Lipopolisaccaridi (LPS) è stata aggiunta come un induttore di maturazione DC. moDCs immaturi possono anche essere indotti a maturazione con cocktail pro-infiammatoria:(TNF-α), interleuchina 1 beta (IL-1β), interleuchina 6 (IL-6) e prostaglandina E2) o citochine pro-infiammatorie (TNF-alfa e interferone gamma (IFN-Γ)). Cocktail pro-infiammatorio genera moDCs maturi con funzioni di alta co-stimolazione e migratori ma producono livelli relativamente bassi di IL-12 38. TNF-α o IFN-Γ da solo non è in grado di indurre un fenotipo stabile dendritica 39. LPS stimola Toll-like receptor 4 (TLR4), media l'attivazione di NF-kB e mitogeno activated protein chinasi (MAPK) per indurre la maturazione DC. DC maturazione indotta da LPS mostra un up-regulation di marcatori di maturazione DC (CD83, CD86, HLA-DR) e ha portato alla produzione di IL-12p70. Inoltre, questo passo può essere ulteriormente modificato per accoppiare LPS con agonisti TLR3 per produrre cellule dendritiche mature per cancro vaccini clinici. In questo lavoro, DC tolerogeniche sono dimostrato di essere resistente a maturazione in seguito al trattamento con LPS. Questi semi maturi come DC non sono immunogenica e non lo fanno ReleaSE citochine pro-infiammatorie 40.
Le limitazioni di questo protocollo trovano nel processo di differenziazione. Il processo richiede 8 giorni dal giorno 0 al 7 ° giorno che pone una difficoltà per essere adattato in analisi di un elevato throughput. Una modifica nel protocollo è necessario per abbreviare il processo di differenziazione ancora produrre un elevato numero di cellule dendritiche vitali nei diversi stati. In secondo luogo, le cellule dendritiche sono generati mediante aggiunta di citochine in questo protocollo e queste citochine non sostengono popolazione DC per un lungo periodo di tempo. Inoltre, citochine sono usati in concentrazioni molto superiore in vivo e potrebbero causare lo sviluppo di parte di percorsi che non sono fisiologicamente identica a DC in vivo. Per esempio in colture in vitro di precursori DC hanno dimostrato di rispondere al GM-CSF, che non è una citochina essenziale per la normale differenziazione DC in vivo 41. Tuttavia, la stimolazione citochina può essere un metodo utile per geneAlto tasso di numero di DC in vitro per la sperimentazione. La possibilità di sottoporre queste cellule generate da questo protocollo per altre analisi, come immunofluorescenza, citometria a flusso, ALLO studi di reazione e studi metabolici aumenta l'utilità di questo metodo. Queste cellule dendritiche in vitro servire come un buon modello per migliorare la conoscenza dello sviluppo DC, la maturazione e la presentazione dell'antigene, che è in precedenza difficile da fare con rari numeri di DC in vivo.
Capacità DC 'di regolare l'immunità immunologica contro la tolleranza li rende i candidati attraenti in terapie contro il cancro e le malattie autoimmuni 42, 43, 44, 45. DC immunogeniche generati in questo protocollo può essere utilizzato per migliorare l'efficacia della vaccinazione contro le malattie infettive e tumori; mentre DC tolerogeniche possono essere utilizzati per controllare le risposte delle cellule T indesiderati e prevenire il rigetto in seguito a trapianto. l'intricataequilibrio tra immunità e tolleranza dipende dallo stato immensamente differenziazione DC. differenziazione DC è un programma coordinato cellulare che è governato da molteplici vie di segnalazione e destino metabolico. Diversi stati di differenziazione di DC si differenziano per le esigenze bioenergetica e biosintesi; per esempio, DC attivate richiedono adattamenti metabolici più energici importanti per la sopravvivenza e la migrazione rispetto ai PVS in stato di riposo. E 'importante notare che la vitamina D3, desametasone e rapamicina sono noti per la loro capacità di indurre DC tolerogeniche, sono stati descritti per influenzare il metabolismo DC. In questo lavoro, il metabolismo energetico del moDCs provenienti da diversi stati di differenziazione sono stati caratterizzati utilizzando gli analizzatori di flusso extracellulari e moDCs tolerogeniche esposto il più alto di maturazione metabolica plasticità e LPS-indotta è diminuita questa plasticità. Metabolismo anabolizzanti supporta DC maturazione mentre catabolici influenze metabolismo tollerogenico DC funziona 46. DCSgenerato da questo protocollo può essere utilizzato per valutare se modificare lo stato metabolico delle cellule dendritiche tenere premuto il tasto per modificare l'immunità e la tolleranza nelle terapie. In conclusione, abbiamo presentato un protocollo per la generazione di immaturi, tollerogenico e moDCs maturi fondamentale per lo studio delle funzioni immunomodulanti PVS.
Divulgazioni
Open access fees for this article were provided by, Agilent Technologies.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Agenzia per la Scienza, Tecnologia e Reasearch Nucleo finanziamento (a JEC).
Materiali
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 mL centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 mL falcon tube | Falcon | 352096 | PBMC isolation |
| 50 mL falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 mL Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
Riferimenti
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon