Method Article
Génération de Immature, d'âge mûr et tolérogène cellules dendritiques avec Metabolic Différentes phénotypes
Dans cet article
Résumé
Immature dendritic cells can be selectively differentiated into tolerogenic or mature dendritic cells to regulate the balance between immunity and tolerance. This work presents a means to generate from immature monocyte derived dendritic cells (moDCs), in vitro tolerogenic and mature moDCs that differ in metabolic phenotypes.
Résumé
Résultats de la réponse immunitaire d'une interaction complexe entre le système immunitaire inné antigène non spécifique et le système immunitaire adaptatif de l'antigène spécifique. Le système immunitaire est un équilibre constant dans le maintien de la tolérance aux auto-molécules et de réagir rapidement aux agents pathogènes. Les cellules dendritiques (CD) sont puissantes cellules présentatrices d'antigène professionnelles qui lient le système immunitaire inné pour le système immunitaire adaptatif et équilibrent la réponse adaptative entre le soi et le non-soi. En fonction des signaux de maturation, les cellules dendritiques immatures peuvent être stimulés sélectivement pour se différencier en DCs immunogènes ou tolérogènes. les cellules dendritiques immunogéniques fournissent des signaux de prolifération de cellules T spécifiques de l'antigène pour l'expansion clonale; tandis que les cellules dendritiques tolérogènes régulent la tolérance par la suppression des cellules T spécifiques de l'antigène ou de l'expansion clonale des cellules T régulatrices. En raison de cette propriété unique, les cellules dendritiques sont très recherchés en tant qu'agents thérapeutiques pour le cancer et papille auto-immuneases. Les cellules dendritiques peuvent être chargées avec des antigènes spécifiques in vitro et injectés dans le corps humain pour produire une réponse immunitaire spécifique à la fois immunogène et tolérogène. Ce travail présente un moyen pour générer in vitro à partir de monocytes, les cellules dendritiques immatures monocytes dérivés (moDCs), tolérogène et moDCs matures qui diffèrent dans l' expression des marqueurs de surface, la fonction et les phénotypes métaboliques.
Introduction
DC a été décrite par Paul Langerhans (cellules de Langerhans) à la fin du XIXe siècle comme référencé par Jolles 1 et caractérisé par Ralph Steinman et Zanvil Cohn en 1973 qui les a reconnus comme des cellules présentatrices d'antigène professionnelles 2. DCs sont présents dans le sang périphérique et dans la plupart des tissus du corps, particulièrement abondantes dans les tissus qui sont exposés à l'environnement extérieur tels que la peau (présent sous forme de cellules de Langerhans) et dans les garnitures du nez, des poumons, de l'estomac et les intestins qui permettent qu'ils rencontrent des antigènes extrinsèques. Immature PED ont la capacité d' endocytose mais relativement faible capacité à stimuler les cellules T 3. Immature DC expriment différents récepteurs de reconnaissance des formes (PRR) que les modèles de capture des pathogènes associés moléculaires (PAMP) ou des motifs moléculaires dommages-associés (Damps) 4. signaux de danger Activation voiture maturation vers les PED immunogènes alors auto-molécules entraînent T unresponsivene cellulairess et de l' apoptose 5. DCs immunogènes sont caractérisés par la surexpression de molécules du CMH et des molécules de surface co-stimulatrices et leur capacité de premiers lymphocytes T naïfs 6,7.
Immature PED peut également être mûri vers un état Treg induisant ou tolérogène en réponse à la vitamine D3 métabolite 1a, 25 (O) 2 D 3 et certains agents immunosuppresseurs comme l' interleukine-10 (IL-10), la dexaméthasone et la rapamycine 8-9. Les DC tolérogènes sont caractérisées par leur expression de motifs inhibiteurs à base de tyrosine d'immunorécepteur (ITIM) contenant des récepteurs de surface et des ligands. Signal transduction de ITIM contenant des membres de la famille ILT, ILT3 et ILT4 dans les PED tolérogènes inhibent alloproliferation et conduire Foxp3 + Treg extension 10,11. Ces propriétés uniques des DCs tolérogènes conduisent à leur profonde activité in vivo, à savoir la capacité d'induire une tolérance robuste aux greffes allogéniques transplantées et supprEss le développement de maladies auto-immunes. Tolérogène DCs peut être considérée par conséquent comme un sous-type de polarisation DC matures qui fonctionnent dans l'inhibition de l'activation immunitaire.
À l' heure actuelle, il existe deux sous - ensembles généraux de cellules dendritiques dans le sang périphérique humain: DC plasmacytoïdes et DC myéloïdes 12. DC circulantes sont constituant rare à moins de 2% de leucocytes dans le sang humain et cela pose une difficulté à l'isolement d'un nombre approprié de pays en développement pour étudier leurs fonctions immunorégulatrices. Pour surmonter ce problème, les monocytes différenciés DCs sont utilisées comme modèle in vitro pour l'étude de la fonction des cellules dendritiques. Ces DC in vitro ont des récepteurs et des fonctions similaires par rapport aux CD in vivo. Comparaison détaillée des in vivo PED et dérivés de monocytes DC in vitro (généré de moDCs) sont étudiés par d' autres laboratoires 13, 14, 15. Il est également rapporté que moDCs et CD1c + DC étaient équivalentes à l' antigène présentant et en induisant la fonction des cellules T 15.
Dans cet article, nous décrivons une méthode de génération de moDCs immatures de monocytes du sang périphérique, puis de les différencier en DC immunogènes et tolérogènes. Ces cellules dendritiques dérivées de monocytes (moDCs) sont caractérisées par leurs marqueurs de surface, le profil des cytokines immunorégulatrices, des fonctions et états métaboliques. les cellules dendritiques immunogènes et tolérogènes produisent différentes cytokines qui se traduisent par l'expansion des cellules soit T allogéniques ou des cellules T régulatrices. Dans cet article, cytokine profilage est réalisée avec des systèmes utilisant la technologie multiplex. milieu de cellules de croissance sont incubés avec l'anticorps immobilisé code couleur des perles et lire dans un analyseur compact. états métaboliques des PED sont analysés en utilisant des analyseurs de flux extracellulaires qui mesurent le taux d'oxygène de la consommation, un indicateur de la respiration cellulaire, et le taux d'acidification extracellulaire qui reflète la glycolysele flux dans les cellules dendritiques. La mesure de ces taux bioénergétiques fournit un moyen de suivre les changements dans le métabolisme cellulaire qui sont essentiels dans le développement des cellules dendritiques et de la fonction.
Protocole
Cette recherche a été approuvé par le comité d' examen institutionnel (NUS-IRB 10-250).
1. Isolement des cellules mononucléaires du sang périphérique (CMSP)
- Préparation du réactif
- Préparer du PBS / EDTA: solution saline tamponnée au phosphate (PBS) et compléter avec 2 mM d'acide éthylènediaminetétraacétique (EDTA). Stériliser cette solution par filtration à travers un filtre de 0,2 um. Remarque pour stocker PBS / EDTA à 4 ° C et chaud à la température ambiante avant utilisation.
- Préparer un tampon de coloration: solution saline tamponnée au phosphate (PBS) avec supplément de sérum de 2% de fœtus bovin (FBS), 10 mM d'acide 4- (2-hydroxyéthyl) -1-piperazineethanesulfonic (HEPES), 2 mM d'acide éthylènediaminetétraacétique (EDTA). Stériliser cette solution par filtration à travers un filtre de 0,2 um.
- Recueillir le sang du sang Cone
Remarque: Le cône de sang contient des composants blancs de cellules sanguines recueillies après la plaqueletpheresis de l'hôpital. Si le sang est recueilli dans des tubes d'héparine ou de l'EDTA, diluer le sang avec du PBS en rapport 1: 1 et passez à l'étape 1.3; si la couche leucocytaire est reçue, diluer la couche leucocytaire avec du PBS en rapport 1: 2 et passez à l'étape 1.3.- Couper les deux extrémités du cône pour permettre au sang de couler hors d'un tube de 50 ml. A noter que le cône contient habituellement de 10 ml de sang.
- Utiliser une seringue à extrémité émoussée contenant 30 ml de PBS / EDTA pour laver le cône et le recueillir dans un tube de 50 ml.
- Diluer le sang supplémentaire avec du PBS / EDTA jusqu'à un volume final de 80 ml.
- L' isolement des PBMC par centrifugation 16 Densité
- Aliquoter 15 ml de Ficoll chacun 4 frais tubes de 50 ml.
- Utilisez un 25 ml pipettes sérologiques pour ajouter 20 ml de sang dilué sur la couche Ficoll. Prenez note de tenir le tube de 50 ml à un angle de 45 et de prendre soin de ne pas perturber l'interphase.
- Centrifuger les tubes à 805 xg sans freins pendant 30 min, 20 ° C.
- Retirer lecouche de plasma et de recueillir l'anneau de CMSP se trouvant juste en dessous de la couche de plasma avec une pipette Pasteur. Combinez quatre tubes de PBMC en deux tubes de 50 ml. Remarque pour éviter la collecte de la couche transparente en dessous de la CMSP.
- Ajouter du PBS / EDTA jusqu'à un volume final de 50 ml par tube de PBMC et centrifuger à 548 x g avec des freins pendant 10 min, 20 ° C.
- Aspirer le surnageant et remettre en suspension le culot dans chaque tube avec 25 ml de tampon de coloration et de combiner en un seul tube de 50 ml.
- Centrifuger à 367 xg avec des freins pendant 5 min, 4 ° C.
- Aspirer le surnageant et remettre le culot avec 10 ml de tampon de coloration.
2. monocytes Enrichissement par séparation magnétique 17
- Déterminer Nombre de cellules
- Prendre 20 pl de PBMC suspension cellulaire et mélanger avec 20 pi de bleu trypan pour compter le nombre de cellules vivantes en utilisant cytomètre.
- Centrifugeuse suspension de cellules à 367 xg avec des freinspendant 10 min, 4 ° C.
- Aspirer le surnageant et remettre en suspension complètement culot cellulaire à une concentration de 10 7 cellules par 80 pi de tampon de coloration.
- étiquetage magnétique
- Ajouter 20 ul de microbilles CD14 par 10 7 cellules, bien mélanger et laisser incuber pendant 15 minutes à 2 - 8 ° C.
- Laver les cellules en ajoutant 1 ml de tampon de coloration par 10 7 cellules et centrifuger à 367 x g avec des freins pendant 10 min, 4 ° C.
- Aspirer le surnageant du culot cellulaire et remettre en suspension complètement à une concentration de 10 7 cellules par 50 ul de tampon de coloration.
- séparation magnétique
- Utiliser la colonne de dimensions moyennes pour un maximum de 2 x 10 8 cellules au total.
Remarque: Choisissez une colonne et d'un séparateur approprié en fonction du nombre de cellules totales et le nombre de cellules CD14 + recommandées dans la fiche technique. - Placer la colonne dans le champ magnétique ofa séparateur approprié et à préparer la colonne par rinçage avec 500 pi de tampon de coloration.
- Introduire à la pipette la suspension cellulaire sur colonne et recueillir les cellules non marquées qui passent à travers la colonne avec un tube de 15 ml.
- Remplacer un nouveau tube de 15 ml dans la colonne et colonne de lavage 3 fois avec 500 pi de tampon de coloration. Assurez-vous que le réservoir de la colonne est vide avant d'ajouter nouveau tampon de coloration entre les lavages.
- Retirer la colonne du séparateur et le placer sur un nouveau tube de 15 ml.
- Introduire à la pipette 1 ml de tampon de coloration sur la colonne. Rincer immédiatement les cellules magnétiquement marquées en poussant fermement le piston (fourni dans le kit) dans la colonne.
- Répéter les étapes 2.3.2 à 2.3.6 en utilisant la fraction éluée sur une colonne pour augmenter la pureté des cellules CD14 +. On notera que les billes seront libérés automatiquement à partir des cellules dans la culture lors de l'étape 3.2.
- Utiliser la colonne de dimensions moyennes pour un maximum de 2 x 10 8 cellules au total.
3. Différenciation des cellules dendritiques à différents Activation STates
- Préparation du réactif (endotoxines niveau doit être inférieur à 0,1 UE / ml dans tous les réactifs)
- Préparer un milieu de culture cellulaire: RPMI 1640 supplémenté avec 10% de sérum bovin fœtal (FBS), 1% acides aminés non essentiels (AANE) et 0,05 mM de 2-mercaptoéthanol (2ME). Stériliser cette solution par filtration à travers un filtre de 0,2 um.
- Préparer des cytokines: reconstituer l'IL-4 et du GM-CSF dans des cellules de culture d'eau de qualité à une concentration de 0,25 mg / ml dans des conditions aseptiques. cytokines aliquotes dans 200 microtubes ul et conserver à -80 ° C.
- Préparer la vitamine D3 stock: reconstituer la vitamine D3 dans la culture cellulaire eau de qualité à une concentration de 100 mM dans des conditions aseptiques. Aliquoter vitamine D3 dans 1,5 ml microtubes et conserver à -20 ° C.
- Préparer la dexaméthasone stock: reconstituer la dexaméthasone dans la culture cellulaire eau de qualité à une concentration de 10 mM dans des conditions aseptiques. Aliquoter dexamethasOne dans 1,5 ml microtubes et conserver à -20 ° C.
- Préparer LPS: reconstituer lipopolysaccharides (LPS) dans la culture cellulaire de l'eau de qualité à une concentration de 1 mg / ml dans des conditions aseptiques. LPS aliquotes dans 1,5 ml microtubes et conserver à -20 ° C.
- Génération Différents moDCs
- Semences 4 ensembles de monocytes CD14 + en concentration de 0,3 à 0,5 x 10 6 / ml de milieu de culture cellulaire supplémenté avec 200 ng / ml de GM-CSF et 200 ng / ml d'IL-4 dans des plaques de 6 puits. Notez que ceci est jour 0 et le volume du milieu dans chaque 6 puits est de 2 ml.
- Incuber les cellules dans la culture tissulaire incubateur à 37 ° C avec 5% de CO 2.
- Retirer 850 pi de milieu de la culture au Jour 4 et centrifuger à 300 g pendant 5 min, 4 ° C. Aspirer le surnageant et remettre en suspension le culot dans 1 ml de milieu de culture cellulaire contenant 2 x de (200 ng / ml de GM-CSF et 200 ng / ml d'IL-4). Ajouter ce mélange de cellules de retourà la culture. Notez que la concentration ajoutée pour GM-CSF et l'IL-4 2x deviendra 1x quand on ajoute le 1 ml de milieu de retour dans la culture.
- Ajouter 1 pi de vitamine D3 stock et 1 microlitre de dexaméthasone actions par ml de milieu à deux des ensembles le jour 5 pour générer moDCs tolérogènes. A noter que la concentration finale de la vitamine D3 est de 100 nM et de dexaméthasone est de 10 nm; addition de GM-CSF et de l'IL-4 est pas nécessaire le jour 5.
- Ajouter 200 ng / ml de GM-CSF et 200 ng / ml d'IL-4 pour tous les groupes le jour 6.
- Ajouter 1 pg / ml de LPS à l'un des ensembles traités avec seulement du GM-CSF et IL-4 au jour 6 afin de générer moDCs matures.
- Ajouter 1 pg / ml de LPS à un ensemble des moDCs tolérogènes au Jour 6 pour générer LPS-tolérogènes moDCs.
- Récolter les différents types de moDCs au jour 7 par rinçage boîte de culture avec du PBS, de l'EDTA pour la cytométrie de flux ou d'autres études. A noter que seules les cellules non-adhérentes sont récoltées. Prenez note que le rendement en pourcentage de CD14 + Monocytes pour moDCs immatures, matures, moDCs moDCs tolérogènes et DC LPS-tolérogènes sont environ 90%, 50%, 60% et 60% respectivement, et varie entre les donneurs de sang et FBS beaucoup.
4. cytométrie de flux
- Surface cellulaire Marker Caractérisation sur moDCs
- Détacher les cellules de boîte de culture par pipetage. Laver les cellules une fois avec du PBS / EDTA et remettre les cellules en une concentration de 5 x 10 5 cellules par 50 pi de tampon de coloration dans 1,5 ml microtube.
- Incuber 0,5 x 10 6 cellules avec des aliquotes de PerCP conjugué HLADR (1: 100), CD80 conjugué au PE (01:50), CD83 conjugué au PE (1:25), CD86 conjugué au PE (01:50), APC - CD11c conjugué (01:50), CD14 conjugué au PE (01:50) et conjugué à PE BDCA3 (01:50) et d'APC conjugué à ILT3 (1:25) dans l'obscurité pendant 30 min à 4 ° C. Isotype PerCP conjugué MAb (1:20), PE-conjugué MAb (01h11), APC conjugué MAb (01h11) servira de contrôles négatifs.
- Détecter les niveaux des marqueurs de surface en utilisant un cytomètre en flux 18 d'expression.
- Analyse des mitochondries Membrane Potentiel de moDCs
- Préparer la solution mère de 1 mM Rouge chlorométhyl-X-rosamine (CMXRos) en ajoutant 94,1 pi de diméthylsulfoxyde (DMSO) par 50 pg de lyophilisé Red CMXRos.
- Laisser incuber 2 x 10 5 à 100 nM moDCs rouge CMXRos dans 1 ml de solution saline équilibrée de Hank (HBSS) pendant 30 min à 37 ° C dans un tube de 15 ml.
- Ajouter 2 ml de PBS / EDTA à des cellules et centrifuger à 300 g pendant 5 min, température ambiante. Répétez 2 fois. Aspirer le surnageant et le culot de cellules resuspendre dans 300 pi de PBS, EDTA, 2% de FCS pour cytométrie de flux. Prendre note d'utiliser le canal PE pour analyser le signal rouge CMXRos.
- Marqueur Caractérisation des cellules T
- Incuber 50 ul de 1,2 x 10 6 CFSE marqué allo lymphocytes T CD4 + (généré à partirétape 5.6) avec PerCP conjugué CD3 (1: 200), PE / Cy7 conjugué CD4 (1: 400) et CD25 APC / Cy7 conjugué (1: 100) dans l'obscurité pendant 30 min à 4 ° C. T-cellules tache en utilisant un kit commercial avec Foxp3-Alexa Fluor 647 (1:50) dans l'obscurité pendant 1 heure à température ambiante.
5. Etudes Alloreaction
- Préparer une solution 5 mM d'ester carboxyfluorescéine succinimidyl (CFSE) par l'addition de 18 ul de DMSO à lyophiliser CFSE, selon le protocole du fabricant.
- Purifier les lymphocytes T CD4 + à partir de PBMC
- Déterminer le nombre de cellules en prenant 20 pl de PBMC suspension cellulaire et mélanger avec 20 pi de bleu trypan pour compter le nombre de cellules vivantes en utilisant un cytomètre.
- Centrifugeuse suspension de cellules à 367 xg avec freins pour 10 min, 4 ° C.
- Aspirer le surnageant du culot cellulaire et remettre en suspension complètement en une concentration de 5 x 10 7 cellules par 1 ml de tampon de coloration dans un polysty 5 mlTube rene.
- Ajouter CD4 humaine + cellules T Enrichissement Cocktail à cellules 50 pl / ml. Bien mélanger et incuber à température ambiante (15 - 25 ° C) pendant 10 min.
- particules magnétiques Vortex pendant 30 secondes et ajouter des particules magnétiques à des cellules 100 pl / ml. Bien mélanger et incuber à température ambiante pendant 5 min.
- Ajouter un tampon de coloration à la suspension cellulaire à un volume total de 2,5 ml. Mélanger les cellules dans le tube par pipetage vers le haut et vers le bas 2 - 3 fois. Placer le tube dans l'aimant et laisser incuber pendant 5 min.
- Inversez aimant avec tube et décanter la suspension (contient des cellules T) dans un nouveau tube 5 ml de polystyrène.
- Déterminer le nombre de cellules et incuber 1,2 x 10 6 cellules CD4 + avec des cellules T 5 uM CFSE dans 1 ml de PBS pendant 20 min à 37 ° C, à l' abri de la lumière.
- Ajouter cinq fois le volume initial de coloration du milieu de culture cellulaire (préparée selon l'étape 3.1.1) aux cellules et on incube pendant 5 min.
- centrifuge à 300 xg pendant 5 min, 4 ° C et remettre en suspension le culot dans du milieu de culture cellulaire à une concentration de 2 x 10 5 par 75 ul.
- Ajouter 75 ul de 2 10 5 cellules CD4 + T lymphocytes CFSE marqués x à chaque culture MODC contenant 75 ul de milieu de culture de cellules avec 0, 2,5 x 10 3 à 5 x 10 3, 10 x 10 3, 20 x 10 3 et 40 x 10 3 moDCs dans des plaques à 96 puits à fond en U. La culture pendant 6 jours dans un incubateur de culture tissulaire à 37 ° C avec 5% de CO 2.
- Récolte par pipetage des cellules T CD4 + dans le tube de 15 ml et centrifuger à 300 g pendant 5 min, 4 ° C. Recueillir le surnageant pour l'analyse des cytokines et le culot de cellules de remettre en suspension dans 2 ml de PBS / EDTA et centrifuger à 300 g pendant 5 min à 4 ° C.
6. Cytokine Analyse 19
- Collecter les surnageants provenant des études de alloreaction comme décrit dans l'étape 5.5.
- Préparation du Réactif pour Human Cytokine / Chemokine Analyse du panneau magnétique
- Pour la préparation de la bouteille de mélange de billes d'anticorps immobilisé pour flacons individuels de perles (inclus dans le kit), vortex pendant 1 min. Ajouter 60 ul de chaque anticorps perle flacon à la bouteille de mélange (inclus dans le kit) et porter à un volume final de 3 ml avec Perle Diluant (fourni).
- Pour la préparation des contrôles de qualité, reconstituent Contrôle de la qualité 1 et 2 Contrôle de la qualité (inclus dans le kit) avec 250 pi d'eau déminéralisée.
- Pour la préparation du tampon de lavage, diluer 30 ml de tampon de lavage 10x (inclus dans le kit) avec 270 ml d'eau déminéralisée.
- Pour la préparation de cytokine humaine Standard, reconstituer le standard de cytokine humaine (inclus dans le kit) avec 250 pi d'eau déminéralisée pour donner 10.000 pg / ml de concentration.
- Ajouter 50 pi de 10.000 pg / ml standard cytokine humaine à 200 pi de tampon de dosage (fourni dans le kit) dans un tube de 1,5 ml pour faire 2.000 pg / ml de travail standard. Transfert 50 pi de 2000 pg / ml standard cytokine humaine à 200 pi de tampon de dosage (fourni dans le kit) dans un tube de 1,5 ml pour faire 400 pg / ml de travail standard.
- Transfert 50 pi de 400 pg / ml standard cytokine humaine à 200 pi de tampon de dosage (fourni dans le kit) dans un tube de 1,5 ml pour faire 80 pg / ml de travail standard. Transfert 50 pi de 80 pg / ml standard cytokine humaine à 200 pi de tampon de dosage (fourni dans le kit) dans un tube de 1,5 ml pour faire 16 pg / ml de travail standard.
- Transfert 50 pi de 16 pg / ml standard cytokine humaine à 200 pi de tampon de dosage (fourni dans le kit) dans un tube de 1,5 ml pour faire 3,2 pg / ml de travail standard. 0 pg / ml de travail standard a seulement 200 pi de tampon de dosage dans un tube de 1,5 ml.
- Pré plaque de filtre humide (inclus dans le kit) par pipetage 200 pi de tampon de dosage (fourni) dans chaque puits du filtreassiette. Sceller et placer la plaque de filtre sur un agitateur de plaque pendant 10 min à température ambiante.
- tampon Aspirer Assay et ajouter 25 ul de chaque norme ou le contrôle de la qualité dans les puits appropriés.
- Ajouter 25 ul de milieu de culture cellulaire (préparée selon l'étape 3.1.1), à l'arrière-plan, les normes et les puits témoins.
- Ajouter 25 pi de tampon d'essai dans les puits d'échantillon et ajouter 25 ul d'échantillon dans les puits d'échantillons appropriés.
- Tourbillonnaire la bouteille de mélange contenant des billes d'anticorps immobilisé et ajouter 25 ul des billes mélangées à chaque puits. Sceller la plaque et incuber avec agitation sur un agitateur de plaque pendant une nuit à 4 ° C.
- Aspirer plaque fluide et lavage 2 fois en ajoutant 200 pl / puits de tampon de lavage et d'aspiration du fluide.
- Ajouter 25 ul d'anticorps de détection (fournies) dans chaque puits. Sceller et incuber avec agitation sur un agitateur de plaque pendant 1 heure à température ambiante.
- Ajouter 25 ul de streptavidine phycoérythrine (provided) à chaque puits contenant 25 ul d'anticorps de détection. Sceller et incuber avec agitation sur un agitateur de plaque pendant 30 min à température ambiante.
- Aspirer plaque fluide et lavage comme décrit dans l'étape 6.8.
- Ajouter 150 ul / puits de fluide gaine à tous les puits et perles de resuspendre sur un agitateur de plaque pendant 5 min.
- Détecter l' intensité de la fluorescence des billes en utilisant un système 20 3D. Analyser les données médianes d'intensité fluorescentes en utilisant une méthode d'ajustement de courbe log-logistique de cinq paramètres pour le calcul des concentrations de cytokines / chimiokines dans des échantillons 21.
7. en temps réel la consommation d'oxygène Taux (OCR) et extracellulaires Acidification tarif (ECAR) Mesures
- Préparation du réactif / Matériaux
- Préparer le milieu OCR: medium Assay supplémenté avec 25 mM de glucose et de pyruvate de sodium 1 mM (pH 7,35). Stériliser cette solution par filtration à travers un filtre de 0,2 um. Prenez note que ce milieu est prepared sans FBS parce que les composants de FBS sont complexes et varient d'un lot à anthères beaucoup.
- Préparer le milieu de ECAR: Base de milieu additionné de 2 mM de L-glutamine (pH 7,35). Stériliser cette solution par filtration à travers un filtre de 0,2 um. Notez que ce milieu est préparé sans bicarbonate, glucose, pyruvate et FBS. Notez que FBS a une capacité tampon et interférer avec la lecture de ECAR.
- Préparer des composés pour les mesures OCR: Resuspendre oligomycine avec 630 pi de milieu OCR pour faire 100 uM solution stock et diluer avec du milieu OCR 16 uM concentration de travail. Resuspendre cyanure de carbonyle 4- (trifluorométhoxy) phénylhydrazone (FCCP) avec 720 pi de milieu OCR pour faire 100 uM solution stock et diluer avec du milieu OCR à 4,5 uM concentration de travail. Resuspendre roténone / antimycine A avec 540 ul de milieu OCR pour faire 50 uM solution mère et diluer avec du milieu OCR 10 uM concentration de travail.
- Préparercomposés pour les mesures de ECAR: Resuspendre glucose avec 3 ml de milieu de ECAR pour faire mM solution 100 et diluer à 80 mM concentration de travail. Resuspendre oligomycine avec 720 pi de milieu de ECAR pour faire 100 uM solution mère et complétez à 18 mM concentration de travail. Resuspendre 2-désoxy-D-glucose avec 1,5 ml de milieu de ECAR faire mM solution 1000.
- Pipet 200 pi de calibrant dans chaque puits de la cartouche et stocker à 37 ° C sans CO 2 un jour avant les mesures.
- Mesures en temps réel OCR
- La récolte et les remettre en suspension moDCs chaque type de moDCs OCR dans un milieu à une concentration de 60 x 10 3 par 150 ul de milieu OCR.
- Seed cellules 60 x 10 3 / puits dans une plaque 96 puits à fond plat poly-D-lysine et incuber dans un incubateur non-CO 2 pendant 1 heure à 37 ° C. Prendre note d'utiliser 50 pi de 50 ng / ml de poly-D-lysine pour enduire la plaque pendant 1 heure et laver avecl'eau stérile. Gardez plaque sèche pendant 2 heures à la température ambiante avant utilisation.
- Pipette 25 pi de milieu dans le port d'injection A pour tous les puits OCR; 25 pi de milieu OCR contenant 16 uM de oligomycine dans le port d'injection B pour tous les puits; 25 pi de milieu OCR contenant 4,5 uM de (FCCP) en injection le port C pour tous les puits et 25 moyen OCR ul contenant mM roténone 10 / antimycine A dans le port d'injection D pour tous les puits. A noter que la concentration de puits finale pour oligomycine est égal à 2 uM, FCCP est de 0,5 uM et la roténone / antimycine A est égal à 1 uM.
- Placer la plaque dans l'analyseur de flux extracellulaire et exécuter une étude complète OCR avec tous moDCs simultanément en quatre étapes consécutives: respiration basale (après moyen injection du port A), l'inhibition de la V complexe mitochondrial (après l'injection de drogue du port B), maximale respiration induction (après l' injection de drogues du port C) et d' électrons inhibition de la chaîne de transport (après la drogue depuis le port D) 22. Prenez note qu'il ya 3 cycles entre les injections et 6 intervalle de minutes entre les mesures.
- Mesures ECAR en temps réel
- Récolte moDCs et resuspendre chaque type de moDCs dans un milieu de ECAR à une concentration de 60 x 10 3 par 150 pi de milieu de ECAR.
- Seed 6 x 10 4 cellules / puits dans une plaque de fond plat de 96 puits de poly-D-lysine et incuber dans un incubateur non-CO 2 pendant 1 heure à 37 ° C.
- Pipette 25 pi de milieu de ECAR dans le port d'injection A pour tous les puits; moyen ECAR 25 ul contenant 10 mM de glucose dans l'orifice d'injection B pour tous les puits; moyen ECAR 25 ul contenant 18 uM de oligomycine dans l'orifice d'injection C pour tous les puits et 25 ul contenant du milieu OCR 1000 mM de 2-désoxy-D-glucose dans l'orifice d'injection D pour tous les puits. On notera que la concentration de puits finale pour le glucose est de 10 uM, oligomycine est de 2 uM et 2-désoxy-D-glucose est de 100 mM.
- Placer la plaque dans l'analyseur de flux extracellulaire et exécuter unétude complète de ECAR avec tous les moDCs simultanément en quatre étapes successives: la respiration basale (après moyen injection du port A), la glycolyse induction (après l'injection de drogue du port B), l'induction de la glycolyse maximale (après l'injection de drogue du port C) et l'inhibition de la glycolyse (après drogue du port D) 22.
- Analyser les différences statistiques en utilisant ANOVA à une voie avec un post-test de comparaison multiple de Tukey.
Résultats
Purification de monocytes et de cellules dendritiques Différenciation
Les monocytes ont été purifiés à partir de PBMC par la densité centrifugation du sang périphérique (figure 1A), suivie CD14 + séparation de sélection positive magnétique (figure 1B) et mis en culture dans un milieu complet en présence de GM-CSF et IL-4 pour obtenir des cellules dendritiques immatures ( La figure 2A). L' addition de la vitamine D3 et la déxaméthasone après le GM-CSF et IL-4 a donné lieu à la différenciation des moDCs immatures dans moDCs tolérogènes (figure 2B). LPS a été ajouté pour induire la maturation des moDCs immatures à mûrir moDCs (figure 2C) et moDCs tolérogènes ont été stimulées avec du LPS pour vérifier la résistance à la maturation (figure 2D). Les échantillons de sang utilisés dans ce travail ont été obtenus à partir de donneurs sains avec précédente informésconsentement.
MODC Caractérisation
Surface Marker Caractérisation par cytométrie de flux
L' analyse des marqueurs de surface DC a montré que moDCs matures ont exprimé les plus hauts niveaux de marqueurs de maturation HLA-DR, CD83 et CD86 par rapport à moDCs tolérogènes LPS-traités, moDCs tolérogènes et moDCs immatures (figure 3). Ces résultats démontrent que tolérogènes moDCs étaient résistants à la maturation par rapport à moDCs immatures après stimulation par le LPS. En outre, le LPS traité moDCs tolérogènes et moDCs tolérogènes affiché une expression accrue de CD14, BDCA3 (CD141) et la transcription Immunoglobulin-like (ILT) 3 par rapport à moDCs immatures et matures. Les moDCs tolérogènes que nous avons généré ici est compatible avec les rapports précédents 23.
Caractérisation fonctionnelle de moDCs
moDCs induites par la maturation deviennent immunogènes et libèrent des cytokines qui favorisent la prolifération des lymphocytes T CD4 +. Nous avons évalué l'immunogénicité des sous-types différents MODC en mesurant la prolifération des lymphocytes T co-cultivées. MoDCs tolérogènes sont médiocrement immunogène par rapport à moDCs matures, comme le montre la faible alloproliferation des lymphocytes T CD4 + (figure 4A). MoDCs tolérogènes sont caractérisés par leur faible IFN-Γ faible d' IL-12p40 et IL-10 à haute production de cytokines dans alloreaction co-cultures avec des lymphocytes T CD4 + (figure 4B). En outre, les cellules T allospécifiques augmentant le nombre de moDCs tolérogènes en co-cultures de moDCs matures induite CD4 + a augmenté la fréquence des cellules T CD25 haute Foxp3 + réglementaires (Figure 4C).
Analyse de l' activité mitochondrialeRed CMXRos est utilisé pour refléter l'activité mitochondriale pour analyser les niveaux de potentiel de membrane mitochondriale dans moDCs. MoDCs tolérogènes ont observé que l' activité mitochondriale plus élevée par rapport aux autres sous - types MODC différenciés (figure 5A). Ensuite, le taux de consommation d'oxygène des mitochondries (ROC) est évaluée pour les différents sous-types MODC en utilisant un bioanalyseur. mesures OCR permettent un aperçu haute résolution du profil métabolique, fournissant des informations, y compris mais sans s'y limiter à la respiration basale, la capacité respiratoire de secours, fuite de protons et de la respiration non-mitochondrial. La mesure de l'OCR fournit un moyen pour évaluer la capacité des cellules à répondre à un stress. Les cellules sont métaboliquement perturbés par l'addition de trois composés différents en succession. La première injection est Oligomycin (ATP Coupler) qui inhibe complexe V de la chaîne de transport d'électrons (ETC), l'inhibition de la synthèse d'ATP. Cette étape distingue le pourcentage d'oxygène consommée pour la synthèse de l'ATP et le pourcentage d'oxygène consommée pour vaincre fuite de protons à travers la membrane mitochondriale interne. La deuxième injection est FCCP (ETC accélérateur) qui perturbe la synthèse d'ATP en transportant les ions hydrogène à travers la membrane mitochondriale plutôt que par le canal de protons de V. Complex L'effondrement du potentiel de la membrane mitochondriale conduit à une consommation rapide de l'énergie et de l'oxygène, sans la génération d'ATP. traitement FCCP peut être utilisé pour calculer la capacité respiratoire de secours des cellules. Maintien de la capacité respiratoire de secours dans des conditions de stress est essentielle à la survie des cellules. Cette capacité est déterminée par plusieurs facteurs, y compris la disponibilité du substrat et de la capacité fonctionnelle des enzymes impliquées dans la ETC. La troisième injection est une combinaison de la roténone, une Complex I inhibiteur, et antimycine A, un inhibiteur du complexe III. Cette combinaison arrête la respiration mitochondriale et de l' OCR est observée à diminuer en raison de la fonction mitochondriale altérée (figure 5C). MoDCs tolérogènes affichent des niveaux plus élevés que OCR basales moDCs matures (Figure 5D). En outre, tolérogène, LPS-tolérogène et moDCs immatures a montré une augmentation de la capacité respiratoire de secours par rapport aux moDCs matures (figure 5E).
Caractérisation métabolique de moDCs
Parce que l' acide lactique et des protons sont libérés des cellules au cours de la glycolyse, nous avons analysé l'activité glycolytique des moDCs en effectuant une analyse en temps réel du taux d'acidification extracellulaire (ECAR) (figure 6B). En présence de glucose, le taux de glycolyse de tous moDCs augmenté par rapport à la phase de base, avecmoDCs matures présentant le taux glycolyse plus élevé que moDCs immatures (Figure 6D). Tolérogène et moDCs immatures présentent glycolyse maximale plus élevée (induite par oligomycine en présence de glucose) par rapport à moDCs LPS traitées (figure 6B). La capacité glycolytique de moDCs tolérogènes et immatures était plus élevé que moDCs matures (Figure 6E). Contrairement à leur taux élevé glycolyse, Réserve glycolyse était le plus bas en moDCs matures (Figure 6F).
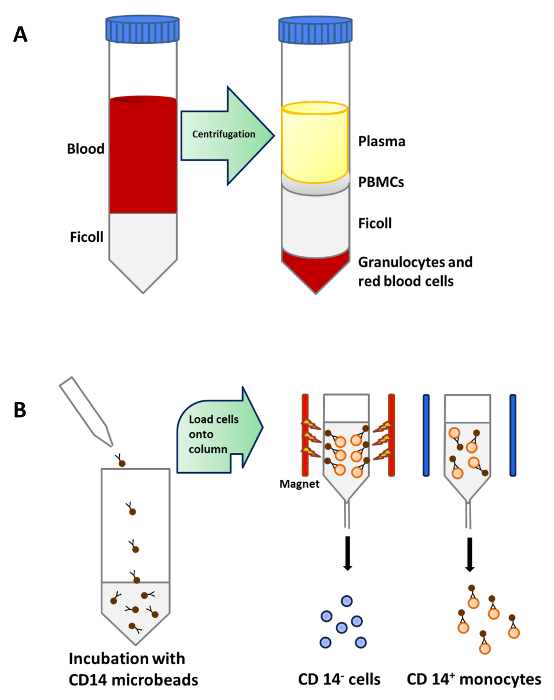
Figure 1:. Purification de monocytes du sang périphérique (A) 25 ml de sang est soigneusement étalé sur 15 ml de Ficoll par tube de 50 ml avant centrifugation. Les PBMC sont concentrées dans une couche au- dessous du plasma après centrifugation de densité (B) . Les PBMC sont incubées avec des microbilles qui sont conj ugated à des anticorps monoclonaux CD14 humains (isotype: souris IgG2a). puis chargé sur une colonne qui est placée dans le champ magnétique d'un séparateur pour isoler les monocytes CD14 + S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
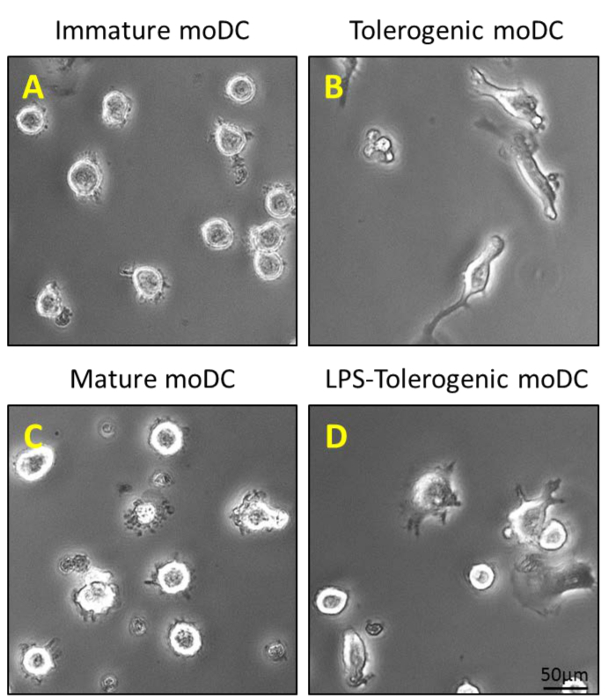
Figure 2: Caractérisation morphologique de moDCs. (A) 200 ng / ml de GM-CSF et l' IL-4 est ajouté à monocytes CD14 + purifiées au jour 0, 4 et 6 pour générer moDCs immatures; et (B) une étape supplémentaire de stimulation avec 100 nM de vitamine D3 et 10 nM de dexaméthasone au jour 5 génère moDCs tolérogènes. MoDCs Immature et moDCs tolérogènes sont stimulées avec 1 pg / ml de LPS sur Jour 6 pour générer (C) matures moDCs et moDCs (D) LPS-tolérogènes.TTPs: //www.jove.com/files/ftp_upload/54128/54128fig2large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
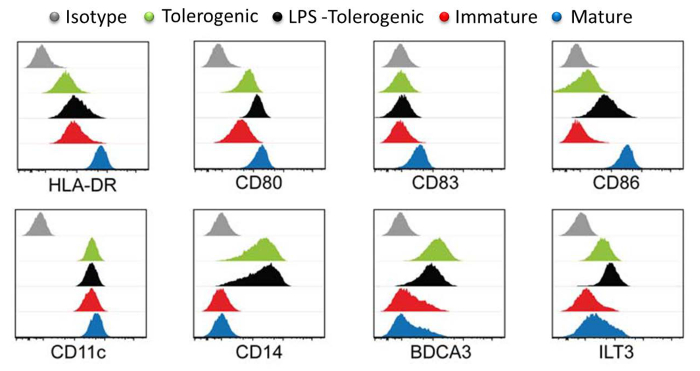
Figure 3:. Surface Marker Caractérisation par cytométrie de flux Les niveaux de marqueurs de surface HLA-DR, CD80, CD83, CD86, CD11, CD14, BDCA3 et LT3 en tolérogène Expression (vert), LPS-tolérogènes (noir), immature (rouge), mature (bleu) moDCs. contrôles isotypiques sont affichés en gris. histogramme individuel pour chaque type de cellule est tracée avec l'axe Y le nombre de cellules en fonction du log de l'axe X de l'intensité du fluorophore et recouvert. Tous les histogrammes sont représentatifs de quatre expériences indépendantes. Ce chiffre a été modifié à partir de J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 Juin, 2015). Reproduit et republié avec la permission du droit d'auteur. Droit d' auteur 2015. L'Association américaine desImmunologistes, Inc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
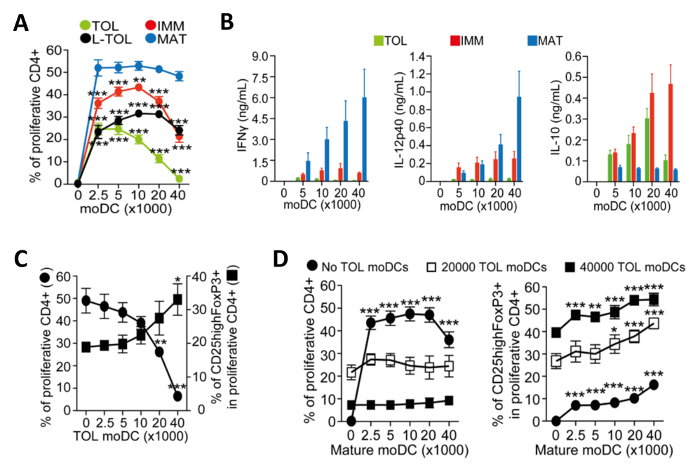
Figure 4: Caractérisation fonctionnelle des moDCs. (A) Quantification de la fréquence de alloproliferation des lymphocytes T CD4 + induites par co-culture avec un nombre croissant de tolérogène (TOL, vert), LPS-tolérogène (L-TOL, noir), immature (IMM, rouge) et matures (MAT ; bleu) moDCs. Les données ont été rassemblées à partir de quatre expériences indépendantes; moyenne + SEM différences statistiques entre tous moDCs contre moDCs matures ont été analysés par ANOVA à deux voies avec Dunnett comparaison multiple post-test. (B) Analyse de la cytokine IFN-Γ (panneau de gauche), IL-12p40 (panneau du milieu) et Il- 10 (volet droitl) dans les surnageants de alloreactions entre les lymphocytes T CD4 + co-cultivées avec un nombre croissant de soit tolérogène (vert), immature (rouge) ou bleu) moDCs (matures. Les données ont été regroupées à partir de six expériences indépendantes; moyenne ± SEM alloproliferation (C) CD4 + T-cellules et les cellules T de régulation d' expansion induite par co-culture avec moDCs matures en présence de nombres de moDCs tolérogènes croissante. Gauche de l' axe Y, la fréquence de cellules CD4 + prolifération des lymphocytes T. Y-axe droit, la fréquence des CD25 haute Foxp3 + cellules gated sur les lymphocytes T prolifératifs CD4 +. Les données ont été regroupées à partir de trois expériences indépendantes; moyenne ± SEM Les différences statistiques entre la présence par rapport à l' absence de moDCs tolérogènes ont été analysés par ANOVA à une voie avec Dunnett comparaison multiple post-test. (D) alloproliferation CD4 + T-cell (gauche) et la fréquence des CD25highFoxP3 cellules + (droite) induite par co- culture avec moDCs tolérogènesen présence d'un nombre croissant de moDCs matures. Les données ont été regroupées à partir de deux ou trois expériences indépendantes; moyenne ± SEM Les différences statistiques entre la présence par rapport à l'absence de moDCs matures ont été analysées par ANOVA à deux voies avec Dunnett comparaison multiple post-test. Ce chiffre a été modifié à partir de J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 Juin, 2015). Reproduit et republié avec le droit d' auteur la permission. Droit d' auteur 2015. L'Association américaine des immunologistes, Inc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
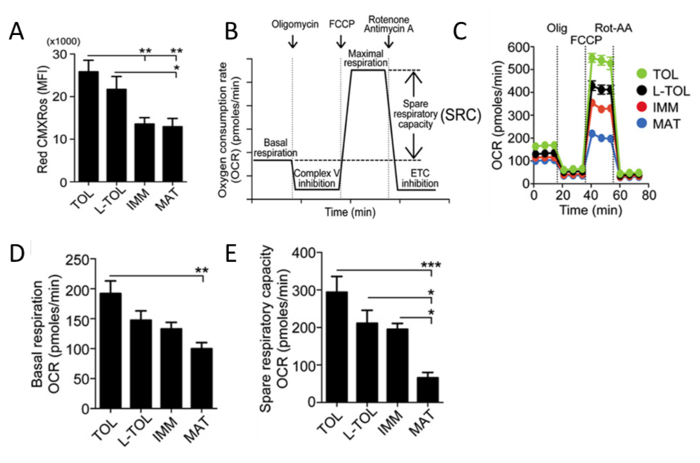
Figure 5: Analyse de l' activité mitochondriale de moDCs. (A) Les niveaux de potentiel de la membrane mitochondriale (rouge CMXRos) dans moDCs ont été obtenus en ffaible analyse cytométrique. Les données de quatre expériences indépendantes ont été regroupées. Moyenne ± SEM (B) Représentation schématique d'une respiration mitochondriale en temps réel. analyse ROC à partir de la respiration basale et après l'addition de l'oligomycine (inhibition complexe V), FCCP (respiration maximale induction) et la roténone / antimycine un mélange (chaîne de transport d'électrons inhibition [etc.]). La SRC (basale maximale soustraite de la respiration maximale) mitochondrial est dérivé de la courbe ROC. (C) étude cinétique représentant des mitochondries OCR (pmol / min) dans tolérogène (TOL, vert), LPS-tolérogène (L-TOL, noir) , immature (IMM, rouge) et matures (MAT, bleu) moDCs en utilisant l' addition séquentielle de oligomycine (Olig), FCCP, et roténone / antimycine A (Rot-AA). (D) OCR quantification de la respiration basale de moDCs et ( E) épargnez capacité respiratoire de moDCs. Les données ont été regroupées à partir de cinq expériences indépendantes. Moyenne ± SEM. Ce chiffre a été modifié à partir de J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 Juin, 2015). Reproduit et republié avec le droit d' auteur la permission. Droit d' auteur 2015. L'Association américaine des immunologistes, Inc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
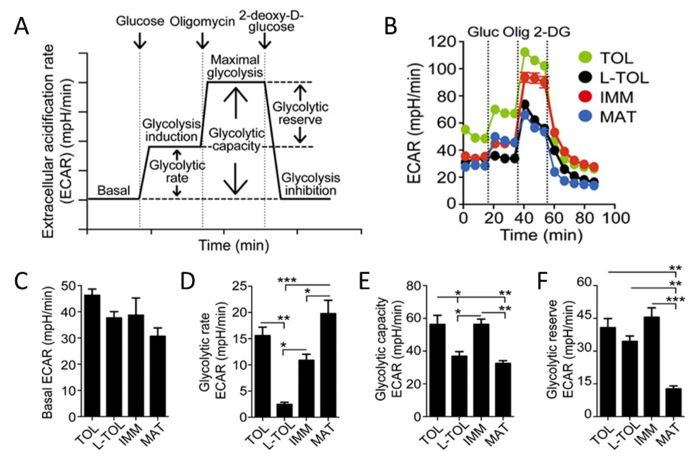
Figure 6: Caractérisation métabolique des moDCs. (A) Représentation schématique de la glycolyse en temps réel. Analyse ECAR commence à partir ECAR de base, dans laquelle les cellules ont été incubées dans un milieu exempt de glucose, suivie par l'addition de glucose (glycolyse induction), oligomycine (qui induit la glycolyse cellulaire maximale et l'inhibition complexe V), et enfin 2-désoxy-D- glucose(Inhibition de la glycolyse). Taux glycolytique (glycolyse d'induction soustraite pour ECAR basale), la capacité de la glycolyse (glycolyse maximale soustraite pour basale ECAR), et réserve glycolyse (glycolyse maximal soustrait pour glycolyse induction) sont dérivées de la courbe de ECAR. (B) étude cinétique représentant de la glycolyse dépendante ECAR (mpH / min) dans tolérogène (TOL, vert), LPS-tolérogène (L-TOL, noir), immature (IMM, rouge), et mature (MAT, bleu) moDCs en utilisant l'addition séquentielle de glucose (Gluc), oligomycine (Olig), et 2-DG. (C) les barres indiquent les niveaux de ECAR basales (D) taux glycolyse (E) de la capacité de la glycolyse, et (F) réserve glycolytique de moDCs. Les données ont été regroupées à partir de trois expériences indépendantes; dire 6 SEM. Les différences statistiques ont été analysées par ANOVA à une voie avec un post-test de comparaison multiple de Tukey. Ce chiffre a été modifié à partir de J Immunol 194 (11), 5174-5186, doi: 10,4049 / jimmunol.1303316 (1 Juin, 2015). Reproduit et republié avec le droit d' auteur la permission. Droit d' auteur 2015. L'Association américaine des immunologistes, Inc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le présent document décrit une méthode pour générer à partir de monocytes moDCs immatures, moDCs tolérogènes et moDCs matures. Les étapes importantes dans ce protocole sont discutés en détail dans les paragraphes suivants. Il est important de noter que le sang périphérique humain est utilisé comme matériau de départ dans ce protocole et les précautions universelles pour le traitement du sang humain doit être pratiquée. Bien qu'il soit techniquement possible d'obtenir des DC à partir de la moelle osseuse chez l' homme 24, la différenciation DC in vitro à partir de cellules présentes dans le sang périphérique est préféré en raison de la disponibilité du sang périphérique par rapport à la moelle osseuse. Parmi les cellules présentes dans le sang périphérique, les cellules CD34 + et les monocytes souches hématopoïétiques sont couramment utilisés pour la production in vitro de DC. Hématopoïétique CD34 + des cellules souches sont cultivées avec du GM-CSF et du TNF-α pour obtenir des sous - ensembles et CD1a + CD14 + , qui sont ensuite différenciés en outre Langerhanscomme les cellules et les cellules dendritiques. A l'inverse, les monocytes sont cultivés dans du GM-CSF et IL-4 pour générer moDCs immatures. Plusieurs protocoles sont utilisés pour l'enrichissement de monocytes du sang périphérique; par exemple, par l' adhésion à des plats en plastique, élutriation et kits d'isolement 25, 26 Les avantages du protocole d'adhésion sont un minimum de dommages aux cellules et relativement rentables cependant cellule de pureté peut être compromise. et une étape supplémentaire est nécessaire pour détacher les cellules pour les expériences ultérieures. Élutriation est une technique qui sépare les cellules en fonction de leur taille et de la densité. Les avantages de l'élutriation sont la viabilité cellulaire et les monocytes peuvent être facilement utilisées pour d'autres expériences; Cependant cette technique est limitée par la disponibilité d'un élutriateur et l'impossibilité de séparer les différentes populations de cellules (cellules T et les monocytes) avec des paramètres de sédimentation similaires. Commercialement kits d'isolement disponibles utilisent microbilles magnétiques pour sélectionner soit positivement ousélectionner négativement la population monocytaire. Certains protocoles sont biaisés vers l'isolement des monocytes en utilisant la sélection négative que les monocytes isolés restent «intactes» (non lié par des marqueurs ou des microbilles). Dans ce protocole, perles CD14 ont été utilisés pour sélectionner les monocytes humains positifs de CMSP. CD14 manque un domaine cytoplasmique et liaison de l'anticorps à CD14 ne déclenche pas la transduction du signal. En outre, les microbilles se détacher de monocytes après la culture et, partant, ne gêne pas le processus de différenciation. En outre, le CD14 est fortement exprimé sur la plupart des monocytes et faiblement sur les neutrophiles et certaines cellules dendritiques myéloïdes, par conséquent , cette méthode d'isolement des résultats de pureté cellulaire plus élevée que les autres méthodes 17.
monocytes sanguins peuvent être différenciés en DC ou les macrophages et le sort des monocytes dépend grandement de l'environnement de cytokine. Dans cet article, moDCs sont générées en ajoutant des facteurs de stimulation des colonies de granulocytes-macrophages (GM-CSF) Et l'interleukine 4 (IL-4), les monocytes du sang périphérique humain. GM-CSF est nécessaire pour la survie des monocytes et IL-4 exerce une activité inhibitrice sur la différenciation des macrophages; et l'addition de GM-combinatoire SCSF et l' IL-4 , les monocytes produisent un pourcentage plus élevé de moDCs immatures par rapport à des cytokines individuelles 27. Il existe d' autres protocoles qui génèrent moDCs en y ajoutant le facteur alpha de nécrose tumorale (TNF-α), l' interféron alpha (IFN-α) et l' interleukine 13 (IL-13) , les monocytes du sang périphérique 28, 29, 30. La combinaison de GM-CSF et de l'IL-4 a été optimisé dans les années 1990 et maintenant un protocole accepté qui génère DC immatures en plastique différenciées en moDCs immunogènes ou tolérogènes et polarisés en Th1, Th2 ou Th17 promotion moDCs.
moDCs immatures sont différenciées en moDCs tolérogènes par l'addition de la vitamine D3 et la dexaméthasone. Il existe plusieurs protocoles pour générer des DC tolérogènes par exemple, par l'intermédiairefacteur nucléaire kappa B (NF-kB) , l' inhibition de l'activation β-caténine, la vitamine D3, la dexaméthasone et la rapamycine 31, 32, 33, 34, 35, 9, 36, 37. Bien que la vitamine D3 et la dexaméthasone seule ont été rapportés pour induire un effet tolérogène sur les DC, la combinaison de la vitamine D3 et le résultat de la dexaméthasone dans une plus grande suppression de la alloproliferation que lorsque des médicaments individuels sont utilisés. Par conséquent, le protocole actuel pour la production de DCs tolérogène a été modifié pour une combinaison de vitamine D3 et la dexaméthasone. Cette méthode est actuellement acceptée comme un modèle pour les PED tolérogènes humaines avec une utilité thérapeutique. Il est également important de noter que la vitamine D3 reconstituée et la dexaméthasone ont une courte durée de conservation.
Dans ce protocole, les lipopolysaccharides (LPS) a été ajouté sous la forme d'une maturation de l'inducteur à courant continu. moDCs Immature peuvent également être amenés à maturation en utilisant un cocktail pro-inflammatoire:(TNF-α), l'interleukine 1 bêta (IL-1β), interleukine 6 (IL-6) et de la prostaglandine E2) ou des cytokines pro-inflammatoires (TNF-a et l'interféron gamma (IFN-Γ)). Cocktail Pro-inflammatoire génère moDCs matures avec des fonctions de haute co-stimulateurs et migrateurs , mais ils produisent des niveaux relativement faibles de l' IL-12 38. TNF-α ou IFN-Γ est seul pas capable d'induire un phénotype dendritique stable 39. LPS stimule le récepteur Toll-like 4 (TLR4), médie l'activation de NF-kB et mitogen activated protein kinases (MAPK) pour induire la maturation des DC. DC maturation induite par le LPS présente une régulation positive de courant continu des marqueurs de maturation (CD83, CD86, HLA-DR), et a également conduit à la production d'IL-12p70. En outre, cette étape peut encore être modifié pour coupler LPS avec des agonistes de TLR3 pour produire les CD matures pour les vaccins cliniques sur le cancer. Dans cet article, les DC tolérogènes sont présentés pour être résistant à la maturation lors du traitement LPS. Ces semi-matures comme les PED ne sont pas immunogènes et ne le font pas releasoi cytokines pro-inflammatoires 40.
Les limitations de ce protocole réside dans le processus de différenciation. Le processus prend 8 jours à partir du jour 0 au jour 7 qui pose une difficulté à être adapté en analyse à haut débit. Une modification dans le protocole est nécessaire de raccourcir le processus de différenciation encore produire un nombre élevé de pays en développement viables dans les différents Etats. Deuxièmement, les pays en développement sont générés par addition de cytokines dans ce protocole et ces cytokines ne soutiennent pas la population continue pendant une longue période de temps. De plus, les cytokines sont utilisés à des concentrations beaucoup plus élevées que in vivo et pourrait se traduire par le développement biaisée des voies qui ne sont pas physiologiquement identiques aux CD in vivo. Il a été démontré par exemple dans des cultures in vitro de précurseurs de DC pour répondre à GM-CSF, qui est une cytokine pas essentiel pour la différenciation in vivo normale DC 41. Cependant, la stimulation de cytokines peut être un procédé utile pour le gèneévaluer un grand nombre de DC in vitro pour l' expérimentation. La capacité de soumettre ces cellules générées par ce protocole à d'autres analyses telles que l'immunofluorescence, par cytométrie de flux, allo études de réaction et d'études métaboliques augmente l'utilité de cette méthode. Ces DC in vitro servent comme un bon modèle pour améliorer la connaissance du développement continu, la maturation et la présentation de l' antigène qui est déjà difficile à faire avec les numéros rares DC in vivo.
La capacité des PED à réguler l' immunité immunologique par rapport à la tolérance en fait des candidats intéressants en thérapeutique contre le cancer et les maladies auto - immunes 42, 43, 44, 45. DC immunogènes générés dans ce protocole peuvent être utilisés pour améliorer l'efficacité de vaccination contre les maladies infectieuses et les tumeurs; tandis que les DC tolérogènes peuvent être utilisés pour contrôler les réponses des cellules T non désirées et de prévenir le rejet après transplantation. Le complexeéquilibre entre l'immunité et la tolérance dépend énormément sur DC état de différenciation. différenciation DC est un programme cellulaire coordonné qui est régi par de multiples voies de signalisation et devenir métabolique. Différents états de différenciation des DC diffèrent des besoins bioénergétiques et la biosynthèse; par exemple, les DC activées nécessitent des adaptations métaboliques plus énergiques importantes pour la survie et la migration par rapport aux pays en développement à l'état de repos. Il est important de noter que la vitamine D3, la dexaméthasone et la rapamycine sont connus pour leur capacité à induire des DC tolérogènes, ont été décrits pour influencer le métabolisme continu. Dans cet article, le métabolisme énergétique de moDCs de différents états de différenciation ont été caractérisés au moyen d'analyseurs de flux extracellulaire et moDCs tolérogènes présentait la maturation la plus haute plasticité métabolique et induite par le LPS a diminué cette plasticité. Métabolisme Anabolic soutient les PED maturation tandis que les influences du métabolisme cataboliques tolérogène DC fonctionne 46. Les PEDproduite à partir de ce protocole peut être utilisé pour déterminer si la modification de l'état métabolique des PED détiennent la clé de la modification de l'immunité et de la tolérance en thérapeutique. En conclusion, nous avons présenté un protocole pour la génération d'immature, tolérogène et moDCs matures crucial pour l'étude des fonctions immunorégulatrices de PED.
Déclarations de divulgation
Open access fees for this article were provided by, Agilent Technologies.
Remerciements
Ce travail a été soutenu par l'Agence pour la science, la technologie et Reasearch Financement de base (JEC).
matériels
| Name | Company | Catalog Number | Comments |
| Ficoll | GE Healthcare | 17-1440-03 | PBMC isolation |
| Syringe | Becton, Dickinson | 302832 | PBMC isolation |
| 1.5 mL centrifuge tube | Axygen | MCT-150-C | PBMC isolation |
| 15 mL falcon tube | Falcon | 352096 | PBMC isolation |
| 50 mL falcon tube | Falcon | 352070 | PBMC isolation |
| Centrifuge | Eppendorf | 5810R | PBMC isolation |
| 0.2 µm filter | Sartorius stedim biotech | 17597 | PBMC isolation |
| MACs kit | Miltenyi biotec | 130-042-201 | Monocyte enrichment |
| MiniMACS Separator | Miltenyi biotec | 130-042-102 | Monocyte enrichment |
| Cell culture grade water | Invitrogen, Life Technologies | Cell culture | |
| RPMI | Gibco, Life Technologies | 11875-093 | Cell culture |
| FBS | Hyclone | SH30070103 | Cell culture |
| Penicillin-streptomycin | Gibco, Life Technologies | 15140 | Cell culture |
| Phosphate Buffered Saline | Gibco, Life Technologies | 10010-031 | Cell culture |
| NEAA | Gibco, Life Technologies | 11140-040 | Cell culture |
| EDTA | Gibco, Life Technologies | 15575 | Cell culture |
| HEPES | Gibco, Life Technologies | 15630-080 | Cell culture |
| Sodium Pyruvate | Gibco, Life Technologies | 11360-070 | Cell culture |
| GM-CSF | Miltenyi biotec | 130-093-868 | Cell culture |
| IL-4 | Miltenyi biotec | 130-093-924 | Cell culture |
| Vitamin D3 | Sigma | D1530 | Cell culture |
| Dexamethasone | Sigma | D2915 | Cell culture |
| LPS | Sigma | l2755 | Cell culture |
| trypan blue | Gibco, Life Technologies | 15250-061 | Cell culture |
| PerCP-conjugated HLADR | BioLegend | 307628 | Cytometry |
| PE-conjugated CD80 | BD Biosciences | 557227 | Cytometry |
| PE-conjugated CD83 | BD Biosciences | 556855 | Cytometry |
| PE-conjugated CD86 | BD Biosciences | 555665 | Cytometry |
| APC-conjugated CD11c | BD Biosciences | 340544 | Cytometry |
| PE-conjugated CD14 | Miltenyi biotec | 130-091-242 | Cytometry |
| PE-conjugated BDCA3 | Miltenyi biotec | 130-090-514 | Cytometry |
| APC-conjugated ILT3 | eBioscience | 12-5139-73 | Cytometry |
| Isotype matched PerCP- conjugated Mab | BioLegend | 400250 | Cytometry |
| Isotype matched PE- conjugated Mab | Miltenyi biotec | 130-091-835 | Cytometry |
| Isotype matched APC- conjugated Mab | Miltenyi biotec | 130-091-836 | Cytometry |
| BD LSR II Flow Cytometer | BD Pharmingen | BD LSR II | Cytometry |
| cytofix/cytoperm | BD Biosciences | 554714 | Cytometry |
| APC/CY7-conjugated CD25 | BD pharmingen | 557753 | Cytometry |
| PE/CY7-conjugated CD4 | Biolegend | 300512 | Cytometry |
| PerCP-conjugated CD3 | Biolegend | 300428 | Cytometry |
| EasySep Human CD4+ T cell enrichment kit | STEMCELL Technologies | 19052 | Alloreaction study |
| EasySep magnet | STEMCELL Technologies | 18000 | Alloreaction study |
| Cell Trace CFSE cell proliferation kit | Molecular probes | C34554 | Alloreaction study |
| HBSS | Gibco, Life Technologies | 14025092 | Alloreaction study |
| Alexa Fluor 647-conjugated FoxP3 | BD Biosciences | 560889 | |
| Milliplex MAP Human Cytokine/Chemokine magnetic bead panel | Millipore | HCYTOMAG-60K | Cytokine analysis |
| 5 mL Polystyrene tube | Falcon | 352058 | Cytokine analysis |
| Luminex Sheath Fluid | Millipore | SHEATHFLUID | Cytokine analysis |
| FLEXMAP 3D system with xPONENT software | Luminex Corporation | FLEXMAP 3D | Cytokine analysis |
| MitoTracker Red CMXRos | Cell Signalling | 9082 | Mitochondrial activity |
| DMSO | Sigma Aldrich | D2650 | Mitochondrial activity |
| XF Assay Medium (OCR) | Seahorse Bioscience | 102352-000 | Metabolic adaptation |
| Glucose | Sigma Aldrich | G8769 | Metabolic adaptation |
| XF Base Medium (ECAR) | Seahorse Bioscience | 102353-100 | Metabolic adaptation |
| L-glutamine | Gibco, Life Technologies | 25030-081 | Metabolic adaptation |
| Calibrant | Seahorse Bioscience | 100840-000 | Metabolic adaptation |
| XF Cell Mito Stress kit | Seahorse Bioscience | 103015-100 | Metabolic adaptation |
| XF Glycolysis Stress kit | Seahorse Bioscience | 103020-100 | Metabolic adaptation |
| Seahorse | Seahorse Bioscience | XFe96 | Metabolic adaptation |
Références
- Jolles, S. Paul Langerhans. J Clin Pathol. 55 (4), 243-24 (2002).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med. 137 (5), 1142-1162 (1973).
- Steinman, R. M., Swanson, J. The endocytic activity of dendritic cells. J Exp Med. 182 (2), 283-288 (1995).
- Hemmi, H., Akira, S. TLR signalling and the function of dendritic cells. Chem Immunol Allergy. 86, 120-135 (2005).
- Mueller, D. L. Mechanisms maintaining peripheral tolerance. Nat Immunol. 11 (1), 21-27 (2010).
- Inaba, K., et al. Efficient presentation of phagocytosed cellular fragments on the major histocompatibility complex class II products of dendritic cells. J Exp Med. 188 (11), 2163-2173 (1998).
- Caux, C., et al. B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med. 180 (5), 1841-1847 (1994).
- Paavonen, J., Lehtinen, M. Interactions between human papillomavirus and other sexually transmitted agents in the etiology of cervical cancer. Curr Opin Infect Dis. 12 (1), 67-71 (1999).
- Ohtani, M., et al. Mammalian target of rapamycin and glycogen synthase kinase 3 differentially regulate lipopolysaccharide-induced interleukin-12 production in dendritic cells. Blood. 112 (3), 635-643 (2008).
- Wilde, B., et al. Dendritic cells in renal biopsies of patients with ANCA-associated vasculitis. Nephrol Dial Transplant. 24 (7), 2151-2156 (2009).
- Al-Hello, H., et al. An enterovirus strain isolated from diabetic child belongs to a genetic subcluster of echovirus 11, but is also neutralised with monotypic antisera to coxsackievirus A9. J Gen Virol. 89, 1949-1959 (2008).
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), 74-80 (2010).
- Osugi, Y., Vuckovic, S., Hart, D. N. Myeloid blood CD11c(+) dendritic cells and monocyte-derived dendritic cells differ in their ability to stimulate T lymphocytes. Blood. 100 (8), 2858-2866 (2002).
- Reynolds, G., Haniffa, M. Human and Mouse Mononuclear Phagocyte Networks: A Tale of Two Species. Front Immunol. 6, (2015).
- Jefford, M., et al. Functional comparison of DCs generated in vivo with Flt3 ligand or in vitro from blood monocytes: differential regulation of function by specific classes of physiologic stimuli. Blood. 102 (5), 1753-1763 (2003).
- Menck, K., et al. Isolation of human monocytes by double gradient centrifugation and their differentiation to macrophages in teflon-coated cell culture bags. J Vis Exp. (91), (2014).
- Zhou, L., et al. Impact of human granulocyte and monocyte isolation procedures on functional studies. Clin Vaccine Immunol. 19 (7), 1065-1074 (2012).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Faresjo, M. A useful guide for analysis of immune markers by fluorochrome (Luminex) technique. Methods Mol Biol. 1172, 87-96 (2014).
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. J Vis Exp. (65), (2012).
- Defawe, O. D., et al. Optimization and qualification of a multiplex bead array to assess cytokine and chemokine production by vaccine-specific cells. J Immunol Methods. 382 (1-2), 117-128 (2012).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J Vis Exp. (46), (2010).
- Chunharas, A., Pabunruang, W., Hongeng, S. Congenital self-healing Langerhans cell histiocytosis with pulmonary involvement: spontaneous regression. J Med Assoc Thai. 85, 1309-1313 (2002).
- Bai, L., Feuerer, M., Beckhove, P., Umansky, V., Schirrmacher, V. Generation of dendritic cells from human bone marrow mononuclear cells: advantages for clinical application in comparison to peripheral blood monocyte derived cells. Int J Oncol. 20 (2), 247-253 (2002).
- Felzmann, T., et al. Monocyte enrichment from leukapharesis products for the generation of DCs by plastic adherence, or by positive or negative selection. Cytotherapy. 5 (5), 391-398 (2003).
- Berger, T. G., et al. Efficient elutriation of monocytes within a closed system (Elutra) for clinical-scale generation of dendritic cells. J Immunol Methods. 298 (1-2), 1-2 (2005).
- Sallusto, F., Lanzavecchia, A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med. 179 (4), 1109-1118 (1994).
- Pace, S. T., Gelman, B. B., Wong, B. R. Primary Langerhans cell histiocytosis of the lacrimal gland in an adult. Can J Ophthalmol. 50 (3), 40-43 (2015).
- Ravanfar, P., Wallace, J. S., Pace, N. C. Diaper dermatitis: a review and update. Curr Opin Pediatr. 24 (4), 472-479 (2012).
- Gebhardt, C., et al. A case of cutaneous Rosai-Dorfman disease refractory to imatinib therapy. Arch Dermatol. 145 (5), 571-574 (2009).
- Vazquez, P., Robles, A. M., de Pablo, F., Hernandez-Sanchez, C. Non-neural tyrosine hydroxylase, via modulation of endocrine pancreatic precursors, is required for normal development of beta cells in the mouse pancreas. Diabetologia. 57 (11), 2339-2347 (2014).
- Pellacani, G., et al. Distinct melanoma types based on reflectance confocal microscopy. Exp Dermatol. 23 (6), 414-418 (2014).
- Shi, Y., et al. Hepatic involvement of Langerhans cell histiocytosis in children--imaging findings of computed tomography, magnetic resonance imaging and magnetic resonance cholangiopancreatography. Pediatr Radiol. 44 (6), 713-718 (2014).
- Haustein, M., Terai, N., Pablik, J., Pillunat, L. E., Sommer, F. Therapy-resistant swelling of the upper eyelid in childhood. Ophthalmologe. 111 (1), 53-57 (2014).
- Haidinger, M., et al. A versatile role of mammalian target of rapamycin in human dendritic cell function and differentiation. J Immunol. 185 (7), 3919-3931 (2010).
- Macedo, C., Turquist, H., Metes, D., Thomson, A. W. Immunoregulatory properties of rapamycin-conditioned monocyte-derived dendritic cells and their role in transplantation. Transplant Res. 1 (1), 16 (2012).
- Fischer, R., Turnquist, H. R., Taner, T., Thomson, A. W. Use of rapamycin in the induction of tolerogenic dendritic cells. Handb Exp Pharmacol. 188 (188), 215-232 (2009).
- Nicolette, C. A., et al. Dendritic cells for active immunotherapy: optimizing design and manufacture in order to develop commercially and clinically viable products. Vaccine. 25, 47-60 (2007).
- Han, T. H., et al. Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma. J Immunother. 32 (4), 399-407 (2009).
- Paananen, A., et al. Molecular and biological analysis of echovirus 9 strain isolated from a diabetic child. J Med Virol. 69 (4), 529-537 (2003).
- HC, O. N., Wilson, H. L. Limitations with in vitro production of dendritic cells using cytokines. J Leukoc Biol. 75 (4), 600-603 (2004).
- Mest, H. J., et al. Glucose-induced insulin secretion is potentiated by a new imidazoline compound. Naunyn Schmiedebergs Arch Pharmacol. 364 (1), 47-52 (2001).
- Puc, J., et al. Mitochondrial activity after cold preservation of pancreatic islet cells treated with pefloxacin (PFX). Ann Transplant. 3 (1), 38-41 (1998).
- Alarcon, C., Serna, J., Perez-Villamil, B., de Pablo, F. Synthesis and differentially regulated processing of proinsulin in developing chick pancreas, liver and neuroretina. FEBS Letters. 436 (3), 361-366 (1998).
- Jekunen, A. P., Kairemo, K. J., Paavonen, T. Imaging of Hand-Schuller-Christian syndrome by a monoclonal antibody. Clin Nucl Med. 22 (11), 771-774 (1997).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nat Rev Immunol. 15 (1), 18-29 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon