Method Article
In Situ Labeling der mitochondrialen DNA - Replikation in Drosophila Adult Ovarien von EdU Anfärben
In diesem Artikel
Zusammenfassung
Drosophila oogenesis continues to be exceptionally useful in the study of mitochondrial proliferation and inheritance. This manuscript describes a detailed protocol used to label the replicating mitochondrial DNA (mtDNA) in Drosophila adult ovaries with 5-ethynyl-2´-deoxyuridine (EdU), which facilitates uncovering mechanisms associated with mitochondrial inheritance that were previously debatable.
Zusammenfassung
The mitochondrial genome is inherited exclusively through the maternal line. Understanding of how the mitochondrion and its genome are proliferated and transmitted from one generation to the next through the female oocyte is of fundamental importance. Because of the genetic tractability, and the elegant, ordered simplicity by which oocyte development proceeds, Drosophila oogenesis has become an invaluable system for mitochondrial study. An EdU (5-ethynyl-2´-deoxyuridine) labeling method was utilized to detect mitochondrial DNA (mtDNA) replication in Drosophila ovaries. This method is superior to the BrdU (5-bromo-2'-deoxyuridine) labeling method in that it allows for good structural preservation and efficient fluorescent dye penetration of whole-mount tissues.
Here we describe a detailed protocol for labeling replicating mitochondrial DNA in Drosophila adult ovaries with EdU. Some technical solutions are offered to improve the viability of the ovaries, maintain their health during preparation, and ensure high-quality imaging. Visualization of newly synthesized mtDNA in the ovaries not only reveals the striking temporal and spatial pattern of mtDNA replication through oogenesis, but also allows for simple quantification of mtDNA replication under various genetic and pharmacological perturbations.
Einleitung
Neben dem Kerngenom, jede eukaryotische Zelle enthält auch Tausende von Kopien von kleinen kreisförmigen DNA in der mitochondrialen Matrix. Während mitochondriale DNA (mtDNA) wesentliche Untereinheiten der Elektronentransportkette kodiert, die Mehrheit der mitochondrialen Proteoms, einschließlich aller Faktoren, die für die Replikation und Transkription von mtDNA durch die nukleare Genom kodiert. Im Gegensatz zum Kerngenom, die Mendelschen Vererbungsgesetze folgt, wird das Tier mitochondriale Genom ausschließlich über die mütterliche Linie vererbt. Daher verstehen, wie mtDNA stark vermehrt wird und von einer Generation zur nächsten durch die weibliche Eizelle übertragen wird, ist von grundlegender Bedeutung. Allerdings gibt es anhaltende Debatte darüber, wie mtDNA-Replikation in der weiblichen Keimbahn geregelt wird. Darüber hinaus schlägt die weithin akzeptierte mtDNA Engpass Theorie für mtDNA Übertragung, dass die Bevölkerung von mtDNA in Urkeimzellen auf eine relativ kleine Zahl unterabgetastet during Entwicklung 1 2. Es bedeutet auch, dass die mtDNA-Replikation ist zeitlich und räumlich reguliert während der Oogenese. Daher wird die in situ Nachweis von mtDNA - Replikation während der Entwicklung der Keimbahn das Verständnis des Mechanismus der mtDNA Vererbungs erleichtern.
Drosophila oogenesis ein genetisch manipulierbaren System mtDNA - Replikation und Übertragung zu studieren. In jeder der beiden Drosophila Ovarien, gibt es 16-20 unabhängige Strings Eikammern genannt Ovariolen 3, die die Funktionseinheiten der Eierproduktion sind (siehe 1A). Jede Ovariole enthält eine progressive lineare Organisation der Oogenese, wo die vordere Spitze einer Struktur namens Germarium zusammengesetzt ist. Die Germarium wird weiter in vier Bereiche unterteilt, die Keimzellen an unterschiedlichen Entwicklungsstadien enthalten. In der Region 1, gehen Keimbahn-Stammzellen durch asymmetrische Teilung Tochterzellen als c bekannt zu produzierenystoblasts. Region 2a enthält die cystoblasts, die ihre endgültige Teilung abgeschlossen haben. Cystoblasts laufen vier Runden der Division produziert 16-Zellgruppen. Die 16 Zellen bleiben zytoplasmatische Brücken miteinander verbunden sind Kanäle genannt Ring. Nur einer der Zellen verpflichtet sich zur Differenzierung der Eizelle, während die anderen 15 als polyploid Nährzellen entwickeln. Eine wesentliche cytoplasmatische Struktur, wie fusome bekannt ist , wird vorgeschlagen , mit der Bildung von Ringkanälen zu erleichtern, die Zyste Polarität und die Krankenschwester Zell-Wechselwirkungen Oozyte 4,5 bestimmen. Da die Zysten in Richtung Bereich 2b bewegen, erstrecken sich die Zyste Strukturen, die die gesamte Breite des Germarium, und sich mehr mit Follikel-Zellen in Verbindung gebracht. Die Germarium Strukturen enden mit Bereich 3 des ersten Knospung Eikammer enthält. Anschließend werden die Eikammern am hinteren Ende des Germarium zusammengebaut, das in 14 morphologisch unterschiedlichen Phasen durch die Ovariole fortzuschreiten. Das Wachstum der Eizelle, hängt von den Nährzellen, which Transportproteine, mRNA und endomembrane Strukturen (zB Golgi) über die Ringkanäle in die Eizelle. Während Drosophila oogenesis wurde festgestellt , dass ein Bruchteil der Mitochondrien in jeder 16-Zell - Zyste wurden mit dem fusome verbunden sind , bewegt durch die Ringkanäle und wurden in die einzelnen Eizelle in einer großen Masse geliefert genannt Balbiani Körper 6. Dieses Phänomen wurde vorgeschlagen, um die Qualitätskontrolle der mitochondrialen Vererbung durch weiblichen Ovarien beizutragen.
Nachweis von mtDNA-Synthese beruht auf dem Einbau von markierten DNA-Vorläufer in die zelluläre DNA. Traditionell wurde ein Nukleosid - Analogon von Thymidin - 5-bromo-2'-desoxyuridin (BrdU) verwendet , die 7,8 mtDNA - Replikation in Gewebekulturzellen zu etikettieren. Allerdings ist die Antikörper-basierte BrdU-Markierung weist mehrere Einschränkungen, insbesondere für ganze-mount Gewebefärbung. Ein wesentlicher Nachteil von BrdU-Markierung ist, dass es DNA-Denaturierung erfordert aussetzendie BrdU-Epitop, so dass es durch die anti-BrdU-Antikörper nachgewiesen werden. Die Probe wurde behandelt unter rauen denaturierenden Bedingungen wie Chemikalien (beispielsweise Salzsäure oder Mischungen aus Methanol und Essigsäure), Wärme oder Verdau mit DNase werden, die die Struktur der Probe stören könnten und erschweren die folgenden Färbeverfahren 9, 10.
Hier wird eine alternative Thymidin - Analogon 5-ethinyl-2'-desoxyuridin (EDU) wird verwendet , um die Replikation von mitochondrialer DNA in Drosophila erwachsenen Ovarien zu etikettieren. Diese Methode ist schneller und hochempfindlich. EdU wird leicht in die zelluläre DNA während der DNA-Replikation eingebaut. Die folgende Erkennung auf einem "Klick" Reaktion basiert, ein Cu (I) -katalysierte kovalente Reaktion zwischen dem terminalen Alkin - Gruppe und einem fluoreszierenden Azid 10. Da die Reaktion nicht die Denaturierung der Probe erfordern, ermöglicht es eine gute strukturelle Erhaltung. Ferner ist die Größe der Farbstoff einzide ist nur 1/500 derjenigen eines Antikörpermoleküls 10, die eine schnelle und effiziente Eindringen von Vollmontage Gewebe ermöglicht. Wir haben diese Methode verwendet , um mtDNA - Replikation während der Drosophila oogenesis und fand eine verblüffende räumliche Muster in der Germarium Region von Drosophila Ovar 11, die uns erkennen , führen eine Replikationsabhängigen mtDNA selektiven Vererbungsmechanismus vorzuschlagen. Wir präsentieren hier ein ausführliches Protokoll über EdU Kennzeichnung von mtDNA - Replikation in Drosophila Ovarien. Um die Anwendung des Protokolls zeigen , testeten wir auch die mtDNA - Replikation in einer mtDNA mutanten Drosophila (mt: CoI T300I) 11, sowie mit diversen Behandlung mitochondrialer Entkoppler, der die mitochondriale Membranpotential abzuleiten und potenziell mtDNA - Replikation stören.
Protokoll
1. Gewebeentnahme und Dissection
- In jedem Fläschchen mit Trockenhefe, Kultur 10 erwachsene Frau fliegt mit 10 Männern für 2-3 Tage.
Hinweis: Die Aufrechterhaltung gut genährten weiblichen Fliegen wird die Qualität und die Ausbeute an Ovar Produktion und erleichtern Dissektion verbessern. - Anesthetize das Weibchen auf einem Kohlendioxid fliegt (CO 2) fliegen Pad.
- Unter dem Stereoskop, setzen einige Tropfen RT - Medium (Schneiders Drosophila - Medium mit 10% fötalem Rinderserum (FBS) ergänzt) auf einem Sezieren Pad. Führen Sie alle Dissektion Verfahren in dem Medium das Gewebe am Leben und gesund zu halten.
- Schnappen Sie sich ein gemästet Frau mit scharfen feinen Nase Zange an ihrem unteren Thorax fliegen. Verwenden Sie eine andere Gruppe von Zange am äußersten hinteren der Fliege sanft zu zerren, bis die Gewebe im Unterleib ausgesetzt sind. Lösen Sie die beiden Ovarien aus anderen Geweben (zB Innereien).
Hinweis: Jeder Ovar zeigt eine undurchsichtige Struktur, die compose istd von 16-20 befestigt Ovariolen. - Um das Eindringen von Reagenzien zu verbessern, öffnen Sie die Ovarien von ihnen auseinander und vorbei an den Spitzen der Zange zwischen jedem Ovariole ein paar Mal ziehen. Halten Sie die Ovariolen innerhalb eines Eierstocks verbunden Verlust von Gewebe während der folgenden Verfahren zu minimieren.
- Übertragen Sie die Ovarien sofort auf eine 1,5 - ml - Mikroröhrchen mit 500 ul Schneiders Drosophila - Medium mit 10% FBS.
- Wiederholen Sie die Präparation und sammeln 10-15 Ovarien in jedem Reaktionsgefäß.
2. EdU Labeling
- Saugen Sie das Medium in jedem Rohr, und ersetzen mit 500 ul Schneiders Drosophila - Medium mit 10% FBS , enthaltend 7 uM Aphidicolin.
Hinweis: Aphidicolin verwendet wird Kern - DNA - Synthese durch Hemmung der DNA - Polymerase α ohne Beeinträchtigung der mtDNA - Replikation 7, 12 zu blockieren. Es ist möglich, die Aphidicolin-Konzentration auf bis zu erhöhenbis 70 um bessere Hemmung zu erzielen. Die Stammlösung von 3-30 mM Aphidicolin in DMSO kann für bis zu 6 Wochen bei -20 ° C im Dunkeln gelagert werden. - Damit die Ovarien gesund, sicherzustellen, dass sie unter Lösungen eingetaucht werden, während das Medium verändert. Verwenden Schneiders Drosophila - Medium mit 10% FBS bis Schritt 2.6.
- Inkubieren Ovarien 3 h bei RT auf einem Benchtop-Rocker mit sanfter Drehung.
- Zur medikamentösen Therapie, zum Beispiel mitochondrialen Entkoppler carbonyl Cyanid 4-trifluormethoxy phenylhydrazons (FCCP), fügen Sie die entsprechende Konzentration des Wirkstoffs (zB 10 & mgr; M FCCP) in das Medium nach 2 h von Aphidicolin - Behandlung. Nach weiteren 1 h inkubiert.
- Entfernen Sie das Medium, das Aphidicolin mit oder ohne Arzneimittel. Kurz spülen Sie die Ovarien mit Medium (Aphidicolin nicht notwendig ist) zweimal.
- 1 ml Medium, das 10 & mgr; M EdU und 7 uM Aphidicolin und weiter incubatinbei RT g für 2 Std. Lagern Sie die 10 mM EdU Stammlösung (in DMSO) bei -20 ° C.
- Entfernen Sie das Medium, das EdU und Aphidicolin. Waschen mit Medium (ohne Aphidicolin) zweimal für jeweils 3 min.
3. Gewebefixierung und Permeabilisierungs
- Bereiten einer 4% Paraformaldehydlösung in phosphatgepufferter Salzlösung (PBS, pH 7,4).
Hinweis: Wir verwendeten kommerziell erhältlichen Paraformaldehyd gespeichert in vorgeritzten Ampullen. Öffnen Sie eine neue Ampulle und mit Wasser auf 4% vor dem Gebrauch.
ACHTUNG: Formaldehyd ist giftig; es sollte mit der Haut und Augenschutz in einem Abzug gehandhabt werden. - Fix Ovarien mit 4% Paraformaldehyd für 20 min bei RT unter leichtem Rotation.
- Entfernen Sie die Fixiermittel und waschen Ovarien zweimal in 1 ml 3% BSA in PBS für jeweils 5 min.
- Um das Gewebe durchdringbar zu machen, entfernen Sie die Waschlösung und 1 ml 0,5% Triton X-100 in PBS. 20 min bei RT inkubiert.
- Entfernen Sie die Permeabilisierung Lösung und waschen zweimal in 1 mlvon 3% BSA in PBS.
4. EdU Erkennung
Hinweis: EdU Nachweis beruht auf "Klick" Chemie, eine Cu (I) -katalysierte [3 + 2] -Cycloaddition 13, die fluoreszierende Azide an die terminalen Alkin Gruppe EdU hinzufügt und das fluoreszierende Molekül zum anschließenden Nachweis unterzogen. Da Cu (I), die leicht an die nicht-katalytische Cu (II) -Spezies oxidiert wird, ist erforderlich , um die Reaktion zu katalysieren, wird empfohlen , die Cu (II) -sulfat in situ zu reduzieren , Cu (I) zu erhalten. Das heißt, Cu (II) -sulfat in Gegenwart eines Reduktionsmittels, wie Ascorbinsäure, verwendet wird (hierin die "Puffer additive"), Kupfer (I) zu erzeugen.
- Vor dem Versuch, bereiten Sie die Arbeitslösung des Alexa Fluor Azid (Alexa Fluor 488 Azid, Alexa Fluor 555 Azid oder andere, je nach dem bevorzugten Fluorophore, die als "Farbstoff Azid" im Folgenden genannt werden), EDU Reaktionspuffer und EdU Puffer-Zusatz nach HerstellerAnleitung.
- Die Rekonstitution der Farbstoff Azid in 70 ul DMSO. Bewahren Sie die Arbeitslösung bei -20 ° C für bis zu 1 Jahr.
- Bereiten Sie frische EdU Reaktionspuffer, die 10-fach EdU Reaktionspuffer mit entsalztem Wasser durch Verdünnen.
Hinweis: Nach dem Gebrauch speichern alle verbleibenden 1x Lösung bei 4 ° C. Die 1x Lösung ist stabil für bis zu 6 Monate. - Machen Sie eine 10x Stammlösung des EdU Puffer-Zusatz durch vollständig um das Pulver in 2 ml entionisiertem Wasser gelöst.
Hinweis: Diese Stammlösung für bis zu 1 Jahr bei -20 ° C stabil ist. Wenn die Lösung eine braune Farbe entwickelt, wurde abgebaut und verworfen werden sollte.
- Bereiten Sie die EdU Reaktion Cocktail frisch jedes Mal, und innerhalb von 15 Minuten der Vorbereitung. Um reproduzierbare Ergebnisse zu erzielen, stellen Sie sicher, dass die Reaktionskomponenten in den gleichen Verhältnissen gehalten.
- (Hergestellt in Schritt 4.1.3) 1:10 in entsalztem Wasser Make frisch 1x EdU Zusatzlösung Puffer durch die 10x Stammlösung verdünnt wird. Verwenden Sie dieses sÖSUNG am selben Tag.
- Vorbereitung 1 ml EdU Reaktionscocktail , indem die folgenden Bestandteile , um die Kombination von : 860 & mgr; l 1x EdU Reaktionspuffer, 40 ul CuSO 4, 2,5 & mgr; l Farbstoff Azid, 100 ul 1x EdU Pufferadditiv.
Hinweis: Es ist wichtig, dass die Bestandteile zugegeben werden, um eine optimale Leistung zu gewährleisten.
- Entfernen Sie die PBS mit 3% BSA und 0,5 ml der EDU Reaktion Cocktail in jedes Röhrchen. bei RT inkubieren für 30 min unter leichtem Rotation. Halten Sie die Proben vor Licht geschützt.
- Entfernen Sie die EdU Reaktion Cocktail und waschen Sie einmal mit 1 ml 3% BSA in PBS.
- Waschen Sie die Proben einmal mit 1 ml PBS.
5. Antikörpermarkierung
Hinweis: Führen Sie Antikörpermarkierung nach EdU Färbung. Wenn keine zusätzliche Färbung gewünscht wird, kann man direkt an der Montage und Abbildungs fortzufahren. Es ist wichtig, dass die Proben von Licht in allen folgenden Verfahren geschützt werden.
- Entfernen Sie die Waschlösung. Blockieren die Ovarien in 1 ml Blockierungslösung, enthaltend 0,2% BSA und 0,1% Triton X-100 in PBS für 30 min.
- Entfernen Sie die Blockierungslösung und ersetzen mit dem primären Antikörper verdünnt in Blockierungslösung (zB Maus ATP - Synthase - Untereinheit α - Antikörper, 1: 1000 Verdünnung). Inkubieren im Dunkeln bei 4 ° CO / N.
- Waschen der Proben mit 1 ml Blockierungslösung 3-mal, jeweils 10 Minuten Zeit. Um den Hintergrund zu minimieren, waschen Sie noch zwei Mal für jeweils 30 min. Entfernen Sie die Blockierungslösung.
- Inkubieren mit sekundärem Antikörper , verdünnt in Blockierungslösung (beispielsweise Ziegen - anti-Maus - Alexa Fluor 568 sekundärem Antikörper, 1: 200 Verdünnung) für 2 h bei RT.
Hinweis: Verwenden Sie eine andere Farbe als das zu EdU gekoppelt. - Wiederholen Sie die Waschschritte durchgeführt in Schritt 5.3.
- Spülen Sie mit 1 ml PBS einmal entfernen, um die Reinigungsmittel.
6. Montage und Imaging
- Entfernen Sie vorsichtig alle PBS und immediately decken Ovarien mit 50 ul Medium Montage (mit oder ohne DAPI).
Hinweis: Verwenden Sie einen Montagemedium, das härtet nicht aus, während die Ovariolen voneinander getrennt werden. Ovarien kann für bis zu einer Woche bei 4 ° C in Befestigungsmedium gespeichert werden. - Schneiden Sie das Ende einer Pipettenspitze und es verwenden, Ovarien sorgfältig auf einen Objektträger übertragen werden.
- Völlig getrennt jeder Ovariole mit scharfen feinen Nase Zange unter dem Stereomikroskop. Entfernen Sie die Verbindungsgewebe am hinteren Ende und Stufe 14 oder reife Eizelle Kammern. Die jungen Eikammern sind am vorderen Ende und transparent.
- Ausrichten der Eikammern mit einer Pinzette, so daß sie miteinander nicht überlappen.
- ein # 1.5 Deckglas auf der Oberseite der Proben langsam senken. Ermöglichen die Befestigungsmittel für mehrere Stunden bei RT zu polymerisieren. Siegel mit transparentem Nagellack.
- Bild schiebt den nächsten Tag oder bei 4 ° C vor der Bildgebung.
- Visualisieren unter einem konfokalen mikop mit einem 63X Ölimmersionsobjektiv. Erfassen Sie dreidimensionale z-Stapel Bilder.
Hinweis: Es gibt starke EdU Signal in reifere Eikammern und Hintergrundfluoreszenz in der epithelialen Mantel. Wenn EdU Kennzeichnung in einem bestimmten Germarium untersuchen, sollte man germariums vermeiden, die durch oder in der Nähe zu anderen Geweben überlappen oder später stufigen Eikammern.
Ergebnisse
Das obige Protokoll ermöglicht die Visualisierung der punctate Strukturen im Zusammenhang mit Mitochondrien (1B-C), die während der Oogenese Drosophila mitochondrialen DNA - Replikation zeigen. Die EDU puncta mit Mitochondrien lokalisiert gekennzeichnet durch für die ATP - Synthase - alpha - Untereinheit (Abbildung 2) Färbung. Die beobachteten Signale fehlten in Ovarien mit Ethidiumbromid 11 behandelt, einem Inhibitor für mtDNA - Replikation 14, Validierung , dass diese puncta tatsächlich Label replizierende mtDNA.Aphidicolin verwendet wurde , nukleare DNA - Färbung zu verhindern , ohne dass dies Auswirkungen mtDNA Replikation (Abbildung 2). Ohne Aphidicolin - Behandlung, beschriften intensive EdU Signale , die Kerne und mtDNA puncta wurden kaum nachgewiesen werden (Abbildung 3). Jedoch in Gegenwart von Aphidicolin wurde Kern Inkorporation dramatisch reduziert und viele puncta mit Mitochondrien assoziiert beobachtet.
Es gibt ein hohes Maß an mtDNA - Replikation in post-Germarium Eikammern (1B). Doch vor allem, angezeigt mtDNA-Replikation ein räumliches Muster in Germarium. Wie durch die Anzahl der EdU puncta angegeben ist , gibt es ein moderates Maß an mtDNA - Replikation in Region 1 des Germarium, aber fast keine EdU Einbau in Region 2A (1C). Da die Zyste in der Germarium zu Region 2B bewegt sich nach unten, wieder mtDNA - Replikation und die Anzahl der EdU puncta in der hinteren Zyste von 2B Region war viel höher als die in der Region 2A (1C). Insbesondere wurde intensive EdU Inkorporation um die Ringkanäle eingeengt und der fusome Strukturen, wie sie in der hu li tai Shao (HES) Protein gefärbt. mtDNA gehalten in Bereich 3 des Germarium (1C) auf einem hohen Niveau zu replizieren
Um die Zuordnung von spezif demonstrierenic Gene oder Behandlung mit mtDNA Proliferation konnte Drosophila Ovarien Genmanipulation oder medikamentöse Behandlung unterzogen werden. Wir behandelten Ovarien mit verschiedenen Konzentrationen von FCCP, einem klassischen mitochondrialen protonophore, das mitochondriale Membranpotential ableitet. Als Kontrolle hatte DMSO keine Auswirkung auf mtDNA Replikation (4A). Hohe Dosen von FCCP (10 uM) fast mtDNA Replikation verarmt vollständig im gesamten Germarium (4D). Dennoch geringere Konzentration von FCCP (2 oder 5 & mgr; M) hatte einen geringen Einfluss auf die mtDNA - Replikation in Region 1 , aber gehemmt Replikation in Regionen 2B und 3 (4B-C), was darauf hindeutet Regionen 2B und 3 empfindlicher auf mitochondriale Störung sind, oder sie halten relativ langsamer Replikationskinetik. Die obigen Ergebnisse zeigten, dass mtDNA-Replikation mit mitochondrialen Aktivität assoziiert ist. Insbesondere reagiert verschiedenen Regionen der Germarium unterschiedlich auf die mitochondriale impairment.
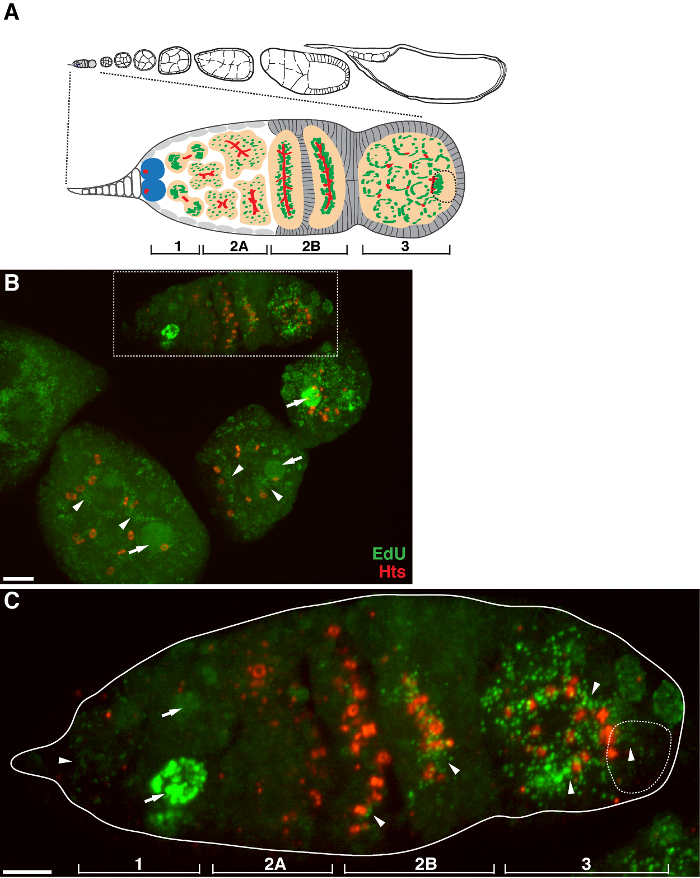
Abbildung 1. mtDNA - Replikation während der Drosophila oogenesis. (A) Schematische Darstellung eines Drosophila Ovariole und eine vergrößerte Ansicht des Germarium. Die Ovariole zeigt von links nach rechts, von vorne nach hinten, aufeinanderfolgenden Entwicklungsstadien der Eikammern. Im Germarium, die fusome (rot), Keimbahn-Stammzellen (blau), Mitochondrien (grün), Zukunft Oozyten (gestrichelte Linie, anerkannt durch Positionierung, fusome Struktur und mitochondriale Cluster), die Entwicklung von Zysten (Pfirsich) und vier Entwicklungsbereiche werden gezeigt . (B) Repräsentative Z-Stapel - Projektion eines Ovariole Wildtyp gekennzeichnet durch EdU und Antikörper gegen Hts-RC, einem Marker für die Ringkanäle und fusome. In Gegenwart von Aphidicolin wurde die EdU in mtDNA eingebaut (Pfeilspitzen) und Kerne (Pfeile). Maßstabsbalken, 10 & mgr; m.(C) Vergrößerte Ansicht von germaria im boxed Region in B skizziert. Die vier Entwicklungsbereiche sind angegeben. Maßstabsbalken, 5 um 11. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
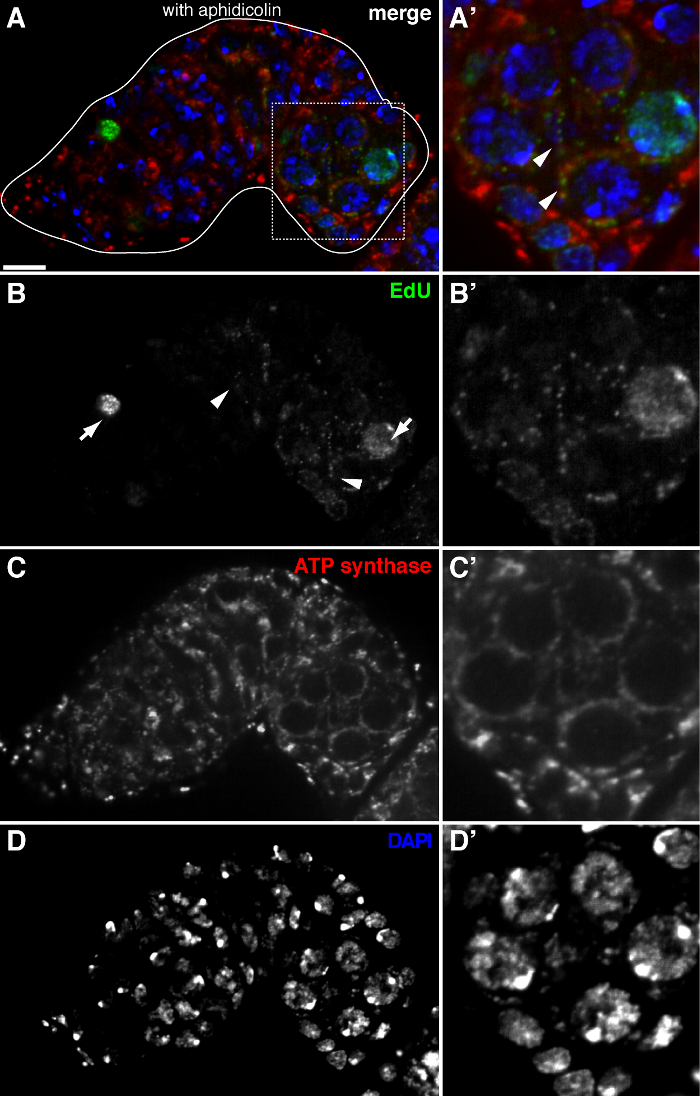
Abbildung 2. mtDNA Replikation in der Germarium Drosophila visualisiert durch EdU Einbau mit Aphidicolin - Behandlung (A) -. (D) Repräsentative konfokalen Abschnitt eines Wildtyp Germarium zeigt EdU Inkorporation (grün, b), Mitochondrien, durch ATP - Synthase alpha - Untereinheit Färbung markiert (red, C), und Kerne, markiert mit DAPI - Färbung (blau, D) mit Vorinkubation mit DNA - Polymerase-α - Inhibitor Aphidicolin. (A &# 39 ;-D ') ein vergrößertes Bild des eingerahmten Bereich in (A) zeigt EdU Inkorporation (B'), Mitochondrien (C ') und Kerne (D'). In Gegenwart von Aphidicolin wird Kern Inkorporation (Pfeile) verringert und viele puncta wurden innerhalb von Mitochondrien (Pfeilspitzen) lokalisiert. Maßstabsbalken, 10 & mgr; m. Die Figur wurde von 11 geändert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
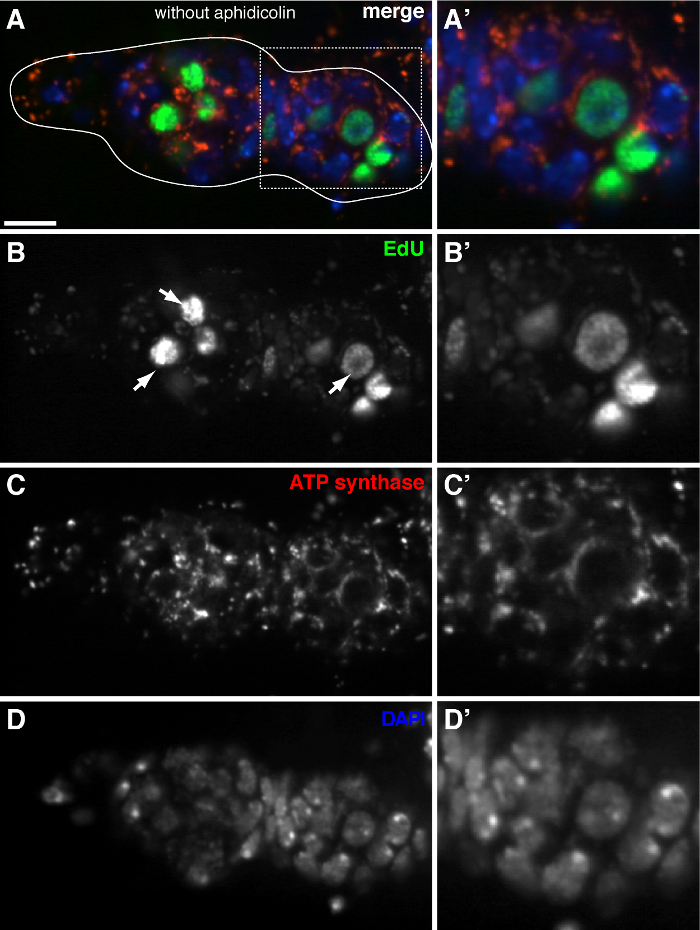
Abbildung 3. mtDNA - Replikation wird kaum in der Drosophila Germarium ohne Aphidicolin - Behandlung nachgewiesen werden (A) . - (D) Repräsentative konfokalen Abschnitt eines Wildtyp Germarium zeigt EdU Inkorporation (grün), Mitochondrien, gekennzeichnet durchATP-Synthetase-Untereinheit alpha-Färbung (rot), und Kerne, markiert mit DAPI-Färbung (blau) in Abwesenheit der DNA-Polymerase-α-Inhibitor Aphidicolin. (A'-D ') ein vergrößertes Bild des eingerahmten Bereich in (A) zeigt Inkorporation EdU (B'), Mitochondrien (C ') und Kerne (D'). Ohne Aphidicolin wurden intensiv EdU Signale Etikett Kerne (Pfeile) und mtDNA puncta kaum erkannt. Maßstabsbalken, 10 & mgr; m. Die Figur wurde von 11 geändert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
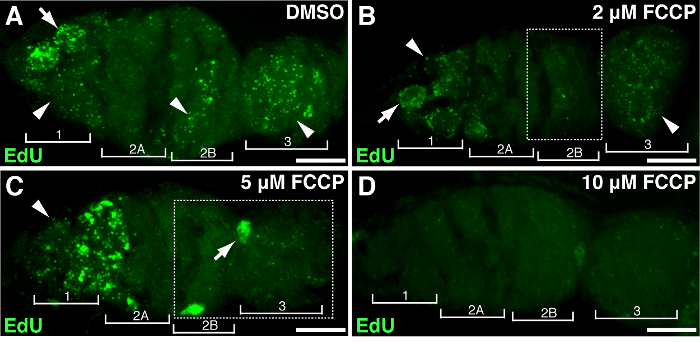
Abbildung 4. Mitochondrial Entkupplungsgleise beeinträchtigt die mtDNA - Replikation. Repräsentative z-Stack Projekte Wildtyp Germarium mit DMSO behandelt zeigt(A) oder der mitochondrialen Entkopplers FCCP bei Konzentrationen von 2 uM (B), 5 & mgr; M (C), 10 uM (D) während EdU Inkorporation. Beachten Sie die beeinträchtigte EdU Kennzeichnung in der Region 2B behandelt mit 2 uM FCCP (B), und in beiden Bereich 2B und 3 behandelt mit 5 uM FCCP (skizziert in Kästen). Vier Entwicklungsregionen sind dargestellt. Pfeile, die Kern-DNA; Pfeilspitzen, mtDNA. Maßstabsbalken, 10 & mgr; m. Die Figur wurde von 11 geändert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
EdU Kennzeichnung ist ein neuartiges und effizientes Verfahren der DNA-Synthese in proliferierenden Zellen zu erfassen, die sich auf den Einbau und Färbung von Nukleosidanaloga in neu synthetisierte DNA basiert. Dieses Verfahren ist besser als die BrdU-Markierungsverfahren, dass es schneller und sehr empfindlich. Noch wichtiger ist , ermöglicht es für eine gute strukturelle Erhaltung und effiziente EDU-Farbstoffpenetration von 9 Gewebe ganze Montage, 10. Historisch gesehen , als eine überlegene Alternative zu BrdU - Markierung, wurde während der S-Phase des Zellkern - DNA - Replikation EdU Markierung verwendet für das Studium Zellzyklus. Aphidicolin ist ein Inhibitor der DNA - Polymerase α, die für die Kern - DNA - Replikation in der S-Phase 12 15 der Haupt Polymerase ist. mtDNA-Replikation wird durch DNA-Polymerase-γ durchgeführt wird, die unempfindlich ist Behandlung Aphidicolin. Daher Behandlung mit Aphidicolin vor und während der EdU Inkubation deutlich hemmte EdU Einbau in die Kern-DNA. Es solltezu beachten, dass Aphidicolin für mehrere Wochen stabil sein kann, wenn in geeigneter Weise gespeichert, und die Wirksamkeit von Aphidicolin in Kern-DNA-Replikation war variabel Hemmung in unseren Händen. Die Ovariolen oder Eikammern mit starken sollten nukleare DNA-Markierung ausgeschlossen werden von der weiteren Datenanalysen.
mtDNA Replikation kann leicht als puncta im Zytoplasma sichtbar gemacht werden, die auch eine einfache Möglichkeit bietet, indem die Anzahl von EdU puncta, normiert auf das Gesamtvolumen des Zytoplasmas das Niveau der mtDNA-Replikation zu quantifizieren. Imaging-Software kann angewendet werden, um automatisch EdU puncta in mikroskopischen Bildern zu identifizieren, die für die rechnerische Analysen großer Datenmengen besonders nützlich ist. Allerdings sollten Vorkehrungen getroffen werden, da die unvollständige Hemmung der Zellkern-DNA-Replikation zu der EDU Einbau in verschiedene Loci auf dem Chromosom und zeigen als puncta innerhalb des Kerns führen kann. Auch in anderen Fällen, die Aufnahme der Intensität von EdU in replicating mtDNA können schwach sein, während der Hintergrund und Rauschen hoch sein könnte. Daher sollten die einzelnen Parameter für die automatische Bildanalyse genau definiert. Es wird auch empfohlen, dass die Bilder sollten mit geschulten Augen, um sicherzustellen, überprüft werden, dass die richtige EdU puncta identifiziert werden.
Visualisierung von neu synthetisierten mtDNA während Drosophila Oogenese bietet die Möglichkeit zu untersuchen , wie mtDNA Replikation unter physiologischen oder pathologischen Bedingungen reguliert wird, indem das Experiment in Fliegen auf eine Vielzahl von pharmakologischen und genetischen Störungen unterworfen , durchgeführt wird . In einer früheren Studie wurde EdU Inkorporationstest in einem mtDNA mutierten Drosophila mt ausgeführt: COI T300I 11. Darüber hinaus können die mitochondrialen Membranpotentials zu unterbrechen, wurden Ovarien mit verschiedenen Konzentrationen von mitochondrialen Entkoppler FCCP behandelt oder 2,4-Dinitrophenol (DNP) vor EdU Inkorporation. In Abhängigkeit von den experimentellen Zweckenund Drogen Eigenschaften, verschiedene Methoden könnte für eine effektive Lieferung angenommen. Für erwachsene Fliegen, Medikamente können als Dampf (zB Ethanol und Kokain) 16,17 oder Drogen präsentiert werden können in das Abdomen injiziert, wo es schnell im ganzen Körper diffundiert 18. Die am weitesten verbreitete Praxis besteht darin, dass Medikamente zur Fliege Lebensmittel oder einer Saccharose / arzneimittel gesättigtem Filterpapier zugesetzt werden. Zum Beispiel kann der Inhibitor von Mikrotubuli Anordnung, Colchicin, wurde 2-3 Tage vor Ovar dissection 19 fliegt zugeführt. Daher ist es wichtig, die Arzneimittelverabreichungsmethode und wählen geeigneten Konzentrationen zu bewerten.
Um die erfolgreiche Abbildung von mtDNA - Replikation in Drosophila Ovarien, mehrere wichtige Schritte sicherstellen müssen sorgfältig ausgeführt. Foremost, bei der Präparation und EdU Inkorporation die Lebensfähigkeit und die Gesundheit der Ovarien zu erhalten ist wichtig (die Schritte 1 und 2). Die Drosophila Mediums Schneider mit FBS muss RT erwärmt werdenvor Gebrauch. Man sollte einen direkten Kontakt zwischen den Eikammern und Sezieren Werkzeuge oder Pipettenspitzen zu minimieren. Die Ovarien sollten unter Lösungen für alle Zeiten eingetaucht werden, um Austrocknung zu vermeiden. führen die Gewebe Falsche Handhabung leicht in Ohnmacht fallen oder keine Fluoreszenzsignale. Während des Gewebes Montageschritt sollte Ovariolen voneinander getrennt werden, und verteilt auf dem Objektträger. Stellen Sie sicher, dass die Eikammern nicht übereinander gestapelt werden. Wir haben festgestellt, dass die Eikammern über Stufe 14 wenig EdU Einbau angezeigt. Zusätzlich wegen der großen Größe, die Eier späten Stadium Kammern verursachen oft die benachbarten jüngeren Eikammern unscharf zu sein. Daher empfiehlt es sich, dass die späten Stadium Eikammern verworfen werden.
Hier bieten wir Ihnen ein detailliertes Protokoll zur Markierung von mtDNA in Drosophila erwachsenen Ovarien zu replizieren. Dieses Verfahren ermöglicht eine einfache Quantifizierung von mtDNA-Replikation unter verschiedenen genetischen und pharmakologischen Störungen,und wird nützlich sein, zum Präparieren Mechanismen entwicklungs mitochondrialen Biogenese und mtDNA Erbe zugrunde liegen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We thank K. Delaney for comments on the manuscript. This work was supported by the National, Heart, Lung, and Blood Institute (NHLBI) Intramural Program.
Materialien
| Name | Company | Catalog Number | Comments |
| Schneider’s Drosophila medium | Invitrogen | 21720-024 | |
| FBS | Invitrogen | 10100-147 | |
| Pair of Dumont #5 Forceps | Fine Science Tools | 11252-20 | |
| Aphidicolin | Sigma | A0781 | Aliquot after dissolving in DMSO. Avoid repetitive thawing and freezing. Protect from light. May be used within 6 weeks after dissolving. |
| FCCP | Sigma | C2920 | |
| DMSO | Sigma | D2650 | |
| Paraformaldehyde, 16% EM grade | Electron Microscopy Sciences | 15710 | Formaldehyde is toxic; it should be handled in a fume hood with skin and eye protection. |
| PBS | KD Medical | RGF-3190 | |
| BSA | Sigma | A7030 | |
| Triton X-100 | Sigma | T9284 | |
| Click-iT EdU Alexa Fluor 488 Imaging Kit | Invitrogen | C10337 | EdU, CuSO4, Alexa Fluor 488 azide, EdU reaction buffer and Edu buffer additive are included |
| Mouse ATP synthase subunit α antibody, (15H4C4) | MitoSciences | Ab14748 | 1:1,000 dilution |
| Mouse Hts antibody (clone RC) | Developmental Studies Hybridoma Bank (DSHB) | hts RC | 1:1,000 dilution |
| Goat anti-mouse Alexa Fluor 568 secondary antibody | Invitrogen | A-11004 | 1:200 dilution |
| Vectashield mounting medium with DAPI | Vector Laboratories | H-1500 | |
| Glass coverslips, #1.5 22 mm x 22 mm | Fisher Scientific | 12-541-B | |
| Microscope slide | Fisher Scientific | 22-038-103 | |
| Nail polish | Elf | Many of the pigments used in nail polishes are fluorescent and leach into specimens. Only clear nail polish should be used. |
Referenzen
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nat Rev Genet. 6 (5), 389-402 (2005).
- Wallace, D. C., Chalkia, D. Mitochondrial DNA genetics and the heteroplasmy conundrum in evolution and disease. Cold Spring Harb Perspect Biol. 5 (11), a021220 (2013).
- Spradling, A. C. . The development of Drosophila melanogaster. , (1993).
- Riechmann, V., Ephrussi, A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev. 11 (4), 374-383 (2001).
- Lin, H., Yue, L., Spradling, A. C. The Drosophila fusome, a germline-specific organelle, contains membrane skeletal proteins and functions in cyst formation. Development. 120 (4), 947-956 (1994).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J Cell Biol. 135 (4), 883-893 (1996).
- Iborra, F. J., Kimura, H., Cook, P. R. The functional organization of mitochondrial genomes in human cells. BMC Biol. 2, (2004).
- Rakic, P. Neurogenesis in adult primate neocortex: an evaluation of the evidence. Nat Rev Neurosci. 3 (1), 65-71 (2002).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U S A. 105 (7), 2415-2420 (2008).
- Hill, J. H., Chen, Z., Xu, H. Selective propagation of functional mitochondrial DNA during oogenesis restricts the transmission of a deleterious mitochondrial variant. Nat Genet. 46 (4), 389-392 (2014).
- Lentz, S. I., et al. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In Vitro. Journal of Histochemistry & Cytochemistry. 58 (2), 207-218 (2010).
- Tornoe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(i)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J Org Chem. 67 (9), 3057-3064 (2002).
- Horwitz, H. B., Holt, C. E. Specific inhibition by ethidium bromide of mitochondrial DNA synthesis in physarum polycephalum. J. Cell Biol. 49, 546-553 (1971).
- Huberman, J. A. New views of the biochemistry of eucaryotic DNA replication revealed by aphidicolin, an unusual inhibitor of DNA polymerase alpha. Cell. 23 (3), 647-648 (1981).
- McClung, C., Hirsh, J. Stereotypic behavioral responses to free-base cocaine and the development of behavioral sensitization in Drosophila. Curr Biol. 8 (2), 109-112 (1998).
- Moore, M. S., et al. Ethanol intoxication in Drosophila: Genetic and pharmacological evidence for regulation by the cAMP signaling pathway. Cell. 93 (6), 997-1007 (1998).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Gamma-aminobutyric acid B receptor 1 mediates behavior-impairing actions of alcohol in Drosophila: adult RNA interference and pharmacological evidence. Proc Natl Acad Sci U S A. 100 (9), 5485-5490 (2003).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell Tissue Res. 228 (1), 21-32 (1983).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten