Method Article
In Situ etichettatura di DNA mitocondriale di replica in Drosophila adulti ovaie di Edu colorazione
In questo articolo
Riepilogo
Drosophila oogenesis continues to be exceptionally useful in the study of mitochondrial proliferation and inheritance. This manuscript describes a detailed protocol used to label the replicating mitochondrial DNA (mtDNA) in Drosophila adult ovaries with 5-ethynyl-2´-deoxyuridine (EdU), which facilitates uncovering mechanisms associated with mitochondrial inheritance that were previously debatable.
Abstract
The mitochondrial genome is inherited exclusively through the maternal line. Understanding of how the mitochondrion and its genome are proliferated and transmitted from one generation to the next through the female oocyte is of fundamental importance. Because of the genetic tractability, and the elegant, ordered simplicity by which oocyte development proceeds, Drosophila oogenesis has become an invaluable system for mitochondrial study. An EdU (5-ethynyl-2´-deoxyuridine) labeling method was utilized to detect mitochondrial DNA (mtDNA) replication in Drosophila ovaries. This method is superior to the BrdU (5-bromo-2'-deoxyuridine) labeling method in that it allows for good structural preservation and efficient fluorescent dye penetration of whole-mount tissues.
Here we describe a detailed protocol for labeling replicating mitochondrial DNA in Drosophila adult ovaries with EdU. Some technical solutions are offered to improve the viability of the ovaries, maintain their health during preparation, and ensure high-quality imaging. Visualization of newly synthesized mtDNA in the ovaries not only reveals the striking temporal and spatial pattern of mtDNA replication through oogenesis, but also allows for simple quantification of mtDNA replication under various genetic and pharmacological perturbations.
Introduzione
Inoltre genoma nucleare, ogni cellula eucariotica contiene anche migliaia di copie di DNA circolare piccolo nella matrice mitocondriale. Mentre il DNA mitocondriale (mtDNA) codifica subunità essenziali della catena di trasporto degli elettroni, la maggioranza del proteoma mitocondriale, compresi tutti i fattori per la replicazione e trascrizione del mtDNA sono codificati dal genoma nucleare. In contrasto con il genoma nucleare che segue le leggi di Mendel dell'ereditarietà, il genoma mitocondriale animale viene ereditato esclusivamente attraverso la linea materna. Pertanto, la comprensione di come mtDNA è proliferato e trasmessa da una generazione a quella successiva attraverso l'ovocita femminile è di fondamentale importanza. Tuttavia, vi è continuo dibattito su come replicazione del mtDNA è regolata nella linea germinale femminile. Inoltre, la teoria collo di bottiglia mtDNA ampiamente accettata per la trasmissione del mtDNA suggerisce che la popolazione di mtDNA in cellule germinali primordiali è un sotto-campione di un numero relativamente piccolo during di sviluppo 1 2. Ciò implica anche che la replicazione del DNA mitocondriale è temporalmente e spazialmente regolamentato durante oogenesis. Quindi, il rilevamento in situ di replicazione del mtDNA durante lo sviluppo germline faciliterà la comprensione del meccanismo di mtDNA ereditarietà.
Drosophila oogenesi fornisce un sistema geneticamente trattabili per studiare la replicazione del DNA mitocondriale e la trasmissione. In ciascuna delle due ovaie Drosophila, ci sono 16-20 stringhe indipendenti di camere uovo chiamati ovarioli 3, che sono le unità funzionali di produzione di uova (vedere Figura 1A). Ogni ovariole contiene un'organizzazione lineare progressiva dell'oogenesi, dove la punta anteriore è composto da una struttura chiamata germarium. Il germarium è ulteriormente suddiviso in quattro regioni che contengono le cellule germinali in fasi di sviluppo differenti. Nella regione 1, le cellule staminali germinali passare attraverso la divisione asimmetrica per produrre cellule figlie noto come cystoblasts. Regione 2a contiene i cystoblasts che hanno completato la loro divisione finale. Cystoblasts sottoposti a quattro cicli di divisione che produce gruppi di 16 cellule. I 16 cellule rimangono collegati tra loro da ponti citoplasmatici chiamati canali anello. Solo una delle celle impegna a differenziazione ovocita, mentre l'altro 15 sviluppano come cellule infermiere poliploidi. Una struttura essenziale citoplasmatica, noto come fusome, si propone di agevolare la formazione di canali anello, determinare la polarità cisti e l'infermiera interazioni cellula-ovociti 4,5. Poiché le cisti muovono verso regione 2b, le strutture cisti coprono l'intera larghezza della germarium, e diventano più associati con cellule follicolari. Le strutture germarium terminano con la regione 3 contenente la prima camera uovo in erba. Successivamente, le camere d'uovo vengono assemblate alla fine posteriore della germarium, che il progresso attraverso il ovariole in 14 tappe morfologicamente distinte. La crescita di ovociti dipende dalle cellule infermiere, which proteine di trasporto, mRNA e strutture endomembrane (ad esempio, Golgi) tramite i canali ad anello nel citoplasma dell'ovocita. Durante Drosophila oogenesi, si è constatato che una frazione dei mitocondri all'interno di ogni cisti di 16 cellule sono stati associati con il fusome, mosso attraverso i canali ad anello e sono stati consegnati nel singolo ovocita in una grande massa chiamato Balbiani corpo 6. Questo fenomeno è stato proposto di contribuire al controllo della qualità di eredità mitocondriale attraverso ovaie femminili.
Rilevazione della sintesi del DNA mitocondriale si basa sulla costituzione dei precursori del DNA marcati nel DNA cellulare. Tradizionalmente, un analogo nucleosidico della timidina 5-bromo-2'-deossiuridina (BrdU) è stato utilizzato per etichettare la replicazione del mtDNA in cellule di coltura dei tessuti 7,8. Tuttavia, l'etichettatura BrdU a base di anticorpi presenta diverse limitazioni, soprattutto per tutto il montaggio colorazione dei tessuti. Uno dei principali svantaggi di etichettatura BrdU è che richiede denaturazione del DNA per esporrel'epitopo BrdU, in modo che possa essere rilevato dal anticorpo anti-BrdU. Il campione deve essere trattato in condizioni denaturanti duri quali sostanze chimiche (ad esempio, acido cloridrico o miscele di metanolo e acido acetico), calore o digestione con DNasi che potrebbero interrompere la struttura del campione e complicare la seguente procedura di colorazione 9, 10.
Qui, in alternativa timidina analogico 5-etinil-2'-deossiuridina (EdU) viene utilizzato per etichettare il DNA mitocondriale replicare in Drosophila ovaie adulte. Questo metodo è più veloce e altamente sensibile. EdU è facilmente incorporato nel DNA cellulare durante la replicazione del DNA. La seguente rilevamento si basa su una reazione "click", un Cu (I) -catalyzed reazione covalente tra il gruppo alchino terminale e una azide fluorescente 10. Poiché la reazione non richiede la denaturazione del campione, permette una buona conservazione strutturale. Inoltre, la dimensione di colorante unZide è soltanto 1/500 di quella di una molecola anticorpale 10, che consente la penetrazione veloce ed efficiente dei tessuti tutto il montaggio. Abbiamo usato questo metodo per rilevare la replicazione del mtDNA durante Drosophila oogenesis e ha trovato un modello spaziale sorprendente nella regione germarium di Drosophila dell'ovaio 11, che ci portano a proporre un meccanismo di ereditarietà del mtDNA selettivo replica-dipendente. Presentiamo qui un protocollo dettagliato sull'etichettatura EdU di replicazione del mtDNA in ovaie di Drosophila. Per dimostrare l'applicazione del protocollo, abbiamo provato anche la replicazione del mtDNA in un mtDNA mutante Drosophila (mt: COI T300I) 11, nonché con il trattamento diversificato di uncouplers mitocondriali, che dissipano il potenziale di membrana mitocondriale e potenzialmente interrompono replicazione del mtDNA.
Protocollo
1. Tessuto Raccolta e dissezione
- In ogni flacone contenente lievito secco, cultura 10 femmina adulta vola con 10 maschi per 2-3 giorni.
Nota: Mantenere le mosche di sesso femminile ben nutriti migliorerà la qualità complessiva e la resa della produzione ovarica e facilitare la dissezione. - Anestetizzare la femmina vola su un anidride carbonica (CO 2) vola pad.
- Sotto lo stereoscopio, mettere alcune gocce di media RT (media Drosophila Schneider integrato con siero fetale bovino al 10% (FBS)) su un rilievo da dissezione. Condurre tutte le procedure di dissezione nel mezzo per mantenere in vita e in buona salute i tessuti.
- Afferra una femmina ingrassato mosca con una pinza sottile dal naso taglienti al suo torace inferiore. Utilizzare un altro set di pinze per tirare delicatamente all'estremo posteriore del volo fino a quando i tessuti nell'addome sono esposti. Staccare le due ovaie da altri tessuti (ad esempio budella).
Nota: ogni display ovaio una struttura opaca che è componed di 16-20 ovarioli allegati. - Per migliorare la penetrazione dei reagenti, aprire le ovaie tirando loro parte e passando le punte della pinza tra ogni ovariole un paio di volte. Mantenere le ovarioli collegati all'interno di un ovaio per minimizzare la perdita dei tessuti durante le seguenti procedure.
- Trasferire le ovaie subito in una provetta da 1,5 ml microcentrifuga contenente 500 ml di mezzo di Drosophila di Schneider con il 10% FBS.
- Ripetere la dissezione e raccogliere 10-15 ovaie in ogni provetta.
2. EdU Labeling
- Aspirare il mezzo in ogni tubo, e sostituirlo con 500 ml di mezzo di Drosophila di Schneider con il 10% FBS contenente 7 micron afidicolina.
Nota: afidicolina viene utilizzato per bloccare la sintesi del DNA nucleare, inibendo DNA polimerasi α senza influenzare la replicazione del mtDNA 7, 12. È possibile aumentare la concentrazione afidicolina finoa 70 mM per ottenere una migliore inibizione. La soluzione madre di 3-30 mM afidicolina in DMSO può essere conservato al buio a -20 ° C per un massimo di 6 settimane. - Per mantenere le ovaie sani, in modo che essi sono immersi in soluzioni durante il cambio del mezzo. Utilizzare medio Drosophila Schneider con il 10% FBS fino al passo 2.6.
- Incubare ovaie per 3 ore a temperatura ambiente su una sedia a dondolo da banco con rotazione delicata.
- Per il trattamento della droga, per esempio, mitocondriale sganciamento carbonile cianuro fenilidrazone 4 trifluoromethoxy (FCCP), aggiungere la concentrazione adeguata di farmaci (ad esempio, 10 micron FCCP) nel mezzo, dopo 2 ore di trattamento afidicolina. Continuare l'incubazione per un altro 1 ora.
- Rimuovere il contenente afidicolina mezzo con o senza farmaci. Brevemente risciacquare le ovaie con media (afidicolina non è necessario) due volte.
- Aggiungere 1 ml di mezzo contenente 10 mM EdU e 7 micron afidicolina e continuare incubating a temperatura ambiente per 2 ore. Conservare la soluzione 10 mM EdU disponibile (DMSO) a -20 ° C.
- Rimuovere il terreno contenente EdU e afidicolina. Lavare con medio (senza afidicolina) due volte per 3 minuti ciascuno.
3. Fissazione dei tessuti e permeabilizzazione
- Preparare una soluzione di paraformaldeide al 4% in tampone fosfato (PBS, pH 7,4).
Nota: Abbiamo usato paraformaldeide disponibile commerciale memorizzati in fiale pre-segnato. Aprire una nuova ampolla e diluire al 4% prima dell'uso.
ATTENZIONE: La formaldeide è tossica; esso dovrebbe essere gestito in una cappa aspirante con la pelle e protezione per gli occhi. - Fissare ovaie con 4% paraformaldeide per 20 minuti a RT con rotazione dolce.
- Rimuovere il fissativo e lavare ovaie due volte in 1 ml di 3% BSA in PBS per 5 minuti ogni volta.
- Per permeabilize i tessuti, rimuovere la soluzione di lavaggio e aggiungere 1 ml di 0,5% Triton X-100 in PBS. Incubare a temperatura ambiente per 20 min.
- Rimuovere la soluzione permeabilizzazione e lavare due volte in 1 mldel 3% BSA in PBS.
4. Individuazione EdU
Nota: EdU rilevamento si basa sulla chimica "click", un Cu (I) -catalyzed [3 + 2] cicloaddizione 13, che aggiunge azidi fluorescenti al gruppo alchino terminale EdU, e la molecola fluorescente viene sottoposto a successiva rivelazione. Poiché Cu (I), che è facilmente ossidato a specie non catalitici Cu (II), è necessario per catalizzare la reazione, si raccomanda di ridurre la (II) solfato Cu in situ per ottenere Cu (I). Cioè, Cu (II) solfato viene utilizzato in presenza di un riducente come l'acido ascorbico (qui il "buffer additivo") per generare il rame (I).
- Prima dell'esperimento, preparare la soluzione di lavoro del azide Alexa Fluor (Alexa Fluor 488 azide, Alexa Fluor 555 azide o altri, a seconda del fluoroforo preferita, che prendono il nome di "dye azide" di seguito), tampone di reazione EdU e tampone EdU additivo secondo il fornitore diistruzioni.
- Ricostituire il colorante azide in 70 ml di DMSO. Conservare la soluzione di lavoro a -20 ° C fino a 1 anno.
- Preparare tampone fresco reazione EdU diluendo il tampone di reazione 10x EdU con acqua deionizzata.
Nota: Dopo l'uso, conservare qualsiasi soluzione 1x rimanendo a 4 ° C. La soluzione 1x è stabile per un massimo di 6 mesi. - Fare una soluzione 10x magazzino del buffer additivo EdU sciogliendo completamente la polvere in 2 ml di acqua deionizzata.
Nota: Questa soluzione madre è stabile fino a 1 anno a -20 ° C. Se la soluzione si sviluppa un colore marrone, si è degradato e deve essere scartato.
- Preparare il cocktail reazione EdU nuovo ogni volta, ed utilizzare entro 15 minuti dalla preparazione. Per ottenere risultati riproducibili, assicurarsi che i componenti della reazione sono mantenuti agli stessi rapporti.
- Fare fresco 1x EdU tampone soluzione additiva diluendo la soluzione di 10x magazzino (preparata al punto 4.1.3) 1:10 in acqua deionizzata. Utilizzare questo soluzione lo stesso giorno.
- Preparare 1 ml di EdU cocktail reazione combinando i seguenti ingredienti in ordine: 860 microlitri di buffer 1x EdU reazione, 40 microlitri CuSO 4, 2,5 ml di tintura azide, 100 ml 1x EdU buffer di additivo.
Nota: È importante che gli ingredienti vengono aggiunti al fine di garantire prestazioni ottimali.
- Rimuovere il PBS con il 3% di BSA e aggiungere 0,5 ml di cocktail reazione EdU ad ogni provetta. Incubare a temperatura ambiente per 30 min con rotazione dolce. Mantenere i campioni al riparo dalla luce.
- Rimuovere il cocktail reazione EdU e lavare una volta con 1 ml di 3% di BSA in PBS.
- Lavare i campioni una volta con 1 ml di PBS.
5. anticorpo etichettatura
Nota: eseguire l'etichettatura degli anticorpi dopo EdU colorazione. Se nessuna colorazione aggiuntiva si desidera, si può procedere al montaggio e di imaging direttamente. È importante che i campioni siano protetti dalla luce in tutte le seguenti procedure.
- Rimuovere la soluzione di lavaggio. Bloccare le ovaie in 1 ml di soluzione bloccante contenente 0,2% di BSA e 0,1% Triton X-100 in PBS per 30 min.
- Rimuovere la soluzione di saturazione e sostituirlo con l'anticorpo primario diluito in soluzione bloccante (ad esempio, il mouse ATP sintetasi subunità α anticorpi, 1: 1000 diluizione). Incubare al buio a 4 ° CO / N.
- Lavare i campioni di 1 ml di soluzione bloccante 3 volte, 10 minuti ogni volta. Per ridurre al minimo lo sfondo, lavare altre due volte per 30 minuti ciascuno. Rimuovere la soluzione di saturazione.
- Incubare con anticorpo secondario diluito in soluzione bloccante (per esempio, di capra anti-topo Alexa Fluor 568 anticorpo secondario, diluizione 1: 200) per 2 ore a temperatura ambiente.
Nota: Utilizzare un colore diverso da quello accoppiato ad edu. - Ripetere le fasi di lavaggio eseguiti in fase 5.3.
- Lavare con 1 ml di PBS, una volta per rimuovere il detergente.
6. Montaggio e Imaging
- Rimuovere con attenzione tutto il PBS e immediatamente coprire le ovaie con 50 ml mezzo di montaggio (con o senza DAPI).
Nota: utilizzare un mezzo di montaggio che non indurisce mentre i ovarioli vengono separati l'uno dall'altro. Ovaie possono essere memorizzati in un mezzo di montaggio a 4 ° C per una settimana. - Tagliare l'estremità di un puntale e utilizzarlo per trasferire accuratamente ovaie su un vetrino da microscopio.
- Completamente separata ogni ovariole con una pinza sottile dal naso taglienti allo stereomicroscopio. Rimuovere i tessuti che collegano alla fine posteriore e la fase 14 o camere uovo maturo. I giovani camere uova sono alla fine anteriore e trasparente.
- Allineare le camere d'uovo con una pinza in modo che non si sovrappongano tra loro.
- Lentamente abbassare vetrino coprioggetti # 1.5 sulla cima dei campioni. Lasciare che il mezzo di montaggio per polimerizzare per diverse ore a temperatura ambiente. Sigillare con smalto trasparente.
- Immagine scivola il giorno dopo, o conservare a 4 ° C prima di imaging.
- Visualizza sotto a mi confocalecroscope con un obiettivo ad immersione in olio 63X. Cattura immagini tridimensionali z-stack.
Nota: Vi è una forte EdU segnale in camere d'uovo in seguito allo stadio e fluorescenza di fondo nella guaina epiteliale. Nell'esaminare etichettatura EdU in un particolare germarium, si dovrebbe evitare germariums che si sovrappongono da o vicino ad altri tessuti o camere d'uovo in seguito allo stadio.
Risultati
Il protocollo di cui sopra permette la visualizzazione delle strutture puntiformi associate con i mitocondri (Figura 1B-C), che indicano la replicazione del DNA mitocondriale durante Drosophila oogenesis. Il puncta EdU localizzato con mitocondri segnati da macchie di ATP sintetasi subunità alfa (Figura 2). I segnali osservati erano assenti in ovaie trattati con bromuro di etidio 11, un inibitore per la replica mtDNA 14, convalidando che questi puncta effettivamente etichetta replicare mtDNA.Aphidicolin stato usato per inibire la colorazione del DNA nucleare senza influire replicazione del mtDNA (Figura 2). Senza trattamento afidicolina, intensi segnali EdU etichettare i nuclei, e mtDNA puncta erano appena rilevati (Figura 3). Tuttavia, in presenza di afidicolina, incorporazione nucleare fu drasticamente ridotto e sono stati osservati numerosi puncta associati mitocondri.
C'è un alto livello di replicazione del mtDNA in camere d'uovo post-germarium (Figura 1B). Tuttavia, in particolare, la replicazione del mtDNA visualizzato un modello spaziale nel germarium. Come indicato dal numero di EdU puncta, c'è un livello moderato di replicazione del mtDNA nella regione 1 del germarium, ma quasi nessun EdU incorporazione nella regione 2A (Figura 1C). Come la cisti muove verso il basso a regione 2B in germarium, replicazione del mtDNA ripreso e il numero di EdU puncta nella cisti posteriore della regione 2B è molto superiore a quello della regione 2A (Figura 1C). In particolare, intensa incorporazione EdU si è concentrata intorno ai canali ad anello e le strutture fusome, come macchiato dal hu li tai shao proteine (HTS). mtDNA mantenuto replica ad un livello elevato nella regione 3 della germarium (Figura 1C)
Per dimostrare l'associazione di specifgeni o il trattamento con la proliferazione mtDNA ic, ovaie Drosophila potrebbero essere sottoposti a manipolazione genetica o di trattamento farmacologico. Abbiamo trattato ovaie con differenti concentrazioni di FCCP, un protonophore mitocondriale classico, che dissipa potenziale di membrana mitocondriale. Come controllo, DMSO non ha effetto sulla replicazione del mtDNA (Figura 4A). Alte dosi di FCCP (10 micron) quasi esaurite replicazione del mtDNA interamente in tutto il germarium (Figura 4D). Tuttavia, la concentrazione più bassa di FCCP (2 o 5 mM) ha avuto un impatto minimo sulla replicazione del mtDNA nella regione 1 ma la replica inibito nelle regioni 2B e 3 (Figura 4B-C), suggerendo regioni 2B e 3 sono più sensibili alle perturbazioni mitocondriale, o mantengono relativi cinetica di replica più lenti. I risultati di cui sopra hanno indicato che la replicazione del DNA mitocondriale è associata con l'attività mitocondriale. In particolare, diverse regioni del germarium risposto diversamente a imp mitocondrialeairment.
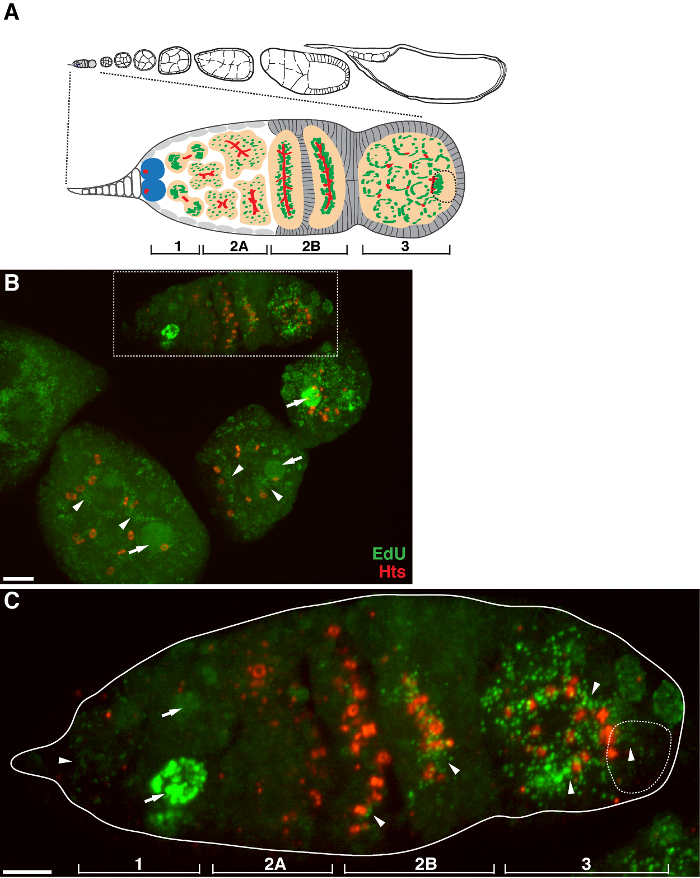
Figura 1. replicazione del mtDNA durante Drosophila oogenesis. (A) Schema di un ovariole Drosophila e una vista ingrandita del germarium. Il ovariole illustra da sinistra a destra, anteriore a posteriore, successive fasi di sviluppo di camere di uovo. Nel germarium, il fusome (rosso), le cellule staminali germinali (blu), i mitocondri (verdi), ovocita futuro (linea tratteggiata, riconosciuto dal posizionamento, la struttura fusome e cluster mitocondriali), lo sviluppo di cisti (pesca) e quattro regioni di sviluppo sono mostrati . (B) Rappresentante proiezione z-stack di una wild-type ovariole etichettati da EdU e anticorpi contro HTS-RC, un marker per i canali ad anello e fusome. In presenza di afidicolina, EDU è stata incorporata nel DNA mitocondriale (punte di freccia) e nuclei (frecce). barra della scala, 10 micron.(C) Visualizzazione ingrandita della germaria delineati nella regione scatola in B. Le quattro regioni di sviluppo sono indicati. Barra della scala, 5 micron 11. Cliccate qui per vedere una versione più grande di questa figura.
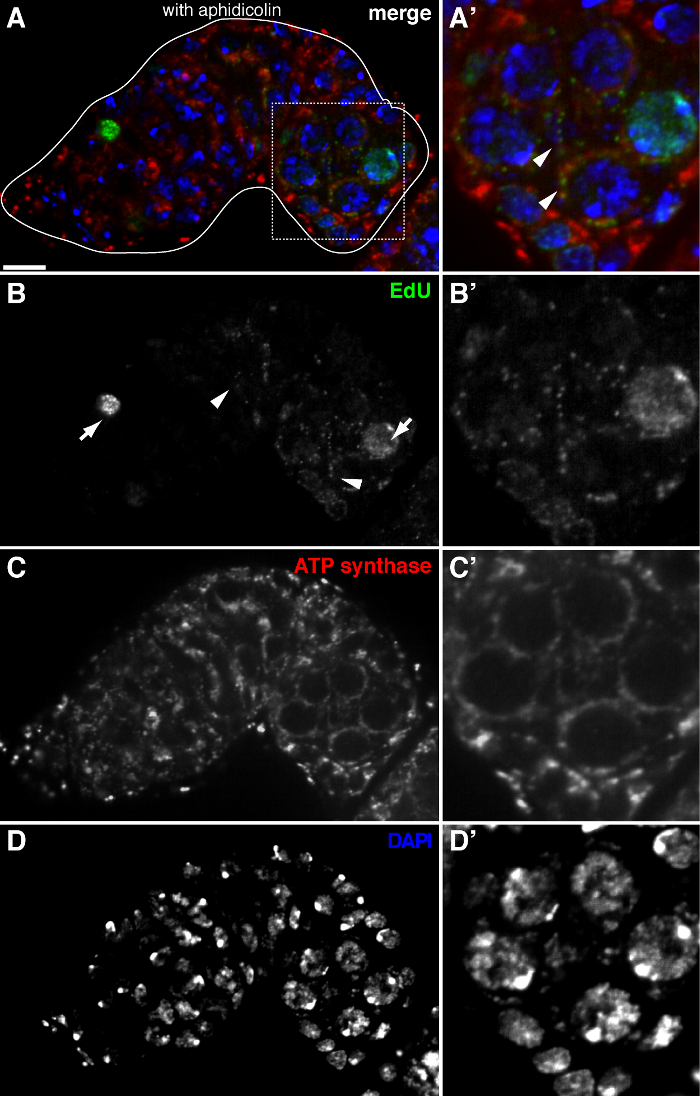
Figura 2. replicazione del mtDNA nel germarium Drosophila visualizzato da Edu incorporazione con trattamento afidicolina (A) -. Sezione confocale rappresentante di un tipo germarium selvaggio che mostra EdU incorporazione (D) (verde, b), i mitocondri, segnata da ATP sintetasi subunità alfa colorazione (rosso, C), e nuclei, marcato con colorazione DAPI (blu, D) con pre-incubazione con DNA polimerasi inibitore-α afidicolina. (A &# 39 ;-D ') un'immagine ingrandita della zona in scatola in (A) mostrando EdU incorporazione (B'), i mitocondri (C ') e nuclei (D'). In presenza di afidicolina, incorporazione nucleare (frecce) si riduce e molti puncta sono stati localizzati all'interno dei mitocondri (punte di freccia). Barre di scala, 10 micron. Il dato è stato modificato da 11. Si prega di cliccare qui per vedere una versione più grande di questa figura.
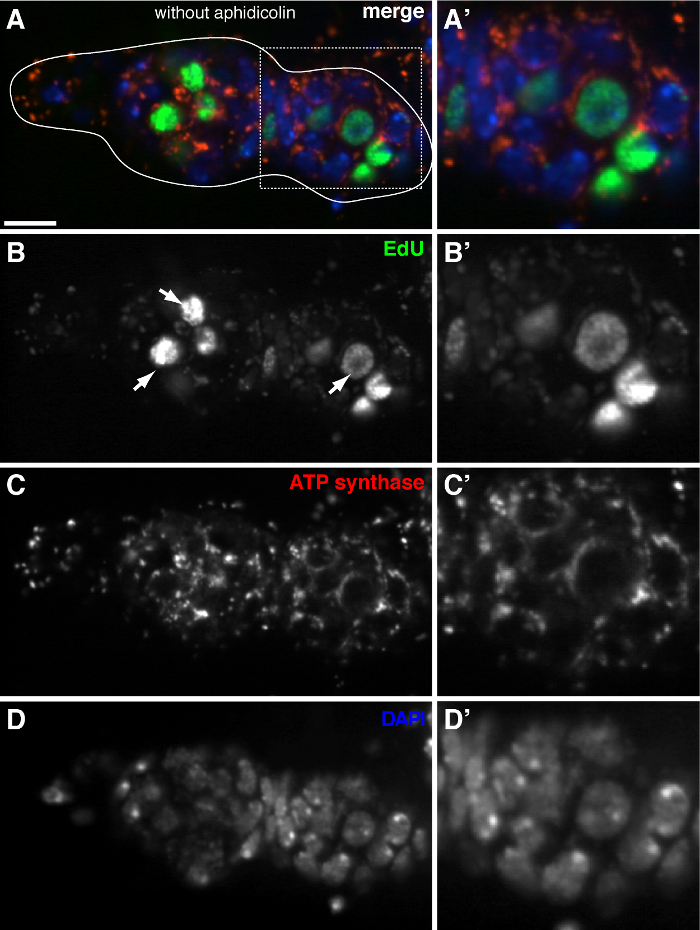
Figura 3. replica del DNA mitocondriale è appena rilevato nel germarium Drosophila senza trattamento afidicolina (A) -. (D) Sezione confocale rappresentante di un tipo germarium selvaggio che mostra EdU incorporazione (verde), i mitocondri, segnata daATP sintasi subunità alfa colorazione (rosso), e nuclei, marcato con colorazione DAPI (blu) in assenza del afidicolina DNA polimerasi inibitore-α. 'Immagine A ingrandita della zona in scatola in (A) mostra EdU incorporazione (B (A'-D)'), mitocondri (C ') e nuclei (D'). Senza afidicolina, intensi segnali EdU etichetta nuclei (frecce), e mtDNA puncta erano appena rilevati. Barre di scala, 10 micron. Il dato è stato modificato da 11. Si prega di cliccare qui per vedere una versione più grande di questa figura.
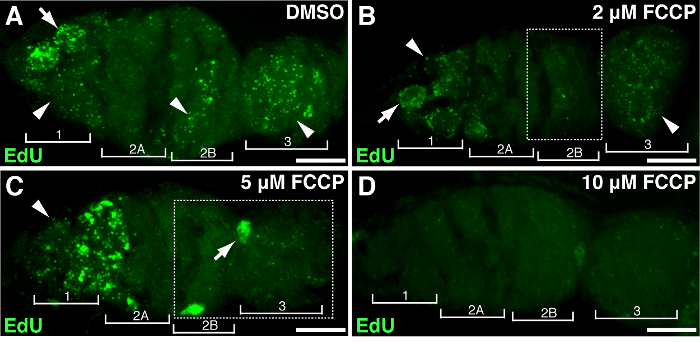
Figura 4. mitocondriale sganciamento danneggia la replicazione del mtDNA. Progetti z-stack rappresentativi mostrano wild-type germarium trattati con DMSO(A) o il FCCP disaccoppiatore mitocondriale a concentrazioni di 2 mM (B), 5 mM (C), 10 mM (D) durante EdU incorporazione. Si noti l'etichettatura EdU alterata nella regione 2B trattati con 2 mM FCCP (B), e in entrambi regione 2B e 3 trattati con 5 micron FCCP (descritto in scatole). Quattro regioni di sviluppo sono mostrati. Frecce, DNA nucleare; punte di freccia, mtDNA. barra della scala, 10 micron. Il dato è stato modificato da 11. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
etichettatura EdU è un nuovo metodo ed efficiente per rilevare la sintesi del DNA in cellule proliferanti, che si basa sulla costituzione e la colorazione di analoghi nucleosidici nel DNA di nuova sintesi. Questo metodo è superiore al metodo di etichettatura BrdU in quanto è più veloce e altamente sensibile. Ancora più importante, permette di buona conservazione strutturale e penetrazione edu-dye efficiente di tutto il montaggio tessuti 9, 10. Storicamente, come un'alternativa superiore per l'etichettatura BrdU, etichettatura EdU è stato utilizzato per studiare la replicazione del DNA nucleare durante la fase S del ciclo cellulare. Afidicolina è un inibitore della DNA polimerasi α, che è la polimerasi principale per la replicazione del DNA nucleare in fase S 12 15. replicazione del mtDNA viene effettuata da DNA polimerasi γ, che è insensibile ai afidicolina trattamento. Quindi, il trattamento con afidicolina prima e durante l'incubazione EdU significativamente inibito EdU incorporazione nel DNA nucleare. Dovrebbenotato che afidicolina può essere stabile per diverse settimane se opportunamente conservato, e l'efficacia di afidicolina nell'inibire la replicazione del DNA nucleare era variabile nelle nostre mani. I ovarioli o camere d'uovo con una forte etichettatura DNA nucleare dovrebbero essere esclusi dalla analisi di ulteriori dati.
replicazione del mtDNA può essere facilmente visualizzato come puncta nel citoplasma, che offre anche un modo semplice per quantificare il livello di replicazione del mtDNA contando il numero di EdU puncta, normalizzata al volume totale di citoplasma. software di imaging può essere applicato a identificare automaticamente EdU puncta nelle immagini microscopiche, il che è particolarmente utile per le analisi computazionali di grandi insiemi di dati. Tuttavia, dovrebbero essere prese precauzioni, in quanto l'inibizione incompleta della replicazione del DNA nucleare può portare alla costituzione EdU in loci distinti sul cromosoma e visualizzare come puncta all'interno del nucleo. Anche in altri casi, l'intensità della EdU incorporazione in replicolata mtDNA potrebbe essere debole, mentre lo sfondo e il rumore potrebbe essere elevato. Pertanto, i singoli parametri per analisi automatica delle immagini devono essere attentamente definiti. Si raccomanda inoltre che le immagini devono essere esaminati con gli occhi addestrati per fare in modo che una corretta puncta EdU sono identificati.
Visualizzazione di nuova sintesi mtDNA durante Drosophila oogenesis offre l'opportunità di indagare come la replicazione del DNA mitocondriale è regolata in condizioni fisiologiche o patologiche, svolgendo l'esperimento in mosche sottoposti a una serie di perturbazioni farmacologici o genetici. In uno studio precedente, saggio di incorporazione EdU è stato eseguito in un mtDNA mutante Drosophila mt: COI T300I 11. Inoltre, per interrompere il potenziale di membrana mitocondriale, ovaie sono state trattate con varie concentrazioni di mitocondriale FCCP disaccoppiatore o 2,4-dinitrofenolo (DNP) prima EdU incorporazione. A seconda dei fini sperimentalie le caratteristiche di droga, metodi diversi potrebbero essere adottate per la consegna efficace. Per mosche adulte, farmaci possono essere presentati in forma di vapore (per esempio, etanolo e cocaina) 16,17 o farmaci possono essere iniettati nell'addome, dove diffonde rapidamente in tutto il corpo 18. La pratica più comune è che i farmaci siano aggiunti all'alimento mosca o una carta da filtro di saccarosio / farmaco-saturo. Ad esempio, l'inibitore di assemblaggio dei microtubuli, colchicina, è stato alimentato a mosche per 2-3 giorni prima della dissezione ovaio 19. Quindi, è importante valutare il metodo drug delivery e selezionate concentrazioni appropriate.
Per garantire il successo di imaging di replicazione del mtDNA in ovaie di Drosophila, diversi passaggi critici devono essere eseguiti con cura. Primo, preservando la vitalità e la salute delle ovaie durante la dissezione e EdU incorporazione è essenziali (punti 1 e 2). Medio Drosophila della Schneider con FBS ha bisogno di essere riscaldato a RTprima dell'uso. Uno dovrebbe ridurre al minimo il contatto diretto tra le camere d'uovo e strumenti di dissezione o puntali delle pipette. Le ovaie dovrebbero essere immerso sotto soluzioni tutti i tempi per evitare la disidratazione. Cattiva gestione i tessuti possono facilmente portare a svenire o segnali fluorescenti. Durante la fase di montaggio dei tessuti, ovarioli dovrebbero essere separati l'uno dall'altro e sparsi sul vetrino da microscopio. Assicurarsi che le camere di uova non sono impilati uno sopra l'altro. Abbiamo notato che le camere a base di uova al di là di fase 14 visualizzati po 'incorporazione edu. Inoltre, a causa delle grandi dimensioni, le camere di uovo fase avanzata spesso causano vicine camere uovo più giovani di essere fuori fuoco. Pertanto si raccomanda che le camere fase tardiva uovo essere scartati.
Qui forniamo un protocollo dettagliato per l'etichettatura replicare mtDNA in Drosophila ovaie adulte. Questo metodo consente la semplice quantificazione di replicazione del mtDNA sotto varie perturbazioni genetiche e farmacologiche,e sarà utile per la dissezione meccanismi alla base dello sviluppo biogenesi mitocondriale e mtDNA eredità.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We thank K. Delaney for comments on the manuscript. This work was supported by the National, Heart, Lung, and Blood Institute (NHLBI) Intramural Program.
Materiali
| Name | Company | Catalog Number | Comments |
| Schneider’s Drosophila medium | Invitrogen | 21720-024 | |
| FBS | Invitrogen | 10100-147 | |
| Pair of Dumont #5 Forceps | Fine Science Tools | 11252-20 | |
| Aphidicolin | Sigma | A0781 | Aliquot after dissolving in DMSO. Avoid repetitive thawing and freezing. Protect from light. May be used within 6 weeks after dissolving. |
| FCCP | Sigma | C2920 | |
| DMSO | Sigma | D2650 | |
| Paraformaldehyde, 16% EM grade | Electron Microscopy Sciences | 15710 | Formaldehyde is toxic; it should be handled in a fume hood with skin and eye protection. |
| PBS | KD Medical | RGF-3190 | |
| BSA | Sigma | A7030 | |
| Triton X-100 | Sigma | T9284 | |
| Click-iT EdU Alexa Fluor 488 Imaging Kit | Invitrogen | C10337 | EdU, CuSO4, Alexa Fluor 488 azide, EdU reaction buffer and Edu buffer additive are included |
| Mouse ATP synthase subunit α antibody, (15H4C4) | MitoSciences | Ab14748 | 1:1,000 dilution |
| Mouse Hts antibody (clone RC) | Developmental Studies Hybridoma Bank (DSHB) | hts RC | 1:1,000 dilution |
| Goat anti-mouse Alexa Fluor 568 secondary antibody | Invitrogen | A-11004 | 1:200 dilution |
| Vectashield mounting medium with DAPI | Vector Laboratories | H-1500 | |
| Glass coverslips, #1.5 22 mm x 22 mm | Fisher Scientific | 12-541-B | |
| Microscope slide | Fisher Scientific | 22-038-103 | |
| Nail polish | Elf | Many of the pigments used in nail polishes are fluorescent and leach into specimens. Only clear nail polish should be used. |
Riferimenti
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nat Rev Genet. 6 (5), 389-402 (2005).
- Wallace, D. C., Chalkia, D. Mitochondrial DNA genetics and the heteroplasmy conundrum in evolution and disease. Cold Spring Harb Perspect Biol. 5 (11), a021220 (2013).
- Spradling, A. C. . The development of Drosophila melanogaster. , (1993).
- Riechmann, V., Ephrussi, A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev. 11 (4), 374-383 (2001).
- Lin, H., Yue, L., Spradling, A. C. The Drosophila fusome, a germline-specific organelle, contains membrane skeletal proteins and functions in cyst formation. Development. 120 (4), 947-956 (1994).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J Cell Biol. 135 (4), 883-893 (1996).
- Iborra, F. J., Kimura, H., Cook, P. R. The functional organization of mitochondrial genomes in human cells. BMC Biol. 2, (2004).
- Rakic, P. Neurogenesis in adult primate neocortex: an evaluation of the evidence. Nat Rev Neurosci. 3 (1), 65-71 (2002).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U S A. 105 (7), 2415-2420 (2008).
- Hill, J. H., Chen, Z., Xu, H. Selective propagation of functional mitochondrial DNA during oogenesis restricts the transmission of a deleterious mitochondrial variant. Nat Genet. 46 (4), 389-392 (2014).
- Lentz, S. I., et al. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In Vitro. Journal of Histochemistry & Cytochemistry. 58 (2), 207-218 (2010).
- Tornoe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(i)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J Org Chem. 67 (9), 3057-3064 (2002).
- Horwitz, H. B., Holt, C. E. Specific inhibition by ethidium bromide of mitochondrial DNA synthesis in physarum polycephalum. J. Cell Biol. 49, 546-553 (1971).
- Huberman, J. A. New views of the biochemistry of eucaryotic DNA replication revealed by aphidicolin, an unusual inhibitor of DNA polymerase alpha. Cell. 23 (3), 647-648 (1981).
- McClung, C., Hirsh, J. Stereotypic behavioral responses to free-base cocaine and the development of behavioral sensitization in Drosophila. Curr Biol. 8 (2), 109-112 (1998).
- Moore, M. S., et al. Ethanol intoxication in Drosophila: Genetic and pharmacological evidence for regulation by the cAMP signaling pathway. Cell. 93 (6), 997-1007 (1998).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Gamma-aminobutyric acid B receptor 1 mediates behavior-impairing actions of alcohol in Drosophila: adult RNA interference and pharmacological evidence. Proc Natl Acad Sci U S A. 100 (9), 5485-5490 (2003).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell Tissue Res. 228 (1), 21-32 (1983).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon