Method Article
Die Anwendung von genetisch kodierter Fluorescent Stickstoffmonoxid (NO) • Sonden, die geNOps, für Echtzeit-Imaging von NO • Signale in Einzelzellen
In diesem Artikel
Zusammenfassung
This manuscript presents protocols for the application of novel genetically encoded nitric oxide (NO•) probes (geNOps) to monitor single cell NO• fluctuations in real-time using fluorescence microscopy. The Ca2+-triggered NO• formation on the level of individual endothelial cells was visualized by combining geNOps with a chemical Ca2+ sensor.
Zusammenfassung
Stickoxid (NO •) ist ein kleiner Rest, der mehrere wichtige Zellfunktionen bei Säugern, Bakterien und Pflanzen vermittelt. Trotz des Vorhandenseins einer großen Anzahl von Verfahren zum Nachweis von NO • in vivo und in vitro, die Echtzeit - Überwachung von NO • auf Einzelzellebene ist sehr anspruchsvoll . Die physiologischen oder pathologischen Wirkungen von NO • werden durch die tatsächliche Konzentration bestimmt und die Zeit dieser radikalen wohnen. Dementsprechend Methoden, die die Einzelzellen-Detektion von NO • sind höchst wünschenswert, zu ermöglichen. Vor kurzem haben wir die Palette von NO • Indikatoren, die von einzelnen fluoreszierenden Protein basierenden genetisch codierten Stickoxid (NO •) Sonden (geNOps) einzuführen, die direkt auf zellulare • Schwankungen NO reagieren, und daher behandelt diesen Bedarf. Hier zeigen wir die Verwendung von geNOps intrazellulären NO • Signale in Reaktion auf zwei verschiedene chemische beurteilen NO • liefernde Molekülen. Unsere Ergebnisse also bestätigen, dass frisch 3- (2-Hydroxy-1-methyl-2-nitrosohydrazino) -N-Methyl-1-propan (NOC-7) hat eine viel höhere Potentialänderung hervorzurufen, in die intrazellulären Spiegel NO • wie bei der im Vergleich anorganische NO • Spender Natriumnitroprussid (SNP). Darüber hinaus die grünen geNOps (G-GENOP) und die chemische Ca 2+ Indikator Fura-2 wurde durchgeführt , um zu visualisieren , die strenge Regulierung von Ca 2+ -abhängigen NO • Bildung in einzelnen Endothelzellen zweifarbige Abbildung lebender Zellen verwendet wird . Diese repräsentativen Experimente zeigen, dass geNOps sind geeignete Werkzeuge, die Echtzeit-Erzeugung und den Abbau von Einzelzell NO • Signale in verschiedenen Versuchsanordnungen zu untersuchen.
Einleitung
Wir haben vor kurzem eine neue Klasse von genetisch kodierten Fluoreszenz NO • Sonden entwickelt, die so genannte geNOps 1. Diese Sensoren bestehen aus einem einfach aufgebaut, Bakterien abgeleitetes, NO • Bindungsdomäne 2, die zu einer deutlichen Fluoreszenzprotein konjugiert ist (FP) Variante 3 (cyan, grün oder orange FP). NEIN • sofort innerhalb der geNOps auf die Nicht-Häm - Eisen (II) Zentrum 4 Bindung verringert die Fluoreszenzintensität 1. Wichtig ist , erholt sich die geNOps Fluoreszenz schnell und vollständig , wenn die intrazelluläre NO • Stufen 1 sinken. Dementsprechend ermöglichen geNOps Echtzeit-Bildgebung von (Teil-) zellulären Schwankungen NO •. Obwohl die NO • Sensormechanismus von geNOps unklar bleiben, so weit, sie haben bewiesen ausgezeichnete NO • Reporter zu sein, und so haben die Wirksamkeit einer neuen Ära der polychromen, quantitative NO • bioimagin zu öffneng mit hoher räumlicher und zeitlicher Auflösung 1, 5. Andere verfügbare fluoreszierende NO sind • Sonden basierend auf kleinen chemischen Verbindungen, die in die Zellen geladen werden müssen, und werden von NO • 6 irreversibel verändert. Weitere Nachteile von NO • empfindliche kleine Fluorophore sind ihre potenziellen Zytotoxizität und relativ geringe Spezifität , die es schwierig machen , sie zu nutzen in einem zuverlässigen, analytische und schlüssige Art und Weise 7, 8, 9. Obwohl die effektive Nutzung von genetisch kodierten Fluoreszenzsonden - Techniken effizienten Gentransfer erfordert, FP-basierte genetisch kodierte Sensoren haben als unverzichtbare Werkzeuge entstanden , die unser Verständnis der inneren Funktionsweise der Zellen 10, 11 revolutioniert haben. Vor der Entwicklung der einzelnen FP-basierten geNOps, a Förster Resonanzenergietransfer (FRET) -basierte NO • Sensor, bezeichnet als NOA-1 12, errichtet wurde. Sato et al. diese anspruchsvolle Sonde entwickelt , die Ebenen von zwei Untereinheiten des NO • sensitiv lösliche Guanylatcyclase (sGC), beide konjugiert an FRET-basierten Sensoren berichten zyklischem Guanosinmonophosphat (cGMP) 12 besteht. Da diese Sonde auf cGMP reagiert, ist es nur indirekt erfasst , intrazelluläre NO • Schwankungen 12. Obwohl NOA-1 bis NO • Erhebungen im Nano molaren Bereich reagiert, hat dieses Tool nicht aufgrund von Einschränkungen häufig so weit, wahrscheinlich in Bezug auf die Verfügbarkeit und die Praktikabilität dieser sperrigen bipartiter Sensor verwendet.
Vielseitige Funktionen von NO •, die Auswirkungen grundlegende biologische Prozesse haben sich gut 13 charakterisiert worden ist , 14. Viele Studien belegen, dass die NO • concentration innerhalb von Zellen und Subdomains bestimmt Zellschicksal in Gesundheit und Krankheit 14, 15, 16. In Säugetieren, NO • wird hauptsächlich erzeugt enzymatisch in verschiedenen Zelltypen durch die gut charakterisierte Stickstoffmonoxid-Synthase (NOS) Familie 17. Bisher sind drei Isoformen von NOS wurden 18 beschrieben, 19, 20; dies sind die Ca 2+ / Calmodulin-abhängigen endotheliale NOS (eNOS oder NOS-3) 18 und die neuronale NOS (nNOS oder NOS-1) 19 und die Ca 2+ / Calmodulin-unabhängige konstitutiv aktive induzierbare NOS (iNOS oder NOS 2) 20. Darüber hinaus hat die Existenz von mitochondrialen NOS (mtNOS) auch 21 vorgeschlagen. Jedoch wird mtNOS als Spleißvariante von nNOS betrachtet und wird daher nicht gesondert klassifiziert als Isoform 21. Eine andere Isoform, abgesehen von denen in Säugerzellen ist das sogenannte bakterielle NOS (bNOS), hauptsächlich in gram-positive Bakterien 22. Die enzymatische Herstellung von NO • ist hoch gesteuert und hängt von der Verfügbarkeit von mehreren Cofaktoren wie Nicotinamidadenindinucleotidphosphat (NADPH), Adenin - Dinukleotid (FAD), Tetrahydrobiopterin (BH4), molekularem Sauerstoff und L-Arginin 17 Flavin. Die kationische Aminosäure L-Arginin ist das Substrat , das zu L-Citrullin auf NO • Produktion 17 umgewandelt wird. Zusätzlich zu der hoch regulierten enzymatische Erzeugung von NO • Es wurde postuliert , daß der Rest durch die Mitochondrien unter hypoxischen Bedingungen 23 nicht-enzymatisch aus Nitrit pools reduziert werden kann. Sobald NO • innerhalb einer Zelle hergestellt wird, kann es frei diffundieren durch Biomembranen 14,ref "> 15. Jedoch ist die sehr kurze Halbwertszeit dieses Restes wird im Wesentlichen durch die Umgebungsbedingungen bestimmt wird , und verschiedene Wege und chemische Reaktionen effizient NO • Ebenen 24 verschlechtern. Schließlich wird die Bildung, Diffusion und Abbau von NO • hängt auf verschiedenen Umgebungsbedingungen , die bestimmen , die effektive Konzentration des hoch biologisch aktiven Moleküls 24.
Die geNOps Technologie ermöglicht den direkten Nachweis von (Teil-) zelluläre NO • Fluktuation 1 und ist daher geeignet, erneut zu untersuchen und entdecken neu die Mechanismen , die für den Aufbau und Abbau von zellulären NO • Signale. Hier bieten wir einfache Protokolle und repräsentative Ergebnisse für die Nutzung von geNOps exogen hervorgerufen zu visualisieren und endogen erzeugten NO • Profile, auf der Ebene einzelner Zellen. Außerdem kann die Technologie für geNOps ap angepasst werdendung in anderen Systemen Zellmodell die komplexen Muster von NO • Bildung, Diffusion und Abbau in Reaktion auf diverse zelluläre Stimuli und Spannungen zu studieren.
Protokoll
1. Herstellung von chemischen Puffer und Lösungen
- Vorbereiten eines Aufbewahrungspuffer , enthaltend 135 mM NaCl, 5 mM KCl, 2 mM CaCl 2, 1 mM MgCl 2, 10 mM HEPES, 2,6 mM NaHCO 3, 0,44 mM KH 2 PO 4, 0,34 mM Na 2 HPO 4, 10 mM D- Glucose, 2 mM L-Glutamin, 1x MEM-Vitamine, MEM 1x Aminosäuren, 1% Pen-Strep und 1% Amphotericin B. lösen aller Komponenten in destilliertem Wasser und rührt den Puffer für 20 min unter Verwendung eines Magnetrührers bei Raumtemperatur verwendet wird. Stellen Sie den pH-Wert auf 7,44 unter Verwendung von 1 M NaOH. Nach Zutropfen von NaOH, pH Messung eines pH-Meters verwendet, während kontinuierlich gerührt wurde.
- Vorbereiten eines physiologischen Ca2 + -haltigen Puffer, der 140 mM NaCl besteht, 5 mM KCl, 2 mM CaCl 2, 1 mM MgCl 2, 10 mM D-Glucose und 10 mM HEPES. Stellen Sie den pH-Wert auf 7,4 unter Verwendung von NaOH wie in Schritt 1.1 beschrieben.
- Vorbereiten eines Ca 2+ -freiem Puffer , die aus den gleichen Bestandteilen bestehtwie in Schritt 1.2 aufgeführt. Verwenden 1 mM EGTA anstelle von 2 mM.
- Solubilisieren Fura-02.00 in DMSO eine 1 mM Stammlösung zu erhalten. Aliquot der Stammlösung in dicht verschlossenen Fläschchen und bei -20 ° C für bis zu einem Monat. Wenn gefroren, damit die Stammlösung für mindestens 1 Stunde bei Raumtemperatur äquilibrieren vor Licht geschützt. Verdünne die Fura-2AM-Stammlösung in 1 ml Lagerpuffer (Schritt 1.1) auf eine Endkonzentration von 3,3 uM zu erhalten.
- Bereiten Sie 1 ml einer 100 mM Histamin-Stammlösung in destilliertem Wasser (pH-Wert 7,0). Verdünne die 100 mM Histamin - Stammlösung in 100 ml Ca 2+ -enthaltenden physiologischen Puffer auf eine Endkonzentration von 100 uM Histamin.
- Solubilisieren N & omega;-Nitro-L-arginin (L-NNA) in 100 ml calciumhaltigen physiologischen Puffer auf eine Endkonzentration von 300 uM zu erhalten. Lagere die Lösungen bei 37 ° C Wasserbad für mindestens 1 Stunde, bis die L-NNA vollständig gelöst ist.
- Solubilisieren 10 mg NOC-7 in destilliertem water (pH 7,0), um eine 10 mM Stammlösung zu erhalten. Aliquot der Stammlösung in kleinen Portionen in dicht verschlossenen Fläschchen und lagern sofort bei -70 ° C. Verdünne die NOC-7-Stammlösung in einem physiologischen Puffer auf eine Endkonzentration von 10 uM NOC-7 zu erhalten.
HINWEIS: NOC-7 ist eine kleine chemische Verbindung, die spontan NO freisetzt mit einer kurzen Halbwertszeit. Immer bereiten die Arbeitspuffer, die kurz vor NOC-7 zu jedem Experiment besteht. - Machen Sie eine 1 mM Natriumnitroprussid (SNP) Lösung in einer physiologischen Calciumpuffer bereitstellt und einen 10 & mgr; M verdünnt.
HINWEIS: Immer kleine Mengen herzustellen (~ 10 ml) von NO-Donator Lösungen aufgrund der schnellen Abbaurate. - Bereiten einer Phosphat - gepufferten Lösung (PBS) , bestehend aus 137 mM NaCl, 2,7 mM KCl, 9,2 mM Na 2 HPO 4 und 1,5 mM KH 2 PO 4. Stellen Sie den pH-Wert auf 7,44 mit NaOH / HCl.
2. Zellpräparation
HINWEIS: order zu erreichen Einheitlichkeit bei der Durchführung von Stickoxid Messung (NO •) in einzelnen Zellen geNOps verwenden, müssen Zellen mit einem Eisen (II) / Vitamin C - Puffer vor der Bildgebung Experimente zur Wiederherstellung Fe 2+ vorinkubiert werden innerhalb des NO • -bindende Domäne des NO • -Sonden. Im Falle der EA.hy926 und HEK293-Zellen, Inkubation für 20 min mit dem Eisen (II) Booster-Lösung führt zur vollständigen Aktivierung der NO • Sensoren.
- Seed 5,5 x 10 5 EA.hy926 oder HEK293 - Zellen für den nächsten Tag oder 3,5 x 10 5 Zellen für den Tag nach am nächsten Tag, am 30.-mm Mikroskop - Deckgläser in eine Vertiefung einer 6-Well - Platte. Inkubiere Zellen bei 37 ° C in einer befeuchteten Umgebung mit 5% CO 2.
Hinweis: Detaillierte Informationen zur Adenovirus - Infektion von Säugerzellen und Virus Konstruktion wurde von Zhang et al. 25. Dieser Schritt gilt nicht für die HEK 293 Zellen, die stabil G-GENOP Ausdruck zu bringen. - Nehmen Sie fötalen Kälberserum (FCS) und antibiotikafreien Dulbecco-Eagle modifizierte Medium (DMEM) und fügen Sie Adeno-assoziierten Virus Typ 5 (AAV5) Vektor, der das Gen, welches für G-GENOP (MOI: 500 für EA.hy926 Zellen ergeben fast 100 % positive Zellen; MOI: 1 ist effizient für HEK293-Zellen).
HINWEIS: Die Verwendung von Adeno-assoziierten viralen Vektoren ist der Risikogruppe 2 Biosicherheitsstufe 2 zugeordnet allgemein für die Arbeit mit diesem Vektor erforderlich ist. Falls erforderlich, können Virus-Infektion auch in FCS enthaltendem Medium durchgeführt werden. Alternativ können Zellen , die transient Lipid-basierende Träger transfiziert werden unter Verwendung von 1. - Entfernen Sie das Kulturmedium und waschen Sie die Zellen mit vorgewärmten (37 ° C) PBS. 1 ml DMEM / AAV5 Mediums auf jede Vertiefung für 1 Std. Dieser Schritt gilt nicht für die HEK 293 Zellen, die stabil G-GENOP Ausdruck zu bringen.
- 1 ml 20% FCS-haltigem DMEM auf jede Vertiefung in einer Endkonzentration von 10% FCS. Sie nicht die AAV5 haltigen Medien aus den Zellen zu entfernen. Gently Wippe die Platte das Medium in den Brunnen zu homogenisieren. Inkubiere Zellen für 48 Stunden bei 37 ° C in einer befeuchteten Umgebung mit 5% CO 2. Dieser Schritt gilt nicht für die HEK 293 Zellen, die stabil G-GENOP Ausdruck zu bringen.
- Nach 48 Stunden, waschen Sie die Zellen mit PBS vorgewärmt. Anschließend fügen Sie 2 ml vorgewärmten Speicherpuffer (Abschnitt 1.1) in jede Vertiefung und inkubieren Zellen bei Raum RT von Lichtstrahlung geschützt mindestens 1 Stunde.
- Ersetzen Sie den Speicherpuffer mit 1 ml / Vertiefung des Eisen (II) Booster-Lösung bei Raumtemperatur (RT). Inkubieren Zellen für genau 20 Minuten in der Dunkelheit.
HINWEIS: Verwenden Sie nicht die optimale Inkubationszeit überschreiten oder zu reduzieren, da dies die Ansprechbarkeit der NO • Sonden beeinträchtigen könnten. - Wasche die Zellen einmal mit Speicherpuffer und Inkubation jeder Vertiefung mit 2 ml Aufbewahrungspuffer für mindestens 2 h bei RT, um die Zellen zu erlauben, zu äquilibrieren.
- Ersetzen Sie den Speicherpuffer mit 3,3 uM Fura-02.00 in 1 ml Lagerpuffer für 45 min bei RT, geschütztvon Licht.
- Wasche die Zellen zweimal mit Speicherpuffer und Inkubation erneut für mindestens 30 min, um Zellen zu erlauben, zu äquilibrieren.
3. Live Cell Imaging von NO • und Ca 2+ Signale in einzelnen Zellen
- Fix eine 30 mm Deckglas beschichtet mit EAhy.926 oder HEK293-Zellen (aus Schritt 2.1) in einer Metall Perfusionskammer und legen Sie es auf dem Mikroskop. Schließen Sie den Zustrom Rohr zu den Pufferspeicher und den Ausstrom an eine Vakuumpumpe. Achten Sie auf einen gleichmäßigen Fluss und vermeiden des Deckglases zu entleeren.
- Starten Sie die Schwerkraft angetriebene Perfusion mit physiologischer Calciumpuffer (aus Stufe 1.2) eine halbautomatische Perfusionssystem verwendet.
HINWEIS: Ein solches System besteht aus Pufferbehälter, jeweiligen Schläuche, Magnetventile , die elektronisch gesteuert und eine Vakuumpumpe (siehe Figur 1B). Die Durchflussrate kann von 1 bis 3 ml / min, abhängig von der Höhe der Perfusion Reservoirs liegen. Für eine konsistente lokalen Drogen AnwenKation, die Strömungsgeschwindigkeit aller verwendeten Reservoirs sollte annähernd gleich sein. Dies sollte vor dem Abbildungsversuchen getestet werden. Man bedenke, dass Endothelzellen reagieren Scherbeanspruchung erhöht, die durch strenge Perfusion induziert werden kann. - Schalten Sie das Abbildungssystem und erlauben Vorwärmung aller Geräte für 30 min.
- Definieren Sie Imaging-Einstellungen unter Verwendung der jeweiligen Software. Wählen Sie Anregungswellenlänge 340 nm und 380 nm für Fura-2-Bildgebung und 480 nm für die Anregung G-GENOP. Zur Minimierung der Fluoreszenz Bleichen der Kamera Binning bis 4 erhöhen und Anregungsintensitäten und Belichtungszeiten zu reduzieren. Siehe auch Schritte 3,6-3,8.
HINWEIS: Imaging Einstellungen und Parameter sind abhängig von den verwendeten Geräten, Fura-2 Beladungseffizienz und G-GENOP Expressionsniveaus. - Wählen Sie den Abbildungsbereich durch die xyz-Tisch des Mikroskops bis mehrere fluoreszierende Zellen bewegen, sind im Fokus. Dann definieren Bereiche von Interesse (ROIs) über die jeweilige Software-Tool. Zeichnen Regionen, die mehrere ganze single fluoreszierende Zellen pro Bildfeld manuell. Darüber hinaus definieren einen Hintergrundbereich von ähnlicher Größe.
HINWEIS: Sobald Bilder erworben wurden und gespeichert ROIs können auch entsprechende Bildanalyse-Software (siehe Materialliste) unter Verwendung von neu nach dem Imaging-Verfahren für die weitere Analyse definiert werden. - Startdaten auf einem invertierten und erweiterte Fluoreszenzmikroskop mit einem motorisierten Probentisch und einer monochromatischen Lichtquelle zu sammeln. bei 340 nm und 380 nm für Fura-02.00 und 480 nm für G-GENOP jeweils abwechselnd erregt. Stellen jeweiligen Belichtungszeiten, so dass für alle Kanäle, ein klares Fluoreszenzsignal nachweisbar im Laufe der Zeit ist. Siehe auch Schritt 3.4.
ANMERKUNG: Diese hängt von der Intensität des Anregungslichts und der Kamera-Binning. Beispielsweise verwenden 15% Intensität des Anregungslichts, eine Kamera Binning von 4 und 150 ms für 340 nm, 50 ms für 380 nm und 300 ms für 480 nm. Siehe auch Schritt 3.4. - Sammeln Sie das emittierte Licht bei 510 nm für Fura-2 / AM, 520 nm für G-Genop eine Charge-Coupled Device (CCD) Kamera mit entsprechenden Filter, bestehend aus dem 500 nm Erreger, ein 495 nm dichroitischen und einem 510-520 nm Emitter. Nehmen Sie einen Gesamtrahmen alle 3 Sek.
- Aufzeichnen der ersten Minuten (falls erforderlich bis zu 3 min) in physiologischer Ca 2+ Puffer (1.2) , um die Basislinie der entsprechenden Fluoreszenz - Signale über die Zeit zu erhalten.
- Sobald eine stabile Grundlinie Fluoreszenz beobachtet wird, wechseln zu 100 uM Histamin oder ATP (1 & mgr; M oder 100 & mgr; M) Physiologische Ca 2+ Puffer, der Zellen für 3 min zu stimulieren.
HINWEIS: EA.hy926 Zellen, die (bei 380 nm angeregt Fluoreszenz bei 340 nm angeregt Fluoreszenz geteilt durch) zu den Agonisten zeigen einen starken Anstieg des Fura-2-Verhältnis reagieren und eine deutliche Abnahme des G-GENOP Fluoreszenzsignal. - Wechseln Sie zurück zu den physiologischen Ca 2+ Puffer ohne Histamin oder ATP und L-NNA für 5 min , die Verbindungen aus den Zellen zu entfernen. Dieser Schritt könnte, bis die Fluores- verlängert werdenzenz Änderungen werden vollständig zurückgewonnen.
- Administrieren 10 uM NOC-7 in physiologischer Ca 2+ Puffer für 2 min , um die Perfusion System. Der NO-Donor wirkt sich stark auf G-GENOP Fluoreszenz, die in der Regel verringert sich um> 20% als Antwort auf 10 uM NOC-7. In EA.hy926 Zellen ist die NOC-7-Effekt etwa 3-fach stärker im Vergleich zu den Agonisten G-GENOP Fluoreszenzquench induziert.
- Für ca. 10 min mit physiologischer Ca Waschen Sie die NO • freisetz Verbindung aus 2+ einmal basale Fluoreszenz Aufzeichnung wird wiedergewonnen Puffer und zu stoppen.
4. Datenanalyse
- Export erworben durchschnittliche Fluoreszenzintensitätsdaten von einzelnen Zellen über die Zeit, zu der Datenanalysesoftware.
- Subtrahieren jeweiligen Hintergrundwerte und das Verhältnis von 340 nm bis 380 nm der jeweiligen Fura-2 Signale jeder einzelnen Zelle über die Zeit zu berechnen.
- Subtrahieren Sie die Hintergrundwerte des G-GENOP Kanal die tatsächliche fl zu erhaltenuorescence Intensität der NO-Sonde (F) im Laufe der Zeit eine Berechnung Software.
- Nehmen Fluoreszenzbasiswerten als F 0 (F 0 , um die Fluoreszenz der NO - Sonde im Laufe der Zeit ohne Stimulation). Siehe auch 4.5 und 1C Schritt.
- Berechnen Sie eine Funktion über die Zeit für die Fluoreszenzbleicheffekte unter Verwendung der folgenden Gleichung: F 0 = F inital • exp (-K • Zeit) + F Plateau. F inital: maximale Fluoreszenzsignal einmal Bildgebung gestartet; K: Geschwindigkeitskonstante der Fluoreszenz Bleichen im Laufe der Zeit; F Plateau: Mindest Fluoreszenz durch Bleichen im Laufe der Zeit erreicht; Siehe auch Schritte 4.3- 4.4 und 1C.
HINWEIS: Für die Näherung alle Fluoreszenzwerte über die Zeit vor und nach der Zellstimulation verwendet werden können. Weitere Einzelheiten werden von Bentley et al angegeben. 27. - Um das G-GENOP Signals über die Zeit normalisieren, berechnen 1-F / F0 (Schritte 4,3-4,5). Siehe Abbildung 1C und 1D.
Ergebnisse
Visualisierung von Einzellige NO • Profile in Reaktion auf transient Applied NO-Donatoren
Wir verwendeten Klon eine HEK - Zelle , die keine • Signale auf Einzelzellebene als Reaktion auf zwei verschiedenen NO-freisetz kleinen chemischen Verbindungen, NOC-7 und SNP zu visualisieren stabil G-GENOP (1A), um zum Ausdruck bringt. Die NO • Donoren wurden nacheinander aufgebracht und entfernt von Zellen während der Bebilderung einer Schwerkraft basierenden Perfusionssystem verwenden , die kontinuierliche Strömung (1B) gewährleistet. Alle Zellen, die G-GENOP mit unterschiedlichen Intensitäten zeigten eine deutliche Verringerung der Fluoreszenz in Reaktion auf die NOC-7 und SNP (1C), was schnelle NO • Akkumulation innerhalb der Zellen bei der Zugabe der NO • Donatoren. Normierte Fluoreszenzsignale (1-F / F 0) gezeigt , dass sowohl NO • Spender evozierte homogene cellular NO • Erhebungen , die nach Auswaschen der NO • freisetz Verbindungen (1D) vollständig zurückgewonnen. Jedoch 10 uM SNP nur 50% des zellulären NO • Signal (9,63 ± 1,05%, n = 3/38) induziert, die durch 10 uM NOC-7 (18,10 ± 1,20%, n = 3/38, p erreicht < 0,0001). Um mit der gleichen intrazellulären NO • Werte zu erreichen , sowohl NO • Spendern wurde eine Konzentration von 1 mM SNP erforderlich (1C, 1D).
Als nächstes testeten wir die Fähigkeit von frisch gegen abgelaufener NOC-7, hergestellt intrazellulären NO • Ebenen in HEK-Zellen zu erhöhen. Zu diesem Zweck stellten wir vier Versuchspuffer 5 uM NOC-7 enthält. Der NO-Donor wurde • entweder hinzugefügt frisch gerade vor der Messung oder innerhalb Reservoire für 1 Stunde gehalten, 2 h und 3 h bei Raumtemperatur vor der Messung. Die verschiedenen Puffer wurden nacheinander aufgebracht und entfernt fROM mit der G-GENOP exprimierenden Zellen ein Perfusionssystem (2B) verwendet wird . Dieser Ansatz stellte die Stabilität der wässrigen NOC-7 - Lösungen , die, wie erwartet, zeigten Kapazitäten im Laufe der Zeit verringert intrazellulären NO • Stufen (2A, 2C) zu erhöhen. Interessanterweise gewonnen NO • Signale wesentlich schneller nach dem Entfernen der abgelaufenen Puffer, im Vergleich zu der intrazellulären NO • Antwort , die durch frisches NOC-7 (2C), vielleicht anzeigt Adhäsion der intakten NO • liefernde Moleküle an Zellkomponenten evozierten wurde .
Die gleichzeitige Visualisierung von Ca 2+ und NO • Signale in Einzel Endothelzellen
Um Ca 2+ zu studieren NO • Bildung in Endothelzellen -triggered, die häufig verwendete endothelialen immortalisierte Zell-Surrogat, Linie EA.hy926 Zelle war transiently mit G-GENOP transfiziert und mit Fura-2 / AM geladen (siehe Protokoll 2.8). Die Transfektion ergab etwa 10% der G-GENOP positive Endothelzellen (n = 6, 3A), die ausreichend ist , aufzuzeichnen Ca 2+ -evoked NO • Produktion auf der Ebene der einzelnen Endothelzellen. Allerdings haben wir erreicht fast 100% G-GENOP positive EA.hy926 Zellen ein Adeno-assoziierter viraler Vektor verwendet (n = 6; siehe Protokoll 2.2). Vor mehrkanaligen Messungen wurden die Zellen für 20 min bei Raumtemperatur in Lagerungspuffer , bestehend L-NNA, eine potente irreversible NOS-Inhibitor 26 inkubiert. Kontrollzellen wurden in dem gleichen Speicherpuffer ohne L-NNA (siehe Protokoll 1.1) (3B) gehalten. Die Behandlung von Kontrollzellen mit Histamin, einem potenten Inositol - 1,4,5-triphosphat (IP 3) erzeugendes Agonisten, sofort erhöhte cytosolische Ca 2+ durch einen allmählichen Anstieg der intrazellulären NO • gefolgt Ebenen , bis der Agonist war entfernend (3C, 3D). Die Zellen vorbehandelt mit dem NOS-Inhibitor zeigte ähnliche Ca 2+ Signale cytosolische, während die intrazelluläre NO • Niveau nahezu unbeeinflusst in Reaktion auf Histamin (Abbildung 3E) blieb. EA.hy926 Zellen G-GENOP exprimieren , wurden auch mit 1 & mgr; M behandelt und 100 & mgr; M des IP 3 erzeugendes Agonisten ATP um , ob oder nicht zu testen geNOps sind geeignet Nein • Signale in Reaktion auf sowohl niedrige physiologischen und supraphysiologischen zu überwachen Konzentrationen eines Agonisten (Abbildung 3F). In der endothelialen evozierte Zelllinie 1 & mgr; M ATP eine klare cytosolische NO • Signal, das etwa die Hälfte des Signals von 100 & mgr; M ATP (3F) erhalten.

Abbildung 1: Intrazelluläres NO Profile als Antwort auf verschiedene NO-Liberati ng Molekülen. (A) Weitfeldbilder von HEK - Zellen stabil exprimieren Cytosol - G-GENOP. Maßstabsbalken = 20 & mgr; m. (B) Schematische Darstellung eines Schwerkrafthalbautomatische Perfusions - System für die kontrollierte Anwendung und Entfernung von NOC-7 und SNP. (C) Repräsentative (von 3 unabhängigen Versuchen) nicht normalisierte Einzelzellfluoreszenzintensität Spuren in willkürlichen Einheiten über der Zeit von HEK - Zellen stabil exprimieren cytosolischen G-Genop als Antwort auf 10 uM NOC-7, 10 uM SNP und 1 mM SNP. Schwarz fett Kurve stellt die durchschnittliche Kurve von 26 Einzelzellspuren (hellgrau Kurven). Punktierte schwarze Kurve stellt F 0, die für die Normalisierung verwendet wurde. (D) Normalized und invertierten einzelne Spuren (1-F / F 0, lichtgrau Kurven), und die mittlere Kurve (schwarze dicke Kurve) im Laufe der Zeit als Reaktion auf 10 & mgr; M NOC-7, 10 & mgr; M SNP und 1 mM SNP extrahiert aus Panel C.es / ftp_upload / 55486 / 55486fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
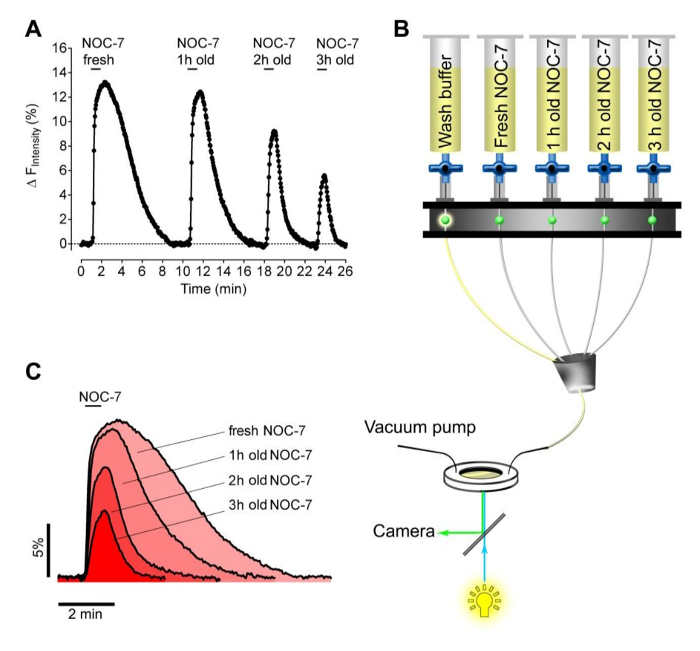
Abbildung 2: Stabilitätstest von NOC-7 unter Verwendung von stabil G-GENOP exprimierenden HEK - Zellen. (A) Repräsentative NO • Konzentrations - Wirkungs - Kurve über die Zeit stabil G-GeNOps exprimierenden HEK - Zellen bei Anwendung von frischen und alten NOC-7 - Pufferlösungen. Alle NOC-7 enthaltenden Puffer wurden hergestellt, zunächst mit einer Endkonzentration von 5 & mgr; M die gleiche Stammlösung unter Verwendung von (50 mM). Die Ablaufzeit der jeweiligen Lösungen nach der Herstellung bis zum Abbildungs beträgt 1 Stunde, 2 Stunden und 3 Stunden wie angegeben. (B) Schematische Darstellung eines Schwerkrafthalbautomatische Perfusion System nacheinander hinzufügen und NOC-7 - haltigen Lösungen während der Bildgebung zu entfernen. (C) Zeitliche Korrelationenzellulare NO • Signale in Reaktion auf frisch zubereitet und alten NOC-7-Puffer. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3: Die gleichzeitige Mehrkanalaufnahmen von NO • und Ca 2+ Signale in einzelnen EA.hy926 Zellen. (A) Repräsentative Weitfeld - Fluoreszenzbilder von EAhy.926 Zellen, die G-GENOP (linkes Bild) , die mit Fura-2 / AM (mittlere und rechte Platten) geladen werden. Maßstabsbalken = 20 & mgr; m. (B) Schematische Darstellung der Behandlung von EAhy.926 Zellen mit 500 uM N & omega;-nitro-L-Arginin (L-NNA) für 20 min in einer sechs-Well - Platte vor der Messung. (C) Repräsentative zeitlichen Verlauf einer gleichzeitigen Aufzeichnung von Fura-2 (Anregung: 340 nm / 380 nm EMISSIon: 510 nm) und G-Signale GENOP (Anregung: 480 nm; Emission: 520 nm) als Antwort auf 100 uM Histamin. Wie bereits erwähnt Histamin wurde nach 3 min mit einem Perfusions-System entfernt. (D) Die Kurven repräsentieren gleichzeitige Aufnahmen von zytosolischen Ca 2+ (Fura-2 - Verhältnis Signale, F 340 / F 380 ist grau durchgezogene Linie) und NO • (normalisiert und invertierte Kurve, 1-F / F 0 ist grün durchgezogene Linie) Signale im Laufe der Zeit von einer einzigen Fura-2 / aM Endothelzellen transiente Expression G-GENOP geladen. Zellen wurden mit 100 & mgr; M Histamin für 3 min in einem Ca 2+ (2 mM CaCl 2) , enthaltend Puffer (n = 8/3) stimuliert. (E) Vertreter gleichzeitig Ca 2+ (grau durchgezogene Linie) aufgezeichnet und NO • (grüne durchgezogene Linie) Signale im Laufe der Zeit von einer EA.hy926 Zelle , die mit 500 & mgr; M N & omega;-Nitro-L-Arginin (L-NNA) vorbehandelt wurde vor Messung (n = 12/3). Zellen wurden mit 100 & mgr; M Histamin in Gegenwart von 2 mM behandeltCa 2+. (F) Durchschnittskurven cytosolische NO • Signale in Antwort auf 1 & mgr; M ATP durch eine zweite Zellstimulation mit 100 uM ATP , gefolgt darstellt. Die Balken stellen Mittelwerte ± SD der maximalen G-GENOP Signale in Antwort auf 1 & mgr; M ATP (weiße Balken) und 100 uM ATP (grüner Balken) von 4 unabhängigen Experimenten; p <0,001 vs. 1 uM ATP. P-Wert wurde unter Verwendung eines ungepaarten t-Test berechnet. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Seit der Entdeckung von NO • als ein wichtiges Signalmolekül in der Biologie 28, die spezifische Echtzeitmessung des Restes in einzelnen Zellen, Geweben und ganzen Tieren mit hoher Auflösung in eine machbare und zuverlässige Art und Weise hat gestrebt wurde. Hier berichten wir über die Anwendung der neu entwickelten genetisch kodierte Fluoreszenz NO • Sonden (geNOps) , die exakte Abbildung lebenden Zellen ermöglichen von NO • Signale Weitfeld - Fluoreszenzmikroskopie 1 verwendet wird .
Zur Umgehung Klon aufwendige und invasive Transfektionsverfahren HEK Zelle, die G-GENOP stabil exprimiert grün fluoreszierende verwendet wurde exogen erzeugt zu quantifizieren Single-Cell-NO • Profile. Wie HEK - Zellen normalerweise nicht produzieren NO • endogen 29, Dieser Zelltyp ist für die Erzeugung eines Genop basierten Sensor Zelllinie geeignet, die für viele andere Anwendungen in Kokultur Bedingungen nützlich sein könntenmit NO • Herstellung von Primärzellen oder auch in lebenden Tieren 30. Doch in dieser Studie zeigen wir die Fähigkeit verschiedener NO • liefernde Verbindungen, von unterschiedlichen Konzentrationen und Stabilitäten, intrazellulären NO • Signale zu erinnern an die G-GENOP exprimierenden HEK Zellmodell. Unsere Daten zeigten, dass die NO-Konzentration • -Donor-, Qualität und Anwendungsverfahren schließlich die Muster der intrazellulären NO • Profile bestimmen. Solche Informationen sind für die In - situ - pharmakokinetische Charakterisierung verschiedener NO • Spender unverzichtbar, die aus mehreren Krankheiten bezeichnend sind. Bemerkenswerterweise wurden geNOps gezeigt, stabil , um mehrere wiederholte Anwendungen von NO • reagieren -Donor- Impulse über eine sehr lange Zeit 1. Dementsprechend NO die Experimente unter Verwendung • liefernde Verbindungen, die hier vorgestellt, erlauben semi-quantitative Rückschlüsse auf die verschiedenen Amplituden und die Kinetik der jeweiligen zellulären NO226; Signale (1 und 2).
Obwohl die stabil exprimieren wahrscheinlich HEK-Zellklon aus einer einzigen Zelle stammt, wurde eine große Heterogenität der G-geNOps Expressionsniveaus beobachtet werden (Abbildung 1). Dies ist ein gemeinsames Merkmal der stabilen Zellklone wie die Transkription des (genom integriert) Gen von Interesse unter der Kontrolle von vielen Faktoren ab, wie beispielsweise diverse Umweltbelastungen ist , die 31 Raten Zellwachstum 32 beeinflussen, und die Zellzyklusstatus 33. Die einzelnen FP-basierten geNOps sind nicht-ratiometrische Sonden und damit die NO • -induzierten Verlust der Fluoreszenzintensität steigt mit der GENOP Expressionsniveau 1. Dementsprechend Normalisierung der geNOps Signale ist für zellulare NO • Signale insbesondere bei einer vergleichenden Analyse quantifizieren. Wie in unserer jüngsten Studie, eine strenge lineare Korrelation b gezeigtwischen die basale Fluoreszenzintensität von geNOps und die Stärke des NO • -induzierten Fluoreszenzlöschung über einen breiten Bereich von Fluoreszenzintensitäten wurde 1 gefunden. Dies ist ein wichtiges Merkmal der geNOps für absolute Quantifizierung von zellulären NO • Signale. Wie in 1 gezeigt ist , Normalisierung der G-geNOps Signale in Reaktion auf NOC-7 und SNP ergab homogene NO • Signale in verschiedenen HEK - Zellen aus der gleichen Platte, was anzeigt , daß HEK - Zellen im Hinblick auf ihre Fähigkeit , nicht unterschiedlich sind bis zu nehmen und verschlechtern die NO • Radikal, das aus dem NO • Spender stammt. Im Gegensatz dazu zeigten Verwendung geNOps in HeLa-Zellen klar Heterogenitäten zellulärer NO • Signale zwischen den verschiedenen Zellen in Reaktion auf NOC-7. Diese Unterschiede weisen auf zelltypspezifische NO • Metabolismus und Abbauraten, die mehrere Implikationen in der Zellphysiologie und Pathologie haben könnte, und kann mit dem GENOP werden aufgedeckts-Technologie.
Dennoch sind zwei wichtige Merkmale von geNOps berücksichtigt werden müssen sorgfältig auf die korrekte Verwendung der Sensoren und Dateninterpretationen: i) geNOps benötigen ausreichende Eisen (II) vollständig auf NO reagieren • 1 und ii) auf der Variante FP kann je nach geNOps sein pH - empfindliche 1. Hier beschreiben wir ein Protokoll, das für das nicht-toxische Eisen (II) Supplementierung von geNOps geeignet zu sein, die exprimiert werden, entweder in HEK, HeLa oder EA.hy926-Zellen (siehe Protokoll 2.6) gefunden wurde. Während es mit Eisen , dass Zellbehandlung nachgewiesen wurde (II) / Vitamin C nicht die Zellmorphologie beeinflußte die Lebensfähigkeit der Zellen und die metabolische Aktivität von Zellen 1, könnte es notwendig sein , diesen wichtigen Schritt für andere Zelltypen und Geweben zu optimieren. Doch in einigen experimentellen Bedingungen kann die Anforderung von Eisen (II) Laden die Anwendbarkeit von geNOps begrenzen. Bemerkenswerterweise wurde gezeigt, dass Ascorbat N reduzierenO • 35 und Ascorbat-Eisen (II) Komplexe sind in der Lage • 36 NO, 37 abfängt. Darüber hinaus kann überschüssiges Eisen (II) und Ascorbat induzieren Entzündungsreaktionen 39 und abkuppeln eNOS 41. Solche Effekte müssen berücksichtigt werden, wenn die geNOps Technologie. Es hat sich unter bestimmten experimentellen Bedingungen wird der intrazelluläre pH beeinflußt 34 deutlich, die das Potential hat , zu beeinflussen die geNOps Fluoreszenz 1 gezeigt , dass. Bemerkenswerterweise sind die Cyan und Grün geNOps Varianten relativ empfindlich pH eine Abnahme der Fluoreszenz bei der Versauerung 1 zeigt. Daher akute Änderungen des (Teil-) zellulären pH könnte falsch NO • Signale simulieren, wenn der pH-empfindliche geNOps verwenden. In unserer bisherigen Arbeit, die parallele Nutzung von NO • unempfindlich geNOps (geNOps mut) als negative contro wie vorgeschlagenls wird empfohlen , echte zelluläre NO • Signal zu sezieren von pH 1 ändert. Zusätzlich können zelluläre pH - Änderungen pH - Sonden wie Sypher 34 unter Verwendung inspiziert werden.
Ferner visualisiert wir die Bildung endogener enzymatischer NO • als Antwort auf eine physiologische Ca 2+ -mobilisierende Agonist in der Endothelzelle Surrogat EA.hy926. Die EA.hy926 Zelllinie ist eine häufig verwendete Modellsystem zum Ausdruck konsequent eNOS 38. Die Verwendung von geNOps transient in EA.hy926 Zellen exprimiert wird , bestätigt , dass IP 3 -vermittelte Ca 2+ Signale tiefe NO • Bildung in diesem Zelltyp hervorzurufen, die fast vollständig von L-NNA blockiert wurde. Um wurden zeitlich Ca 2+ korrelieren mit NO • Signale, G-GENOP-exprimierenden Zellen mit dem UV-erregbaren chemischen Ca 2+ -Indikator Fura-2 / AM geladen. Die spektrale Trennung des Ca 2+ gebunden und ungebunden Fura-2 fluo Fluoreszenz aus dem G-Signal Genop kann leicht mit handelsüblichen Filtersätze 40 erreicht werden. Imaging beide Sonden enthüllt , dass die Ca 2+ -triggered enzymatische NO • Bildung viel langsamer erfolgt im Vergleich zu der cytosolischen Ca 2+ Anstieg dieser endothelialen Zelltyp. Ähnliche Kinetik der Single-Cell - NO • Signale in Endothelzellen aus Rinderlungenarterie auf Zellbehandlung mit der IP - 3 erzeugendes Agonisten Bradykinin, haben sowie Schubspannungen wurden NOA-1 berichtet verwenden, eine indirekte hoch NO • sensitiv Sensor 12 . Dementsprechend betonen diese Daten , dass die Ca 2+ -evoked eNOS abgeleiteten NO • Bildung eine gewisse Anlaufzeit benötigt , bis die volle enzymatische Aktivität erreicht wird. Obwohl die Kinetik der zellulären NO • Bildung, Diffusion und Abbau kann von anderen Daten extrahiert werden, zB spannungsbasierte Messungen von NO • -induzierten Schiff Entspannungss = "xref"> 26, der große Vorteil von Fluoreszenzsonden NO • ist , dass sie direkt zelluläre NO • Schwankungen in sichtbare Signale in Echtzeit konvertieren. Somit liefert Abbildungs zelluläre NO • Signale mit geNOps hoher räumlicher und zeitlicher Auflösung und bietet einzigartige Möglichkeiten in der (Wieder-) die (Unter-) zelluläre NO • Homöostase zu untersuchen. Zum Beispiel eNOS Abbildungs 42 in Kombination mit der geNOps Technologie in einzelne Endothelzellen pendelt könnte geeignet sein 43 NEIN • Bildung mit der subzellulären Lokalisation und Translokation des NO • -produzierenden Enzym oder andere relevante Proteine wie Calmodulin und Caveolin zu korrelieren.
Hier beschreiben wir die praktikabel Anwendung von G-GENOP exprimierenden HEK und EA.hy926 Zellen exogen zu visualisieren und endogen erzeugt zelluläre NO • Signale auf der Ebene einzelner Zellen und in Echtzeit auf einem konventionellen Weitfeld-Fluoreszenz microscope. verschiedenen experimentellen Bedingungen mit allen Arten von interessanten Zelltypen Unsere Daten implizieren, dass geNOps geeignet sind, um spezifisch (sub) unter zellulären NO • Dynamik zu verfolgen.
Offenlegungen
EE, MW, RM und WFG, Mitarbeiter der Medizinischen Universität Graz, haben eine UK-Patentanmeldung (Patentanmeldung Nr WO2015EP74877 20.151.027, Priorität Nummer GB20140019073 20141027) eingereicht, die Teile der Forschung in diesem Manuskript beschreiben. Lizenzen im Zusammenhang mit diesem Patent sind vorgesehen , um Next Generation Fluoreszenz - Imaging (NGFI) GmbH ( http://www.ngfi.eu/ ), einem Spin-off - Unternehmen von der Medizinischen Universität Graz.
Danksagungen
The authors acknowledge C.J. Edgell, Pathology Department, University of North Carolina at Chapel Hill, NC, USA for providing the EA.hy926 cells. Author E.E. is supported by Nikon Austria within the Nikon-Center of Excellence, Graz and is a fellow of the Ph.D. program in Molecular Medicine at the Medical University of Graz. The researchers are also supported by the Ph.D. program Metabolic and Cardiovascular Disease (DK-W1226) of the Medical University of Graz. This work was also funded by the FWF project P 28529-B27. Microscopic equipment is part of the Nikon-Center of Excellence, Graz that is supported by the Austrian infrastructure program 2013/2014, Nikon Austria Inc., and BioTechMed, Graz.
Materialien
| Name | Company | Catalog Number | Comments |
| NaCl | Carl Roth, Karlsruhe, Germany | 3957.20 | sodium chloride |
| KCl | Carl Roth, Karlsruhe, Germany | 6781.1 | potassium chloride |
| CaCl2 .2H2O | Carl Roth, Karlsruhe, Germany | T885.1 | calcium chloride dihydrate |
| MgCl2 .6H2O | Carl Roth, Karlsruhe, Germany | 2189.2 | magnesium chloride hexahydrate |
| HEPES | Carl Roth, Karlsruhe, Germany | 9105.3 | 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid |
| NaHCO3 | Carl Roth, Karlsruhe, Germany | 8551.1 | sodium hydrogencarbonate |
| KH2PO4 | Merck, Darmstadt, Germany | 104873 | potassium dihydrogen phosphate |
| Na2HPO4 .2H2O | Carl Roth, Karlsruhe, Germany | 4984.1 | sodium hydrogenphosphate dihydrate |
| D(+)-Glucose monohydrate | Carl Roth, Karlsruhe, Germany | 6780.1 | >99.5%; for cell culture, endotoxin free; |
| EGTA | Carl Roth, Karlsruhe, Germany | 3054.2 | ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid; calcium chelating agent |
| NaOH | Carl Roth, Karlsruhe, Germany | 6771.1 | sodium hydroxide |
| HCl | Carl Roth, Karlsruhe, Germany | 4625.1 | hydrochloric acid, fuming, 37% (~10 N) |
| DMSO | Carl Roth, Karlsruhe, Germany | 4720.1 | dimethyl sulfoxide; highly polar, aprotic organic solvent |
| L-Glutamic acid hydrochloride | Sigma Aldrich, Vienna, Austria | G2128 | (S)-2-Aminoglutaric acid |
| DMEM, low glucose | Sigma Aldrich, Vienna, Austria | D5523 | Dulbecco’s Modified Eagle’s Medium - low glucose; with 1000 mg/L glucose and L-glutamine, without sodium bicarbonate, powder, suitable for cell culture |
| MEM Vitamin solution (100X) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11120037 | 100x the vitamins found in the standard Minimum Essential Medium (MEM) |
| MEM Amino acids solution (50X) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11130036 | 50X the essential amino acids (except L-glutamine) found in the standard Minimum Essential Medium (MEM) |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15140122.00 | antibiotics to prevent bacterial contamination of cell cultures |
| Amphotericin B | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15290026.00 | Gibco Amphotericin B contains 250 µg of amphotericin B (Fungizone) and 205 µg of sodium deoxycholate; prevents the contamination of cell cultures by yeast and multicellular fungi |
| FCS | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10270106 | Fetal Bovine Serum, qualified, E.U.-approved, South America origin |
| PBS, pH 7.4 | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10010031.00 | phosphate-buffered saline |
| Fura-2 (AM) | Teflabs, Austin, TX, USA | 102 | fluorescent cytosolic calcium indicators |
| Histamine dihydrochlorid | Sigma Aldrich, Vienna, Austria | H7250 | 2-(4-Imidazolyl)ethylamine dihydrochloride; IP3-generating agonist |
| Nω-Nitro-L-arginine | Sigma Aldrich, Vienna, Austria | N5501 | N5-(Nitroamidino)-L-2,5-diaminopentanoic acid; L-NNA; inhibitor of nitric oxide synthase |
| NOC-7 | Calbiochem/Merck, Darmstadt, Germany | 487952 | 3-(2-Hydroxy-1-methyl-2-nitrosohydrazino)-N-methyl-1-propanamine; nitric oxide (NO) donor short half-life of NO release |
| Sodium nitroprusside dihydrate | Santa Cruz Biotechnology, Texas, USA | sc-203395A | sodium nitroferricyanide(III) dihydrate; nitric oxide releasing compound |
| 30-mm Cover slips | Karl Hecht, Sondheim v. d. Rhön, Germany | 41001130 | glass cover slips, HECHT "Assistent", size 1, round, 30-mm, (VE: 100 pcs.) |
| Iron(II) booster solution | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | Iron(II) containing physiological buffer for non toxic iron(II) loading of cells; http://www.ngfi.eu/product/ironii-booster-solution/ |
| G-geNOp plasmid | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | plasmid DNA encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product/g-genop/ |
| G-geNOp AAV5 | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | adenovirus encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/viral-genops-vectors/g-genop-aav5/ |
| G-geNOp sensor cell line | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | human embryonic kidney cell line (HEK293) stably expressing green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/g-genop-sensor-cell-line/ |
| HEK293A cell line | Invitrogen/Thermo Fisher Scientific, Waltham, MA, USA | R70507 | subclone of human embryonic kidney cell line (HEK293) |
| EA.hy926 cell line | American Type Culture Collection (ATCC), Wesel, Germany | CRL-2922 | somatic cell hybrid clone of human umbilical vein cell line with a thioguanine-resistant clone of A549 |
| TILL iMIC | Till Photonics, Graefling, Germany | n.a. | digital microscope |
| Polychrome V monochromator | Till Photonics, Graefling, Germany | n.a. | ultra fast switching |
| AVT Stingray F145B | Allied Vision Technologies, Stadtroda, Germany | n.a. | Versatile CCD camera with Sony ICX285 EXview HAD sensor, IEEE 1394b |
| alpha Plan Fluar 40 | Zeiss, Göttingen, Germany | n.a. | x40 objective |
| dichroic filters | Chroma Technology Corp, Rockingham, Vermont, USA | n.a. | GFP emitter 514/3 nm (515dcxr) |
| ValveBank8 Controller | AutoMate Scientific, Inc., Berkeley, California, USA | 01-08 | programmable perfusion system control unit |
| BVC control | Vacuubrand, Wertheim, Germany | 727200 | Chemistry diaphragm pump ME 1C; vacuum pump for perfusion system |
| ImageJ software | NIH Image | Java image processing program inspired by NIH Image. http://imagej.net/Welcome |
Referenzen
- Eroglu, E., et al. Development of novel FP-based probes for live-cell imaging of nitric oxide dynamics. Nat Commun. 7, 10623 (2016).
- Bush, M., et al. The structural basis for enhancer-dependent assembly and activation of the AAA transcriptional activator NorR. Mo. Microbiol. 95 (1), 17-30 (2015).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nat. Methods. 13 (7), 557-562 (2016).
- D'Autréaux, B., Tucker, N., Spiro, S., Dixon, R., Poole, e. d. .. P. o. o. l. e. ,. R. .. K. .. ,. (. e. d. ). .. ,. Characterization of the Nitric Oxide-Reactive Transcriptional Activator NorR. Globins and Other Nitric Oxide-Reactive Proteins, Part B. 437, 235-251 (2008).
- Strack, R. Sensors and probes: Yes to genetically encoded NO• sensors. Nat Methods. 13 (4), 288 (2016).
- Auten, R. L. Response to 'The use of diaminofluorescein for nitric oxide detection: Conceptual and methodological distinction between NO and nitrosation. Free Radic. Biol. Med. 50 (12), 1812 (2011).
- Sivaraman, G., Anand, T., Chellappa, D. A Fluorescence Switch for the Detection of Nitric Oxide and Histidine and Its Application in Live Cell Imaging. ChemPlusChem. 79 (12), 1761-1766 (2014).
- Ye, X., Rubakhin, S. S., Sweedler, J. V. Detection of nitric oxide in single cells. Analyst. 133 (4), 423-433 (2008).
- Thyagarajan, B., Malli, R., Schmidt, K., Graier, W. F., Groschner, K. Nitric oxide inhibits capacitative Ca2+ entry by suppression of mitochondrial Ca2+ handling. Br J Pharmacol. 137 (6), 821-830 (2002).
- Germond, A., Fujita, H., Ichimura, T., Watanabe, T. M. Design and development of genetically encoded fluorescent sensors to monitor intracellular chemical and physical parameters. Biophy. Rev. 8, 121-138 (2016).
- Malli, R., Eroglu, E., Waldeck-Weiermair, M., Graier, W. F. Filling a GAP-An Optimized Probe for ER Ca2+ Imaging In Vivo. Cell Chem Biol. 23 (6), 641-643 (2016).
- Sato, M., Hida, N., Umezawa, Y. Imaging the nanomolar range of nitric oxide with an amplifier-coupled fluorescent indicator in living cells. Proc Natl Acad Sci USA. 102 (41), 14515-14520 (2005).
- Weidinger, A., Kozlov, A. V. Biological Activities of Reactive Oxygen and Nitrogen Species: Oxidative Stress versus Signal Transduction. Biomolecules. 5 (2), 472-484 (2015).
- Paolo, S. Nitric Oxide in Human Health and Disease. Encyclopedia of life sciences. , (2005).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87 (1), 315-424 (2007).
- Bonafe, F., Guarnieri, C., Muscari, C. Nitric oxide regulates multiple functions and fate of adult progenitor and stem cells. J Physiol Biochem. 71 (1), 141-153 (2015).
- Forstermann, U., Sessa, W. C. Nitric oxide synthases: regulation and function. Eur. Heart J. 33 (7), 829-837 (2012).
- Dudzinski, D. M., Igarashi, J., Greif, D., Michel, T. The regulation and pharmacology of endothelial nitric oxide synthase. Annu Rev Pharmacol Toxicol. 46, 235-276 (2006).
- Zhou, L., Zhu, D. -. Y. Neuronal nitric oxide synthase: structure, subcellular localization, regulation, and clinical implications. Nitric Oxide. 20 (4), 223-230 (2009).
- Aktan, F. iNOS-mediated nitric oxide production and its regulation. Life Sci. 75 (6), 639-653 (2004).
- Ghafourifar, P., Cadenas, E. Mitochondrial nitric oxide synthase. Trends Pharmacol Sci. 26 (4), 190-195 (2005).
- Crane, B. R., Sudhamsu, J., Patel, B. A. Bacterial nitric oxide synthases. Annu Rev Biochem. 79, 445-470 (2010).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat Rev Drug Discov. 7 (2), 156-167 (2008).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochim Biophys Acta. 1411 (2-3), 273-289 (1999).
- Zhang, Y., et al. Estrogen-related receptors stimulate pyruvate dehydrogenase kinase isoform 4 gene expression. J Biol Chem. 281 (52), 39897-39906 (2006).
- Holzmann, S., Kukovetz, W. R., Windischhofer, W., Paschke, E., Graier, W. F. Pharmacologic differentiation between endothelium-dependent relaxations sensitive and resistant to nitro-L-arginine in coronary arteries. J Cardiovasc Pharmacol. 23 (5), 747-756 (1994).
- Bentley, M., et al. Vesicular calcium regulates coat retention, fusogenicity, and size of pre-Golgi intermediates. Mol Biol Cell. 21 (6), 1033-1046 (2010).
- Ignarro, L. J. Nitric oxide: a unique endogenous signaling molecule in vascular biology. Biosci Rep. 19 (2), 51-71 (1999).
- Upreti, M., Kumar, S., Rath, P. C. Replacement of 198MQMDII203 of mouse IRF-1 by 197IPVEVV202 of human IRF-1 abrogates induction of IFN-β, iNOS, and COX-2 gene expression by IRF-1. Biochem Biophys Res Com. 314 (3), 737-744 (2004).
- Lacin, E., Muller, A., Fernando, M., Kleinfeld, D., Slesinger, P. A. Construction of Cell-based Neurotransmitter Fluorescent Engineered Reporters (CNiFERs) for Optical Detection of Neurotransmitters In Vivo. J Vis Exp. (111), (2016).
- de Nadal, E., Ammerer, G., Posas, F. Controlling gene expression in response to stress. Na. Rev Genet. 12 (12), 833-845 (2011).
- Latchman, D. S. Transcriptional Gene Regulation in Eukaryotes. Encyclopedia of life sciences. , (2005).
- Bertoli, C., Skotheim, J. M., de Bruin, R. A. M. Control of cell cycle transcription during G1 and S phases. Nat Rev Mol Cell Biol. 14 (8), 518-528 (2013).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Suarez, S. A., et al. Nitric oxide is reduced to HNO by proton-coupled nucleophilic attack by ascorbate, tyrosine, and other alcohols. A new route to HNO in biological media. J Am Chem Soc. 137 (14), 4720-4727 (2015).
- Kuropteva, Z. V., Kudryavtsev, M. E. Ferrous-ascorbate complexes as carriers of nitric oxide. Gen Physiol Biophys. 16 (1), 91-96 (1997).
- Vanin, A. F., Huisman, A., Stroes, E. S., Ruijter-Heijstek, F. C., Rabelink, T. J., van Faassen, E. E. Antioxidant capacity of mononitrosyl-iron-dithiocarbamate complexes: implications for NO trapping. Free Radic Biol Med. 30 (8), 813-824 (2001).
- Lindberg, R. A., Dewhirst, M. W., Buckley, B. J., Hughes, C. S., Whorton, A. R. Ca2+-dependent nitric oxide release in endothelial but not R3230Ac rat mammary adenocarcinoma cells. Am J Physiol. 271 (1), 332-337 (1996).
- Campo, G. M., et al. The SOD mimic MnTM-2-PyP(5+) reduces hyaluronan degradation-induced inflammation in mouse articular chondrocytes stimulated with Fe (II) plus ascorbate. Int J Biochem Cell Biol. 45 (8), 1610-1619 (2013).
- Waldeck-Weiermair, M., et al. Spatiotemporal correlations between cytosolic and mitochondrial Ca2+ signals using a novel red-shifted mitochondrial targeted cameleon. PLOS ONE. 7 (9), 45917 (2012).
- Kuzkaya, N., Weissmann, N., Harrison, D. G., Dikalov, S. Interactions of peroxynitrite with uric acid in the presence of ascorbate and thiols: implications for uncoupling endothelial nitric oxide synthase. Biochem Pharmacol. 70 (3), 343-354 (2005).
- Liu, J., Hughes, T. E., Sessa, W. C. The first 35 amino acids and fatty acylation sites determine the molecular targeting of endothelial nitric oxide synthase into the Golgi region of cells: a green fluorescent protein study. J Cell Biol. 137 (7), 1525-1535 (1997).
- Feron, O. The Endothelial Nitric-oxide Synthase-Caveolin Regulatory Cycle. J Biol Chem. 273 (6), 3125-3128 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten