Method Article
Aplicação de codificados geneticamente fluorescente óxido nítrico (NO •) Sondas, as geNOps, para imagens em tempo real de NO • Os sinais em células individuais
Neste Artigo
Resumo
This manuscript presents protocols for the application of novel genetically encoded nitric oxide (NO•) probes (geNOps) to monitor single cell NO• fluctuations in real-time using fluorescence microscopy. The Ca2+-triggered NO• formation on the level of individual endothelial cells was visualized by combining geNOps with a chemical Ca2+ sensor.
Resumo
O óxido nítrico (NO •) é um pequeno radical, que medeia múltiplas funções celulares importantes em mamíferos, bactérias e plantas. Apesar da existência de um grande número de métodos para a não detecção de • in vivo e in vitro, a monitorização em tempo real de NO • ao nível de uma única célula é um grande desafio. Os efeitos fisiológicos ou patológicos de NO • são determinadas pela concentração real e o tempo de paragem deste radical. Assim, os métodos que permitem a detecção de uma única célula de NO • são altamente desejáveis. Recentemente, ampliamos a palete de NO • indicadores, introduzindo única fluorescente óxido nítrico geneticamente codificado à base de proteínas sondas (NO •) (geNOps) que respondem diretamente para celulares não • flutuações e, portanto, atende a essa necessidade. Aqui demonstramos o uso de geNOps para avaliar intracelulares não • sinais em resposta a dois química diferente NO • moléculas -liberating. Nossos resultados alsO confirmam que recentemente preparada 3- (2-hidroxi-1-metil-2-nitrosohydrazino) -N-metil-1-propanamina (CON-7) tem um potencial muito mais elevado para evocar mudança na intracelulares não • níveis, em comparação com o inorgânica NO • nitroprussiato doador de sódio (SNP). Além disso, duas cores de imagem de células vivas usando os geNOps verde (G-geNOp) eo indicador químico Ca 2+ fura-2 foi realizada para visualizar a regulação apertada de Ca2 + dependente de NO • formação em células endoteliais individuais. Estas experiências representativas demonstram que geNOps são ferramentas adequadas para investigar a geração em tempo real e degradação de uma única célula não • sinais em diversas montagens experimentais.
Introdução
Recentemente, desenvolvemos uma nova classe de fluorescentes geneticamente codificados não • sondas, chamou os geNOps 1. Estes sensores consistir simplesmente de um construído, bactérias derivadas, NÃO • domínio de ligação 2, que é conjugado com uma proteína fluorescente distinto (FP) variante 3 (ciano, verde ou laranja FP). NÃO • se ligar ao centro de ferro não heme (II) 4 dentro dos geNOps reduz instantaneamente a intensidade de fluorescência 1. É importante ressaltar que a fluorescência geNOps recupera rápida e plenamente quando intracelulares não • níveis diminuem 1. Assim, geNOps permitem imagens em tempo real de (sub) celulares não • flutuações. Embora o NO • detecção mecanismo de geNOps permanecem obscuras até agora, eles provaram ser excelentes Não • repórteres, e, portanto, têm a potência para abrir uma nova era de policromático, quantitativa NO • bioimaging com altas resoluções espaciais e temporais 1, 5. Outros disponível fluorescentes NÃO • sondas são baseadas em compostos químicos pequenos, que têm de ser carregados em células, e são irreversivelmente modificadas por NO • 6. Desvantagens adicionais de NO • pequenas fluoróforos sensíveis são a sua citotoxicidade potencial e especificidade relativamente baixa o que torna difícil para usá-los de forma fiável, analítico e conclusivo 7, 8, 9. Embora o uso eficaz de sondas fluorescentes geneticamente codificados requer técnicas eficientes de transferência de genes, baseados em FP sensores geneticamente codificados surgiram como ferramentas indispensáveis que revolucionaram a nossa compreensão do funcionamento interno de células 10, 11. Antes do desenvolvimento das geNOps individuais baseados em FP, um Förster transferência de energia de ressonância (FRET) -based NÃO • sensor, referido como um NOA-12, foi construído. Sato et al. concebida esta sonda sofisticado, que consiste em duas subunidades do NO • sensível a guanilato ciclase solúvel (GCs), ambos conjugados sensores baseados em FRET para relatórios guanosina monofosfato cíclico (cGMP) níveis 12. Como esta sonda responde a cGMP, só indiretamente sente intracelulares não • flutuações 12. Embora NOA-1 responde a não • elevações na faixa de nano-molar, esta ferramenta não tem sido utilizado com frequência, até agora, provavelmente devido a limitações quanto à disponibilidade e viabilidade de este sensor bipartite volumoso.
Funções versáteis de NO •, que impacto fundamental processos biológicos têm sido bem caracterizados 13, 14. Muitos estudos provaram que o NO • Concentraçãn dentro das células e subdomínios determina o destino celular na saúde e doenças 14, 15, 16. Em mamíferos, NÃO • é gerado principalmente enzimaticamente em vários tipos de células pela família bem caracterizada sintase de óxido nítrico (NOS) 17. Até agora, três isoformas de NOS foram descritos 18, 19, 20; estes são o Ca 2+ endotelial / dependente de calmodulina-NOS (eNOS ou NOS-3) 18 e neuronal NOS (nNOS ou NOS-1) 19, eo Ca2 + / calmodulina-independente constitutivamente ativa NOS induzível (iNOS ou NOS- 2) 20. Além disso, a existência de mitocondrial NOS (mtNOS) também tem sido sugerida 21. No entanto, mtNOS é considerado como uma variante de splicing de nNOS, e, por conseguinte não é classificado separadamente como uma isoforma de 21. Outra isoforma, para além daqueles em células de mamífero, é o chamado NOS bacteriana (bNOS), encontra-se principalmente em bactérias gram-positivas 22. A produção enzimática de NO • é altamente controlada e depende da disponibilidade de vários co-factores, tais como fosfato de dinucleótido nicotinamida adenina (NADPH), flavina adenina dinucleótido (FAD), tetra-hidrobiopterina (BH4), oxigénio molecular e L-arginina 17. O aminoácido L-arginina é o substrato catiónico que é convertido em L-citrulina em cima NÃO • produção 17. Para além da geração enzimática altamente regulada • de NO, tem sido postulado que o radical pode ser reduzido não enzimaticamente a partir de misturas de nitritos por mitocôndrias sob condições de hipoxia 23. Uma vez NO • é produzido dentro de uma célula, que pode se difundir livremente através biomembranes 14,ref "> 15. No entanto, a meia-vida muito curta deste radical é determinada principalmente pelas condições ambientais, e vários caminhos e reações químicas degradar de forma eficiente não • níveis 24. Eventualmente, a formação, difusão e degradação de NO • depende em diversos parâmetros ambientais que determinar a concentração eficaz da molécula altamente biologicamente activa 24.
A tecnologia geNOps permite a detecção directa de (sub) NO celular • flutuação 1 e é, portanto, adequado para investigar novamente, e recentemente descobrir os mecanismos responsáveis pelo acúmulo e decomposição de celulares não • sinais. Aqui, nós fornecemos protocolos simples e resultados representativos para o uso de geNOps para visualizar exogenamente evocado e endogenamente gerados NO • Perfis, sobre o nível de células individuais. Além disso, a tecnologia geNOps pode ser adaptado para application em outros sistemas modelo celular para estudar os padrões complexos de NO • formação, difusão e degradação em resposta a diversos estímulos celulares e tensões.
Protocolo
1. Preparação de tampões e soluções químicas
- Preparar um tampão de armazenamento contendo NaCl 135 mM, KCl 5 mM, CaCl 2 2 mM, MgCl 2 1 mM, HEPES 10 mM, 2,6 mM de NaHCO3, 0,44 mM de KH 2 PO 4, 2 mM de Na 0,34 HPO 4, 10 mM de D- glucose, 2 mM de L-glutamina, 1x MEM de vitaminas, ácidos aminados 1x MEM, 1% de pen strep a 1% e anfotericina B. Dissolve-se todos os componentes em água destilada e agita-se o tampão durante 20 min usando um agitador magnético, à temperatura ambiente. Ajustar o pH a 7,44 com NaOH 1 M. Após a adição gota a gota de NaOH, medir o pH com um medidor de pH, enquanto continuamente mexendo.
- Preparar um tampão de Ca 2+ molecular contendo fisiológico que consiste de NaCl 140 mM, KCl 5 mM, CaCl2 2 mM, MgCl 2 mM, D-glicose 10 mM, 1, e 10 mM de HEPES. Ajustar o pH para 7,4 utilizando NaOH como descrito na etapa 1.1.
- Preparar um tampão livre de Ca 2+ que consiste dos mesmos ingredientescomo listado no passo 1.2. Use 1 mM EGTA em vez de 2 mM.
- Solubiliza-se Fura-2:00 em DMSO para se obter uma solução de estoque 1 mM. Alíquota da solução estoque em tubos de ensaio hermeticamente fechado e armazenar a -20 ° C durante até um mês. Se congelado, permitir que a solução de reserva a equilibrar à temperatura ambiente durante pelo menos 1 hora ao abrigo da luz. Dilui-se a solução stock de Fura-2:00 em 1 mL de tampão de armazenamento (passo 1.1) para se obter uma concentração final de 3,3 uM.
- Prepare 1 ml de uma solução de estoque de histamina 100 mM em água destilada (pH 7,0). Dilui-se a solução estoque 100 mM de histamina em 100 ml de Ca 2+ molecular contendo tampão fisiológico para uma concentração final de 100 pM de histamina.
- Solubiliza-Nco-nitro-L-arginina (L-NNA) em 100 ml de tampão fisiológico contendo cálcio para se obter uma concentração final de 300 uM. Armazenar as soluções a 37 ° C banho de água durante pelo menos 1 hora até que a L-NNA esteja completamente dissolvido.
- Solubiliza-se 10 mg de 7-NOC em WA destiladaTer (pH 7,0) para se obter uma solução de reserva 10 mM. Alíquota da solução estoque em pequenas alíquotas em frascos hermeticamente fechados e imediatamente a -70 ° C. Dilui-se a solução estoque CON-7 num tampão fisiológico para obter uma concentração final de 10 uM CON-7.
NOTA: CON-7 é um composto químico pequeno que liberta espontaneamente NO, com uma meia-vida curta. Sempre preparar os buffers de trabalho que consiste apenas NOC-7 antes de cada experiência. - Adicione uma solução 1 mM de nitroprussiato de sódio (SNP) num tampão fisiológico de cálcio e preparar uma diluição de 10 uM.
NOTA: Sempre preparar pequenas quantidades (~ 10 ml) de soluções de dador de NO, devido à taxa de degradação rápida. - Prepara-se uma solução de fosfato tamponada (PBS) que consiste em 137 mM de NaCl, 2,7 mM de KCl, 9,2 mM de Na 2 HPO 4, 1,5 mM e KH 2 PO 4. Ajustar o valor de pH a 7,44 com NaOH / HCI.
2. Preparação de células
NOTA: Em order para alcançar a uniformidade no desempenho de medição do óxido nítrico (NO •) em células individuais utilizando geNOps, as células têm de ser pré-incubada com o ferro (II) / vitamina C que contém tampão antes para experiências de imagiologia de modo a restaurar a Fe 2+ dentro do nO • domínio liga�o ao do nO • -probes. No caso de células EA.hy926 e HEK293, incubação durante 20 min com a solução de reforço de ferro (II) conduz a activação completa do NO • sensores.
- Semente de 5,5 x 10 5 EA.hy926 ou células HEK293 para o dia seguinte ou 3,5 x 10 5 células para o dia após dia seguinte, em 30 mm vidros de cobertura do microscópio em um poço de uma placa de 6 poços. Incubar as células a 37 ° C num ambiente humidificado com 5% de CO 2.
NOTA: as informações detalhadas sobre a infecção adenoviral de células de mamíferos e construção de vírus foi descrito por Zhang et ai. 25. Esta etapa não se aplica para as células HEK 293 que expressam de forma estável G-geNOp. - Tome soro fetal de vitelo (FCS) e águia meio modificado por Dulbecco (DMEM) isento de antibiótico e adicionar adeno-associado tipo de vírus 5 (AAV5) vector que transporta o gene que codifica para o G-geNOp (MOI: 500 para células EA.hy926 produzem quase 100 % de células positivas; MOI: 1 é eficiente para células HEK293).
NOTA: O uso de vetores virais adeno-associados é atribuído ao grupo de risco 2. Biossegurança confinamento de grau 2 é geralmente necessária para o trabalho com este vector. Se necessário, a infecção pelo vírus também pode ser realizado em FCS contendo meio. Alternativamente, as células podem ser transfectadas transientemente utilizando transportadores à base de lípidos 1. - Remover o meio de cultura e lavar as células com pré-aquecido (37 ° C) PBS. Adicionar 1 ml de meio DMEM / AAV5 em cada cavidade durante 1 hora. Esta etapa não se aplica para as células HEK 293 que expressam de forma estável G-geNOp.
- Adicionar 1 ml de FCS a 20% contendo DMEM em cada poço a uma concentração final de 10% de FCS. Não remova a mídia AAV5 contendo a partir das células. cavalheiroLY oscilar a placa para homogeneizar o meio dentro dos poços. Incubar as células durante 48 h a 37 ° C num ambiente humidificado com 5% de CO 2. Esta etapa não se aplica às células HEK 293 que expressam de forma estável G-geNOp.
- Após 48 horas, lavar as células com PBS pré-aquecido. Subsequentemente, adicionar 2 ml de tampão pré-aquecido de armazenamento (secção 1.1) a cada poço e incubar as células na sala TA durante pelo menos 1 hr protegido contra a radiação da luz.
- Substituir o tampão de armazenamento com 1 ml / poço de a (II) de ferro de reforço solução à temperatura ambiente (RT). Incubar as células durante exactamente 20 min no escuro.
NOTA: Não exceda ou reduzir o tempo de incubação ideal, pois isso pode afetar a capacidade de resposta dos não • sondas. - Lave as células uma vez com tampão de armazenamento e incubar cada poço com 2 ml de tampão de armazenamento durante pelo menos 2 horas à temperatura ambiente, a fim de permitir que as células se equilibre.
- Substituir o tampão de armazenamento com 3,3 fiM de Fura-2:00 em tampão de armazenamento de 1 ml durante 45 min à temperatura ambiente, protegidada luz.
- Lavar as células duas vezes com o tampão de armazenamento e incubar, mais uma vez durante pelo menos 30 minutos, a fim de permitir que as células se equilibre.
3. Imagens de células vivas de NO • e Ca 2+ Signals em células individuais
- Corrigir um 30 milímetros tampa de deslizamento revestido com células EAhy.926 ou HEK293 (do passo 2.1) em um compartimento metálico perfusão e colocá-lo no microscópio. Ligar o tubo de afluxo para os reservatórios de tampão e o efluxo de uma bomba de vácuo. Garantir um fluxo consistente e evitar a drenagem do lamela.
- Inicie a perfusão conduzido por gravidade com tampão fisiológica de cálcio (a partir do passo 1.2), utilizando um sistema de perfusão semi-automático.
NOTA: Este sistema consiste de reservatórios de tampão, os respectivos tubos, válvulas magnéticas que são controlados electronicamente e uma bomba de vácuo (ver Figura 1B). O caudal pode variar de 1 a 3 ml / min, dependendo da altura dos reservatórios de perfusão. Para apli drogas locais consistentescação, a taxa de fluxo de todos os reservatórios utilizados deve ser aproximadamente igual. Isto deve ser testado antes de experiências de imagiologia. Considere-se que células endoteliais responder a um aumento da tensão de corte, que pode ser induzida por perfusão rigorosa. - Ligue o sistema de imagem e permitir que o warm up de todos os dispositivos para 30 min.
- Definir as configurações de imagem usando respectivo software. Select excitação comprimento de onda de 340 nm e 380 nm para o fura-2 de imagem e 480 nm para excitar G-geNOp. Para minimizar a fluorescência de branqueamento aumentar o binning câmera para 4 e reduzir a intensidade de excitação e tempos de exposição. Veja também os passos 3,6-3,8.
NOTA: As configurações de imagem e parâmetros dependem dos dispositivos utilizados, fura-2 eficiência de carregamento e os níveis de expressão G-geNOp. - Selecione a região de imagem movendo-table xyz a do microscópio até várias células fluorescentes estão no foco. Em seguida, definir regiões de interesse (ROI) por meio da respectiva ferramenta de software. Desenhe regiões que abrangem diversos toda single células fluorescentes por campo de imagem manualmente. Além disso, definem uma região de fundo de tamanho semelhante.
NOTA: Uma vez que as imagens tenham sido adquiridos e armazenados ROIs também pode ser definida recentemente, após o processo de imagem para análise posterior usando respectivo software de análise de imagem (veja Lista de Materiais). - Iniciar a recolha de dados sobre um microscópio de fluorescência invertida e avançado com uma fase de amostra motorizado, e uma fonte de luz monocromática. Alternadamente excita a 340 nm e 380 nm para Fura-02:00 e 480 nm para o G-geNOp, respectivamente. Definir os respectivos tempos de exposição de modo que para todos os canais, um sinal de fluorescência claro é detectável ao longo do tempo. Consulte também o passo 3.4.
NOTA: Este depende da intensidade da luz de excitação e a criação de faixas de câmara. Por exemplo, usar 15% da intensidade da luz de excitação, um binning câmera de 4 e 150 ms para 340 nm, 50 ms para 380 nm, e 300 ms para 480 nm. Consulte também o passo 3.4. - Recolhe a luz emitida a 510 nm para o fura-2 / AM, 520 nm para o G-Genop utilizando um dispositivo de câmara de carga acoplada (CCD) com o conjunto de filtro apropriado que consiste na excitação 500 nm, uma dicróica 495 nm e um emissor de 510-520 nm. Gravar um quadro total de cada 3 s.
- Registam-se os primeiros minutos (se necessário até 3 minutos) em tampão fisiológico de Ca2 + (1,2) para se obter a linha de base dos respectivos sinais de fluorescência ao longo do tempo.
- Uma vez que uma linha de base estável de fluorescência é observado, alternar a 100 uM de histamina ou ATP (1? M ou 100? M) contendo tampão fisiológica de Ca 2+ para estimular as células durante 3 min.
NOTA: As células EA.hy926 que respondem aos agonistas mostram um aumento acentuado do rácio de fura-2 (fluorescência excitada a 340 nm dividida pela fluorescência animado em 380 nm) e uma diminuição clara do sinal de fluorescência G-geNOp. - Voltar para o tampão fisiológico Ca 2+, sem histamina ou ATP e L-NNA por 5 min para remover os compostos a partir das células. Esta etapa pode ser prolongada até as FLUORESalterações cência são completamente recuperados.
- Administrar 10 uM CON-7 em tampão fisiológico Ca 2+ durante 2 min utilizando o sistema de perfusão. O dador de NO afecta fortemente L-geNOp de fluorescência, que normalmente diminui por> 20% em resposta a 10 uM CON-7. Em células EA.hy926 o efeito CON-7 é cerca de 3 vezes mais forte em comparação com a induzida por agonista L-geNOp fluorescência de têmpera.
- Lavar o composto liberador de NO • por aproximadamente 10 min com Ca 2+ fisiológica tampão e parar a gravação, uma vez fluorescência basal é recuperado.
Análise 4. Dados
- Exportação adquiridos dados de intensidade de fluorescência média de células individuais ao longo do tempo, para o software de análise de dados.
- Subtrair respectivos valores de fundo e calcular o rácio de 340 nm, em 380 nm dos seus respectivos sinais de Fura-2 de cada única célula ao longo do tempo.
- Subtrair os valores do canal L-geNOp fundo para obter o fl realuorescência intensidade da sonda NÃO (F) ao longo do tempo usando qualquer software de cálculo.
- Aqui os valores da linha de base de fluorescência como F 0 (F 0 é a fluorescência da sonda de NO ao longo do tempo, sem estimulação). Veja também o passo 4.5 e Figura 1C.
- Calcular uma função ao longo do tempo para que os efeitos de fluorescência de branqueamento utilizando a seguinte equação: F 0 = F inital • exp (K • Time) + F planalto. F inital: sinal de fluorescência máxima vez de imagem é iniciado; K: constante da taxa de fluorescência ao longo do tempo de branqueamento; Mínimo de fluorescência atingido por branqueamento ao longo do tempo;: plateau F Veja também as etapas de 4.3- 4.4 e Figura 1C.
NOTA: Para o aproximação, todos os valores de fluorescência ao longo do tempo, antes e após a estimulação de células pode ser utilizado. Mais detalhes são especificados por Bentley et al. 27. - Para normalizar o sinal L-geNOp ao longo do tempo, calcular 1-F / F0 (Passos 4,3-4,5). Ver Figura 1C e 1D.
Resultados
Visualização de uma única célula NÃO • Perfis em resposta a transitoriamente Aplicada NO Doadores
Foi utilizado um clone de células HEK que expressam estavelmente L-geNOp (Figura 1A), a fim de visualizar NÃO • sinais sobre o nível de uma única célula em resposta a dois pequenos compostos químicos que libertam NO diferentes, NOC-7 e SNP. Os não • doadores foram consecutivamente aplicado e removido a partir de células durante a imagem utilizando um sistema de perfusão à base de gravidade que garantiu fluxo contínuo (Figura 1B). Todas as células que expressam G-geNOp com diferentes intensidades mostrou uma clara redução da fluorescência em resposta a NOC-7 e SNP (Figura 1C), indicando rápido NO • acumulação nas células com a adição dos não • doadores. Sinais de fluorescência normalizados (1-F / F 0) demonstraram que tanto Não • doadores evocado cellula homogênear NÃO • elevações que completamente recuperados após a lavagem dos compostos liberador de não • (Figura 1D). No entanto, 10 uM de SNP induziu apenas 50% do NO celular • sinal (9.63 ± 1.05%, n = 3/38), que foi alcançado de 10 uM CON-7 (18,10 ± 1,20%, N = 3/38, p < 0,0001). A fim de atingir iguais intracelulares não • níveis com dois doadores NO •, foi necessária uma concentração de 1 mM de SNP (Figuras 1C, 1D).
Em seguida, testamos a capacidade dos recém-preparados contra expirado NOC-7 para elevar intracelulares não • níveis em células HEK. Para esta finalidade, preparou quatro buffers experimentais contendo 5 uM CON-7. O NO • dador foi adicionado de fresco, quer apenas antes da medição, ou mantidos em reservatórios durante 1 h, 2 h e 3 h à temperatura ambiente antes da medição. Os diferentes tampões foram consecutivamente aplicados e removidos from as células que expressam G-geNOp utilizando um sistema de perfusão (Figura 2B). Esta abordagem revelou a estabilidade de NOC-7 soluções aquosas que, como esperado, houve diminuição da capacidade ao longo do tempo para elevar os níveis intracelulares não • (Figuras 2A, 2C). Curiosamente, NÃO • Os sinais de recuperação significativamente mais rápida após a remoção de tampões expirados, em comparação com o intracelular NÃO • resposta que foi evocado por fresco CON-7 (Figura 2C), talvez indicando adesão das moléculas intactas NÃO • -liberating em componentes celulares .
A visualização simultânea de Ca 2+ e NÃO • Os sinais nas células endoteliais individuais
A fim de estudar Ca 2+ Triggered NÃO • formação em células endoteliais, as células endoteliais imortalizadas de células-substituto comumente utilizado, linha de células EA.hy926, foi transiently transfectadas com G-geNOp e carregado com Fura-2 / AM (ver protocolo 2.8). A transfecção produziram aproximadamente 10% de células endoteliais positivas L-geNOp (n = 6, Figura 3A), o que é suficiente para gravar Ca 2+ -evoked NÃO • produção do nível de células endoteliais individuais. No entanto, obtivemos quase 100% de L-geNOp células EA.hy926 positiva utilizando um vector viral adeno-associado (n = 6; ver protocolo 2.2). Antes das medições de vários canais, as células foram incubadas durante 20 min à temperatura ambiente em tampão de armazenagem que consiste de L-NNA, um potente inibidor irreversível SOE-26. As células de controlo foram mantidos no mesmo tampão de armazenamento sem L-NNA (ver Protocolo de 1,1) (Figura 3B). O tratamento de células de controlo com histamina, um potente inositol 1,4,5-trifosfato (IP 3) -generating agonista, instantaneamente elevados níveis citosólica de Ca2 +, seguido de um aumento gradual de intracelular NÃO • até que o agonista era removerd (Figuras 3C, 3D). As células pré-tratadas com o inibidor NOS-mostrou citosólicos de Ca2 + sinais semelhantes, enquanto o intracelular NO • nível manteve-se praticamente inalterado em resposta à histamina (Figura 3E). EA.hy926 células que expressam G-geNOp também foram tratadas com 1? M e 100? M de PI 3 -generating agonista de ATP a fim de testar se ou não geNOps são adequados para monitorar NÃO • sinais em resposta a ambos baixa fisiológica e supra-fisiológica As concentrações de agonista (Figura 3F). Na linha celular endotelial 1 uM ATP evocada uma clara citosólica NÃO • sinal, que era cerca de metade do sinal obtido por 100 uM de ATP (Figura 3F).

Figura 1: Perfis de NO intracelular em resposta a diferentes NO-Liberati ng moléculas. (A) imagens de campo largo de células HEK expressando estavelmente citosólica G-geNOp. Barra de escala = 20 mm. (B) Ilustração esquemática de um sistema semi-automático com base gravidade de perfusão para a aplicação e remoção controlada de NOC-7 e SNP. (C) representativas (de 3 experiências independentes) não normalizada intensidade da fluorescência de uma única célula traça em unidades arbitrárias em função do tempo de células HEK que expressam estavelmente citosólica L-geNOp em resposta a 10 uM CON-7, 10 uM de SNP, e 1 mM de SNP. Preto curva em negrito representa a curva média de 26 traços de uma única célula (leves curvas cinza). Curva preta pontilhada representa F 0, o qual foi utilizado para normalização. (D) os traços individuais normalizadas e invertido (1-F / F 0, luz curvas de cinza), e significa curva (curva em negrito preto) ao longo do tempo em resposta a 10 mM NOC-7, 10 mM SNP, e SNP 1 mM extraído de painel C.es / ftp_upload / 55486 / 55486fig1large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
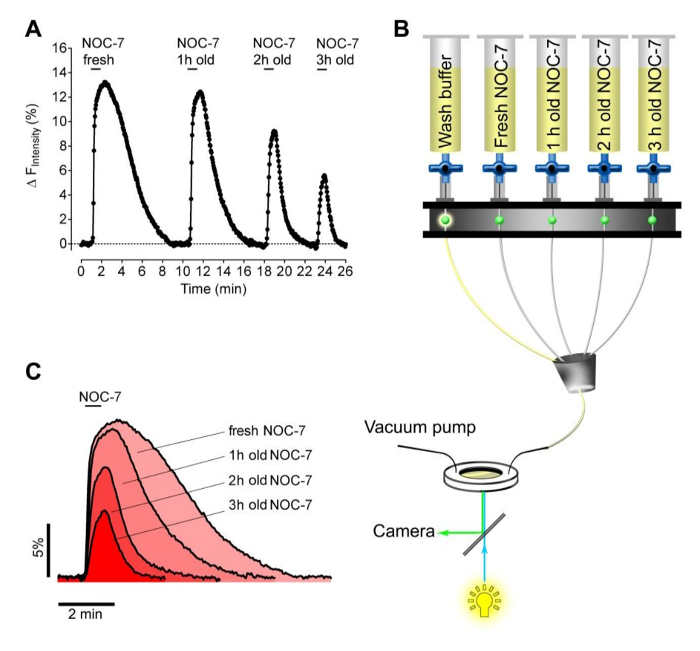
Figura 2: Teste de estabilidade de NOC-7 utilizando células HEK de forma estável que expressam G-geNOp. (A) Representante NO • curva de resposta concentração ao longo do tempo de estavelmente G-GeNOps expressando células HEK a pedido da NOC-7 soluções tampão frescos e velhos. Todos os tampões que contenham NOC-7 foram preparados inicialmente com uma concentração final de 5 uM, utilizando a mesma solução estoque (50 mM). O tempo decorrido das respectivas soluções após a preparação, até valores de imagem para 1 hora, 2 horas e 3 horas, como indicado. (B) Ilustração esquemática de um sistema de perfusão meia-automático baseado gravidade para adicionar e remover consecutivamente soluções NOC-7 contendo durante a imagem. (C) correlações temporais decelular não • sinais em resposta ao recém-preparados e velhos NOC-7 buffers. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: imagem multicanal simultânea de NO • e Ca 2+ sinais em células EA.hy926 individuais. (A) representativos imagens de fluorescência de todo o campo de células que expressam G-EAhy.926 geNOp (painel esquerdo) que são carregadas com fura-2 / AM (média e painéis da direita). Barra de escala = 20 mm. (B) Ilustração esquemática do tratamento de células com 500 uM EAhy.926 Nco-nitro-L-arginina (L-NNA), durante 20 minutos dentro de uma placa de seis poços antes da medição. (C) curso de tempo Representante de um registro simultâneo de fura-2 (excitação: 340 nm / 380 nm Emissde iões: 510 nm) e os sinais de L-geNOp (excitação: 480 nm; emissão: 520 nm), em resposta a 100? M de histamina. Como indicado histamina foi removido após 3 min utilizando um sistema de perfusão. (Linha de Fura-2 sinais de relação, F 340 / F 380 é sólido cinzento) (D) Curvas representam gravações simultâneas de Ca citosólico 2 + e NO • (curva normalizada e invertida, 1-F / F 0 é a linha verde sólido) sinais ao longo do tempo de um único Fura-2 / aM carregado de células endoteliais que expressam transitoriamente L-geNOp. As células foram estimuladas com 100? M de histamina durante 3 min numa Ca2 + (2 mM CaCl2) contendo tampão (n = 8/3). (E) representativas gravado simultaneamente Ca 2+ (linha cinzenta sólida) e NO • (linha sólida verde) sinais ao longo do tempo de uma célula EA.hy926 que foi pré-tratadas com 500 uM Nco-nitro-L-arginina (L-NNA) antes a medição (n = 12/3). As células foram tratadas com 100 uM de histamina na presença de 2 mMCa 2+. (F) representam curvas médias citossólicos não • sinais em resposta a um ATP? M seguido de uma segunda estimulação das células com ATP 100 uM. As barras representam valores médios ± SD de sinais máximas G-geNOp em resposta a um ATP? M (barra branca) e ATP 100? M (barra verde) de 4 experiências independentes; P <0,001 em comparação com 1 uM de ATP. P-valor foi calculado usando um teste t não pareado. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Desde a descoberta de NO • como uma importante molécula de sinalização em biologia 28, a medição em tempo real, específico do radical em células isoladas, tecidos e animais inteiros com alta resolução de uma forma viável e fiável foi aspirado. Aqui nós relatamos a aplicação de recentemente desenvolvidos geneticamente codificados fluorescentes Não • sondas (geNOps) que permitem exata de imagens ao vivo de células de NO • sinais usando microscopia de fluorescência de campo amplo 1.
Para contornar procedimentos de transfecção elaborados e invasivos clone de células HEK que expressa de forma estável fluorescente verde G-geNOp foi utilizado para quantificar unicelulares exogenamente gerado não • perfis. Como as células HEK normalmente não produzem endogenamente • NO 29, este tipo de células é adequado para a geração de uma linha celular do sensor baseado no geNOp, que pode ser útil para muitas outras aplicações em condições de co-culturaSEM • produção de células primárias ou mesmo em animais 30 vivendo. No entanto, no presente estudo demonstram que a capacidade de vários compostos NÃO • -liberating, de diferentes concentrações e estabilidades, para evocar intracelulares não • sinais utilizando o modelo de células HEK expressando G-geNOp. Nossos dados revelaram que o NO • -donor concentração, qualidade e método de aplicação, eventualmente, determinar os padrões de não intracelulares • Perfis. Tal informação é indispensável para a caracterização in situ farmacocinético de diferentes Não • doadores, que são indicativos de várias doenças. Notavelmente, geNOps foram mostrados para responder de forma estável para aplicações múltiplas repetitivas de NO • -donor pulsos ao longo de um muito longo tempo 1. Assim, os experimentos utilizando NO • -liberating compostos aqui apresentados, permitem conclusões semi-quantitativos sobre as várias amplitudes e cinética da respectiva NO celular226; sinais (Figuras 1 e 2).
Embora o clone de células HEK expressando de modo estável, provavelmente, tem origem a partir de uma única célula, uma grande heterogeneidade dos níveis de expressão G-geNOps foi observado (Figura 1). Esta é uma característica comum de clones celulares estáveis como a transcrição do gene (integrada no genoma) de interesse está sob o controlo de diversos factores, tais como diversas tensões ambientais 31 que influenciam taxas de crescimento da célula 32, e o estado do ciclo celular 33. Os únicos geNOps baseados em FP são sondas não-raciométrica e, portanto, a perda induzida NÃO • da intensidade de fluorescência aumenta com o nível de expressão geNOp 1. Por conseguinte, a normalização dos sinais geNOps é essencial para a quantificação celulares não • sinais particularmente no caso de uma análise comparativa. Como mostrado em nosso estudo recente, um rigoroso linear correlação bntre a intensidade de fluorescência basal de geNOps e a força da extinção de fluorescência induzida por NO • sobre uma ampla gama de intensidades de fluorescência foi encontrado um. Esta é uma característica importante do geNOps para a quantificação absoluta de celulares não • sinais. Como mostrado na Figura 1, a normalização dos sinais de G-geNOps em resposta a NOC-7 e SNP revelou homogéneos não • sinais em células HEK diferentes a partir da mesma placa, indicando que as células HEK não são diferentes no que diz respeito à sua capacidade para assumir e degradam o radical nO • que se origina a partir do nO • doador. Em contraste, usando geNOps em células HeLa demonstraram heterogeneidades claras de celulares não • sinais entre células diferentes em resposta a NOC-7. Estas diferenças apontam para não • taxas de metabolismo e decomposição de tipo específico de célula, que pode ter várias implicações na fisiologia celular e patologia, e pode ser descoberto usando o geNOps tecnologia.
No entanto, duas características importantes de geNOps têm de ser cuidadosamente considerada para o uso correto dos sensores e interpretações de dados: i) geNOps exigem adequado de ferro (II) para responder plenamente à NO • 1 e ii) dependendo da variante FP, geNOps pode ser sensíveis ao pH 1. Descrevemos aqui um protocolo que foi encontrado para ser adequado para a suplementação de ferro não tóxico (II) de geNOps, as quais são expressas quer em células HEK, células HeLa ou células EA.hy926 (ver protocolo 2.6). Embora tenha sido demonstrado que o tratamento de células com ferro (II) / vitamina C não afectou a morfologia celular, a viabilidade celular e a actividade metabólica das células 1, que pode ser essencial para optimizar este passo importante para outros tipos de células e tecidos. No entanto, em algumas condições experimentais, o requisito de carga de ferro (II) pode limitar a aplicabilidade do geNOps. Notavelmente, tem sido mostrado que o ácido ascórbico pode reduzir NO • 35 e ascorbato de ferro (II) é capaz de limpar NO • 36, 37. Além disso, o excesso de ferro (II) e ascorbato pode induzir respostas inflamatórias 39 e eNOS desacoplar 41. Tais efeitos devem ser considerados quando se utiliza a tecnologia geNOps. Tem sido mostrado que, sob certas condições experimentais, o pH intracelular é afectada significativamente 34, que tem o potencial de influenciar o geNOps fluorescência 1. Notavelmente, as ciano e verde geNOps variantes são relativamente sensíveis ao pH que mostra uma diminuição da fluorescência após acidificação 1. Assim, alterações agudas do (sub) pH celular pode simular falsos NÃO • sinais ao usar os geNOps sensíveis ao pH. Como sugerido no nosso trabalho anterior, o uso paralelo de NÃO • geNOps insensíveis (geNOps mut) como contro negativols é recomendado para dissecar verdadeira celular NO • sinal do pH muda 1. Além disso alterações do pH celular pode ser inspeccionada utilizando sondas de pH, tais como Sypher 34.
Além disso, o que visualizado enzimática endógena de NO • formação em resposta a um fisiológico Ca2 + -mobilizing agonista na célula endotelial EA.hy926 substituto. A linha de células EA.hy926 é um sistema modelo usado com freqüência consistentemente expressar eNOS 38. Uso de geNOps transitoriamente expressos em células EA.hy926, confirmou que a IP 3 mediada por sinais de Ca2 + evocar profunda NO • formação neste tipo de célula, que foi quase completamente bloqueada pelo L-NNA. Para correlacionar temporariamente Ca 2+ com NÃO • sinais, as células G-geNOp expressando foram carregados com o UV-excitável química Ca 2+ -Indicador fura-2 / AM. A separação espectral do Ca 2+ ligado e não ligado fura-2 fluo rescência a partir do sinal L-geNOp pode ser facilmente conseguido com filtro comercialmente disponível 40 define. Imaging ambas as sondas revelou que o Ca 2+ Triggered enzimática NO • formação ocorre muito mais lento em comparação com aumento do Ca2 + citosólico neste tipo de células endoteliais. Cinética similar de uma única célula não • sinais em células endoteliais de artéria pulmonar bovina em cima do tratamento com células com a bradicinina agonista IP 3 -generating, bem como tensões de cisalhamento foram reportados utilizando NOA-1, um sensor altamente NO • sensível a indireta 12 . Por conseguinte, estes dados evidenciam que o Ca2 + -evoked derivado da eNOS NÃO • formação requer um certo tempo de partida até que a actividade enzimática completa seja alcançada. Embora a cinética celular de NO • formação, difusão e degradação pode ser extraído a partir de outros dados, por exemplo baseada em medições de tensão de NO induzida por relaxamento • vasoss = "xref"> 26, o grande benefício de não fluorescentes • sondas é que convertem diretamente celulares não • flutuações em sinais visíveis em tempo real. Assim, imagiologia NÃO celular • sinais com geNOps proporciona alta resolução espacial e temporal, e oferece possibilidades únicas no (re) investigar a (sub) celular NO • homeostase. Por exemplo, a imagem latente da eNOS vaivém 42 em combinação com a tecnologia geNOps em células endoteliais individuais pode ser adequado para correlacionar NÃO • formação com a localização subcelular e translocação do NO • -producing enzima ou outras proteínas relevantes, tais como a calmodulina e caveolin 43.
Aqui nós descrevemos a aplicação possível de G-geNOp expressando células HEK e EA.hy926 para visualizar exogenamente e endogenamente gerada celulares não • sinais no nível de uma única célula e em tempo real em um convencional amplo campo de fluorescência microscope. Os nossos dados implicam que geNOps são adequados para controlar especificamente celulares (sub) não • dinâmica sob várias condições experimentais utilizando todos os tipos de tipos celulares interessantes.
Divulgações
EE, MW, RM e WFG, membros do pessoal da Universidade de Medicina de Graz, ter apresentado um pedido de patente do Reino Unido (número pedido de patente WO2015EP74877 20.151.027, número de prioridade GB20140019073 20.141.027) que descrevem partes da pesquisa neste manuscrito. Licenças relacionadas com esta patente são fornecidos para Next Generation Fluorescência de imagem (NGFI) GmbH ( http://www.ngfi.eu/ ), uma empresa spin-off da Universidade de Medicina de Graz.
Agradecimentos
The authors acknowledge C.J. Edgell, Pathology Department, University of North Carolina at Chapel Hill, NC, USA for providing the EA.hy926 cells. Author E.E. is supported by Nikon Austria within the Nikon-Center of Excellence, Graz and is a fellow of the Ph.D. program in Molecular Medicine at the Medical University of Graz. The researchers are also supported by the Ph.D. program Metabolic and Cardiovascular Disease (DK-W1226) of the Medical University of Graz. This work was also funded by the FWF project P 28529-B27. Microscopic equipment is part of the Nikon-Center of Excellence, Graz that is supported by the Austrian infrastructure program 2013/2014, Nikon Austria Inc., and BioTechMed, Graz.
Materiais
| Name | Company | Catalog Number | Comments |
| NaCl | Carl Roth, Karlsruhe, Germany | 3957.20 | sodium chloride |
| KCl | Carl Roth, Karlsruhe, Germany | 6781.1 | potassium chloride |
| CaCl2 .2H2O | Carl Roth, Karlsruhe, Germany | T885.1 | calcium chloride dihydrate |
| MgCl2 .6H2O | Carl Roth, Karlsruhe, Germany | 2189.2 | magnesium chloride hexahydrate |
| HEPES | Carl Roth, Karlsruhe, Germany | 9105.3 | 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid |
| NaHCO3 | Carl Roth, Karlsruhe, Germany | 8551.1 | sodium hydrogencarbonate |
| KH2PO4 | Merck, Darmstadt, Germany | 104873 | potassium dihydrogen phosphate |
| Na2HPO4 .2H2O | Carl Roth, Karlsruhe, Germany | 4984.1 | sodium hydrogenphosphate dihydrate |
| D(+)-Glucose monohydrate | Carl Roth, Karlsruhe, Germany | 6780.1 | >99.5%; for cell culture, endotoxin free; |
| EGTA | Carl Roth, Karlsruhe, Germany | 3054.2 | ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid; calcium chelating agent |
| NaOH | Carl Roth, Karlsruhe, Germany | 6771.1 | sodium hydroxide |
| HCl | Carl Roth, Karlsruhe, Germany | 4625.1 | hydrochloric acid, fuming, 37% (~10 N) |
| DMSO | Carl Roth, Karlsruhe, Germany | 4720.1 | dimethyl sulfoxide; highly polar, aprotic organic solvent |
| L-Glutamic acid hydrochloride | Sigma Aldrich, Vienna, Austria | G2128 | (S)-2-Aminoglutaric acid |
| DMEM, low glucose | Sigma Aldrich, Vienna, Austria | D5523 | Dulbecco’s Modified Eagle’s Medium - low glucose; with 1000 mg/L glucose and L-glutamine, without sodium bicarbonate, powder, suitable for cell culture |
| MEM Vitamin solution (100X) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11120037 | 100x the vitamins found in the standard Minimum Essential Medium (MEM) |
| MEM Amino acids solution (50X) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 11130036 | 50X the essential amino acids (except L-glutamine) found in the standard Minimum Essential Medium (MEM) |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15140122.00 | antibiotics to prevent bacterial contamination of cell cultures |
| Amphotericin B | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 15290026.00 | Gibco Amphotericin B contains 250 µg of amphotericin B (Fungizone) and 205 µg of sodium deoxycholate; prevents the contamination of cell cultures by yeast and multicellular fungi |
| FCS | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10270106 | Fetal Bovine Serum, qualified, E.U.-approved, South America origin |
| PBS, pH 7.4 | Gibco/Thermo Fisher Scientific, Waltham, MA, USA | 10010031.00 | phosphate-buffered saline |
| Fura-2 (AM) | Teflabs, Austin, TX, USA | 102 | fluorescent cytosolic calcium indicators |
| Histamine dihydrochlorid | Sigma Aldrich, Vienna, Austria | H7250 | 2-(4-Imidazolyl)ethylamine dihydrochloride; IP3-generating agonist |
| Nω-Nitro-L-arginine | Sigma Aldrich, Vienna, Austria | N5501 | N5-(Nitroamidino)-L-2,5-diaminopentanoic acid; L-NNA; inhibitor of nitric oxide synthase |
| NOC-7 | Calbiochem/Merck, Darmstadt, Germany | 487952 | 3-(2-Hydroxy-1-methyl-2-nitrosohydrazino)-N-methyl-1-propanamine; nitric oxide (NO) donor short half-life of NO release |
| Sodium nitroprusside dihydrate | Santa Cruz Biotechnology, Texas, USA | sc-203395A | sodium nitroferricyanide(III) dihydrate; nitric oxide releasing compound |
| 30-mm Cover slips | Karl Hecht, Sondheim v. d. Rhön, Germany | 41001130 | glass cover slips, HECHT "Assistent", size 1, round, 30-mm, (VE: 100 pcs.) |
| Iron(II) booster solution | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | Iron(II) containing physiological buffer for non toxic iron(II) loading of cells; http://www.ngfi.eu/product/ironii-booster-solution/ |
| G-geNOp plasmid | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | plasmid DNA encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product/g-genop/ |
| G-geNOp AAV5 | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | adenovirus encoding green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/viral-genops-vectors/g-genop-aav5/ |
| G-geNOp sensor cell line | Next generation fluorescent imaging (NGFI), Graz, Austria | n.a. | human embryonic kidney cell line (HEK293) stably expressing green NO sensitive probe (G-geNOp); http://www.ngfi.eu/product-category/genops/g-genop-sensor-cell-line/ |
| HEK293A cell line | Invitrogen/Thermo Fisher Scientific, Waltham, MA, USA | R70507 | subclone of human embryonic kidney cell line (HEK293) |
| EA.hy926 cell line | American Type Culture Collection (ATCC), Wesel, Germany | CRL-2922 | somatic cell hybrid clone of human umbilical vein cell line with a thioguanine-resistant clone of A549 |
| TILL iMIC | Till Photonics, Graefling, Germany | n.a. | digital microscope |
| Polychrome V monochromator | Till Photonics, Graefling, Germany | n.a. | ultra fast switching |
| AVT Stingray F145B | Allied Vision Technologies, Stadtroda, Germany | n.a. | Versatile CCD camera with Sony ICX285 EXview HAD sensor, IEEE 1394b |
| alpha Plan Fluar 40 | Zeiss, Göttingen, Germany | n.a. | x40 objective |
| dichroic filters | Chroma Technology Corp, Rockingham, Vermont, USA | n.a. | GFP emitter 514/3 nm (515dcxr) |
| ValveBank8 Controller | AutoMate Scientific, Inc., Berkeley, California, USA | 01-08 | programmable perfusion system control unit |
| BVC control | Vacuubrand, Wertheim, Germany | 727200 | Chemistry diaphragm pump ME 1C; vacuum pump for perfusion system |
| ImageJ software | NIH Image | Java image processing program inspired by NIH Image. http://imagej.net/Welcome |
Referências
- Eroglu, E., et al. Development of novel FP-based probes for live-cell imaging of nitric oxide dynamics. Nat Commun. 7, 10623 (2016).
- Bush, M., et al. The structural basis for enhancer-dependent assembly and activation of the AAA transcriptional activator NorR. Mo. Microbiol. 95 (1), 17-30 (2015).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nat. Methods. 13 (7), 557-562 (2016).
- D'Autréaux, B., Tucker, N., Spiro, S., Dixon, R., Poole, e. d. .. P. o. o. l. e. ,. R. .. K. .. ,. (. e. d. ). .. ,. Characterization of the Nitric Oxide-Reactive Transcriptional Activator NorR. Globins and Other Nitric Oxide-Reactive Proteins, Part B. 437, 235-251 (2008).
- Strack, R. Sensors and probes: Yes to genetically encoded NO• sensors. Nat Methods. 13 (4), 288 (2016).
- Auten, R. L. Response to 'The use of diaminofluorescein for nitric oxide detection: Conceptual and methodological distinction between NO and nitrosation. Free Radic. Biol. Med. 50 (12), 1812 (2011).
- Sivaraman, G., Anand, T., Chellappa, D. A Fluorescence Switch for the Detection of Nitric Oxide and Histidine and Its Application in Live Cell Imaging. ChemPlusChem. 79 (12), 1761-1766 (2014).
- Ye, X., Rubakhin, S. S., Sweedler, J. V. Detection of nitric oxide in single cells. Analyst. 133 (4), 423-433 (2008).
- Thyagarajan, B., Malli, R., Schmidt, K., Graier, W. F., Groschner, K. Nitric oxide inhibits capacitative Ca2+ entry by suppression of mitochondrial Ca2+ handling. Br J Pharmacol. 137 (6), 821-830 (2002).
- Germond, A., Fujita, H., Ichimura, T., Watanabe, T. M. Design and development of genetically encoded fluorescent sensors to monitor intracellular chemical and physical parameters. Biophy. Rev. 8, 121-138 (2016).
- Malli, R., Eroglu, E., Waldeck-Weiermair, M., Graier, W. F. Filling a GAP-An Optimized Probe for ER Ca2+ Imaging In Vivo. Cell Chem Biol. 23 (6), 641-643 (2016).
- Sato, M., Hida, N., Umezawa, Y. Imaging the nanomolar range of nitric oxide with an amplifier-coupled fluorescent indicator in living cells. Proc Natl Acad Sci USA. 102 (41), 14515-14520 (2005).
- Weidinger, A., Kozlov, A. V. Biological Activities of Reactive Oxygen and Nitrogen Species: Oxidative Stress versus Signal Transduction. Biomolecules. 5 (2), 472-484 (2015).
- Paolo, S. Nitric Oxide in Human Health and Disease. Encyclopedia of life sciences. , (2005).
- Pacher, P., Beckman, J. S., Liaudet, L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 87 (1), 315-424 (2007).
- Bonafe, F., Guarnieri, C., Muscari, C. Nitric oxide regulates multiple functions and fate of adult progenitor and stem cells. J Physiol Biochem. 71 (1), 141-153 (2015).
- Forstermann, U., Sessa, W. C. Nitric oxide synthases: regulation and function. Eur. Heart J. 33 (7), 829-837 (2012).
- Dudzinski, D. M., Igarashi, J., Greif, D., Michel, T. The regulation and pharmacology of endothelial nitric oxide synthase. Annu Rev Pharmacol Toxicol. 46, 235-276 (2006).
- Zhou, L., Zhu, D. -. Y. Neuronal nitric oxide synthase: structure, subcellular localization, regulation, and clinical implications. Nitric Oxide. 20 (4), 223-230 (2009).
- Aktan, F. iNOS-mediated nitric oxide production and its regulation. Life Sci. 75 (6), 639-653 (2004).
- Ghafourifar, P., Cadenas, E. Mitochondrial nitric oxide synthase. Trends Pharmacol Sci. 26 (4), 190-195 (2005).
- Crane, B. R., Sudhamsu, J., Patel, B. A. Bacterial nitric oxide synthases. Annu Rev Biochem. 79, 445-470 (2010).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nat Rev Drug Discov. 7 (2), 156-167 (2008).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochim Biophys Acta. 1411 (2-3), 273-289 (1999).
- Zhang, Y., et al. Estrogen-related receptors stimulate pyruvate dehydrogenase kinase isoform 4 gene expression. J Biol Chem. 281 (52), 39897-39906 (2006).
- Holzmann, S., Kukovetz, W. R., Windischhofer, W., Paschke, E., Graier, W. F. Pharmacologic differentiation between endothelium-dependent relaxations sensitive and resistant to nitro-L-arginine in coronary arteries. J Cardiovasc Pharmacol. 23 (5), 747-756 (1994).
- Bentley, M., et al. Vesicular calcium regulates coat retention, fusogenicity, and size of pre-Golgi intermediates. Mol Biol Cell. 21 (6), 1033-1046 (2010).
- Ignarro, L. J. Nitric oxide: a unique endogenous signaling molecule in vascular biology. Biosci Rep. 19 (2), 51-71 (1999).
- Upreti, M., Kumar, S., Rath, P. C. Replacement of 198MQMDII203 of mouse IRF-1 by 197IPVEVV202 of human IRF-1 abrogates induction of IFN-β, iNOS, and COX-2 gene expression by IRF-1. Biochem Biophys Res Com. 314 (3), 737-744 (2004).
- Lacin, E., Muller, A., Fernando, M., Kleinfeld, D., Slesinger, P. A. Construction of Cell-based Neurotransmitter Fluorescent Engineered Reporters (CNiFERs) for Optical Detection of Neurotransmitters In Vivo. J Vis Exp. (111), (2016).
- de Nadal, E., Ammerer, G., Posas, F. Controlling gene expression in response to stress. Na. Rev Genet. 12 (12), 833-845 (2011).
- Latchman, D. S. Transcriptional Gene Regulation in Eukaryotes. Encyclopedia of life sciences. , (2005).
- Bertoli, C., Skotheim, J. M., de Bruin, R. A. M. Control of cell cycle transcription during G1 and S phases. Nat Rev Mol Cell Biol. 14 (8), 518-528 (2013).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Suarez, S. A., et al. Nitric oxide is reduced to HNO by proton-coupled nucleophilic attack by ascorbate, tyrosine, and other alcohols. A new route to HNO in biological media. J Am Chem Soc. 137 (14), 4720-4727 (2015).
- Kuropteva, Z. V., Kudryavtsev, M. E. Ferrous-ascorbate complexes as carriers of nitric oxide. Gen Physiol Biophys. 16 (1), 91-96 (1997).
- Vanin, A. F., Huisman, A., Stroes, E. S., Ruijter-Heijstek, F. C., Rabelink, T. J., van Faassen, E. E. Antioxidant capacity of mononitrosyl-iron-dithiocarbamate complexes: implications for NO trapping. Free Radic Biol Med. 30 (8), 813-824 (2001).
- Lindberg, R. A., Dewhirst, M. W., Buckley, B. J., Hughes, C. S., Whorton, A. R. Ca2+-dependent nitric oxide release in endothelial but not R3230Ac rat mammary adenocarcinoma cells. Am J Physiol. 271 (1), 332-337 (1996).
- Campo, G. M., et al. The SOD mimic MnTM-2-PyP(5+) reduces hyaluronan degradation-induced inflammation in mouse articular chondrocytes stimulated with Fe (II) plus ascorbate. Int J Biochem Cell Biol. 45 (8), 1610-1619 (2013).
- Waldeck-Weiermair, M., et al. Spatiotemporal correlations between cytosolic and mitochondrial Ca2+ signals using a novel red-shifted mitochondrial targeted cameleon. PLOS ONE. 7 (9), 45917 (2012).
- Kuzkaya, N., Weissmann, N., Harrison, D. G., Dikalov, S. Interactions of peroxynitrite with uric acid in the presence of ascorbate and thiols: implications for uncoupling endothelial nitric oxide synthase. Biochem Pharmacol. 70 (3), 343-354 (2005).
- Liu, J., Hughes, T. E., Sessa, W. C. The first 35 amino acids and fatty acylation sites determine the molecular targeting of endothelial nitric oxide synthase into the Golgi region of cells: a green fluorescent protein study. J Cell Biol. 137 (7), 1525-1535 (1997).
- Feron, O. The Endothelial Nitric-oxide Synthase-Caveolin Regulatory Cycle. J Biol Chem. 273 (6), 3125-3128 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados