Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Der 4-Gefäß-Stichprobenansatz für integrative Studien der menschlichen Plazenta-Physiologie
In diesem Artikel
Zusammenfassung
Wir präsentieren eine detaillierte Methode, um die menschliche Plazenta-Physiologie in vivo zu studieren. Die Methode kombiniert die Blutentnahme von den ankommenden und ausgehenden Gefäßen auf der mütterlichen und fötalen Seite der Plazenta mit Ultraschallmessungen von Volumen Blutfluss und Plazenta Gewebe Probenahme.
Zusammenfassung
Die menschliche Plazenta ist für die Forschung sehr unzugänglich, während sie sich noch in utero befindet . Das gegenwärtige Verständnis der menschlichen Plazenta-Physiologie in vivo beruht daher weitgehend auf Tierversuchen, trotz der hohen Vielfalt der Arten in der Plazenta-Anatomie, der Hämodynamik und der Dauer der Schwangerschaft. Die überwiegende Mehrheit der menschlichen Plazenta-Studien sind Ex-vivo- Perfusions-Studien oder in vitro- Trophoblasten-Studien. Obwohl in vitro Studien und Tiermodelle wesentlich sind, ist die Extrapolation der Ergebnisse aus solchen Studien auf die menschliche Plazenta in vivo ungewiss. Wir zielten darauf ab, die menschliche Plazenta-Physiologie in vivo zu behandeln und ein detailliertes Protokoll der Methode vorzustellen. Durch die Ausnutzung des intraabdominellen Zugangs zur Uterusvene kurz vor dem Uterusschnitt während des geplanten Kaiserschnittes sammeln wir Blutproben aus den ankommenden und ausgehenden Schiffen auf der mütterlichen und fötalen Seite der Plazenta. Bei der Kombination von conKonzentrationsmessungen von Blutproben mit Volumen Blutflussmessungen, sind wir in der Lage, Plazenta und fetale Aufnahme und Freisetzung einer Verbindung zu quantifizieren. Darüber hinaus können Plazenta-Gewebeproben aus denselben Mutter-Fötus-Paaren Messungen der Transporterdichte und -aktivität und anderer Aspekte von Plazenta-Funktionen in vivo liefern. Durch diese integrative Nutzung der 4-Gefäß-Probenahme-Methode sind wir in der Lage, einige der aktuellen Konzepte der Plazenta Nährstofftransfer und Metabolismus in vivo , sowohl in normalen und pathologischen Schwangerschaften zu testen. Darüber hinaus ermöglicht diese Methode die Identifizierung von Substanzen, die von der Plazenta auf die mütterliche Zirkulation abgesondert werden, was ein wichtiger Beitrag zur Suche nach Biomarkern der Plazenta-Dysfunktion sein könnte.
Einleitung
Nach den National Institutes of Health, USA, ist die Plazenta das am wenigsten verstandene Organ im menschlichen Körper 1 , 2 , 3 . Es ist schwierig, die menschliche Plazenta in vivo zugänglich zu machen und zu studieren, ohne die fortdauernde Schwangerschaft unethisch zu riskieren. Studien der Plazenta-Funktion im Menschen sind daher weitgehend auf In-vitro- und Ex-vivo- Modellen basiert. Die Mehrheit der bisherigen in vivo Studien des Plazententransports und des Stoffwechsels wurden bei den Tieren 4 , 5 , 6 durchgeführt . Da jedoch die Plazenta-Struktur und die Funktionen zwischen den Arten stark variieren, muss die Extrapolation der Ergebnisse von Tieren auf den Menschen mit Vorsicht erfolgen. Nur wenige kleinere menschliche in vivo Studien haben plazentale und fetale Aufnahme und Transport unter normalen physiologischen untersuchtAl-Bedingungen, und keiner hat die integrierte Übertragung mehrerer Verbindungen 7 , 8 , 9 , 10 , 11 , 12 , 13 untersucht . Diese grundlegenden Studien zeigen, dass in vivo Studien der menschlichen Plazenta machbar sind und dass sie mehrere Zwecke dienen können. Zuerst können aktuelle Konzepte von Plazenta-Funktionen, die hauptsächlich aus in vitro , ex vivo und Tierstudien abgeleitet sind, in einer menschlichen Umgebung getestet werden und so einen neuen und spezifischeren Einblick in die menschliche Plazenta liefern. Zweitens können die Eigenschaften der dysfunktionellen Plazenta, die mit einem abweichenden fetalen Wachstum, Präeklampsie, mütterlichem Diabetes, metabolischem Syndrom und anderen mütterlichen Stoffwechselstörungen assoziiert sind, besser charakterisiert werden. Drittens bieten menschliche In-vivo- Studien die Möglichkeit, Diagnosen zu entwickelnTic und prädiktive Werkzeuge der Plazenta-Funktion.
Vor diesem Hintergrund wollten wir eine umfassende Sammlung physiologischer Daten erstellen, um die menschliche Plazenta-Funktion in vivo zu untersuchen . Während eines geplanten Kaiserschnittes nutzen wir den intraabdominellen Zugang zur Uterusvene, um Blutproben aus den ankommenden und ausgehenden Gefäßen auf den mütterlichen und fötalen Seiten der Plazenta (die 4-Gefäß-Probenahme-Methode) zu sammeln. Diese Proben werden verwendet , um die paarige arteriovenöse Konzentrationsunterschiede von Nährstoffen zu berechnen und anderen Substanzen 14. Darüber hinaus messen wir den Volumenblutfluss auf beiden Seiten der Plazenta durch Ultraschall. Folglich kann eine Plazenta- und fetale Aufnahme einer beliebigen Verbindung quantifiziert werden. Ferner ist es möglich, von der Plazenta freigesetzte Stoffe zu den mütterlichen und fetalen Zirkulationen 15 , 16 , 17 zu bestimmen. Beim KombinierenD mit klinischen Parametern von Mutter und Kind und Analysen von Plazenta und anderen relevanten Geweben hat diese Methode das spannende Potenzial, viele Aspekte von Plazenta-Funktionen in vivo in denselben Mutter-Fötus-Paaren zu integrieren.
Protokoll
Die Studie wurde von den Datenschutzbeauftragten am Universitätsklinikum Oslo und dem Regionalkomitee für Medizinische und Gesundheitsforschung Ethik, Südnorwegen 2419/2011, genehmigt. Alle Teilnehmer unterschrieben eine schriftliche Einverständniserklärung.
1. Vorbereitungen
HINWEIS: Eine Zeitleiste für die Prozeduren ist in Abbildung 1 dargestellt .
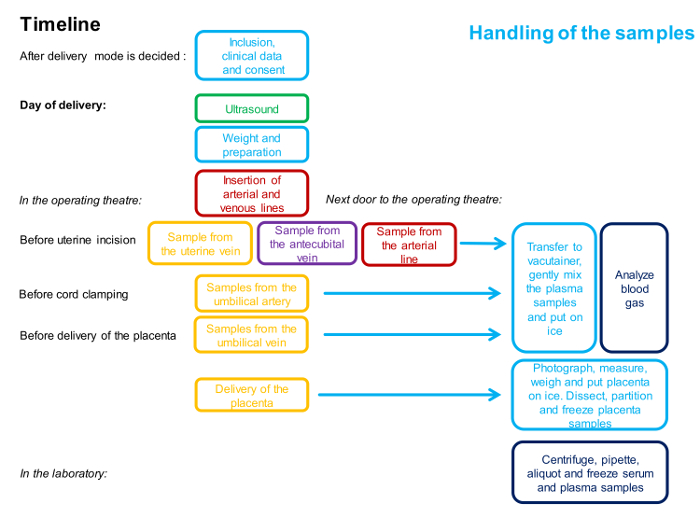
Abbildung 1 : Flussdiagramm Beschreiben des Timings und des Personals, das in der 4-Gefäß-Stichprobenverfahren involviert ist.
Eine Farbe repräsentiert eine Person. Detaillierte Beschreibung der Methode ist im Protokoll angegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Personal
- Stellen Sie sicher, dass alle erforderlichen Mitarbeiter zur Verfügung stehen: ein hochqualifizierter Fetalmedizin-Spezialist, der die Ultraschallmessungen durchführt, zwei Geburtshelfer, die die Chirurgie durchführen, einer der Geburtshelfer und zwei Krankenschwestern, die die Proben sammeln, ein Assistent, der die Blutgasanalysen und einen Assistenten verarbeitet Andere Proben nacheinander und unmittelbar nach der Sammlung.
ANMERKUNG: Im Falle einer fortgeschritteneren Sammlung von Plazenta-Gewebe ist eine zusätzliche Person erforderlich.
- Stellen Sie sicher, dass alle erforderlichen Mitarbeiter zur Verfügung stehen: ein hochqualifizierter Fetalmedizin-Spezialist, der die Ultraschallmessungen durchführt, zwei Geburtshelfer, die die Chirurgie durchführen, einer der Geburtshelfer und zwei Krankenschwestern, die die Proben sammeln, ein Assistent, der die Blutgasanalysen und einen Assistenten verarbeitet Andere Proben nacheinander und unmittelbar nach der Sammlung.
- Ausrüstung
- Vorbereitung der Ausrüstung, 50 ml eiskalte 1 M phosphatgepufferte Kochsalzlösung (PBS), 25 ml kalte RNA-stabilisierende Lösung und 5 x 0,5 ml der optimalen Schneidtemperatur-Verbindung (OCT). Etikettieren Sie die Vacutainer und Röhren. Siehe vorläufige Liste der Ausrüstung.
2. Mütterliche Merkmale
- Notieren Sie die mütterlichen klinischen und nicht-klinischen Merkmale bei der Aufnahme und wiederholen Sie relevante Fragen und michAsurements, einschließlich Gewicht, zum Zeitpunkt der Lieferung. Notieren Sie die Dauer der Fastenzeit vor dem Kaiserschnitt und alle blutdrucksenkenden Episoden, die während der Operation auftreten.
Anmerkung: Fügen Sie den minimalen mütterlichen klinischen Datensatz in einer aktuellen Veröffentlichung von Global Pregnancy CoLaboratory (COLAB) gemeldet. Dieser Artikel enthält auch einige sehr wichtige Aspekte bei der Auswahl der Studienpopulationen und sollte bei der Planung der Studie 18 angesprochen werden. - Betrachten Sie die Aufzeichnung von väterlichen Merkmalen, einschließlich Ethnizität, Alter und Body Mass Index (BMI).
3. Ultraschall
- Führen Sie die Doppler-Ultraschalluntersuchung am Tag der Auslieferung durch, mit den Frauen im Fastenzustand. Führen Sie die Untersuchung während einer Periode der fetalen Ruhe, mit der Frau in semi-Rückenlage Position, etwas seitlich gegenüber der Region von Interesse gekippt, um Kompression der Aorta und Hohlvene zu vermeiden. Überwachen Sie den Ausgang inTensität durch die mechanischen und thermischen Indizes auf dem Display.
- Nabelschnur
- Manifestiere die Nabelvene in einer sagittalen oder schrägen Transektion des fötalen Abdomens. Messen Sie den inneren Gefäßdurchmesser im geraden Teil der intraabdominalen Nabelvene, bevor Sie sichtbare Zweige haben. Verwenden Sie den regulären B-Modus und visualisieren Sie das Gefäß in einem senkrechten Insonationswinkel für Durchmessermessungen und halten Sie mehrere optimale Rahmen für spätere Messungen, um die Wirkung von Änderungen des pulsierenden Durchmessers zu minimieren.
- Wiederholen Sie die Messungen fünf bis zehn mal 19 .
- Am selben Ort verwenden Sie Doppler-Ultraschall und stellen Sie die Sonde so ein, dass sie einen möglichst geringen Insonationswinkel (immer <30 °) erhält, um die zeitlich gemittelte maximale Geschwindigkeit (TAMX) zu messen. Erhalten Sie die Geschwindigkeit über einen Zeitraum von 3 - 5 s (nicht pulsierende Strömung).
- Manifestiere die Nabelvene in einer sagittalen oder schrägen Transektion des fötalen Abdomens. Messen Sie den inneren Gefäßdurchmesser im geraden Teil der intraabdominalen Nabelvene, bevor Sie sichtbare Zweige haben. Verwenden Sie den regulären B-Modus und visualisieren Sie das Gefäß in einem senkrechten Insonationswinkel für Durchmessermessungen und halten Sie mehrere optimale Rahmen für spätere Messungen, um die Wirkung von Änderungen des pulsierenden Durchmessers zu minimieren.
- Uterine Arterie
- Doppler benutzenUltraschall, um die Gebärmutterarterie zu visualisieren, während sie die äußere Iliakalarterie kreuzt, unmittelbar nachdem sie von der A. iliaca interna verzweigt. Stellen Sie die Sonde an dieser Stelle ein, um einen niedrigen Isolationswinkel (immer <30 °) zu erhalten und TAMX zu messen. Erhalten Sie die Geschwindigkeit als die mittlere Geschwindigkeit von drei Herzzyklen.
- Da es unwahrscheinlich ist, dass ein senkrechter Winkel an der gleichen Stelle wie TAMX gemessen wird, folgen Sie dem Gefäß distal, um einen korrekten Winkel für Durchmessermessungen zu erhalten, so nah wie möglich an den Stellen der Durchmessermessungen als erreichbar. Die Durchmessermessungen ausschließen, wenn sichtbare Gefäße vor dieser Stelle abzweigen, ausgewertet durch Farb-Doppler-Ultraschall.
- Verwenden Sie den regulären B-Modus und visualisieren Sie das Gefäß in einem senkrechten Insonationswinkel für Durchmessermessungen und halten Sie mehrere optimale Rahmen für spätere Messungen, um die Wirkung von Änderungen des pulsierenden Durchmessers zu minimieren.
- Wiederholen Sie die Messungen fünf bis zehn mal 19 .
- Beachten Sie die Position der Plazenta.
4. 4-Gefäß Blutentnahme
ANMERKUNG: Die Zeitleiste für die Prozeduren ist in Abbildung 1 dargestellt und ein Überblick über die Proben ist in Abbildung 2 dargestellt .
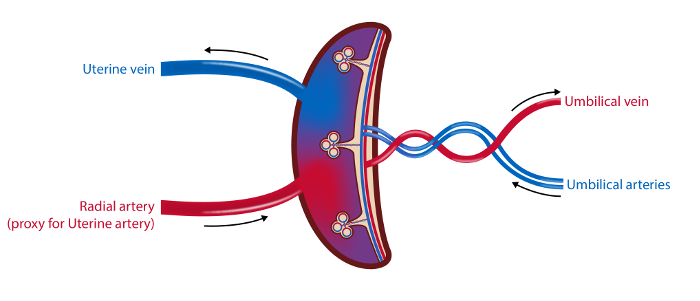
Abbildung 2 : Schematische Darstellung der Placental Vasculature und der Sampling Sites.
Bei der 4-Gefäß-Probenahme werden Blutproben aus der Uterusvene, der Radialarterie (als Proxy für die Uterusarterie) und den Nabelarterien und Vene gezogen. Blutfluss in der Uterusarterie und der Nabelvene wird durch Ultraschall gemessen. Gewebeproben aus der Plazenta werden gesammelt. Abbildung: Øystein H. Horgmo, Universität Oslo.5847fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Sicherheitsmassnahmen
- Geben Sie alle Mitarbeiter im Operationssaal mit Handschuhen, chirurgischen Scrub-Anzügen, Masken und Kopfbedeckungen.
- Stellen Sie den Chirurgen und Forschungspersonal in Kontakt mit dem Operationsfeld mit chirurgischen Scrub-Anzügen, Masken, Kopfbedeckungen, Kleidern und Doppelhandschuhen. Gläser sind optional.
- Stellen Sie das Personal zur Handhabung der Blutproben mit Handschuhen bei.
- Stellen Sie das Personal zur Handhabung der Placenta-Proben mit Handschuhen und chirurgischen Masken zur Verfügung. Die Homogenisierung erfordert die Verwendung von Hauben.
- Vorbereitung im Operationssaal
- Geben Sie ein Briefing und Hand die Ausrüstung für alle Mitarbeiter, die die Probenahme vor Beginn der Operation zu unterstützen.
- Ansprache der Anästhesisten und Anästhesiologie Krankenschwester, die mit dem notwendigen peripheren arteriellen und venösen Zugang zu unterstützen, und sicherzustellen, dassWährend der Probenahme werden keine Flüssigkeiten intravenös verabreicht.
- Geben Sie drei Spritzen (10 ml) ohne Nadeln an die Person, die mit der antecubitalen Aderprobe und zwei Spritzen (eine 20 ml und eine 10 ml) und eine Blutgasspritze (mit Heparin) an die Person unterstützt, die mit der radialen Arterie hilft.
- Bereiten Sie zwei sterile Spritzen (20 ml), fünf sterile Spritzen (10 ml), drei "Schmetterlingsnadeln" und zwei Blutgasspritzen für das Operationsfeld vor.
- Zugang zu Blutgefäßen.
- Befolgen Sie das Standardverfahren vor dem Kaiserschnitt, um den peripheren intravenösen (iv) Zugang zu gewährleisten.
HINWEIS: Die antecubitale Vene ist vorzuziehen, weil es einfacher ist, Proben von dieser Seite zu ziehen. - Lokalisieren Sie die radiale Arterie am Handgelenk durch Ultraschall oder durch Palpation. Nach 0,5 mL subkutaner Lidocain-Analgesie, legen Sie eine arterielle Linie in die radiale Arterie. Verlassen Sie die Probenahme von dieser Seite im Falle von drei fehlgeschlagenen Einfügungen, oderWenn die Frau während der Insertion Schmerzen erlebt.
HINWEIS: Führen Sie den chirurgischen Eingriff des Kaiserschnittes nach Standardverfahren durch. Im Folgenden werden nur die für das Stichprobenverfahren erforderlichen Anpassungen unterstrichen.
- Befolgen Sie das Standardverfahren vor dem Kaiserschnitt, um den peripheren intravenösen (iv) Zugang zu gewährleisten.
- Mütterliche Blutproben
HINWEIS: Erhält alle drei mütterlichen Blutproben (Uterusvene, Radialarterie und Antecubitalvene) gleichzeitig vor dem Uterusschnitt.- Für die Uterusvene, nach dem Öffnen der Bauchhöhle, verwenden Sie einen Retraktor, um die Bauchwand zu heben und die Hauptäste der Uterusvenen auf den anterolateralen Seiten des Uterus freizulegen. Erhalten Sie Blut von Uterusvenen Zweige auf der gleichen Seite wie die Plazenta, wann immer möglich oder verwenden Sie die prominentesten Vene Plexus, wenn die Plazenta befindet sich in der uterinen Mittellinie.
- Legen Sie eine Schmetterlingsnadel auf eine Blutgas-Spritze in der Uterusvene in einem Winkel von etwa 30 Grad und sammeln Sie Blut durch sanfte Aspiration zu vermeidenHämolyse Bei sorgfältiger Sicherung der iv-Position der Schmetterlingsnadel die gefüllte Blutgasspritze durch eine 20 mL und eine 10 mL Spritze nacheinander ersetzen.
HINWEIS: Der optimale Zugang ist am besten auf der kontralateralen Seite der gewählten Uterusvene gewährleistet.
- Legen Sie eine Schmetterlingsnadel auf eine Blutgas-Spritze in der Uterusvene in einem Winkel von etwa 30 Grad und sammeln Sie Blut durch sanfte Aspiration zu vermeidenHämolyse Bei sorgfältiger Sicherung der iv-Position der Schmetterlingsnadel die gefüllte Blutgasspritze durch eine 20 mL und eine 10 mL Spritze nacheinander ersetzen.
- Für die radiale Arterie, aspirieren aus der intra-arteriellen Linie. Die ersten 5 ml verwerfen und dann 3 ml in der Heparinspritze für Blutgasanalysen aspirieren, gefolgt von 3 ml in zwei Spritzen (20 + 10 ml).
- Für die antecubitale Vene, saugt sanft aus dem intravenösen Katheter. Die ersten 5 ml verwerfen und dann 30 ml in drei Spritzen (10 ml) absaugen.
- Führen Sie eine endgültige Inspektion der Probenahmestelle auf der Uterusvene durch, bevor Sie beginnen, den Bauch zu schließen.
- Für die Uterusvene, nach dem Öffnen der Bauchhöhle, verwenden Sie einen Retraktor, um die Bauchwand zu heben und die Hauptäste der Uterusvenen auf den anterolateralen Seiten des Uterus freizulegen. Erhalten Sie Blut von Uterusvenen Zweige auf der gleichen Seite wie die Plazenta, wann immer möglich oder verwenden Sie die prominentesten Vene Plexus, wenn die Plazenta befindet sich in der uterinen Mittellinie.
- Fetale Blutproben
- Wenn das Kind geboren wird, sofort Aspiration von Blut aus der Nabelarterie, ohne die Nabelschnur zu klemmen oder die Plazenta zu liefern. Start WitzH die Spritze für die Blutgasanalyse, und folgen mit drei 10 ml Spritzen, wenn möglich.
- Wenn die Arterienproben gesichert sind, klemmen Sie die Schnur und geben Sie das Kind an die Hebamme vor der Probenahme aus der Nabelvene (Blutgas und 20 + 10 ml Spritzen).
HINWEIS: Erhalten Sie alle Nabelproben innerhalb von Sekunden nach Lieferung und mit der Plazenta in situ, es sei denn, es hat sich spontan abgetrennt. - Befolgen Sie die norwegischen Empfehlungen zum späten Schnurklemmen. Im Falle eines verzweifelten Kindes, klemme und schneide die Schnur sofort und die Hand das Kind an die Hebamme und Neonatologen.
- Umgang mit Blutproben
- Setzen Sie die Blutgasspritzen auf Eis, während Sie den Rest der Blutproben vorbereiten und analysieren sie in einem Blutgasanalysator innerhalb von 5 min.
- Übertragen Sie die Blutproben sofort auf Vacutainer und legen Sie die Plasmaschläuche 1 - 2 min auf eine Wippe, bevor Sie sie auf Eis legen. Lassen Sie die Serumröhrchen auf die ArbeitStuhlbank für 30 Minuten zu begleichen.
HINWEIS: Dies ist ein kritischer Schritt in der Prozedur, die zusätzliche Aufmerksamkeit benötigt, da Proben von allen fünf Standorten gleichzeitig vorbereitet werden müssen, um eine gute Qualität zu gewährleisten. - Die Plasmaproben so schnell wie möglich zentrifugieren und innerhalb von 30 min bei 6 ° C, 2500 xg für 20 min.
- Nach 30 min zentrifugieren die Serumproben bei Raumtemperatur für 10 min bei 2.500 x g.
- Aliquot die Überstände sorgfältig auf 2 ml Kryoröhrchen, wobei 0,5 ml des Überstandes über dem Pellet zurückbleiben, um plättchenfreies Plasma zu gewährleisten.
- Die Proben bei -80 ° C aufbewahren.
5. Sammlung von Placental Tissue
- Legen Sie die Plazenta-Wohnung so schnell wie möglich auf ein Eis gekühltes Sektionsfach, nachdem es geliefert worden ist. Fotografieren und messen den längsten Durchmesser und den Durchmesser bei 90 Grad.
- Wiegen Sie die Plazenta.
- Notieren Sie das Gewicht, die beiden Durchmesser, jeder gRoss Pathologie, Anzahl der Gefäße in der Schnur und das Zeitintervall von der Anlieferung an, wenn die Plazenta auf Eis gelegt wurde.
HINWEIS: Sende die Plazenta zur pathologischen Untersuchung, wenn klinisch angegeben. - Legen Sie die Plazenta mit der mütterlichen Oberfläche nach oben und identifizieren Sie 4 - 5 Probenahmestellen zufällig in jedem Quadranten der Plazenta, Vermeidung von Bereichen der offenen Pathologie. Entfernen Sie die Decidua mit einer Schere, um 3 - 5 mm von der mütterlichen Oberfläche wegzuschneiden. Sammeln Sie ein 1 - 2 cm 3 Stück Zottengewebe von jedem Standort.
- Das gesammelte Gewebe vorsichtig in 50 ml kaltem 1M PBS waschen. Teilen Sie in mehrere Stücke von jeder Probenahmestelle und aliquot.
Hinweis: Die Größe der Plazenta-Stücke hängt von den geplanten Analysen ab. - Fügen Sie Aliquots von 0,1 - 0,5 cm 3 Gewebeproben zu 5 Kryoröhren hinzu und schnappen Sie sich in flüssigem Stickstoff ein.
- Füge kleine Stücke von 0,1 - 0,2 cm 3 zu dem Röhrchen mit 25 ml RNA-Stabilisierungslösung hinzu. Bei 4 lagern6, C für 24 h, verwerfen die RNA-Stabilisierungslösung und ersetzen sie. Einfrieren.
- Füge Stücke von 0,5 cm 3 zu den 5 Kryoröhrchen mit 0,5 mL OCT hinzu, oben mit OCT auffüllen, mischen und einfrieren.
- Die Proben bei -80 ° C bis zur Analyse aufbewahren.
HINWEIS: Burton et al. Bietet einen hervorragenden Überblick über die praktischen Aspekte der Plazenta-Probenahme in Abhängigkeit von den geplanten Analysen. 20 Man empfiehlt, das übrige Gewebe zur Isolierung der mikrovillösen und basalen Membranen vorzubereiten und deziduales Gewebe durch Vakuumsaugtechnik zu sammeln. 21 , 22
6. Neonatale Eigenschaften
- Notieren Sie die neonatalen Eigenschaften, einschließlich Apgar-Score (1, 5 und 10 min), Geschlecht, Gewicht, Länge, Gestationsalter und Zulassung zur Neugeborenen Intensivstation (Länge und Ergebnis des Aufenthalts).
- Betrachten Sie die Messung der neonatalen Körperzusammensetzung durch anthropometrische Messungen, Luft-VerschiebenPlethysmographen oder Dual-Röntgen-Absorptiometrie. 23 , 24
7. Berechnungen
- Nehmen wir eine ähnliche Blutzusammensetzung in der Radial- und Uterusarterie an und berechnen die uteroplazentäre arteriovenöse Konzentrationsdifferenz.
Uteroplazentale arteriovenöse Konzentrationsdifferenz = C A - C V
Umbilische venöse - arterielle Konzentrationsdifferenz = C v - C a
Wo C die Konzentration mit den Indizes ist: A, die radiale Arterie; V, die Uterusvene; V die Nabelvene und a, die Nabelarterie. - Berechnen Sie den Volumen Blutfluss, mL / min (Q):
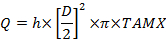
Wenn D der Gefäßdurchmesser (cm) ist, ist TAMX die zeitlich gemittelte maximale Geschwindigkeit und h ist der Koeffizient für das räumliche Blutgeschwindigkeitsprofil. Verwenden Sie 0,5 als Koeffizient für die Nabelvene und0,6 für die Uterusarterie 25 , 26 . - Berechnen Sie die Plazenta-Aufnahme und Freigabe nach Ficks Prinzip:
Uteroplazentale Aufnahme = ( C A - C V ) x Qm
Fetale Aufnahme = ( C v - C a ) X Q f
Subscripts: m, mütterlich und f, fetal.
Ergebnisse
Die 4-Gefäß-Probenahme-Methode ist in der klinischen Praxis anwendbar und wir haben erfolgreich Blutproben von 209 Mutter / Kleinkindern erhalten. In 128 von diesen haben wir auch erreicht, um Volumen Blutfluss zu messen. Komplette 4-Gefäß-Probenahme und gute Qualitäts-Durchflussmessungen von mütterlichen und fetalen Gefäßen wurden in 70 Mutter-Fötus-Paaren ( Abbildung 3 ) erhalten. Darüber hinaus haben wir bisher Blut und Plazenta Proben von 30 pr...
Diskussion
Die Plazenta-4-Gefäß-Probenahme-Methode ist für drei Hauptzwecke relevant. Zuerst kann man daran denken, wie spezifische Substanzen von der Plazenta auf der mütterlichen Seite aufgenommen und möglicherweise auf die Nabelzirkulation und den Fötus übertragen werden, wie unsere Glukose- und Aminosäure-Studien zeigen. Zweitens ist die Methode sehr relevant für die Untersuchung von Stoffen, die von der Plazenta produziert und in die mütterlichen oder fetalen Zirkulationen freigesetzt werden, wie die Progester...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
In erster Linie bedanken wir uns herzlich bei den Müttern, die an diesem Projekt teilgenommen haben. Als nächstes erkennen wir alle Mitarbeiter an, die das Probenahmeverfahren, den Anästhesisten, den Krankenschwester Anästhesisten und die chirurgischen Krankenschwestern unterstützt und erleichtert haben. Das Projekt wäre nicht möglich gewesen, ohne von der Südost-Norwegen-Regionalen Gesundheitsbehörde und der norwegischen Beratungsstelle für Frauengesundheit, Oslo-Universität und der lokalen Finanzierung des Universitätsklinikums Oslo zu finanzieren.
Materialien
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2 - 6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5 cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 mL LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 mL 9NC Coagulation sodium citrate 3.2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1 M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
Referenzen
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten