JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 태반 생리학의 통합 연구에 대한 4 혈관 샘플링 접근법
요약
우리는 장기간 생체 내 생체 태반 생리를 연구하기위한 상세한 방법을 제시합니다. 이 방법은 태아의 모체 및 태아 측에 유입 및 유출 혈관으로부터의 혈액 샘플링을 부피 혈류 및 태반 조직 샘플링의 초음파 측정치와 결합시킨다.
초록
인간 태반은 여전히 utero에서 연구를 위해 매우 접근하기가 어렵습니다. 따라서 생체 내에서 인간 태반 생리학 에 대한 현재의 이해는 태반 해부학, 혈역학 및 임신 기간에있어서 종간의 다양성은 매우 높지만 동물 실험에 기반하고있다. 인간 태반 연구의 대다수는 생체 외 관류 연구 또는 시험관 내 영양막 연구입니다. 시험 관내 연구 및 동물 모델은 필수적이지만, 생체 내 인간 태반 에 대한 그러한 연구 결과의 외삽은 불확실하다. 우리 는 생체 내 에서 인간 태반 생리를 연구하고, 그 방법의 상세한 프로토콜을 제시하고자했다. 계획된 제왕 절개 도중에 자궁 절개 직전에 자궁 내 정맥에 대한 복강 내 접근을 이용하여 우리는 태반의 산모와 태아 측에서 들어오고 나가는 혈관으로부터 혈액 샘플을 채집합니다. 사기를 결합 할 때혈류량 측정을 통한 혈액 샘플의 중심 측정을 통해 태반 및 태아의 흡수 및 모든 화합물 방출을 정량화 할 수 있습니다. 또한, 동일한 모체 - 태아 쌍으로부터의 태반 조직 샘플은 운반체 밀도 및 활성 및 생체 내 태반 기능의 다른 측면의 측정을 제공 할 수있다. 이러한 4 혈관 샘플링 방법의 통합적 사용을 통해 우리는 정상 및 병리학 임신 모두에서 생체 내 태반 영양 전달 및 대사의 현재 개념을 시험 할 수 있습니다. 또한,이 방법은 태반에 의해 분비되는 물질을 모체 순환으로 확인하는 것을 가능하게하는데, 이는 태반 기능 장애의 바이오 마커 검색에 중요한 공헌을 할 수 있습니다.
서문
미국 국립 보건원 (National Institutes of Health)에 따르면, 태반은 인체 1 , 2 , 3 에서 가장 잘 이해되지 않는 기관입니다. 진행중인 임신에 비 윤리적 위험을 가하지 않으면 서 생체 내 에서 인간 태반 에 접근하여 연구하기가 어렵습니다. 그러므로 인간의 태반 기능에 대한 연구는 주로 시험 관내 및 생체 외 모델에 기반을두고있다. 태반 수송과 대사에 대한 이전 의 생체 내 연구의 대부분은 동물 4 , 5 , 6 에서 수행되었다. 그러나 태반의 구조와 기능은 종간에 상당히 다르기 때문에 인간에서 동물로 결과를 외삽하는 것은 신중해야한다. 인간 생체 내 (in vivo) 연구 에서 태아와 태아의 흡수 및 정상 생리학모든 조건을 가지고 있으며 , 화합물 7 , 8 , 9 , 10 , 11 , 12 , 13 의 통합 전이를 연구 한 사람은 없다. 이러한 기초 연구는 인간 태반에 대한 생체 내 연구가 가능하며 여러 목적을 달성 할 수 있음을 보여줍니다. 첫째, 현재 체외 , 체외 및 동물 연구 에서 유래 한 태반 기능의 현재 개념을 인간 환경에서 시험 할 수 있으므로 인간 태반에 대한 새롭고보다 구체적인 통찰력을 얻을 수 있습니다. 둘째, 비정상 태아 성장, 자간전증, 모성 당뇨병, 대사 증후군 및 기타 모체 대사 장애와 관련된 기능 장애 태반의 특성이 더 잘 특성화 될 수 있습니다. 셋째, 인간 생체 내 연구는 진단을 개발할 수있는 기회를 제공한다.틱 기능과 예측 도구.
이 배경에서 우리 는 생체 내 인간의 태반 기능을 조사하기 위해 생리 학적 데이터의 종합적인 수집을 목표로 삼았습니다 . 계획된 제왕 절개 동안, 우리는 자궁 정맥에 대한 복강 내 접근을 이용하여 태반의 모성 및 태아 측 (4 혈관 샘플링 방법)에서 들어오고 나가는 혈관으로부터 혈액 샘플을 수집합니다. 이 샘플은 영양소 및 기타 물질 (14)의 쌍 동정맥 농도 차이를 계산하는 데 사용됩니다. 또한 초음파를 이용하여 태반 양측의 체적 유량을 측정합니다. 따라서, 모든 화합물의 태반 및 태아 섭취를 정량화 할 수있다. 또한, 태반에 의해 방출되는 물질을 산모 및 태아 순환계 15 , 16 , 17 로 결정하는 것이 가능합니다. 결합 할 때엄마와 아이의 임상 적 매개 변수와 태반 및 기타 관련 조직의 분석을 통해이 방법은 동일한 모체 - 태아 쌍 에서 생체 내 태반 기능의 여러 측면을 통합 할 수있는 흥미 진진한 잠재력을 가지고있다.
프로토콜
이 연구는 오슬로 대학 병원의 데이터 보호 관리 및 노르웨이 남부 의료 보건 연구 윤리위원회 (2419/2011)의 승인을 받았습니다. 모든 참가자는 포함시 서면 동의서에 서명했습니다.
1. 준비 사항
참고 : 절차 일정은 그림 1에 요약되어 있습니다.
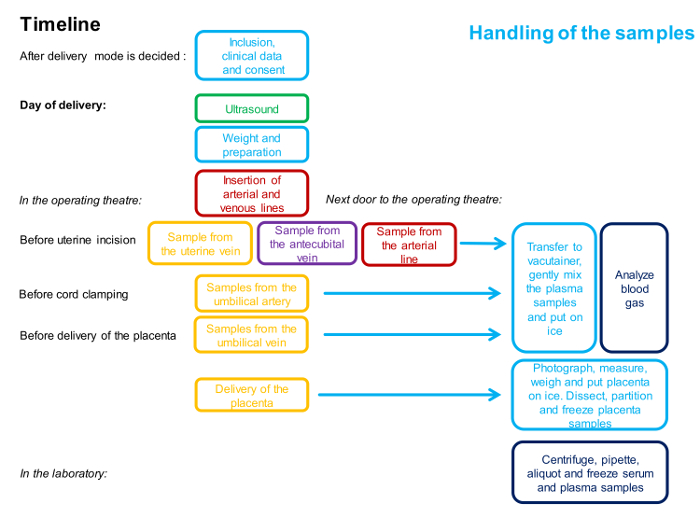
그림 1 : 4- 용기 시료 채취 절차에 관련된 타이밍과 인원을 설명하는 순서도.
하나의 색상은 한 사람을 나타냅니다. 방법에 대한 자세한 설명은 프로토콜에 나와 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 직원
- 초음파 측정을 수행하는 고도로 숙련 된 태아 의학 전문가, 수술을 담당하는 산부인과 의사, 산과 의사 중 한 명과 샘플을 채취하는 간호사 두 명, 혈액 가스 분석을 담당하는 조교 1 명, 연속적으로 그리고 수집 직후 다른 샘플.
참고 :보다 고급 수집 태반 조직의 경우, 추가 사람이 필요합니다.
- 초음파 측정을 수행하는 고도로 숙련 된 태아 의학 전문가, 수술을 담당하는 산부인과 의사, 산과 의사 중 한 명과 샘플을 채취하는 간호사 두 명, 혈액 가스 분석을 담당하는 조교 1 명, 연속적으로 그리고 수집 직후 다른 샘플.
- 장비
- 장비, 얼음 콜드 1 M 인산염 완충 식염수 (PBS) 50 ML, 차가운 RNA 안정 솔루션 25 ML과 최적의 절단 온도 화합물 (OCT) 0.5 ML의 5 ML을 준비합니다. vacutainers 및 튜브를 표시합니다. 장비의 임시 목록을 참조하십시오.
2. 모성 특성
- 모성 임상 및 비 임상 특징을 포함하여 기록하고 관련 질문과 저를 반복하십시오.인도시 체중을 포함한 유지 관리비. 제왕 절개 전에 절식 기간을 기록하고 수술 중 저혈압 증상을 기록하십시오.
참고 : 세계 임신 협동 조합 (COLAB)의 최신 간행물에보고 된 최소한의 산모 임상 데이터 세트를 포함하십시오. 이 기사는 또한 연구 집단을 선정 할 때 매우 중요한 몇 가지 측면을 포함하고 있으므로 연구를 계획하는 동안 다루어야합니다 18 . - 민족, 나이 및 체질량 지수 (BMI)를 포함한 부계 특징을 기록하는 것을 고려하십시오.
3. 초음파
- 단식 상태의 여성과 함께 배달 당일 도플러 초음파 검사를 수행하십시오. 대동맥과 대정맥의 압박을 피하기 위해 태아의 정지 상태에서 여성을 반 앙복 자세로 검사하고 관심 부위와 약간 반대 방향으로 기울입니다. 에서 출력 모니터링디스플레이상의 기계적 및 열적 인덱스에 의한 강도.
- 탯줄 정맥
- 태아 복부의 시상 또는 사시 절제로 제대 정맥을 시각화하십시오. 눈에 보이는 가지 이전에 복부 제대 정맥의 직선 부분에서 내부 혈관 직경을 측정합니다. 정규 B 모드를 사용하고 혈관 직경을 측정하기 위해 수직 인 오손 각도에서 혈관을 가시화하고 박동 직경 변화의 영향을 최소화하기 위해 이후의 측정을위한 몇 가지 최적의 프레임을 유지합니다.
- 측정을 5 ~ 10 배 (19)를 반복합니다.
- 동일한 사이트에서 도플러 초음파를 사용하고 시간 평균 최대 속도 (TAMX)를 측정하기 위해 가능한 한 낮은 주입 각도 (항상 <30 °)를 얻기 위해 프로브를 조정하십시오. 3 - 5 초 (비 맥동 흐름)의 속도를 구하십시오.
- 태아 복부의 시상 또는 사시 절제로 제대 정맥을 시각화하십시오. 눈에 보이는 가지 이전에 복부 제대 정맥의 직선 부분에서 내부 혈관 직경을 측정합니다. 정규 B 모드를 사용하고 혈관 직경을 측정하기 위해 수직 인 오손 각도에서 혈관을 가시화하고 박동 직경 변화의 영향을 최소화하기 위해 이후의 측정을위한 몇 가지 최적의 프레임을 유지합니다.
- 자궁 동맥
- 도플러 사용자궁 동맥이 내 장골 동맥에서 분지 된 직후에 외 골반 동맥을 가로 지르는 동안 자궁 동맥을 시각화하는 초음파입니다. 이 부위에서 프로브를 조정하여 낮은 발병 각도 (항상 <30 °)를 얻고 TAMX를 측정하십시오. 3 개의 심장주기의 평균 속도로 속도를 구하십시오.
- 동일한 위치에서 TAMX가 측정되는 것과 같은 위치에서 수직 각도를 얻지는 않을 것이므로 직경 측정을위한 위치에 가깝게 직경 측정을위한 정확한 각도를 얻기 위해 용기를 원위리로 따라 가십시오. 컬러 도플러 초음파로 평가 한 바에 따라이 부위 이전에 눈에 보이는 혈관이 분지되면 직경 측정을 제외하십시오.
- 정규 B 모드를 사용하고 혈관 직경을 측정하기 위해 수직 인 오손 각도에서 혈관을 가시화하고 박동 직경 변화의 영향을 최소화하기 위해 이후의 측정을위한 몇 가지 최적의 프레임을 유지합니다.
- 측정을 5 ~ 10 배 (19)를 반복합니다.
- 태반의 위치를 기록하십시오.
4. 4 혈관 혈액 샘플링
참고 : 절차 일정은 그림 1에 나와 있으며 샘플 개요는 그림 2에 나와 있습니다.
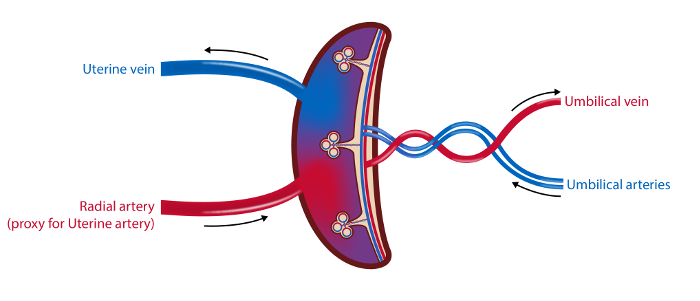
그림 2 : 태반 혈관 및 표본 추출 사이트의 개략도.
4 혈관 샘플링 방법에서 혈액 샘플은 자궁 정맥, 요골 동맥 (자궁 동맥의 대용 물) 및 제대 동맥 및 정맥에서 가져옵니다. 자궁 동맥과 제대 정맥의 혈류는 초음파로 측정됩니다. 태반의 조직 샘플을 수집합니다. 삽화 : Øystein H. Horgmo, 오슬로 대학.5847fig2large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
- 안전 절차
- 작업장의 모든 인원에게 장갑, 수술 용 양복, 마스크 및 모자를 착용하십시오.
- 외과 의사 및 연구 인력에게 외과 수술 용 복장, 마스크, 모자, 가운 및 이중 장갑을 착용하십시오. 안경은 옵션입니다.
- 혈액 샘플을 장갑으로 취급하는 직원을 제공하십시오.
- 태반 샘플을 장갑과 외과 용 마스크로 다루는 요원을 제공하십시오. 균질화에는 후드 사용이 필요합니다.
- 수술실에서의 준비
- 브리핑을하고 수술 시작 전 샘플링을 돕는 모든 요원에게 장비를 건네주십시오.
- 필요한 말초 동맥 및 정맥 접근을 도와 줄 마취과 의사이자 마취과 간호사와 상담하십시오.샘플링 전에 액체를 정맥 내 투여하지 마십시오.
- 요골 동맥을 조력하는 사람에게 주사 바늘없는 세 개의 주사기 (10 mL)를 전 대퇴 정맥 샘플과 보조 주사기 (20 mL와 10 mL 중 한 개)와 혈액 가스 주사기 (헤파린과 함께) 한 사람에게 준다.
- 수술 필드에 2 개의 멸균 주사기 (20 mL), 5 개의 멸균 주사기 (10 mL), 3 개의 "나비 바늘"및 2 개의 혈액 가스 주사기를 준비하십시오.
- 혈관에 접근.
- 제왕 절개 전에 표준 절차를 따라 말초 정맥 주사 (iv) 접근을 보장하십시오.
참고 : 전두엽 정맥은이 부위에서 샘플을 추출하기 쉽기 때문에 바람직합니다. - 초음파 또는 촉진에 의해 손목에서 요골 동맥을 국소화하십시오. 피하 리도카인 진통제 0.5 mL에 따라 요골 동맥에 동맥을 삽입한다. 삽입이 3 회 실패한 경우이 사이트에서 샘플링을 포기합니다.여자가 삽입 중에 통증을 느낀다.
참고 : 표준 절차에 따라 제왕 절개 수술 절차를 수행하십시오. 샘플링 절차에 필요한 조정 만 아래에 밑줄이 그어져 있습니다.
- 제왕 절개 전에 표준 절차를 따라 말초 정맥 주사 (iv) 접근을 보장하십시오.
- 모성 혈액 샘플
참고 : 자궁 절개 전에 세 모체 혈액 샘플 (자궁 정맥, 요골 동맥 및 전두 정맥)을 동시에 얻습니다.- 자궁 정맥 들어, 복강을 열고 복벽을 들어 올리고 자궁 앞쪽에 자궁 정맥의 주요 가지를 드러내는 견인기를 사용합니다. 태반과 같은면의 자궁 정맥 분지에서 혈액을 채취하거나 태반이 자궁 정중선에 위치하면 가장 두드러진 정맥을 사용하십시오.
- 자궁 정맥의 혈액 가스 주사기에 버터 플라이 바늘을 약 30도 각도로 삽입하고 부드러운 흡입을 피하여 혈액을 채취합니다.용혈. 나비 바늘의 iv 위치를 조심스럽게 고정한 채로 채워진 혈액 가스 주사기를 20 mL와 10 mL 주사기로 연속적으로 교체하십시오.
참고 : 최적의 접근은 선택한 자궁 정맥의 반대쪽에 서있을 때 가장 잘 보장됩니다.
- 자궁 정맥의 혈액 가스 주사기에 버터 플라이 바늘을 약 30도 각도로 삽입하고 부드러운 흡입을 피하여 혈액을 채취합니다.용혈. 나비 바늘의 iv 위치를 조심스럽게 고정한 채로 채워진 혈액 가스 주사기를 20 mL와 10 mL 주사기로 연속적으로 교체하십시오.
- 요골 동맥의 경우, 동맥 내에서 흡인을하십시오. 첫 번째 5 mL를 버리고 혈액 가스 분석을 위해 헤파린 주사기에서 3 mL를 흡입 한 다음 두 개의 주사기 (20 + 10 mL)에서 3 mL를 흡입합니다.
- 대퇴 정맥을 위해서는 정맥 카테터에서 천천히 흡인하십시오. 첫 번째 5 mL를 버리고 세 개의 주사기 (10 mL)로 30 mL를 흡입하십시오.
- 복부 폐쇄를 시작하기 전에 자궁 정맥의 샘플링 위치를 최종 검사하십시오.
- 자궁 정맥 들어, 복강을 열고 복벽을 들어 올리고 자궁 앞쪽에 자궁 정맥의 주요 가지를 드러내는 견인기를 사용합니다. 태반과 같은면의 자궁 정맥 분지에서 혈액을 채취하거나 태반이 자궁 정중선에 위치하면 가장 두드러진 정맥을 사용하십시오.
- 태아 혈액 샘플
- 아이가 태어 났을 때 즉시 제대를 고정 시키거나 태반을 옮기지 않고 제대 동맥으로부터 혈액을 배출하십시오. 기지 시작혈액 가스 분석을위한 주사기를 사용하고 가능한 경우 3 개의 10 mL 주사기를 따르십시오.
- 동맥 표본이 확보되면 제대 정맥 (혈액 가스 및 20 + 10mL 주사기)에서 표본 추출하기 전에 코드를 클램프하고 조산사에게 아이를 넘겨줍니다.
참고 : 자발적으로 분리하지 않은 경우 출산 후 몇 초 내에 모든 제대 시료를 수집하고 태반 을 제자리에 놓습니다. - 후기 코드 고정에 관한 노르웨이의 권장 사항을 따르십시오. 고민이 된 어린이의 경우 즉시 코드를 조이고 자르십시오. 조산사 및 신생아 전문의에게 아이를 넘겨주십시오.
- 혈액 샘플 취급
- 나머지 혈액 샘플을 준비하면서 혈액 가스 주사기를 얼음에 담아 혈액 가스 분석기에서 5 분 이내에 분석하십시오.
- 혈액 샘플을 즉시 vacutainers로 옮기고 얼음 위에 올려 놓기 전에 1-2 분 동안 로커에 플라스마 튜브를 놓습니다. 혈청 튜브를 노동에 맡기십시오.30 분 동안 정착하기위한 벤치.
참고 : 5 개의 사이트 모두에서 양질의 품질을 유지하기 위해 동시에 샘플을 준비해야하기 때문에 이것은주의가 필요한 절차에서 중요한 단계입니다. - 가능한 한 빨리 플라스마 샘플을 원심 분리기에 넣고 30 분 이내에 6 ° C, 2,500 xg에서 20 분간 원심 분리하십시오.
- 30 분 후, 2,500 x g에서 10 분간 실온에서 혈청 샘플을 원심 분리한다.
- 분주는 혈장없는 혈장을 보장하기 위해 펠렛 위에 뜨는 0.5 ML을 떠나, 2 ML cryo 튜브에 신중하게 뜨는.
- 샘플을 -80 ° C에 보관하십시오.
5. 태반 조직의 수집
- 태반이 납품 된 후 가능한 한 빨리 얼음으로 냉각 된 절개 트레이에 내려 놓습니다. 가장 긴 직경과 직경을 90도까지 사진 으로 찍고 측정하십시오.
- 태반 무게를 잰다.
- 무게, 두 직경, 모든 g를 기록하십시오.로스 병리학, 탯줄에 혈관 수 및 배달에서 태반을 얼음 위에 놓았을 때까지의 시간 간격.
참고 : 임상 적으로 표시된 경우 병리 검사에 태반을 보냅니다. - 산모 표면이 위로 향한 태반을 놓고 솔직한 병리학 영역을 피하면서 태반의 각 사분면에 무작위로 위치한 4 - 5 개의 샘플링 사이트를 확인합니다. 가위를 사용하여 탈모기를 제거하여 산모 표면에서 3 - 5mm 떨어진 곳을 잘라냅니다. 각 사이트에서 1 ~ 2cm 3 조각의 융모 조직을 수집합니다.
- 콜드 1M PBS 50 ML에서 부드럽게 수집 된 조직을 씻으십시오. 각 샘플링 사이트와 분액에서 여러 조각으로 나눕니다.
참고 : 태반 조각의 크기는 계획된 분석에 따라 달라집니다. - 0.1 - 0.5 cm 3 티슈 샘플의 분취 량을 5 개의 냉동 튜브에 첨가하고 액체 질소로 급속 냉동하십시오.
- RNA 안정화 용액 25 mL와 함께 0.1 - 0.2 cm 3 의 작은 조각을 튜브에 첨가한다. 4시에 쇼핑6, 24 시간 동안 RNA 안정화 용액을 폐기하고 그것을 대체하십시오. 얼다.
- OCT 0.5 mL가 달린 5 개의 cryo tube에 0.5 cm 3의 조각을 넣고, OCT로 위로 올려 놓고 혼합하고 동결시킨다.
- 분석 할 때까지 시료를 -80 ° C에 보관하십시오.
참고 : Burton et al. 계획된 분석에 따라 태반 샘플링의 실용적인 측면에 대한 훌륭한 개요를 제공합니다. 20 microvillous 및 기초 막 분리에 대한 나머지 조직을 제조하고, 진공 흡착 방식에 의해 탈락 조직을 수집하기 위해 고려한다. 21 , 22
6. 신생아의 특성
- Apgar- 점수 (1, 5 및 10 분), 성별, 체중, 길이, 재태 연령 및 신생아 집중 치료실 (입원 기간 및 결과)에 대한 입원을 포함하여 신생아 특성을 기록하십시오.
- 인체 측정, 공기 치환에 의한 신생아 신체 조성 측정 고려또는 X-ray 흡광도 측정법으로 측정 할 수 있습니다. 23 , 24
7. 계산
- 방사형 및 자궁 동맥에서 유사한 혈액 조성을 가정하고 자궁 평활근 정 농도 차이를 계산하십시오.
자궁 동정맥 농도 차이 = C A - C V
정맥 - 동맥 농도 차이 = C v - C a
여기서 C는 첨자가있는 농도 : A, 요골 동맥; V, 자궁 정맥; v 배꼽 정맥과 배꼽 동맥. - 체적 유량, mL / min (Q)을 계산하시오.
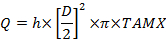
여기서 D는 혈관 직경 (cm)이고, TAMX는 시간 평균 최대 속도이고, h는 공간 혈액 속도 프로파일의 계수입니다. 제대 정맥의 계수로 0.5를 사용하고자궁 동맥 (25), (26) 0.6. - Fick의 원리에 따라 태반 섭취량과 출산량을 계산하십시오 :
자궁 입구 섭취 = ( C A - C V ) x Qm
태아 흡수 = (C의 V - C가) x Q f
아래 첨자 : m, 모성 및 f, 태아.
결과
4 혈관 샘플링 방법은 임상 실험에 적용 가능하며 우리는 209 명의 어머니 / 유아 쌍으로부터 혈액 샘플을 성공적으로 얻었습니다. 이 중 128 회에 우리는 또한 체적 유량을 측정했습니다. 70 마리의 모체 - 태아 쌍 ( 그림 3 )에서 모체와 태아 혈관 모두의 완벽한 4 혈관 표본 추출과 양질의 혈류 측정이 이루어졌습니다. 또한, 우리는 지금까지 30 명의 자?...
토론
태반 4 혈관 샘플링 방법은 세 가지 주요 목적과 관련이 있습니다. 첫째, 우리의 포도당과 아미노산 연구에 의해 입증 된 것처럼 특정 물질이 어떻게 모체 측의 태반에 흡수되어 제대혈과 태아로 옮겨지는지를 연구하는데 사용될 수 있습니다. 둘째,이 방법은 프로게스테론 결과에 의해 입증 된 것처럼, 태반에 의해 생성되어 산모 또는 태아 순환계로 방출되는 물질을 연구하는 데 매우 관련이...
공개
저자는 공개 할 것이 없습니다.
감사의 말
무엇보다도이 프로젝트에 참여한 어머니 들께 진심으로 감사드립니다. 다음으로, 우리는 샘플링 절차, 마취과 의사, 간호사 마취 전문의 및 외과 간호사를 돕고 촉진 한 모든 인원을 인정합니다. 이 프로젝트는 남유럽 노르웨이 지역 보건 당국과 노르웨이의 여성 건강, 오슬로 대학 자문단 및 오슬로 대학 병원이 제공하는 지역 기금으로 기금을 마련하지 않고는 불가능했을 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2 - 6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5 cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 mL LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 mL 9NC Coagulation sodium citrate 3.2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1 M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
참고문헌
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유