Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'approche d'échantillonnage à 4 navires pour les études intégratives de la physiologie du plaidoyer humain
Dans cet article
Résumé
Nous présentons une méthode détaillée pour étudier la physiologie du placenta humain in vivo à terme. La méthode combine l'échantillonnage du sang des vaisseaux entrants et sortants sur les côtés maternel et fœtal du placenta avec des mesures ultrasonores du flux sanguin volumique et de l'échantillonnage du tissu placentaire.
Résumé
Le placenta humain est très inaccessible à la recherche alors qu'il est encore in utero . La compréhension actuelle de la physiologie du placenta humain in vivo repose en grande partie sur des études sur les animaux, malgré la grande diversité des espèces en anatomie placentaire, l'hémodynamique et la durée de la grossesse. La grande majorité des études sur le placenta humain sont des études de perfusion ex vivo ou des études de trophoblastes in vitro . Bien que les études in vitro et les modèles animaux soient essentiels, l'extrapolation des résultats de ces études au placenta humain in vivo est incertaine. Nous avons visé à étudier la physiologie du placenta humain in vivo à terme et à présenter un protocole détaillé de la méthode. En exploitant l'accès intra-abdominal à la veine utérine juste avant l'incision utérine pendant la césarienne prévue, nous recueillons des échantillons de sang des vaisseaux entrants et sortants sur les côtés maternel et fœtal du placenta. En combinant conDes mesures de centration à partir d'échantillons de sang avec des mesures du débit sanguin, nous sommes en mesure de quantifier l'absorption du placenta et du fœtus et la libération de tout composé. En outre, les échantillons de tissus placentaires provenant des mêmes paires mère-foetus peuvent fournir des mesures de la densité et de l'activité des transporteurs et d'autres aspects des fonctions placentaires in vivo . Grâce à cette utilisation intégrative de la méthode d'échantillonnage à 4 navires, nous sommes en mesure de tester certains des concepts actuels de transfert de nutriments placentaires et de métabolisme in vivo , à la fois chez les grossesses normales et pathologiques. En outre, cette méthode permet d'identifier les substances sécrétées par le placenta à la circulation maternelle, ce qui pourrait être une contribution importante à la recherche de biomarqueurs de dysfonctionnement du placenta.
Introduction
Selon le National Institutes of Health, aux États-Unis, le placenta est l'organe le moins compris dans le corps humain 1 , 2 , 3 . Il est difficile d'accéder et d'étudier le placenta humain in vivo sans imposer de contraintes éthiques sur la grossesse en cours. Les études de la fonction placentaire chez l'humain reposent en grande partie sur des modèles in vitro et ex vivo . La majorité des études antérieures in vivo sur le transport du placenta et le métabolisme ont été réalisées chez les animaux 4 , 5 , 6 . Cependant, comme la structure et les fonctions du placenta varient considérablement d'une espèce à l'autre, l'extrapolation des résultats des animaux aux humains doit être effectuée avec prudence. Seules quelques études humaines in vivo plus petites ont étudié l'absorption et le transport du placenta et du fœtus dans des conditions physiologiques normalesToutes les conditions, et aucun n'a exploré le transfert intégré de plusieurs composés 7 , 8 , 9 , 10 , 11 , 12 , 13 . Ces études fondamentales illustrent que les études in vivo du placenta humain sont réalisables et qu'elles peuvent servir à plusieurs fins. Tout d'abord, les concepts actuels de fonctions placentaires principalement dérivés d'études in vitro , ex vivo et animales peuvent être testés dans un milieu humain et fournir ainsi une vision nouvelle et plus spécifique du placenta humain. Deuxièmement, les propriétés du placenta dysfonctionnel associé à la croissance aberrante du foetus, la prééclampsie, le diabète maternel, le syndrome métabolique et d'autres troubles métaboliques maternels peuvent être mieux caractérisés. Troisièmement, les études humaines in vivo offrent l'occasion de développer le diagnosticTic et les outils prédictifs de la fonction placentaire.
Dans ce contexte, nous avons cherché à établir une collection complète de données physiologiques pour étudier la fonction placentaire humaine in vivo. Au cours d'une césarienne planifiée, nous exploitons l'accès intra-abdominal à la veine utérine pour recueillir des échantillons de sang provenant des vaisseaux entrants et sortants sur les côtés maternel et fœtal du placenta (la méthode d'échantillonnage à 4 vaisseaux). Ces échantillons sont utilisés pour calculer les différences de concentration artérioveineuses appariées des nutriments et d'autres substances 14 . En outre, nous mesurons le débit sanguin du volume des deux côtés du placenta par ultrasons. Par conséquent, l'absorption placentaire et foetale de tout composé peut être quantifiée. En outre, il est possible de déterminer les substances libérées par le placenta aux circulations maternelle et fœtale 15 , 16 , 17 . Lorsqu'on combineD avec des paramètres cliniques de la mère et de l'enfant, et des analyses des tissus placentaires et d'autres tissus pertinents, cette méthode a le potentiel excitant d'intégrer de nombreux aspects des fonctions placentaires in vivo dans les mêmes paires mère-fœtus.
Protocole
L'étude a été approuvée par les responsables de la protection des données à l'Hôpital universitaire d'Oslo et le Comité régional pour l'éthique de la recherche médicale et de la santé, Southern Norway 2419/2011. Tous les participants ont signé un consentement éclairé par écrit à l'inclusion.
1. Préparations
REMARQUE: une chronologie pour les procédures est décrite dans la figure 1 .
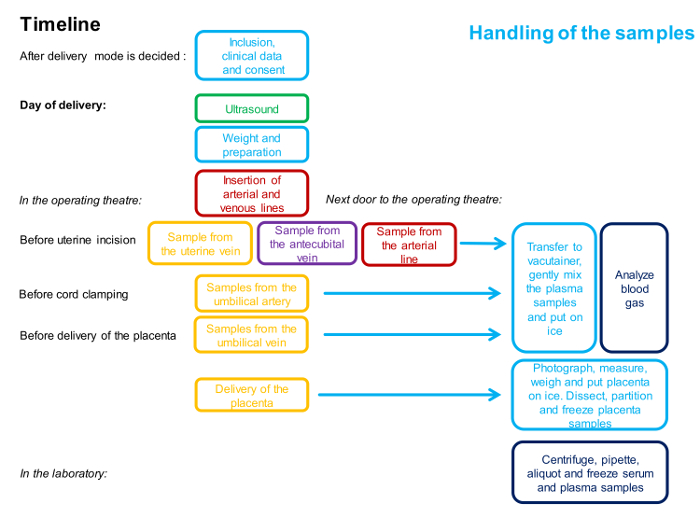
Figure 1 : diagramme décrivant le calendrier et le personnel impliqué dans la procédure d'échantillonnage à 4 navires.
Une seule couleur représente une personne. La description détaillée de la méthode est donnée dans le protocole. Cliquez ici pour voir une version plus grande de ce chiffre.
- Personnel
- Assurez-vous que tout le personnel requis est disponible: un spécialiste de la médecine du foetus hautement qualifié qui effectue les mesures de l'échographie, deux obstétriciens qui effectuent la chirurgie, l'un des obstétriciens et deux infirmières qui collectent les échantillons, un assistant qui manipule les analyses de gaz sanguins et un assistant qui manipule le D'autres échantillons consécutivement et immédiatement après la collecte.
NOTE: Dans le cas d'une collecte plus avancée du tissu placentaire, une personne supplémentaire est requise.
- Assurez-vous que tout le personnel requis est disponible: un spécialiste de la médecine du foetus hautement qualifié qui effectue les mesures de l'échographie, deux obstétriciens qui effectuent la chirurgie, l'un des obstétriciens et deux infirmières qui collectent les échantillons, un assistant qui manipule les analyses de gaz sanguins et un assistant qui manipule le D'autres échantillons consécutivement et immédiatement après la collecte.
- Équipement
- Préparez l'équipement, 50 ml de solution salée tamponnée au phosphate 1 M (PBS), 25 ml de solution stabilisatrice d'ARN froide et 5 x 0,5 ml de composé de température de coupe optimal (OCT). Étiquetez les aspirateurs et les tubes. Voir la liste provisoire de l'équipement.
2. Caractéristiques de la mère
- Notez les caractéristiques cliniques et non cliniques maternelles à l'inclusion et répétez les questions pertinentes et moiLes précautions, y compris le poids, au moment de la livraison. Notez la durée de la période de jeûne avant la césarienne et tous les épisodes hypotensifs se produisant pendant la chirurgie.
Note: Inclure l'ensemble minimal de données cliniques maternelles signalé dans une publication récente de CoLaboratory Global de Grossesse (COLAB). Cet article comprend également des aspects très importants dans le choix des populations étudiées et devrait être abordé lors de la planification de l'étude 18 . - Envisager d'enregistrer les caractéristiques paternelles, y compris l'appartenance ethnique, l'âge et l'indice de masse corporelle (IMC).
3. Echographie
- Effectuez l'échographie Doppler le jour de la livraison, avec les femmes en état de jeûne. Effectuer l'examen pendant une période de quiescence foetale, avec la femme en position semi-supine, incliné légèrement latéralement en face de la région d'intérêt afin d'éviter la compression de l'aorte et de la veine cave. Surveiller la sortie dansLa tension par les indices mécaniques et thermiques sur l'affichage.
- Veine ombilicale
- Visualiser la veine ombilicale dans une transitoire sagittale ou oblique de l'abdomen fœtal. Mesurer le diamètre interne du vaisseau dans la partie droite de la veine ombilicale intra-abdominale, avant toute branche visible. Utilisez le mode B régulier et visualisez le vaisseau dans un angle d'insonction perpendiculaire pour les mesures du diamètre et gardez plusieurs cadres optimaux pour des mesures ultérieures pour minimiser l'effet des changements de diamètre pulsatile.
- Répétez les mesures de cinq à dix fois 19 .
- Sur le même site, utilisez l'échographie Doppler et ajustez la sonde pour obtenir un angle d'insonance le plus bas possible (toujours <30 °) afin de mesurer la vitesse maximale moyenne en temps (TAMX). Obtenir la vitesse sur une période de 3 à 5 s (débit non pulsé).
- Visualiser la veine ombilicale dans une transitoire sagittale ou oblique de l'abdomen fœtal. Mesurer le diamètre interne du vaisseau dans la partie droite de la veine ombilicale intra-abdominale, avant toute branche visible. Utilisez le mode B régulier et visualisez le vaisseau dans un angle d'insonction perpendiculaire pour les mesures du diamètre et gardez plusieurs cadres optimaux pour des mesures ultérieures pour minimiser l'effet des changements de diamètre pulsatile.
- Artère utérine
- Utiliser DopplerÉchographie pour visualiser l'artère utérine alors qu'elle traverse l'artère iliaque externe, immédiatement après qu'elle se ramifie de l'artère iliaque interne. Réglez la sonde sur ce site pour obtenir un faible angle d'insonance (toujours <30 °) et mesurez TAMX. Obtenez la vitesse comme vitesse moyenne de trois cycles cardiaques.
- Étant donné qu'il est peu probable d'avoir un angle perpendiculaire au même endroit que le TAMX, il faut suivre le vaisseau distalement pour obtenir un angle correct pour des mesures de diamètre aussi proches des sites de mesures de diamètre que possible. Exclure les mesures du diamètre si des vaisseaux visibles s'écoulent avant ce site comme évalué par échographie Doppler couleur.
- Utilisez le mode B régulier et visualisez le vaisseau dans un angle d'insonction perpendiculaire pour les mesures du diamètre et gardez plusieurs cadres optimaux pour des mesures ultérieures pour minimiser l'effet des changements de diamètre pulsatile.
- Répétez les mesures de cinq à dix fois 19 .
- Notez la position du placenta.
4. Échantillonnage de sang à 4 vaisseaux
REMARQUE: la chronologie des procédures est décrite à la figure 1 et une vue d'ensemble des échantillons est illustrée à la figure 2 .
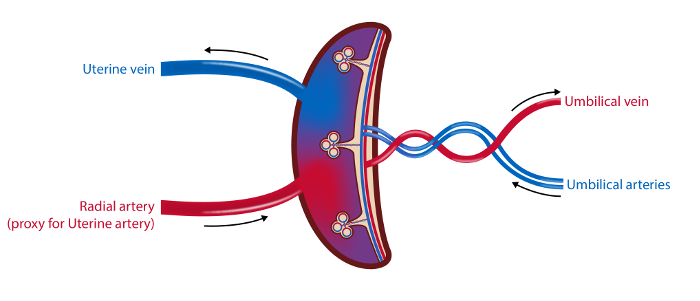
Figure 2 : Illustration schématique de la vasculature placentielle et des sites d'échantillonnage.
Dans la méthode d'échantillonnage à 4 vaisseaux, des échantillons de sang sont tirés de la veine utérine, de l'artère radiale (en tant que vecteur de l'artère utérine) et des artères et des veines ombilicales. Le flux sanguin dans l'artère utérine et la veine ombilicale est mesuré par ultrasons. Des échantillons de tissus provenant du placenta sont collectés. Illustration: Øystein H. Horgmo, Université d'Oslo.5847fig2large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de ce chiffre.
- Les procédures de sécurité
- Fournir tout le personnel dans l'opération théâtre avec des gants, des combinaisons chirurgicales, des masques et des couvre-chefs.
- Fournir aux chirurgiens et au personnel de recherche en contact avec le champ d'opération avec des combinaisons chirurgicales, des masques, des couvre-chefs, des robes et des gants doubles. Les lunettes sont facultatives.
- Fournir au personnel qui manipule les échantillons de sang avec des gants.
- Fournir au personnel qui manipule les échantillons de placenta avec des gants et un masque chirurgical. L'homogénéisation nécessite l'utilisation de hottes.
- Préparation à l'opération Théâtre
- Donner un briefing et remettre l'équipement à tout le personnel qui aidera l'échantillonnage avant le début de la chirurgie.
- S'adresser à l'infirmière anesthésiologiste et anesthésiste qui aidera à l'accès artérielle et veineuse périphérique nécessaire et veillera à ce queAucun liquide n'est administré par voie intraveineuse avant l'échantillonnage.
- Donner trois seringues (10 mL) sans aiguilles à la personne aidant avec l'échantillon de veine antecubitale et deux seringues (une 20 mL et une 10 mL) et une seringue à sang (avec l'héparine) à l'aide de l'artère radiale.
- Préparez deux seringues stériles (20 mL), cinq seringues stériles (10 mL), trois "aiguilles papillons" et deux seringues à gaz pour le champ d'opération.
- Accès aux vaisseaux sanguins.
- Suivez la procédure standard avant la césarienne pour assurer l'accès intraveineux périphérique (iv).
NOTE: La veine antecubitale est préférable car il est plus facile de prélever des échantillons sur ce site. - Localiser l'artère radiale au poignet par ultrasons ou par palpation. Après 0,5 ml d'analgésie sous la lidocaïne sous-cutanée, placez une ligne artérielle dans l'artère radiale. Abandonnez l'échantillonnage de ce site en cas de trois insertions échouées, ouSi la femme éprouve de la douleur lors de l'insertion.
REMARQUE: effectuer la procédure chirurgicale de la césarienne selon la procédure standard. Seuls les ajustements nécessaires à la procédure d'échantillonnage sont soulignés ci-dessous.
- Suivez la procédure standard avant la césarienne pour assurer l'accès intraveineux périphérique (iv).
- Échantillons de sang maternel
NOTE: Obtenez les trois échantillons de sang maternel (veine utérine, artère radiale et veine antecubitale) simultanément avant l'incision utérine.- Pour la veine utérine, après avoir ouvert la cavité abdominale, utilisez un rétracteur pour soulever la paroi abdominale et exposez les branches principales des veines utérines sur les côtés antérolégéraux de l'utérus. Obtenir du sang dans les branches de la veine utérine du même côté que le placenta chaque fois que possible ou utiliser le plexus veineux le plus important si le placenta est situé dans la ligne médiane utérine.
- Insérez une aiguille de papillon sur une seringue de sang dans la veine utérine à un angle d'environ 30 degrés et collectez le sang par aspiration douce pour éviterL'hémolyse. Tout en garantissant soigneusement la position iv de l'aiguille papillon, remplacez la seringue à gaz remplie par une seringue de 20 mL et 10 mL consécutivement.
REMARQUE: L'accès optimal est mieux assuré lorsqu'il est debout sur le côté contralateral de la veine utérine choisie.
- Insérez une aiguille de papillon sur une seringue de sang dans la veine utérine à un angle d'environ 30 degrés et collectez le sang par aspiration douce pour éviterL'hémolyse. Tout en garantissant soigneusement la position iv de l'aiguille papillon, remplacez la seringue à gaz remplie par une seringue de 20 mL et 10 mL consécutivement.
- Pour l'artère radiale, aspirer à partir de la ligne intra-artérielle. Jeter les premiers 5 mL, puis aspirer 3 mL dans la seringue d'héparine pour les analyses de gaz sanguins, puis 3 mL dans deux seringues (20 + 10 mL).
- Pour la veine antecubitale, aspirer doucement du cathéter intraveineux. Jeter les premiers 5 mL, puis aspirer 30 mL dans trois seringues (10 mL).
- Effectuer une inspection finale du site d'échantillonnage sur la veine utérine avant de commencer à fermer l'abdomen.
- Pour la veine utérine, après avoir ouvert la cavité abdominale, utilisez un rétracteur pour soulever la paroi abdominale et exposez les branches principales des veines utérines sur les côtés antérolégéraux de l'utérus. Obtenir du sang dans les branches de la veine utérine du même côté que le placenta chaque fois que possible ou utiliser le plexus veineux le plus important si le placenta est situé dans la ligne médiane utérine.
- Échantillons de sang fœtal
- Lorsque l'enfant est né, aspirer immédiatement le sang de l'artère ombilicale, sans serrer le cordon ombilical ou administrer le placenta. Commencez l'espritH la seringue pour l'analyse des gaz sanguins et suivre avec trois seringues de 10 mL si possible.
- Lorsque les échantillons artériels sont sécurisés, serrer le cordon et remettre l'enfant à la sage-femme avant l'échantillonnage de la veine ombilicale (gaz de sang et 20 + 10 mL de seringues).
REMARQUE: Obtenez tous les échantillons ombilicaux en quelques secondes de l'accouchement et avec le placenta in situ à moins qu'il ne soit détaché spontanément. - Suivez les recommandations norvégiennes sur le serrage du cordon tardif. Dans le cas d'un enfant en difficulté, serrez et coupez le cordon immédiatement et laissez l'enfant à la sage-femme et au néonatologue.
- Manipulation des échantillons de sang
- Mettez les seringues de gaz sanguins sur de la glace tout en préparant le reste des échantillons de sang et analysez-les dans un analyseur de gaz sanguin dans les 5 minutes.
- Transférer immédiatement les échantillons de sang aux vacutainers et placer les tubes de plasma sur un rocker pendant 1 à 2 minutes avant de les mettre sur de la glace. Laissez les tubes de sérum sur le travailUn banc de règlement pour s'établir pendant 30 minutes.
REMARQUE: Il s'agit d'une étape critique dans la procédure qui nécessite une attention particulière car les échantillons des cinq sites doivent être préparés simultanément pour assurer une bonne qualité. - Centrifuger les échantillons de plasma dès que possible et dans les 30 minutes, à 6 ° C, 2 500 xg pendant 20 min.
- Après 30 min, centrifuger les échantillons de sérum à température ambiante pendant 10 min à 2 500 x g.
- Aliquotez les surnageants avec soin dans 2 mL de tubes cryo, en laissant 0,5 mL du surnageant au-dessus de la pastille pour assurer un plasma exempt de plaquettes.
- Conservez les échantillons à -80 ° C.
5. Collecte de tissu plaquettaire
- Placez le placenta à plat vers le bas sur un plateau de dissipation refroidi par glace dès que possible après avoir été livré. Photographiez et mesurez le plus long diamètre et le diamètre à 90 degrés.
- Peser le placenta.
- Notez le poids, les deux diamètres, tout gLa pathologie de Ross, le nombre de vaisseaux dans le cordon et l'intervalle de temps entre la livraison et le moment où le placenta a été placé sur de la glace.
REMARQUE: Envoyer le placenta à l'examen pathologique s'il est indiqué cliniquement. - Placez le placenta avec la surface maternelle vers le haut et identifiez 4 à 5 sites d'échantillonnage situés au hasard dans chaque quadrant du placenta, en évitant les zones de pathologie franche. Retirez la décidua à l'aide de ciseaux pour couper 3 à 5 mm de la surface maternelle. Recueillir un morceau de tissu vilain de 1 à 2 cm 3 de chaque site.
- Lavez doucement le tissu récolté dans 50 ml de PBS froid 1 M. Diviser en plusieurs pièces de chaque site d'échantillonnage et une aliquote.
Remarque: La taille des pièces du placenta dépend des analyses planifiées. - Ajouter des aliquotes de 0,1 à 0,5 cm 3 échantillons de tissus à 5 tubes cryo et congélation instantanée dans de l'azote liquide.
- Ajouter de petits morceaux de 0,1 à 0,2 cm 3 au tube avec 25 ml de solution de stabilisation d'ARN. Magasin à 46; C pendant 24 h, jeter la solution de stabilisation d'ARN et la remplacer. Gel.
- Ajouter des morceaux de 0,5 cm 3 aux 5 tubes cryo avec 0,5 ml d'OCT, compléter avec OCT, mélanger et congeler.
- Conservez les échantillons à -80 ° C jusqu'à l'analyse.
NOTE: Burton et al. Fournit un excellent aperçu des aspects pratiques de l'échantillonnage du placenta en fonction des analyses prévues. 20 Considérez préparer le tissu restant pour l'isolement des membranes microvillées et basales, et pour collecter le tissu décalé par technique d'aspiration sous vide. 21 , 22
6. Caractéristiques néonatales
- Enregistrez les caractéristiques néonatales, y compris le score Apgar (1, 5 et 10 min), le sexe, le poids, la longueur, l'âge gestationnel et l'admission à l'Unité de soins intensifs du nouveau-né (durée et résultat du séjour).
- Envisager de mesurer la composition du corps néonatal par des mesures anthropométriques, déplacer l'airPléthysmographe ou double absorptiométrie des rayons X. 23 , 24
7. Calculs
- Supposons une composition sanguine similaire dans l'artère radiale et utérine et calculez la différence de concentration artérioveineuse uteroplacentale.
Différence de concentration artérioveineuse uteroplacentaire = C A - C V
Différence de concentration artérielle veineuse - artérielle = C v - C a
Lorsque C est la concentration avec les indices: A, l'artère radiale; V, la veine utérine; V la veine ombilicale et a, l'artère ombilicale. - Calculer le débit sanguin du volume, mL / min (Q):
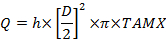
Lorsque D est le diamètre du navire (cm), TAMX est la vitesse maximale moyenne en temps et h est le coefficient pour le profil spatial de la vitesse du sang. Utilisez 0,5 comme coefficient pour la veine ombilicale et0,6 pour l'artère utérine 25 , 26 . - Calculez l'absorption et la libération du placenta selon le principe de Fick:
Capture uteroplacentale = ( C A - C V ) x Qm
Absorption fœtale = ( C v - C a ) X Q f
Sous-rubriques: m, maternelle et f, foetale.
Résultats
La méthode d'échantillonnage à 4 navires s'applique à la pratique clinique et nous avons réussi à obtenir des prélèvements sanguins provenant de 209 couples mère / nourrissons. Dans 128 d'entre eux, nous avons également réalisé pour mesurer le débit sanguin du volume. L'échantillonnage complet de 4 navires et les mesures de débit de qualité des vaisseaux maternels et fœtaux ont été obtenus dans 70 paires mère-foetus ( figure 3
Discussion
La méthode d'échantillonnage du placenta à 4 navires est pertinente pour trois objectifs principaux. Tout d'abord, il peut être utilisé pour étudier comment des substances spécifiques sont absorbées par le placenta du côté maternel et éventuellement transférées à la circulation ombilicale et au foetus, comme en témoignent nos études sur le glucose et les acides aminés. Deuxièmement, la méthode est très pertinente pour étudier les substances produites par le placenta et libérées dans ...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
D'abord et avant tout, nous remercions sincèrement les mères qui ont participé à ce projet. Ensuite, nous reconnaissons tout le personnel qui a aidé et facilité la procédure d'échantillonnage, l'anesthésiste, l'infirmière anesthésiste et les infirmières chirurgicales. Le projet n'aurait pas été possible sans le financement de l'Autorité régionale de la santé du Sud-Est de la Norvège et de l'Unité consultative norvégienne sur la santé des femmes, de l'Université d'Oslo et du financement local fourni par l'Hôpital universitaire d'Oslo.
matériels
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2 - 6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10 cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5 cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 mL LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 mL 9NC Coagulation sodium citrate 3.2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1 M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
Références
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon