Method Article
Visualisierung von Multiciliated Zellen in der Zebrabärbling durch ein kombiniertes Protokoll der ganze Berg Leuchtstofflampen In Situ Hybridisierung und Immunfluoreszenz
In diesem Artikel
Zusammenfassung
Zilien Entwicklung ist wichtig, richtige Organogenese. Dieses Protokoll beschreibt eine optimierte Methode zum Beschriften und ciliated Zellen der Zebrafisch zu visualisieren.
Zusammenfassung
In den letzten Jahren entstanden die Zebrafish Embryos als ein beliebtes Modell, Entwicklungsbiologie durch Merkmale wie ex Utero Embryonalentwicklung und optische Transparenz zu studieren. Insbesondere geworden Zebrafish Embryos Organismus wichtiger vertebrate Niere Organogenese sowie multiciliated Zellentwicklung (MCC) zu studieren. Um MCCs in der embryonalen Zebrafisch-Niere zu visualisieren, haben wir entwickelt ein kombiniertes Protokoll der gesamten-Mount Fluoreszenz in Situ Hybridisierung (FISH) und ganze montieren Immunfluoreszenz (IF), die hochauflösende Bildgebung ermöglicht. Dieses Manuskript beschreibt unsere Technik zur Lokalisierung Co RNA-Transkripte und Protein als Instrument zur Regulierung der Entwicklungsprogramme durch die Expression verschiedener Abstammung Faktoren besser zu verstehen.
Einleitung
In den letzten Jahrzehnten entstanden der Zebrabärbling (Danio Rerio) als bester Modellorganismus Entwicklungsbiologie zu studieren. Die Embryonen entwickeln außerhalb der Mutter und sind optisch transparent. Außerdem tritt die Bildung der lebenswichtigen Organe wie Auge, Niere und Vorderhirn schnell, mit Strukturen von nur 24 h Post Düngung (hpf) gebildet. Wichtig ist, ist das Zebrafish Genom mit Säugetiere1,2,3hoch konserviert. Darüber hinaus haben Zebrafisch und Säugetieren Organe ähnliche Anatomie und Physiologie. Die Zebrafish embryonale Nieren- oder Pronephros, zeigt den Wert des Modellsystems zur Prüfung Genfunktion während der frühen Nephrogenesis und Schicksal Bestimmung der konservierten epithelialen Zell-Populationen von Wirbeltieren Nephron4, 5 , 6 , 7 , 8 , 9 , 10. ebenso Zebrafish Embryos wird immer wichtiger bei der Prüfung der Ontogenese MCCs11,12,13,14,15, 16 , 17.
Wie der Name schon sagt, sind MCCs Epithelzellen zeichnet sich durch ein Bündel von bewegliche Cilien befindet sich auf der apikalen Oberfläche17. In der Zebrabärbling MCCs in Flüssigkeitsströmung funktionieren und sind in ein "Pfeffer" wie Mode in der Mitte jedes Nephron der Pronephros zerstreut durch 24 hpf11,12,13,14, 15 , 16 , 17. obwohl sie nur in einer Handvoll aufgefallen der menschlichen Niere Krankheit Fällen18,19,20,21, MCCs sind weit verbreitet in anderen Säugetieren Geweben wie dem Gehirn und Luftröhre22,23,24, die eine Vielzahl von Herausforderungen für experimentelles Design darstellt. Elegante Studien verschiedene vertebrate Modelle einschließlich Zebrafisch haben einen erhaltenen Weg von MCC Schicksal, mit der Notch-Signalweg als Inhibitor der MCC Entwicklung12,17,25 gezeigt. ,26,27. Daher stellt der Zebrafisch Pronephros eine leicht zugängliche Modell zur Untersuchung der genetischen Mechanismen der MCC Entwicklung in Vivo11,12,13,14, 15 , 16 , 17.
Transparenz und einfache genetische Manipulation von Zebrafisch-Embryonen erwiesen sich als unschätzbare Eigenschaften sein, wenn die genetischen und molekularen Wege zu studieren, die Schicksal der Zelle, Gewebewachstum und Entwicklung des frühen Embryos1,2 regulieren ,3. Als solcher, traditionelle Techniken, um Protein und gen Transkripte, z. B. in Situ Hybridisierung und ganze Berg wenn zu visualisieren, angewendet und optimiert wurden der Zebrafisch16,28,29, 30,31,32,33,34,35,36,37,38. Durch die Kombination von beliebten Protokolle für Fisch und wenn, ist es möglich, beschriften und MCCs in Vivo16,28,37,38zu analysieren.
Protokoll
Das folgende Protokoll verwendet Zebrafish Erwachsenen gepflegt und umsorgt vom Center for Zebrafish Research an der University of Notre Dame. Alle Methoden für die Arbeit mit Erwachsenen Zebrafisch und Embryonen wurden von den institutionellen Animal Care und Use Committee genehmigt.
(1) Embryo Fixierung
- Sammeln Sie Zebrafisch-Embryonen mit oben beschriebenen Methoden39,40. Um 24 Uhr hpf, 500 µL unspezifische Protease-Mischung-Lösung (50 mg/mL) auf der E3 in einem Embryo dish Inkubation bei Raumtemperatur (RT) hinzufügen.
- Wenn Embryonen beginnen, ausbrechen aus dem Chorion, entfernen Sie alle Flüssigkeit aus der Embryo-Schale.
- Waschen Sie die Embryonen 2-3 Mal mit frischen E3 indem etwa 20 mL der E3, sanft wirbeln die E3 in der Schale, und dann die Flüssigkeit in eine flüssige Abfälle Gefäß umfüllen.
- Um die Embryonen einschläfern vor der Befestigung, fügen Sie 2 mL 0,2 % Tricaine auf der E3.
- Transfer der Embryonen in eine 5 mL-Glasflasche mit einem Kunststoff Pasteurpipette. Entfernen Sie die meisten der Tricaine/E3-Lösung mit der Pipette, nachdem die Embryonen auf den Boden des Röhrchens niedergelassen haben.
- Beheben Sie 24 hpf-Embryonen mit 5 mL 4 % Paraformaldehyd (PFA) für 2-4 h bei RT, ohne Aufregung.
Achtung: PFA ist giftig und PFA-Lösungen unter einem chemischen Haube bearbeitet werden sollen, während die Forscher Augenschutz, Handschuhe und einen Laborkittel trägt. Vorbereitung der PFA-Fixativ aus dem granulierten PFA-Pulver sollte mit außerordentlicher Sorgfalt durchgeführt werden, da die granulierte PFA tendenziell durch statische Aufladung zu zerstreuen.
Hinweis: Embryonen können beheben in 4 % PFA über Nacht bei 4 ° C. Bereiten Sie 4 % PFA durch Erhitzen 1 x Phosphat gepufferte Kochsalzlösung (PBS) aufkochen ständig rühren die Lösung vollständig granulierte PFA auflösen. Sobald die Lösung wieder auf RT, die 4 % PFA Filter abgekühlt ist ist, indem man es durch ein 0,45 µm Einweg-System für Vakuumfiltration, sterilisiert dann und regelmÄÑig in 15 mL oder 50 mL Portionen für die Lagerung bei-20 ° C. - Entfernen Sie die 4 % PFA und waschen Embryonen zweimal mit 1 X Phosphat gepufferte Kochsalzlösung mit 0,1 % Tween-20 (PBST) bei RT waschen die Embryonen einmal mit 5 mL 100 % Methanol (MeOH) bei RT hinzufügen 5 mL frische 100 % MeOH, die Embryonen und bei-20 ° C für mindestens 20 min inkubieren.
Hinweis: Embryonen können gespeichert werden, in 100 % MeOH bei-20 ° C bis zum Embryo Vorbereitung bereit.
(2) Embryo Vorbereitung und Hybridisierung
- Rehydrieren die Embryonen durch Waschen einmal in 5 mL 50 % MeOH in 1 X PBST für 5 min bei RT weiter Rehydratation durch Waschen der Embryonen in 5 mL 30 % MeOH in 1 X PBST für 5 min bei RT waschen die Embryonen in 5 mL 1 X PBST zweimal für 5 min bei RT.
- Permeabilize die Embryonen von brüten sie in 5 mL einer Lösung von 1:1,000 Proteinase K (pK) (10 mg/mL) in 1 X PBST für 2 min bei RT
Hinweis: Ältere Embryonen können länger als 2 min in die pK-Konzentration bereits erwähnt, aber eine Konzentration von 5 mg/mL und Inkubation Zeit weniger als 2 min. für Embryonen jünger als 24 vorgeschlagen inkubiert hpf. - Entfernen Sie pK-Lösung und waschen sofort in 5 mL 1 x PBST zweimal bei RT beheben die Embryonen in 5 mL 4 % PFA bei RT für mindestens 20 Minuten.
Hinweis: Embryonen können beheben in 4 % PFA über Nacht bei 4 ° C. - Entfernen Sie PFA und waschen zweimal in 5 mL 1 X PBST bei RT
- Transferieren Sie die Embryonen in 5 mL 1 X PBST in flachen Boden Mikrozentrifugenröhrchen platziert aufrecht in einem Microcentrifuge Rack bei RT, Interaktionen zwischen jedem Embryo und der nachfolgende Hybridisierung Lösung zu erleichtern.
- Waschen Sie die Embryonen zweimal in 1,5 mL Hybridisierung Lösung (Hyb +) bei RT Add 1,5 mL frische Hyb + und inkubieren Sie Embryonen bei 70 ° C im Ofen für ca. 4-6 h Hybridisierung.
- Die 1,5 mL Hyb + mit einem Volumen von Sonde Lösung zu ersetzen (10 µL RNA-Sonde/500 µL Hyb +) ausreichen, um die Embryonen in vollem Umfang abdecken.
Hinweis: Synthetisieren Sie Antisense RNA-Sonde, die zuvor mit Methoden39beschrieben. - Hybridisieren Sie die Sonde über Nacht im Backofen bei 70 ° C Hybridisierung mit der Einzelrohre positioniert aufrecht im Microcentrifuge Rack ohne schütteln.
3. heiße Waschungen und blockieren
Hinweis: Heiße Waschungen erfolgen durch die Embryonen die geeignete Lösung aufsetzen und dann im Ofen bei 70 ° c Hybridisierung Inkubation Um die Waschlösungen bei 70 ° C zu halten, 50 mL Röhrchen jeder Lösung in der Hybridisierung Backofen stellen wenn die Sonde / Hyb + Mischung hinzugefügt.
- Entfernen Sie die Sonde. Waschen Sie die Embryonen zweimal bei 70 ° C in 1,5 mL 50 % Formamid/2 x Puffer Kochsalzlösung Natriumcitrat (SSC) für 20-30 min.
Hinweis: Die Sonde kann in Hyb + bei-20 ° C gelagert und zu einem späteren Zeitpunkt wieder verwendet. - Einmal waschen die Embryonen bei 70 ° C in 1,5 mL 2 X SSC für 15 min. Waschen die Embryonen zweimal bei 70 ° C in 1,5 mL 0,2 X SSC für 20-30 min. Ersetzen 0,2 X SSC mit 1,5 mL blockierende Reagenzien und über Nacht bei 4 ° c inkubieren
Hinweis: Es ist möglich, blockierende Reagenzien bei RT für 4 h statt über Nacht inkubieren.
(4) Antikörper Inkubationszeit und Maleic Acid Buffer Wäschen
Hinweis: Bewahren Sie Embryonen vor Licht geschützt.
- Blocking Reagenz mit 0,2 mL anti-DIG-POD in blockierende Reagenzien in einem Verhältnis von 1:1,000 zu ersetzen und 3 h unter Folie oder einem anderen lichtundurchlässigen decken bei RT inkubieren
Hinweis: Alternativ kann die Antikörper über Nacht bei 4 ° c inkubieren - Waschen Sie nach 3 h die Embryonen in 1,5 mL Maleic Acid Puffer 2-4 Mal für 10-15 min bei RT inkubieren der Embryonen über bei 4 ° C in 1,5 mL frischen Maleic Säure-Puffer Nacht.
Hinweis: Es ist nicht notwendig, über Nacht in Maleic Acid Puffer inkubieren, aber dabei sinkt also Sonde Hintergrund.
5. probe Erkennung und Entfernung von Peroxidase
Hinweis: Bewahren Sie Embryonen vor Licht geschützt.
- Entfernen Sie Maleic Acid Puffer zu und ersetzen Sie mit 1,5 mL 1 X PBS. Waschen von Embryonen zweimal in 1,5 mL 1 X PBS für jede 5 min bei RT inkubieren Embryonen in 0,2 mL der Cy3 fluoreszierende Färbelösung für 60 min bei RT
Hinweis: Inkubationszeit kann für unterschiedliche Sonden variieren. - Waschen Sie die Embryonen einmal mit 1,5 mL der folgenden Prozent MeOH mit 1 X PBS-Puffer für 10 min bei RT: 30 % MeOH, 50 % MeOH, 75 % MeOH und 100 % MeOH.
- Den Embryonen mit 1,5 mL 1 % H2O2 in MeOH für 30 min bei RT. Wash die Embryonen einmal mit 1,5 mL der folgenden MeOH Lösungen mit 1 X PBS-Puffer für 10 min bei RT inkubieren: 75 % MeOH, 50 % MeOH und 30 % MeOH. Waschen Sie die Embryonen zweimal für 5 min bei RT in 1,5 mL 1 X PBS.
Hinweis: Embryonen können mit PBS-Puffer über Nacht bei 4 ° c gespeichert werden
(6) Immunfluoreszenz
Hinweis: Bewahren Sie Embryonen vor Licht geschützt.
- Waschen der Embryonen in 1,5 mL DdH2O 5 min bei RT. Wash die Embryonen in 1,5 mL vorgekühlt Aceton (gehalten bei-20 ° C) für 7 min bei RT den Embryonen einmal in 1,5 mL DdH2O 5 min bei RT. Wash waschen die Embryonen einmal in 1,5 1 mL X PBST mit 1 % DMSO (PBDT) für 5 min bei RT
- Inkubieren Sie die Embryonen in 1,5 mL PBDT + 10 % fetalen bovine Serum (FBS) auf ein Rocker für 2 h bei RT.
- PBDT + FBS zu entfernen und ersetzen Sie mit 1,5 mL des primären Antikörper, Anti-acetyliert Tubulin (produziert von Maus) und Anti-γ-Tubulin (produziert von Kaninchen), verdünnt 1: 400 PBDT + 1 % zusammen FBS. Die Embryonen über Nacht bei 4 ° c inkubieren
Hinweis: Die Inkubationszeiten variieren je nach den primären Antikörper. Testen von verschiedenen Zeitintervallen möglicherweise Kennzeichnung zu optimieren.
(7) sekundäre Antikörper
Hinweis: Bewahren Sie Embryonen vor Licht geschützt.
- Um überschüssige ungebundene Antikörper aus der Embryonen zu entfernen, waschen Sie in 1,5 mL PBDT + 1 % FBS + 0,1 M NaCl für 1 min bei RT auf einer Wippe.
- Waschen Sie die Embryonen 5 Mal in 1,5 mL PBDT + 1 % FBS + 0,1 M NaCl für 30 min auf einer Wippe bei RT waschen die Embryonen in 1,5 mL PBDT + 1 % FBS für 30 min bei RT auf einer Wippe.
- Inkubieren Sie die Embryonen über Nacht bei 4 ° C in 200 µL der Sekundärantikörper Alexa 488 Ziege Anti-Maus IgG und Alexa 647 Ziege Anti-Kaninchen IgG, zusammen in PBDT bei 1: 500 verdünnt.
8. DAPI-Färbung
Hinweis: Bewahren Sie Embryonen vor Licht geschützt.
- Waschen Sie die Embryonen schnell bei RT in 1,5 mL PBDT zwei Mal. Ersetzen PBDT mit 1,5 mL DAPI, 1:15000 in 1 X PBST verdünnt und inkubieren Sie 15 min bei RT auf einer Wippe.
- Waschen Sie die Embryonen in 1,5 mL PDBT + 1 % FBS + 0,1 M NaCl drei Mal bei RT für 15-20 min. Embryonen in 1,5 mL PBDT bei 4 ° C bis zu montieren und Bild zu speichern.
9. Montage und Imaging für Zebrafish Pronephros
- Laien Embryo Lateral auf Objektträger in einem kleinen Volumen, ca. 10 µL, PBDT.
- Drücken Sie den Embryo hinter den Augen mit ein paar feine Zange auf den Kopf zu entfernen und einige der Eigelb-Ball.
- Verwenden Sie die feinen Pinzette sanft entfernt den restlichen Eigelb-Ball aus dem Embryo Körper kratzen. Entfernen Sie die dissoziierten Eigelb und zusätzliche Flüssigkeit aus der Folie mit einem dünnen Tuch.
- Tropfen Sie einen Medien die restlichen Schwanz des Embryos zu montieren und positionieren Sie, so dass das Heck seitlich angeordnet ist. Legen Sie ein Deckglas auf der Oberseite der Rute zum Glätten der Probenmaterials, dann legen Sie in einer überdachten Folie Box.
- Bild Niere Zilien bei 60 X Vergrößerung auf einem confocal Mikroskop über die folgenden Kanäle: DAPI blau (laser-Set 408.0 nm), FITC in grün (laser-Set 488.0 nm), Cy3 Farbstoff-markierten in rot (laser-Satz bei 561.0 nm), und Alexa 680 in weiß (laser-Set 637.0 nm).
Ergebnisse
Wildtyp Zebrafisch-Embryonen wurden behoben, um 24 Uhr hpf und sofort zubereitet wie oben beschrieben. Abbildung 1 zeigt einen experimentelle Workflow zusammen mit ausgewählten dargestellten Phasen. Der Workflow in Schritte 1 bis 8 beschriebenen umfasst die Prozesse der Probe Beschaffung, Fixierung und Manipulation des festen Gewebes, endogene Transkripte mit antisense Riboprobes gefolgt von Immunfluoreszenz zum Label benutzt von Interesse zu kennzeichnen. Schritt 9 im Workflow bezieht sich auf die Montage und bildgebende Verfahren, die speziell für die Visualisierung der Zebrafisch embryonalen Stamm zu optimieren. In den Zeichnungen, die Schritt 9 begleiten, zeigen wir die Methode der Manipulation zur Positionierung des Gewebes auf einen Objektträger. In diesem Schritt werden die Embryos Kopf und Eigelb Kugel entfernt, verlassen die Rute zwischen Objektträger und Deckglas seitlich positioniert werden. Entfernung der Eigelb-Ball und Kopf wird für die beste Darstellung der MCC Wohnbevölkerung in der Pronephros vorgeschlagen, wie der Dotter Ball Auto fluoresziert und den Montageprozess behindert.
In Abbildung 2, die den gleichen Wildtyp Embryo bei 60 X Vergrößerung und einen digitalen Zoom mit der gleichen Vergrößerung zeigt repräsentative Bilder erhalten, mit einem konfokalen Mikroskop angeboten. Die oberen Platten liefern Bilder jedes einzelnen Kanals, während die unteren beiden Platten die zusammengesetzten Überlagerung der diese Bilddaten sind. Das weiße Feld (in der linken Spalte Bild) beschreibt den Bereich, der im Mittelpunkt des digitalen Zooms (Bild rechts) ist. Markiert im abschließenden Panel des digitalen Zooms, wurden Kerne in DAPI, und MCCs wurden erkannt, basierend auf einem antisense Riboprobe entworfen, odf3b, zu erkennen, wo Antikörper an γ-Tubulin bezeichnen die basalen Körper und α-Tubulin bezeichnet die Zilien. In den digitalen Zoom der zusammengesetzten Überlagerung zeigt der gelbe gestrichelte Kreis den Umfang von einem MCC, die durch den Besitz von Zilien odf3b Protokolle und mehrere basale Körper identifiziert wurde. Die angrenzende Mono-ciliated Zelle, gekennzeichnet mit einem gelben gepunkteten Kreis wurde anhand der Phänotyp besitzen einen einzigen Basaltemperatur und einem einzigen Zilie identifiziert.
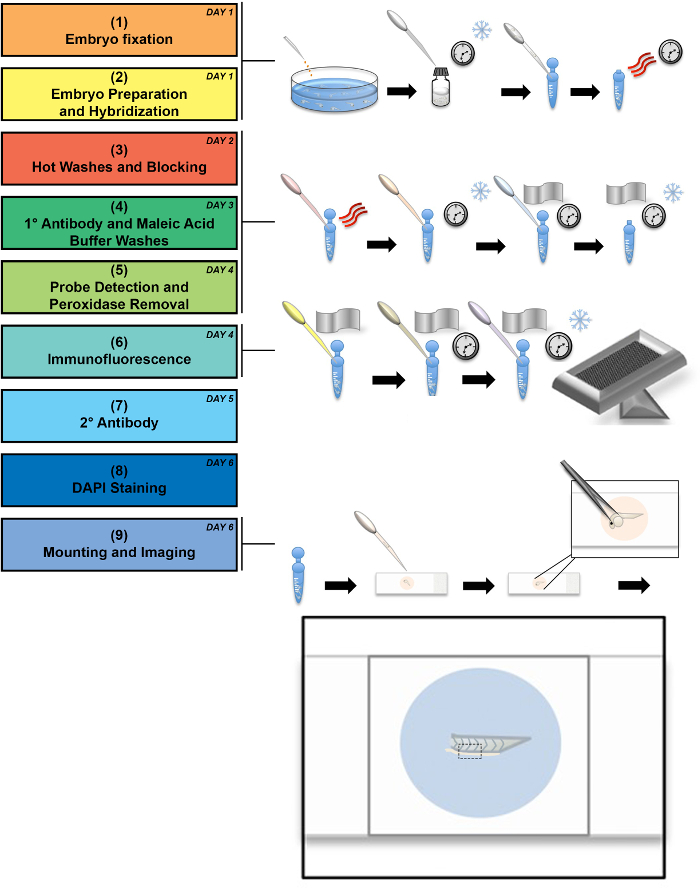
Abbildung 1: Schematische der experimentellen Flussdiagramm. Das Flussdiagramm zeigt einen experimentelle Workflow begleitet von Abbildungen der kritischen Phasen, in denen die Schneeflocke kalt Inkubation zeigt, drei gebogene Linien stehen für Wärme und die Uhr stellt langen Inkubationszeiten. Der Workflow kann durchgeführt werden, bei einem Mindestaufenthalt von 6 Tagen (siehe Tag-Nummer in der rechten oberen Ecke jeder Stufe im Prozess), obwohl einige Schritte über längere Zeiträume durchgeführt werden können, wie im Protokoll erwähnt. Eine detaillierte Darstellung der Montage zieht es heraus, zeigt die endgültige montierten Embryo Rute zwischen Objektträger und Deckglas. Ein schwarzer gestrichelter beschreibt den Bereich, der bei 60 X Vergrößerung abgebildet wird. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Vertreter führt zur Visualisierung von MCCs Zebrafisch Pronephros. Maximale Bildprojektionen eines 24 hpf Wildtyp Zebrafish Embryos bei 60 X Vergrößerung sowie einen digitalen Zoom auf die konfokale bei 60 X Vergrößerung des gleichen Embryos. Die weißen Felder zeigen das Gebiet für den Zoom im Mittelpunkt. Einzelne Flecken DAPI (Kerne), odf3b (MCCs), γ-Tubulin (basale stellen) und α-Tubulin (Zilien) sind beschriftet und dann in den beiden unteren Feldern zusammengeführt. In den digitalen Zoom bieten wir Annäherungen der Zelle Standorte wie folgt: ein MCC wird durch den gestrichelten gelben Kreis skizziert und die gestrichelte gelben Kreis beschreibt eine Mono-ciliated Zelle. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Das oben beschriebene Protokoll ist für die Kennzeichnung MCCs in der Pronephros mit odf3b Transkripte und α-Tubulin in den 24 hpf Zebrafish Embryos optimiert. Die besten Ergebnisse zu erzielen empfiehlt es sich, frisch fest- und vorbereitete Embryonen zu verwenden. Embryonen, die wurden behoben, und gespeichert in MeOH oder Hyb + bei-20 ° C für mehr als 1 Woche können verwendet werden, aber die Wahrscheinlichkeit von unerwünschten Hintergrund Färbung steigt mit der Zeit, die die Embryonen im Speicher gehalten werden.
Modifikationen und Problembehandlung für diese Technik sind notwendig, um diese Methode für andere Suiten des bestimmten Markierungen, z. B. andere antisense Riboprobes und andere Antikörper anpassen. Viele Methoden zur Anpassung der Parameter der Schritte im Prozess der ganze Berg in Situ Hybridisierung wurden bisher dokumentiert von unserer Fraktion und anderen31,34,36,38, 39. Ebenso jedes Protein Antikörper erfordert einige Fehlersuche in Bezug auf die Färbung Zeiten und ungefähre Reichweiten von Verdünnungen und Inkubationszeiten für jedes Primärantikörper dürften am besten durch Auswertung der dokumentierten Ergebnissen28, 35. für Embryonen jünger als 24 hpf, pK-Behandlung sollte kürzer sein als 2 min, wo Embryonen, die älter als 24 hpf mit pK für länger als 2 min behandelt werden sollte. Auch Embryonen älter als 24 hpf Pigment vor der pK-Behandlung gebleicht werden sollten.
Nach der Färbung mit fluoreszierenden Färbelösung, ist es wichtig, alle verbleibenden Fleck, Antikörper und Peroxidasen zu entfernen, indem die Reihe von Methanol und Wasserstoff-Peroxid wäscht. Die PBS-Wäschen unmittelbar nach sind entscheidend für überschüssige Methanol aus den Embryonen zu entfernen. Wichtig ist, bevor Sie mit der IF-Antikörper, haben wir festgestellt, dass das Aceton und deionisiertes Wasser wäscht die Embryonen seltener an einander und/oder die Zentrifuge Rohre halten machen. In unserer Erfahrung, Antikörper gegen bestimmte Transkriptionsfaktoren und andere Gene obwohl sie effizient arbeiten können, Western blots, funktionieren nicht gut denn wenn in der Zebrabärbling. Hoch konservierte und reichlich Proteine wie α-Tubulin und β-Catenin, funktionieren jedoch auch in der Zebrabärbling für IF16,37.
Mit Fisch ist es möglich, RNA-Transkripte von Genen zu visualisieren, die noch keine spezifische Antikörper in der Zebrabärbling haben. Durch die Kombination von Fisch mit IF, kann dieses Protokoll beweist Co Lokalisierung von RNA-Transkripte und Protein gesehen in Vivo (Abbildung 2). Die flexible Art des Protokolls ermöglicht schnelle Fehlersuche für die Visualisierung der verschiedenen RNA-Transkripte und Proteine in zahlreichen Geweben und Zeitpunkten. In Kombination mit den bereits angesehenen Eigenschaften von Zebrafisch-Embryonen, bietet dieses Protokoll von Fisch + wenn ein weiteres Tool um die Expression von Genen und Proteinen wichtige entwicklungspolitische Weg Verordnung zu erkunden.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde teilweise durch die Gewährung R01DK100237 R.A.W und der National Science Foundation Graduate Research Fellowship No unterstützt. DGE-1313583, A.N.M. Wir bedanken uns auch bei der Hochschule der Wissenschaft Sommer Undergraduate Research Fellowship Program zur Unterstützung der M.U. Wir möchten das Zentrum für Zebrafisch-Forschung an der University of Notre Dame für ihre engagierte Betreuung unserer Zebrafisch danken. Wir möchten auch Danke, Abteilung der biologischen Wissenschaften sowie die Mitglieder unseres Labors für all ihre Unterstützung und wertvolle Einblicke.
Materialien
| Name | Company | Catalog Number | Comments |
| non-specific protease mixture solution | Roche | 11459643001, pronase from Streptomyces griseus | Dilute in E3 without methylene blue to make 50mg/mL stock solution; store at -20°C |
| E3 solution | Dilute 50X E3 (250 mM NaCl, 8.5 mM KCl, 16.5 mM CaCl2, 16.5 mM MgSO4 in distilled water) in distilled water; add 1 x 10-5 M methylene blue (sigma M9140) to inhibit contamination | ||
| tricaine (ethyl 3-aminobenzoate methanesulfonate) | Fluka | A5040-250G | To make a 0.2% stock solution, dissolve 1 g of tricaine powder in 10 mL Tris, pH 9.5 and distilled water up to 500 mL |
| embryo dishes | VWR | 351029 | |
| 5 mL glass vials | Wheaton | 225012 | |
| disposable plastic Pasteur pippettes | VWR | 414004-004 | |
| 4% paraformaldehyde (PFA) solution | Electron Microscopy Services | 19210 | Dissolve 4% PFA in 1X PBS and bring to a boil under a fume hood. Cool and aliquot, then store at -20°C. Do not refreeze once thawed for use. |
| 10X PBS | American Bioanalytical | AB11072 | Dilute in distilled water to make a 1X stock |
| Tween-20 stock | American Bioanalytical | AB02038 | Make a 0.1% Tween-20 stock by diluting in distilled water. |
| 1X phosphate buffered saline with 0.1% Tween 20 (PBST) | Sigma | P9416 | 0.1% Tween-20 in 1X PBS |
| methanol (MeOH) | Sigma | 34860-4L | |
| proteinase K | Roche | 3115879001 | Dissolve in distilled water to make a 10 mg/mL stock; aliquot and store at -20°C |
| flat bottom microcentrifuge tubes | VWR | 87003-300; 87003-298 | |
| formamide | American Bioanalytical | AB00600 | store at -20°C |
| hybridization solution (HYB+) | 50% formamide, 5X SSC, 0.1% Tween-20, 5 mg/mL yeast torula RNA, 50 μg/μL heparin; store at -20°C | ||
| hybridization oven | Fisher Scientific | 13-247-10Q | |
| 20X saline-sodium citrate (SSC) buffer solution | American Bioanalytical | AB13156 | dilute in distilled water to make 2X and 0.2X stocks |
| blocking reagent solution | Roche | 11096176001 | dilute in maleic acid buffer to make a 10% stock solution; store at 4°C |
| maleic acid buffer solution | Sigma | M0375 and S7653 | 150mM maleic acid, 100mM NaCl (pH 7.5) |
| anti-Digoxigenin-POD, Fab fragments | Roche | 11207739910 | store at 4°C |
| Cy3 fluorescent staining solution | PerkinElmer, Inc. | NEL744001KT, TSA Plus Cyanin3 system | store at 4°C; prepare staining solution fresh by making a 1:50 dilution of TSA reagent (dissolved in 60 uL of DMSO) in the kit buffer |
| Hydrogen peroxide (H2O2) | Sigma | H1009-500mL | store at 4°C |
| molecular grade distilled water (ddH2O) | Mediatech | 25-055-CM | |
| acetone | American Bioanalytical | AB00636-01000 | store an aliquot at -20°C |
| DMSO | American Bioanalytical | AB00435-01000 | |
| fetal bovine serum (FBS) | Gibco | 10438-034 | aliquot and store at -20°C |
| monoclonal anti-acetylated tubulin clone 6-11B-1 | Sigma-Aldrich | T6793 | aliquot and store at -20°C |
| anti-γ-tubulin anitbody produced in rabbit | Sigma-Aldrich | T5192 | aliquot and store at -20°C |
| odf3b cDNA clone MGC:63985 | OpenBiosystems | IMAGE:6792478 | store bacterial glycerol stock at -80°C |
| NaCL | American Bioanalytical | AB01915-05000 | |
| Alexa flour 647 goat anti-rabbit IgG | Life Technologies | A21245 | store at 4°C; protect from light |
| Alexa fluor 488 goat anti-mouse IgG | Life Technologies | A11029 | store at 4°C; protect from light |
| DAPI | Life Technologies | D1306 | aliquot and store at -20°C |
| glass slide | Thermo-Fisher | 4445 | |
| glass coverslip | Thermo-Fisher | 12-540A | 18 x 18 mm |
| fine forceps | Roboz | RS-1050 | Dumont Tweezers Pattern #55 |
| mounting media | Polysciences, Inc. | 18606, Aqua-Poly/Mount | store at 4°C |
| confocal microscope and associated software | We use a Nikon C2plus Confocal Microscope with NIS-elements AR software | ||
| rocker | Bio-Rad | 1660710EDU |
Referenzen
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341(2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Drummond, I. A. Kidney development and disease in the zebrafish. J Am Soc Nephrol. 16, 299-304 (2005).
- Wingert, R. A., et al. The cdx genes and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. The zebrafish pronephros: a model to study segmentation. Kindey Int. 73 (10), 1120-1127 (2008).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Chambers, B. E., Wingert, R. A. Renal progenitors: roles in kidney disease and regeneration. World J Stem Cells. 8 (11), 367-375 (2016).
- Drummond, B. E., Wingert, R. A. Insights into kidney stem cell development and regeneration using zebrafish. World J Stem Cells. 8 (2), 22-31 (2016).
- Poureetezadi, S. J., Wingert, R. A. Little fish, big catch: zebrafish as a model for kidney disease. Kidney Int. 89 (6), 1204-1210 (2016).
- Kramer-Zucker, A. G., Olale, F., Haycraft, C. J., Yoder, B. K., Schier, A. F., Drummond, I. A. Cilia-driven fluid flow in the zebrafish pronephros, brain and Kupffer's vesicle is required for normal organogenesis. Development. 132, 1907-1921 (2005).
- Liu, Y., Narendra, P., Kramer-Zucker, A., Drummond, I. A. Notch signaling controls the differentiation of transporting epithlelia and multiciliated cells in the zebrafish pronephros. Development. 134, 1111-1122 (2007).
- Ma, M., Jiang, Y. J. Jagged2a-Notch signaling mediates cell fate choice in the zebrafish pronephric duct. PLoS Genetics. 3, e18(2007).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom, and Notch signaling. Dev Biol. 386 (1), 111-122 (2014).
- Wang, L., et al. miR-34b regulates multiciliogenesis during organ formation in zebrafish. Development. 140, 2755-2764 (2013).
- Marra, A. N., Wingert, R. A. Epithelial cell fate in the nephron tubule is mediated by the ETS transcription factors etv5a and etv4 during zebrafish development. Dev Biol. 411 (2), 231-245 (2016).
- Marra, A. N., Li, Y., Wingert, R. A. Antennas of organ morphogenesis: the roles of cilia in vertebrate kidney development. Genesis. 54 (9), 457-469 (2016).
- Duffy, J. L., Suzuki, Y. Ciliated human renal proximal tubular cells. Observations in three cases of hypercalcemia. Am J Pathol. 53, 609-616 (1968).
- Katz, S. M., Morgan, J. J. Cilia in the human kidney. Ultrastruct Pathol. 6, 285-294 (1984).
- Hassan, M. O., Subramanyan, S. Ciliated renal tubular cells in crescentic glomerulonephritis. Ultrastruct Pathol. 19, 201-203 (1995).
- Ong, A. C., Wagner, B. Detection of proximal tubular motile cilia in a patient with renal sarcoidosis associated with hypercalcemia. Am J Kidney Dis. 45, 1096-1099 (2005).
- Worthington, W. C., Cathcart, R. S. III Ependymal cilia: distribution and activity in the adult human brain. Science. 139, 221-222 (1963).
- Cowan, M. J., Galdwin, M. T., Shelhamer, J. H. Disorders of ciliary motility. Am J Med Sci. 321, 3-10 (2001).
- Jain, R., et al. Temporal relationship between primary and motile ciliogenesis in airway epithelial cells. Am J Respir Cell Mol Biol. 43, 731-739 (2010).
- Stubbs, J. L., Vladar, E. K., Axlerod, J. D., Kitner, C. Multicilin promotes centriole assembly and ciliogenesis during multiciliate cell differentiation. Nat Cell Biol. 14, 140-147 (2012).
- Tan, F. E., et al. Myb promotes centriole amplification and later steps of the multiciliogenesis program. Development. 140, 4277-4286 (2013).
- Zhou, F., Narasimhan, V., Shboul, M., Chong, Y. L., Reversade, B., Roy, S. Gmnc is a master regulator of the multiciliated cell differentiation program. Curr Biol. 25, 3267-3273 (2015).
- Jowett, T. Analysis of Protein and gene expression. Methods Cell Biol. 59, 63-85 (1999).
- Schulte-Merker, S. Chapter 2: Looking at Embryos. Zebrafish: A practical approach. 261, 39-58 (2002).
- Brend, T., Holley, S. A. Zebrafish whole mount high-resolution double fluorescent in situ hybridization. J Vis Exp. (25), (2009).
- Lauter, G., Soll, I., Hauptmann, G. Two-color fluorescent in situ hybridization in the embryonic zebrafish brain using differential detection systems. BMC Dev Biol. 11, (2011).
- Drummond, B. E., Li, Y., Marra, A. N., Cheng, C. N., Wingert, R. A. The tbx2a/b transcription factors direct pronephros segmentation and corpuscle of Stannius formation in zebrafish. Dev Biol. 421 (1), 52-66 (2017).
- Jaffe, K. M., Thiberge, S. Y., Bisher, M. E., Burdine, R. D. Imaging cilia in zebrafish. Methods Cell Biol. 97, 415-435 (2010).
- Lauter, G., Soll, I., Hauptmann, G. Multicolor fluorescent in situ hybridization to define abutting and overlapping gene expression in the embryonic zebrafish brain. Neural Dev. 6, (2011).
- Sorrells, S., Toruno, C., Stewart, R. A., Jette, C. Analysis of apoptosis in zebrafish embryos by whole-mount immunofluorescence to detect activated caspase 3. J Vis Exp. (82), e51060(2013).
- Schumacher, J. A., Zhao, E. J., Kofron, M. J., Sumanas, S. Two-color fluorescent in situ hybridization using chromogenic substrates in zebrafish. Bio Techniques. 57, 254-256 (2014).
- Julich, D., et al. beamter/deltaC and the role of Notch ligands in the zebrafish somite segmentation, hindbrain neurogenesis and hypochord differentiation. Dev Biol. 286, 391-404 (2005).
- Gross-Thebing, T., Paksa, A., Raz, E. Simultaneous high-resolution detection of multiple transcripts combined with localization of proteins in whole-mount embryos. BMC Biology. 12, (2014).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat Mount Preparation for Observation and Analysis of Zebrafish Embryo Specimens Stained by Whole Mount In situ Hybridization. J Vis Exp. (89), e51604(2014).
- Poureetezadi, S. J., Donahue, E. K., Wingert, R. A. A Manual Small Molecule Screen Approaching High-throughput Using Zebrafish Embryos. J Vis Exp. (93), e52063(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten