Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Chip-basierte dreidimensionale Zellkultur in perfundierten Micro-Bioreaktoren
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Chip-basierte Plattform für die dreidimensionale Kultivierung von Zellen in Mikro-Bioreaktoren. Ein Chip kann bis zu 10 Mio. Zellen, die unter genau definierten Bedingungen im Hinblick auf die Strömung, Sauerstoffspannung etc. in einem sterilen, geschlossenen Kreislauf kultiviert werden können.
Zusammenfassung
Wir haben eine Chip-basierte Zellkultur-System für die dreidimensionale Kultivierung von Zellen entwickelt. Der Chip ist in der Regel von nicht-biologisch abbaubaren Polymeren, zB Polycarbonat oder Polymethylmethacrylat durch Mikro-Spritzgießen, Mikro Heißprägen oder Mikro-Tiefziehen hergestellt. Aber kann es auch aus biologisch abbaubaren Polymeren hergestellt werden. Seine Abmessungen sind 0,7 1 x 20 x 20 x 0,7 1 mm (HxBxT). Die wichtigsten Merkmale der verwendeten Chips werden entweder ein Raster von bis bis 1156 Kubik Mikro-Containern (cf-Chip) jedes von der Größe 120-300 x 300 x 300 μ (HxBxT) oder runde Vertiefungen mit einem Durchmesser von 300 μ und einer Tiefe von 300 μ (r-Chip). Das Gerüst kann Haus 10 Mio. Zellen in einer dreidimensionalen Konfiguration. Für eine optimale Nährstoff-und Gasversorgung, ist der Chip in einem Bioreaktor Gehäuse eingesetzt. Der Bioreaktor ist Teil eines geschlossenen Kreislauf steril, dass in der einfachsten Konfiguration, zusätzlich von einer Walze Pumpe und ein Medium-Reservoir mit einer Gasversorgung besteht. Der Bioreaktor kann in Perfusion, Superfusion, oder sogar ein Mischbetrieb gefahren werden. Wir haben erfolgreich Zelllinien sowie primäre Zellen über einen Zeitraum von mehreren Wochen kultiviert. Für Ratten primären Leberzellen konnten wir einen Erhalt der organotypischen Funktionen für mehr als 2 Wochen zeigen. Für hepatozellulären Karzinom-Zelllinien konnten wir zeigen die Induktion von Leber-spezifische Gene nicht oder nur geringfügig in Standard-Monolayer-Kultur zum Ausdruck gebracht. Das System könnte auch nützlich sein, wie eine Stammzelle Anbausystem seit der ersten Differenzierung Experimente mit Stammzell-Linien waren viel versprechend.
Protokoll
Dieses Papier beschreibt die Verwendung eines Chip-basierte Plattform (Abb. 1) für die dreidimensionale Kultivierung von Zelllinien sowie primäre Zellen. Da viele Zellen exprimieren organotypischen Funktionen nur in einer 3D-Umgebung zu tun, haben wir ein Polymer-Chip, ein Gerüst, auf die die Zellen können in alle Raumrichtungen haften bietet entwickelt, und das kann in einem Bioreaktor Gehäuse für die Steuerung der Strömung montiert werden , Sauerstoffspannung etc. Je nach Versuchsanordnung kann die Oberfläche des Polymers durch verschiedene Techniken, zB UV-Bestrahlung, PECVD, γ-Pfropfen oder konventionelle Nasschemie geändert werden.
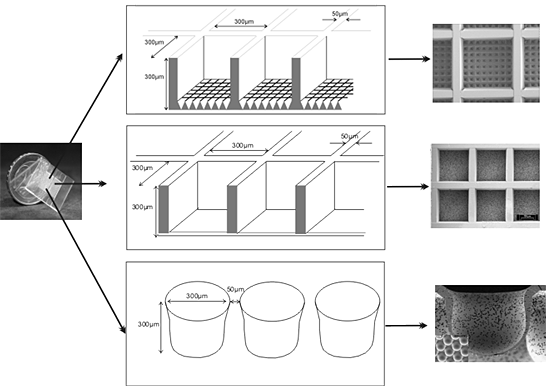
Abbildung 01
1. De-Be-und Hydrophilierung des Chips
Vor Gebrauch muss der Chip entlüftet und hydrophilisiert werden. Dafür ist ein Alkohol-Serie durchgeführt. Isopropanol-Lösungen, bestehend aus 100%, 70%, 50%, 30% Isopropanol in DMPC-behandeltem Wasser hergestellt werden und der Chip ist in jeder Konzentration getaucht, beginnend mit dem 100%-Lösung für bis zu 30s. Der letzte Schritt der Serie besteht aus reinem Dimethyl pyrocarbonat (DMPC)-behandeltem Wasser. Von diesem Punkt an ist es wichtig, dass der Chip nass.
2. Collagen I Beschichtung
Nach dem Alkohol-Serie ist der Chip in der Regel mit einer Kollagen-I-Lösung von Rattenschwanz beschichtet. Von der Kollagen-Stammlösung von 2 mg / ml in 0,2% Essigsäure ein Aliquot entsprechend 30 ug Kollagen-Protein ist mit DMPC-behandeltem Wasser auf ein Endvolumen von 150 ul verdünnt. Dies führt zu einer Kollagen-Beschichtung von der Chip-Oberfläche mit einer Dichte von 10 ug Kollagen I pro cm 2 Fläche.
3. Inokulation von hepatozellulären Karzinom-Zellen
Hepatozellulären Karzinom-Zellen der Linie HepG2 sind trypsiniert und gezählt. Für kurzfristige Versuche (1 bis 6 Tage) 5 * 10 6 Zellen sind in jedem Chip und die entsprechende Steuerung 6 cm Gewebekultur-Petrischalen ausgesät. Um inoculte sind die Chip-5 * 10 6 Zellen in 150 ul Kulturmedium resuspendiert und auf der mikrostrukturierten Fläche des Chips (Abb. 2). Danach wird es in einem Inkubator für 2-3 Stunden platziert. Während dieser Inkubationszeit der Zellen Sediment in der Mikro-Behälter und haften an der Kollagen I-beschichteten Gerüst.

Abbildung 2
4. Einsetzen des Chips in den Bioreaktor Gehäuse
Nach der Inkubationszeit wird der Chip aus dem Brutschrank entnommen und montiert in den Bioreaktor Gehäuse. Für diese, unter der Sterilbank wird die vormontierte Bioreaktor aus der sterilen Verpackung entnommen und zerlegt zu einem gewissen Grad, dass für das Einsetzen des Chips ermöglicht. Der Chip wird vorsichtig mit einer sterilen Pinzette gehandhabt und in die Nut, dass die Dichtung, die Dichtungen der Chip und die Ergebnisse in der Erzeugung von einer oberen und unteren Kompartiment in dem Bioreaktor enthält. Dann wird der Bioreaktor wieder zusammengebaut übertragen in den Inkubator, wo sie mit der Pumpe verbunden ist, die Gasversorgung und die Sauerstoff-Analysator.
5. Befüllen der Anlage
Sobald der Bioreaktor auf das Medium Reservoir verbunden ist, Förderpumpe und Gas den geschlossenen Kreislauf mit Medium gefüllt. Dies wird durch die Positionierung der 3-Wege-Anschlüsse in einer Weise, dass Superfusion, die als die Strömung des Mediums über die Oberseite des Chips definiert ist, erreicht wird getan. Dies führt zu einer Entlastung der eingeschlossenen Luft aus dem Bioreaktor Kreislauf, ohne die Zellen aus dem Schafott. Nachdem das System ist komplett mit Medium gefüllt ist, sind die 3-Wege-Anschlüsse in einer Weise, dass die Perfusion, die als die Strömung von unten den Chip durch das Gewebe definiert ist, erreicht wird eingeschaltet. In der Perfusion Konfiguration ist die Strömung in die Zelle die Bedürfnisse, die für Hepatozyten liegt typischerweise im Bereich von 60 bis 500 ml / min eingestellt.
6. Stichprobenverfahren
Während des Experiments Medium Proben gezogen werden können. Dazu werden Spritzen in die sterile Anschlüsse auf der Oberseite des Mediums Reservoir verbunden. Nach der Probenahme werden die Ports mit 70% Isopropanol sterilisiert.
7. Isolierung von intakten Zellen aus dem Chip für nachgelagerte Anwendungen
Am Ende des Experiments sind die Bioreaktoren aus der Gasversorgung und die Rollerpumpe getrennt, übertragen auf die saubere Werkbank und zerlegt, wie oben beschrieben. Mit einer sterilen Pinzette wird der Chip aus dem Bioreaktor Gehäuse entfernt, platziertin einen 3,5 cm Petrischale mit PBS gespült. Anschließend wird der Chip mit Trypsin / EDTA (0,25% / 0,53 mm) für 5-15 min im Brutschrank inkubiert, um die Zellen aus der mikrostrukturierten Bereich zu lösen. Die gesammelten Zellsuspension für 5 min bei 600 g zentrifugiert Die Zellen können dann für die konventionelle Downstream-Anwendungen, zB Gesamt-RNA oder Protein Isolierung verwendet werden. Routinemäßig isolieren wir Gesamt-RNA (PARIS-Kit, Ambion Inc., Austin, Texas, USA) für die Microarray-Analyse und real-time RT-PCR. Die Proteinexpression wird nach immunhistochemischer Färbung der Zellen im Inneren des Chips mit einem Laser-Scanning-Mikroskop analysiert, kann aber auch anderweitig ausgewertet werden, zB mittels Durchflusszytometrie.
Diskussion
Wir haben eine Chip-basierte Plattform für die dreidimensionale Kultivierung von Zellen in aktiv durchströmten micro Bioreaktoren entwickelt. Die Chips können aus biologisch nicht abbaubaren sowie biologisch abbaubare Polymere, die durch Mikro-Spritzguss, Heißprägen sowie Mikro Warmformtechniken 3 hergestellt werden. Je nach Versuchsanordnung kann die Oberfläche des Polymers durch UV-Bestrahlung 4 modifiziert werden. Hepatocyte Zelllinien sowie primäre Rattenhepatozyten erfolgreich in diese Geräte angebaut werd...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Wir möchten Mechthild Herschbach und Anke Dech für hervorragende technische Unterstützung danken.
Materialien
| Name | Company | Catalog Number | Comments | |
| Cells | Other | ATCC | HB-8065 | |
| Collagen I from rat tail | Reagent | Roche Group | 11 179 179 001 | |
| PARIS kit | Reagent | Ambion | AM1921 | |
| Syto16 | Reagent | Invitrogen | S7578 | |
| anti cytokeratin 18 | Antibody | Abcam | ab668 | Primary Ab, Mouse monoclonal, used 1/100 in PBS |
| Anti E-cadherin | Antibody | Abcam | ab1416 | Primary Ab, Mouse monoclonal, used 1/50 in PBS. |
| Goat anti-albumin | Reagent | Bethyl Laboratories | E80-129 | Primary Ab, goat anti-human Albumin, used 1/200 in PBS |
| Rabbit anti-mouse IgG1 | Antibody | Invitrogen | A11059 | Secondary Ab, Alexa Flour 488 conjugated, used 1/100 in PBS + 0.5 % BSA |
| Cy3 anti-goat IgG | Reagent | Jackson ImmunoResearch | 705-165-003 | Cy3 AffiniPure donkey a-goat IgG Ab, used 1/700 in PBS + 0.5% BSA |
Referenzen
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: A biochemical and fine structural study. J. Cell Biol. 53, 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. 3. Enzymatic requirements for tissue dispersion. Exp. Cell Res. 82, 391-398 (1973).
- Giselbrecht, S., Gietzelt, T., Gottwald, E., Trautmann, C., Truckenmueller, R., Weibezahn, K. F., Welle, A. 3D tissue culture substrates produced by microthermoforming of pre-processed polymer films. Biomed. Microdev. 8, 191-199 (2006).
- Welle, A., Gottwald, E. UV-based patterning of polymeric substrates for cell culture applications. Biomed. Microdev. 4, 33-41 (2002).
- Gottwald, E., Giselbrecht, S., Augspurger, C., Lahni, B., Dambrowsky, N., Truckenmueller, R., Piotter, V., Gietzelt, T., Wendt, O., Pfleging, W., Welle, A., Rolletschek, A., Wobus, A. M., Weibezahn, K. -. F. A chip-based platform for the in vitro generation of tissues in three-dimensional organization. Lab Chip. 7, 777-785 (2007).
- Eschbach, E., Chatterjee, S. S., Noldner, M., Gottwald, E., Dertinger, H., Weibezahn, K. -. F., Knedlitschek, G., G, Microstructured scaffolds for liver tissue with high density: Morphological and biochemical characterization of tissue aggregates. J. Cell. Biochem. 95, 243-255 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten