Method Article
Strukturelle Charakterisierung von Mannan Zellwand Polysaccharide in Anlagen, in denen Tempo
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Strukturanalyse von Polysacchariden durch Gelelektrophorese (PACE), mit Mannan als Beispiel, wird beschrieben.
Zusammenfassung
Pflanzlichen Zellwand Polysaccharide sind notorisch schwierig zu analysieren, und die meisten Methoden erfordern teure Geräte, qualifiziertes Personal und große Mengen von gereinigtem Material. Hier beschreiben wir eine einfache Methode für die Gewinnung von detaillierte Strukturinformationen Polysaccharid, einschließlich Resolution strukturelle Isomere. Für Polysaccharid-Analyse durch Gelelektrophorese (PACE) ist die Zellwand Pflanzenmaterial mit a1 Hydrolasen spezifisch für das Polysaccharid von Interesse (z. B. Mannanases für Mannan) hydrolysiert. Großformat-Polyacrylamid-Gele werden verwendet, um freigegebene Oligosaccharide, trennen das Eindringmittel beschriftet worden. Gele können mit einem modifizierten Gel imaging-System visualisiert werden (siehe Tabelle der Materialien). Der daraus resultierende Oligosaccharid-Fingerabdruck kann entweder qualitativ oder mit der Replikation, quantitativ verglichen werden. Gestänge und Verzweigung Informationen können zusätzliche a1 Hydrolasen (z. B. Mannosidases und Galactosidases) hergestellt werden. Während dieses Protokoll eine Methode beschreibt für die Analyse von Glucomannan Struktur, kann es auf jede Polysaccharid angewendet werden, bei denen charakterisierten a1 Hydrolasen bestehen. Alternativ können verwendet werden, um neuartige a1 Hydrolasen mit definierten Polysaccharid Substrate zu charakterisieren.
Einleitung
Polysaccharid-Analyse durch Gelelektrophorese (PACE) ist eine Methode für die detaillierte Charakterisierung der Polysaccharide1,2,3. Pflanzlichen Zellwand Polysaccharide sind notorisch schwierig zu analysieren, und die meisten Methoden erfordern teure Geräte, qualifiziertes Personal und große Mengen von gereinigtem Material. Hier beschreiben wir eine einfache Methode für die Gewinnung von detaillierte Strukturinformationen Polysaccharid, einschließlich Resolution strukturelle Isomere.
Verständnis Anlagenstruktur Zellwand Polysaccharid ist notwendig für diese Forscher pflanzlichen Zellwand Biosynthese oder die Rolle der pflanzlichen Zellwand Pflanzenentwicklung zu erkunden. Vor kurzem jedoch Zellwand Pflanzenzusammensetzung interessant, eine größere Gruppe von Forschern durch die Ausrichtung auf mit pflanzlicher Biomasse (im Wesentlichen die Zellwand) als Rohstoff für Biokraftstoffe und Biochemikalien4produzieren geworden. Beispielsweise erfordert effiziente enzymatische Verzuckerung dieses Materials ein detailliertes Verständnis der Polysaccharid-Strukturen, damit optimierte enzymatische Cocktails ausgewählte5sein können.
Tempo hat mehrere Vorteile gegenüber alternativen Methoden, die es ideal für die schnelle Analyse von komplexen Glycan Strukturen bilden. Erstens benötigt es keine Reinigung des Polysaccharids in Frage, da für Lösung State Kernspinresonanz (NMR)6benötigt wird. Zweitens Tempo lösen strukturelle Isomere, im Gegensatz zu Massenspektrometrie (MS, z. B. Matrix-unterstützte laser Desorption/Ionisierung (MALDI) und Elektrospray-Ionisation (ESI)), die kann auch schwierig sein, von Flüssigchromatographie (LC) durchführen 7. Drittens Tempo ist sehr empfindlich, mit niedrig-Picomole Auflösung, im Gegensatz zu Dünnschichtchromatographie (TLC) oder Papierchromatographie. Schließlich erfordert keine teure Ausrüstung oder Spezialisten wissen, wie bei MS, NMR und LK der Fall ist.
Die Tempo-Methode stützt sich auf die Spezifität der a1 Hydrolase (GH) Enzyme, die auf bestimmte Glykosid-Gestänge in einem Gemisch von Polysacchariden. Wenn das GH-Enzym auf die Polysaccharid-Kette wirkt, zeigt es eine reduzierende Ende, dann chemisch, in diesem Fall mit einem fluoreszierenden Label derivatisiert werden kann. Der unhydrolyzed Teil der Probe ist durch diese Methode daher nicht nachweisbar gerendert. Die beschrifteten Oligosaccharide werden dann in einem Großformat-Acrylamid-Gel durch Elektrophorese getrennt. Dadurch hervorragende Auflösung sehr ähnliche Moleküle, die Trisaccharides Glc-Mann-Mann und Glc-Mann-Glc haben beispielsweise ein anderes Rf.
Tempo ist weitgehend benutzt worden, um verschiedene Xylan Strukturen über Pflanzen Arten8, zu charakterisieren, Ermittlung Glycosyltransferase Mutanten in Arabidopsis6,9,10,11 , Glycosyltransferase-Assays9durchführen und neuartige GH Aktivitäten12,13zu charakterisieren. Wir haben auch vor kurzem verwendet, um Hefe Zellwand Mannan (Mahboubi und Mortimer, in Vorbereitung) zu charakterisieren. Hier beschreiben wir eine Methode zur Charakterisierung der pflanzlichen Zellwand Glucomannan Struktur, basierend auf früheren Berichte11,14.
Protokoll
1. Ernte von Pflanzenmaterial
- Ernte frisches Pflanzenmaterial (~ 20 mg) und sofort in Ethanol 96 % (V/V) Tauchen und bei 70 ° C für 30 min inkubieren; dadurch wird jede Zellwand entwürdigende Enzyme deaktiviert. Für trockenes Material, beginnen Sie mit Schritt 2.
Achtung: Ethanol ist brennbar.
Hinweis: Ein einzelnes Blatt Stängel oder Rosette bieten genügend Material für die Analyse. Jedoch weniger Fehler auftreten, wenn eine größere Menge an Gewebe zusammengefasst und analysiert, da dies einfacher zu wiegen und zu handhaben ist. - Sorgfältig notieren Gewebetyp und Entwicklungsstadium als Polysaccharid Struktur variiert mit den beiden. Zum Beispiel mit Arabidopsis Thaliana (hier verwendet), inszenieren Sie das Gewebe nach den Methoden von Boyes Et al. 15
Hinweis: In diesem Protokoll haben wir die untere Hälfte des Blütenstandes Stammes, wo ist der erste Schote voll länglich aber nicht vergilben verwendet.
2. Vorbereitung der Alkohol unlöslichen Rückstände (Luft)
- Prepare Luft, nach der Methode von Mortimer Et Al. 9 oder eine andere ähnliche Methode, um ein Pulver fehlen lösliche Zucker wie Saccharose und Stärke zu produzieren.
3. Aliquotierung und Vorbehandlung von AIR
Hinweis: die genaue Menge der Luft benötigt für jede Probe (a) die Fülle des Polysaccharids von Interesse an dem Material und (b) die durchschnittliche Größe der Oligosaccharide hängt von veröffentlicht Das GH. Die Methode fügt ein fluoreszierendes Molekül der reduzierenden Ende jedes Oligosaccharid, d. h. die Anzahl der Oligosaccharide die Empfindlichkeit des Experiments bestimmt. Als Richtwert für Glucomannan in Arabidopsis Stamm verdaut mit GH5/GH26 (wie beschrieben), 500 µg empfiehlt 11, während für Xylan in Arabidopsis Stiel mit GH11 verdaut, 100 µg wie Mortimer empfohlen wird ' s Studie 3.
- Luft (10-15 mg) in einem 15 mL Zentrifugenröhrchen wiegen und eine Endkonzentration von 2 mg/mL H 2 O hinzufügen. Wirbel um eine sogar Aussetzung zu erreichen. Wenn dies problematisch ist, verwenden Sie eine Glas-Homogenisator, um diesen Prozess zu unterstützen.
- Aliquoten 500 µg in Microfuge Röhren. Trocknen mit einer Vakuum-Zentrifuge Aliquote (siehe die Tabelle der Materialien) über Nacht bei 30 ° c
- Vorbehandlung Luft mit 1 M NaOH (20 µL) für 1 h bei Raumtemperatur; das de-acetylates die Polysaccharide und quillt Cellulose-Mikrofibrillen, stören die Biomasse-Struktur und GH Zugriff.
Hinweis: Dieser Schritt kann übersprungen werden, für gereinigte Polysaccharide. Vorsicht – starke Säure/Base.- Gehören ein Aliquot für eine keine-Enzym AIR Control (gleich behandelt wie alle Proben, mit Ausnahme von Schritt 4.1. ist ausgeschlossen).
- Fügen Sie 200 µL H 2 O und 20 µL 1 M HCl neutralisieren. Testen Sie, ob der pH-Wert ~ 6-7 ist durch 1 µL entfernen und auf Papier pH-Indikator-Streifen Schmierblutungen.
- Fügen Sie 50 µL 1 M Ammonium-Acetat-Puffer, pH 6.0 (oder welcher pH-Wert für die GHs in der Studie verwendeten geeignet ist) und H 2 O zu einem Gesamtvolumen von 500 µL.
Hinweis: Ammoniumacetat wird verwendet, da es beim Trocknen sublimiert und so zum Beispiel nicht zusätzliche Salz hinzugefügt wird. Ein Überschuss an Salz kann zu führen schlechte Band-Form und Auflösung auf dem Tempo-Gel.
4. Hydrolyse von Luft mit Glycosyl Hydrolases (GHs)
Hinweis: wie in der Diskussion erwähnt, die Reinheit der GHs ist von entscheidender Bedeutung. Verwenden Sie nur heterologously ausgedrückt, gereinigt Affinität Enzyme. Nach Erhalt der jede Charge des Herstellers, Hydrolyseneigung definierten Aliquote des Substrates (z. B. 500 µg Luft) mit zunehmenden Mengen von GH über Nacht (z. B. 0,5, 1, 2, 5, 10, 15, 20 µL) (3 Einheiten/µL). Wird ein Überschuss von GH, wird der Tempo Fingerabdruck identisch aussehen. Ein Übermaß an Enzym ist erforderlich, um ein reproduzierbares Ergebnis zu liefern, weil es sicher sein muss, dass die Hydrolysereaktion den Endpunkt nähert.
- Hinzufügen einer vorher festgelegten Betrag (siehe oben) des Mannanases (GH5 und GH26 11) an der Luft Aliquote im Puffer ab Schritt 3.5 sowie eine Positive Kontrolle (30 µg von Konjac Glucomannan) und keine-AIR Negativkontrolle (Enzym-Mix in ein Leerrohr). Wirbel und dann Spin kurz auf das Reaktionsgemisch in den Boden des Röhrchens sammeln.
- Inkubation über Nacht bei 37 ° C (oder die geeignete Temperatur für die GH Wahl) mit sanften Agitation (~ 100 u/min).
- Stoppen die Reaktion durch Inkubation bei 95 ° C für 20 min.
Hinweis: Cap-Verschlüsse können verwendet werden, um Flip-Top Microfuge Röhren zu versiegeln.- Mit einer Sitzbank Top Microfuge mit maximaler Geschwindigkeit für 10 min Zentrifugieren und bewahren Überstandes.
- Aufschwemmen Pellet in 250 µL H 2 O, Zentrifuge wie oben beschrieben, und behalten überstand.
- Kombinieren beide Überstände und trocknen in einem Vakuum-Zentrifuge (siehe die Tabelle der Materialien) bei 30 ° C (~ 3 h oder über Nacht ohne Heizung).
5. Vorbereitung der Oligosaccharid-Standards
- vorbereiten 1 mM Lager Lösungen in H 2 O der Mannose (Mann), Mannobiose (Man 2), Mannotriose (Man 3), Mannotetraose (Mann 4), Mannopentaose (Mensch 5) und Mannohexaose (Mann 6), alle β 1-4 verknüpft. Aliquoten und Store bei-20 ° C bis erforderlich.
- Bereiten Sie 3 unterschiedliche Konzentrationen eines Mannes 1-6 Mischung durch die Kombination von 1 µL (Standard S1), 2 µL (S2) oder 5 µL (S3) aller sechs.
- Trocken in einer Vakuum-Zentrifuge (siehe Tabelle der Materialien) bei 30 ° C (~ 1 h).
6. Derivitization der Oligosaccharide
- vorbereiten eine Stammlösung von 0,2 M Ameisen (8-Aminonaphthalene-1,3,6-Trisulfonic Säure) in H 2 O: Essigsäure 17:3. Warmen Lager auf 60 ° C das Solid vollständig auflösen. Shop bei-20 ° C, lichtgeschützt, für ca. 2-3 Monate.
- Vorbereitung eine 0,2 M-Stammlösung von 2-Picoline Boran (2-PB) in DMSO. Dies ist extrem hygroskopisch, also sofort alle Pulver nach Erhalt in DMSO aufzuwirbeln. Aliquoten und Store bei-20 ° C für 1-2 Jahre. Auftauen Aliquote als erforderlich (Speicher bei 4 ° C für 2 Wochen und dann verwerfen).
- Vorbereitung den Derivatisierung Puffer von H 2 O: acetic Acid: DMSO um 17:03:20.
- , Jede Probe, 5 µL der Ameisen, 5 µL 2-PB und 10 µL Derivatisierung Puffer hinzufügen. Spin kurz, sammelt auf dem Boden des Rohres, Vortex gründlich, und dann wieder kurz schleudern. Abbildung 1 Reaktion Beschreibung finden Sie unter.
- Proben Inkubation über Nacht bei 37 ° C, vor Licht geschützt werden.
- Trocken in einer Vakuum-Zentrifuge (siehe Tabelle der Materialien) bei 30 ° C (~ 2 h).
- Aufschwemmen Proben und Standard in 100 µL 3 M Harnstoff. Shop bei-20 ° C, lichtgeschützt bis erforderlich.
7. Vorbereitung der PACE Gele
Hinweis: Montage von Gel-Gießanlage abhängig von der Marke. Hier, wir uSe eine vertikale Elektrophorese-System (siehe Tabelle der Materialien), ausgestattet mit 18 x 24 cm Glasplatten und 1,5 mm Spacer.
- Gel Gießanlage pro Hersteller montieren ' Anweisungen s.
- Machen 10 X Tempo Puffer (1 M Tris-Borat, pH 8,2) wie folgt: ~ 400 mL H 2 O und Mischung auflösen 121,14 g Tris-Base hinzufügen. Passen Sie den pH-Wert auf 8.2 durch Zugabe von soliden Borsäure (ca. 60 g), und dann Volumen bis zu 1 L.
- Machen eine 10 % (w/V) Ammonium Bleichen (APS) Lager H 2 O. Aliquot bei-20 ° c Auftauen Aliquote einmal speichern, bei 4 ° C lagern und nach 2 Wochen wegwerfen.
- Machen und gießen Sie die Lösung von Gel. Für die oben genannten Geräte entsprechen 1 Gel 50 mL. Mischen Sie in einem 50 mL Zentrifugenröhrchen H 2 O (20,2 mL), 5 mL 10 X Tempo Puffer, 24,6 mL 40 % Acrylamid/Bis-Acrylamid (29,1 Acrylamide:Bis). (Vorsicht: giftig).
- 200 µL APS und 20 µL von N, N, N, n-Tetramethyl-Ethylenediamine (TEMED) hinzufügen. Invert sanft zu mischen (zur Vermeidung von Luftblasen Einführung). Gießen Sie das Gel mit einem serologischen oder andere großvolumigen Pipette, ~ 4 cm unterhalb der Oberkante der Glasplatten. Achten Sie auf die Möglichkeit der Anreise in das Gel eingeschlossenen Luftbläschen. Wenn sie tun, nicht mehr gießen und Tilt/Tap das Gel um sie freizugeben.
- Gel mit Isopropanol (Vorsicht : entzündlich) oder sorgfältig, mit H 2 O. Allow Gel zu polymerisieren (20-30 min.), dann gießen Sie die oberste Schicht zu überlagern. Wenn Isopropanol verwendet wurde, dann waschen Sie 2 X mit H 2 O. Dry überschüssige Flüssigkeit mit Löschpapier.
- Machen und gießen Sie das stapelnde Gel. Mischen Sie 6,8 mL H 2 O, 1 mL 10 X Tempo Puffer, 2,8 mL Acrylamid/Bis-Acrylamid (Vorsicht: giftig), 80 µL APS und 8 µL TEMED in ein Zentrifugenröhrchen 15 mL. Kehren Sie um zu mischen und auf polymerisierten Lösung von Gel zu überlagern. Sanft fügen Sie Kämme, Trapping Luftblasen unter den Kamm Zähnen zu vermeiden.
- Zulassen Gel (20-30 min), polymerisieren in feuchten Gewebe und dann in Plastikfolie wickeln und Lagerung bei 4 ° C bis erforderlich. Geschäft mit den Waben vorhanden.
Hinweis: Schritt Gele können gespeichert werden für maximal 2 Wochen (obwohl weniger als 1 Woche ideal ist), wenn sie feucht gehalten werden.
8. Mit einem Tempo Gel
- einen permanenten-Marker zu verwenden, um die gut Positionen auf dem Glas, beschriften, die dabei die Ladereihenfolge Überblick zu behalten helfen werden, und bei der Ermittlung von wo die Brunnen sind einmal der Kamm entfernt wird.
- Entfernen Sie den Kamm. Brunnen mit 1 X Tempo Puffer füllen.
- Verwenden eine 10 µL Microsyringe 2 µL Standards und Proben in den Brunnen zu laden. Vermeiden Sie die Verwendung der äußersten Bahnen, die neigen zu Proben laufen schlecht.
- Montage die obere Kammer des Apparates Gel-Ausführung und legen Sie das Gel in einem gekühlten (~ 10 ° C) laufenden Tank (10 ° C), 1 X Tempo Puffer enthält. Die obere Kammer mit 1 X Tempo Puffer füllen.
- Schalten Sie die macht, und führen Sie das Gel bei 200 V (konstante V) für 30 Minuten und dann Erhöhung der Spannung bis 1000 V für 1 h 40 Minuten. Schützen Gele aus Licht (z. B. durch das Einwickeln von Panzern in schwarzen Mülltüten).
Hinweis: Aktivieren Sie die Gele ~ 5 min nach dem Einschalten der Spannung, und dann noch 5 Minuten nach Erhöhung der Spannung bis 1000 V. Wenn das Power Pack nicht in der Lage ist, die Spannung aufrecht zu erhalten, dann gibt es wahrscheinlich ein Puffer-Leck. Nehmen Sie das Gel aus dem Becken. Montieren Sie die obere Kammer, sorgfältiger Kontrolle Platzierung aller Dichtungen. Ein großer Chip am oberen Rand der Glasplatte kann die Platte bilden eine gute Abdichtung mit der Dichtung verhindern. Dies kann in der Regel vorübergehend behoben werden, indem ein Rückgang von 5 % (w/V) flüssige Agarose zu den abgebrochenen Teil des Glases, vor dem Hinzufügen der oberen Kammer.
9. Visualisierung einer Tempo-Gels
Hinweis: verwenden Sie eine Gel imaging-System ausgestattet mit langwelligem UV-Strahler in den Transilluminator und eine Emission Filter für die Kamera, die für das Fluorophor, hier 530 nm geeignet ist. Alternativ ein Laserscanner kann auch verwendet werden, wie unter Goubet 2.
- Sicherzustellen, dass das Gel imaging-System staubfrei durch Abwischen mit einem feuchten fusselfreien Tuch.
- Das Gel aus dem Tempo-Becken nehmen und kurz angezeigt werden, solange das Gel nach wie vor in die Glasplatten ist (< 80 ms) um festzustellen, ob die Farbstoff-Front noch auf das Gel ist.
- Das Gel mit einem Keil-Tool zu öffnen, und zwar Gel noch auf einer Glasplatte, ein Pizzaschneider verwenden, um sowohl das Stapeln Gel entfernen und, wenn die Farbstoff-Front noch auf das Gel, der Unterseite des Gels ist.
- ~ 5 mL H 2 O auf der Oberfläche der Transilluminator und übertragen Sie dann das Gel direkt auf die Transilluminator. Setzen Sie den Filter UV-605, und schalten Sie die langwelligen UV-Transilluminator (siehe Tabelle der Materialien) mit Hilfe der Software.
Hinweis: Die Ameisen Fluorophor verwendet hier hat eine Anregung/Emission von 353/520 nm. - Nehmen Sie mehrere Bilder bei verschiedenen Belichtungszeiten (z. B. 100 ms bis 10 s). Stellen Sie sicher, dass das UV-Licht zwischen Bilder durch Klicken auf das UV-Licht-Taste (um das Gerät auszuschalten) um zu vermeiden, die Fluoreszenz erniedrigende ausgeschaltet ist. Sicherzustellen, dass mindestens 2 der Bilder keine gesättigten Bands haben (das Gel imaging-Software zeigt dies).
- Gespeicherte Dateien als Bilder hoch-resolution.tif.
Hinweis: Bilder können mit der Software zur Verfügung gestellt mit dem Gel imaging-System oder durch die Verwendung von frei verfügbaren Bildanalyse-Software, wie z. B. ImageJ (https://imagej.nih.gov/ij/) analysiert werden. Siehe Abschnitt Ergebnisse für eine Diskussion der Quantifizierung.
Ergebnisse
Hier zeigen wir eine Beispiel Tempo Gel laufen pro das Protokoll zusammen mit Beschreibungen zur Unterstützung Dateninterpretation und Fehlerbehebung, und es folgt eine allgemeine Anleitung zum erfolgreichen Schritt Gel Auslegung13,16. Eine repräsentative Gel von einem standard Tempo Assay Zellwand Mannan Inhalte ist in Abbildung 2gezeigt, und wird beschrieben durch Bahn-Bahn.
Normen
Bahnen 1, 2 und 3 zeigen eine Leiter kommerziell gekauften Oligosaccharide (Mann1- Mann-6) von 5 (S1), 10 (S2) und 50 (S3) Pmol Konzentration. Wenn Sie eine neue Menge eine kommerzielle Oligosaccharid empfangen, ist es wichtig, die Reinheit auf einem Gel zu überprüfen. Viele Oligosaccharide, besonders Tetrasacccharides und mehr, können erhebliche Kontamination mit Oligosaccharide von anderen Grad der Polymerisation (DPs), wie hier gezeigt für Mann6 (markiert mit *). Bei der Quantifizierung eines Gels, ist es wichtig, mindestens 3 Konzentrationen von den Standards zu haben, da es notwendig für die Berechnung der Standardkurve. Berechnung der Standardkurve kann auch dafür, dass die Derivatisierung Reaktion im Wesentlichen bei Fertigstellung ist hilfreich sein. Standards der bekannte Konzentrationen erlauben Vergleiche zwischen Gele und sind ein nützliches Steuerelement für Trennung und Derivatisierung Qualität.
Positivkontrolle
Bahn 4 zeigt eine Mannanase Verdauung von Konjac Glucomannan. Konjac Glucomannan ist im Handel erhältlich, und während es nicht die gleiche Struktur wie das haben, z. B. fand in Arabidopsis, es dient zwei Zwecken. Erstens ist es eine wichtige Kontrolle für die enzymatische Verdauung. Der Forscher soll sieht eine kommerzielle Substrat verdaut mit ihren GHs Wahl wenn verdaut bis zur Fertigstellung (d. h. , die einen großen Überschuss an GH die Reaktion hinzugefügt wird). Wenn künftig Experimente das Muster ändert, kann dies entweder ein Verlust an Aktivität oder Kontamination der GH-Aktie hinweisen. Zweitens dient es als ein Steuerelement für die Derivatisierung Reaktion in Anwesenheit des Enzyms und Puffer Salze. Wenn die Standards gut aussehen, sondern die Positivkontrolle schlecht ist, kann dann dies bedeuten, dass ein Bestandteil der Hydrolysereaktion hemmenden, die Derivatisierung ist.
Wildtyp (WT) Arabidopsis ergeben sich Luft + Mannanase cocktail (GH5 + GH26)
Bahn 5 zeigt den Tempo-Fingerabdruck eines WT Arabidopsis-Stammes (vgl. Referenzen11,14).
csla9 Arabidopsis ergeben sich Luft + Mannanase cocktail (GH5 + GH26)
Bahn 6 zeigt, zeigt der Tempo Fingerabdruck des Stammes von einem Arabidopsis Pflanzen fehlen die großen Mannan-Synthase11stammen. Vergleichen Sie mit den WT und Negativkontrolle Fingerabdrücke. Während der Großteil der Mannan fehlt in diesem Werk eine kleine Menge bleibt, wie die reduzierten Band Intensitäten für alle Mannanase abgeleitet Oligosaccharide belegt wird dies durch zusätzliche Mannan Synthasen (CSLA2, 3) synthetisiert11.
Negativ-Kontrolle - Enzym nur
Bahn 8 zeigt Bänder auf dem Gel, die nicht spezifisch, das ableiten von Schadstoffen in der Mannanase cocktail, und sollte aus der Analyse ausgeschlossen werden (markiert mit *).
Negativ-Kontrolle - WT nur Luft
Lane 9 zeigt Bänder auf das Gel, das sind nicht spezifisch und sollte aus der Analyse ausgeschlossen werden (markiert mit *).
Negativ-Kontrolle- csla9 Nur Luft
Lane 10 zeigt Bänder auf das Gel, das sind nicht spezifisch und sollte aus der Analyse ausgeschlossen werden (markiert mit *).
Kiefer Holz Luft + Mannanase cocktail (GH5 + GH26)
Lane 7 zeigt den Tempo-Fingerabdruck aus Kiefernholz, die Galactoglucomannan enthält. Dies hat eindeutig ein anderes Muster der veröffentlichten Oligosaccharide, Arabidopsis, aufgrund ihrer unterschiedlichen Struktur.
Negativ-Kontrolle - Kiefer nur Luft
Lane 11 zeigt Bänder auf das Gel, das sind nicht spezifisch und sollte aus der Analyse ausgeschlossen werden (markiert mit *).
Interpretation eine Tempo-Gel ist relativ einfach, erfordert aber Bewusstsein für die folgenden Punkte. Für robuste Daten empfiehlt es sich zur Durchführung Tempo auf mindestens 3 unabhängig voneinander gewachsen biologische repliziert, und es wird empfohlen, mindestens 2 technische Wiederholungen auf jede biologische Replikation durchführen. Beschriebenen Steuerelemente sind entscheidend für die Auslegung, wie unspezifische Bänder müssen ausgeschlossen werden. Wir empfehlen auch laden Proben in einer anderen Reihenfolge auf replizieren Gele, Effekte auszuschließen, die ungleichmäßige Ausleuchtung durch die Transilluminator entstehen. Genaue Interpretation erfordert eine Analyse der Bands, die nicht ausgelastet sind. Da einige Oligosaccharid Fingerabdrücke sowohl sehr hohe und niedrige Fülle Polysaccharide enthalten können, empfiehlt es sich, mehrere Aufnahmen des gleichen Gels zu analysieren. Die Standards können verwendet werden, um zwischen verschiedenen Bildern zu normalisieren.
Für einige Arten von Experimenten es möglicherweise wünschenswert, die Menge der Polysaccharid in der Luftaufbereitung zu quantifizieren. Zwar ist es möglich, aus einem Tempo-Gel zu quantifizieren, es erfordert Kenntnisse über die genaue molekulare Identität jedes Oligosaccharid, veröffentlicht von der GHs und wo befindet es sich auf das Tempo gel. Dies ist derzeit nicht vollständig bekannt für Mannan, aber für andere Polysaccharide z.B. Xylan3festgestellt wurde. Die Standards bieten einen Weg der Normalisierung zwischen Gele, auch wenn Quantifizierung nicht durchgeführt wird, und so in eine semi-quantitative oder qualitative Analyse unterstützen wird.
Identifizierung der Struktur der einzelnen Oligosaccharide lässt sich mit Cocktails der GHs. Sequential Zugabe von weiteren GHs kann enthüllen Details über Zusammenhänge und Ersetzungen von freigegebenen Oligosaccharide (z. B. Zugabe von β - 1,4 - Glucosidase, die auf nicht-reduzierenden Ende wirkt wird zeigen, welche Oligosaccharide in der Mischung enthalten diese Funktion). Verfügbaren Enzyme gehören Galactosidases, Glucuronidases und Glucosidases (siehe CAZy Datenbank16 zusätzliche Informationen); Hogg, D. Et Al. sehen 17 als Vorbild.
Das obige Protokoll kann verwendet werden, um die Aktivität des unbekannten GHs zu charakterisieren. In diesem Fall sollte eine definierte Biomasse, wie Arabidopsis Stiel oder Konjac Glucomannan, verwendet werden, die unbekannte GHs-13auf den Bildschirm.
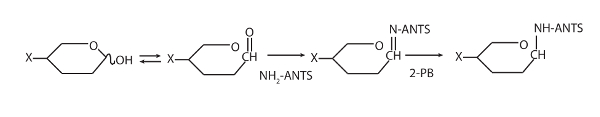
Abbildung 1 : Dies zeigt das Schema für die fluoreszierenden Derivatisierung Oligosaccharide mit Ameisen. Geändert von Goubet2. klicken Sie bitte hier, um eine größere Version dieser Figur.
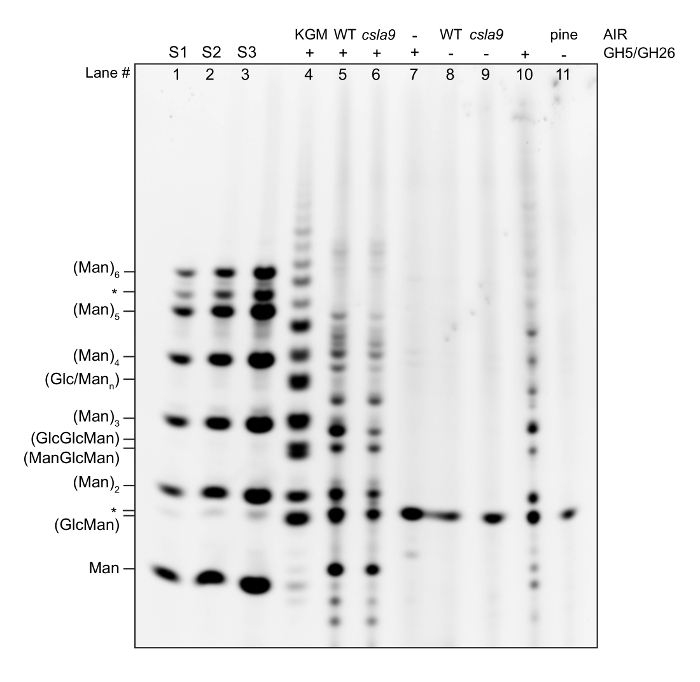
Abbildung 2 : Repräsentative Tempo Gel zeigt des Mannan-Fingerabdrucks von Arabidopsis, Kiefer und eine Arabidopsis-Mutante (csla9) hat die Mannan Biosynthese beeinträchtigt. AlR wurde mit einem Mannanase cocktail hydrolysiert und veröffentlichten Oligosaccharide wurden mit einem Fluorophor derivatisiert. Die Oligosaccharide trennten sich durch Gelelektrophorese auf der Grundlage von Größe, Form und kostenlos. Eine Leiter Manno-Oligosaccharide (Man1-6) ist zur Unterstützung bei der Identifizierung von relativer Mobilitäten veröffentlichten Oligosaccharide und eine Hydrolyse des gereinigten Mannan (abgeleitet von Konjac) ist als Positivkontrolle angezeigt. * = unspezifische Bänder. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Tempo ist eine einfache Methode zur Charakterisierung von Polysaccharid-Struktur. Es kann angewendet werden, Polysaccharid, für die es GHs mit geprägten Tätigkeit bekannt, siehe zahlreiche Beispiele in der Literatur1,6,9,11. TT galt auch für die Charakterisierung der neuartigen GHs12,13,18 und Glycosyltransferases9, durch den Einsatz von definierten Polysaccharid Substrate und Akzeptoren.
Reproduzierbare, interpretierbare Ergebnisse hängen drei Hauptschritte. Erstens sollte das GHs verwendet frei von kontaminierenden Aktivitäten sein. Dies geschieht am besten nur mit heterologously ausgedrückt erreicht, Affinität gereinigt Enzyme. Für die meisten Experimente, zweitens ist es wichtig, dass die enzymatische Hydrolyse der Substrate bei Fertigstellung. Dadurch wird sichergestellt, dass die gleichen Biomasse mit der gleichen GH hydrolysiert bei jedem Versuch den gleichen Fingerabdruck gibt. Schließlich sollte ein Übermaß an Fluorophor in der Derivatisierung Reaktion. Dadurch wird sichergestellt, daß die verfügbaren reduzierenden enden bei nahezu 100 % gekennzeichnet werden. Dies wird dazu führen, dass hohe Reproduzierbarkeit der Ergebnisse sowie Daten, die quantitative.
Gel und Reagenz Qualität sind entscheidend für reproduzierbare Daten zu gewährleisten. Schlechte Qualität-Puffer, vor allem der falsche pH Luftblasen in das Gel, und Proben mit einem Überschuss an Salz können alle Affekt Auflösung und Retention Faktor der Oligosaccharide. Aufnahme der empfohlenen Kontrollen beschrieben im Abschnitt Protokoll und Ergebnisse werden allerdings Problembehandlung aktiviert.
Tempo ist begrenzt durch seine Fähigkeit, Oligosaccharide zu identifizieren. Für einige Versuche ist ein einfachen Fingerabdruck alles, die was notwendig ist. Um wirklich die Menge von Glucomannan in einer Stichprobe von Luft quantitate, z. B. die Identität von allen veröffentlichten Oligosaccharide ist jedoch erforderlich, die ist ein zeitaufwendiger Prozess. Dies ist einfacher für weniger komplexe Polysaccharide wie Xylan-3. Da gibt es einige Oligosaccharid-Standards im Handel erhältlich, kann es nicht immer möglich oder wünschenswert, alle Bands zu identifizieren sein. In diesem Fall kann Tempo sehr schmeichelhaft Daten für Massenspektrometrie (d. h. MALDI-CID9 oder ESI-MS7und NMR6) bereitstellen. Für diese Methoden ist es oft hilfreich, eine groß angelegte Vorbereitung zu tun, durch Größe-Ausschluss Chromatographie trennen und dann analysieren jede Fraktion durch beide Tempo vor MS oder NMR. Während es berichtet wurde, dass Bands herausgeschnitten und durch MALDI-CID identifiziert werden können, in der Praxis fanden wir, dass dies eine geringe Erfolgsquote (möglicherweise aufgrund von Wechselwirkungen der beschrifteten Oligosaccharide mit dem Acrylamid-Gel UV-Licht).
Die andere große Einschränkung der PACE ist Durchsatz. Gute Qualität, interpretierbare Gele mit den entsprechenden Kontrollen haben jedes Gel haben nur ~ 10 experimentelle Proben und Forscher kann erwarten, ~ 4 Tempo Gele pro Tag laufen. Vor kurzem wurde eine Version von Tempo mittels Kapillarelektrophorese (CE) entwickelten19, die Vorbereitung der Proben in 96-Well Platten ermöglicht. Es hat erfolgreich eingesetzt Glycosyltransferase Enzymaktivitäten und Polysaccharid Strukturen6,19, zu charakterisieren, obwohl es Zugriff auf eine CE-Maschine, die sind teuer erfordert in der Anschaffung und Wartung.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Tempo-Methode wurde entwickelt und im Laufe der Jahre von verschiedenen Mitgliedern des Arbeitskreises Dupree (University of Cambridge, UK) optimiert, und wir freuen uns über ihre Beiträge. Diese Arbeit wurde im Rahmen des DOE gemeinsame Bioenergie Instituts (http://www.jbei.org) unterstützt vom U. S. Department of Energy, Office of Science, Büro des biologischen und Umweltforschung, durch Vertrag DE-AC02-05CH11231 zwischen Lawrence finanziert. Berkeley National Laboratory und das US Department of Energy. Wir danken auch Thea Pick- and -Vy Ngo für Hilfe bei der Vorbereitung der csla9 Proben.
Materialien
| Name | Company | Catalog Number | Comments |
| Oligosaccaharide Standards | |||
| Mannose | Sigma-Aldrich | CAS 3458-28-4 | |
| Mannobiose | Megazyme | CAS: 14417-51-7 | |
| Mannotriose | Megazyme | CAS: 28173-52-6 | |
| Mannotetraose | Megazyme | CAS: 51327-76-5 | |
| Mannopentaose | Megazyme | CAS: 70281-35-5 | |
| Mannhexaose | Megazyme | CAS: 70281-36-6 | |
| Glucomannan (Konjac; Low Viscosity) | Megazyme | P-GLCML | |
| Name | Company | Catalog Number | Comments |
| Other specialty chemicals | |||
| 8-Aminonaphthalene-1,3,6-trisulfonic acid | (Molecular probes) Thermo | A350 | |
| 2-picoline borane | TCI | B3018 | |
| 40 % acrylamide/Bis-acrylamide (29:1 acrylamide:Bis) | Bio-rad | 1610146 | |
| Name | Company | Catalog Number | Comments |
| Specialty Equipment | |||
| Gel casting kit | Hoefer | SE660 kit | 18x24 cm glass plates, 0.75 mm spacers |
| Cooling recirculating water bath | Hoefer | RCB20-plus 115v | Needs to be able to maintain temperature at ~10 C |
| G:Box Chemi XRQ Imaging System | Syngene | 05-GBOX-CHEMI-XRQ | Order with filters appropriate to fluorphore, and transilluminator should be fitted with long-wave UV light bulbs |
| High Voltage Power Pack | Thermo | EC1000XL | 1000V |
| Vacuum centrifuge(Speedvac) | Savant | SPD131 | |
| Vertical Gel electrophoresis system | Hoefer | SE660 | |
| Glycosyl hydrolases | |||
| These can be obtained from companies e.g. Megazyme (https://www.megazyme.com/) or Prozomix (http://www.prozomix.com/), or can be expressed in house by requesting the plasmid from the relevant research group. | |||
| Name | Company | Catalog Number | Comments |
| Lab supplies | |||
| 15 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-918 | |
| 50 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-951 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Gel imaging software ( Genesys) | Syngene |
Referenzen
- Barton, C. J., et al. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Planta. 224 (1), 163-174 (2006).
- Goubet, F., Jackson, P., Deery, M. J., Dupree, P. Polysaccharide analysis using carbohydrate gel electrophoresis: A method to study plant cell wall polysaccharides and polysaccharide hydrolases. Anal Biochem. 300 (1), 53-68 (2002).
- Mortimer, J. C. Structural Analysis of Cell Wall Polysaccharides Using PACE. Methods Mol Biol. 1544, 223-231 (2017).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54 (4), 559-568 (2008).
- Lopez-Casado, G., Urbanowicz, B. R., Damasceno, C. M., Rose, J. K. Plant glycosyl hydrolases and biofuels: a natural marriage. Curr Opin Plant Biol. 11 (3), 329-337 (2008).
- Mortimer, J. C., et al. An unusual xylan in Arabidopsis primary cell walls is synthesised by GUX3, IRX9L, IRX10L and IRX14. Plant J. 83 (3), 413-426 (2015).
- Ridlova, G., Mortimer, J. C., Maslen, S. L., Dupree, P., Stephens, E. Oligosaccharide relative quantitation using isotope tagging and normal-phase liquid chromatography/mass spectrometry. Rapid Commun Mass Spectrom. 22 (17), 2723-2730 (2008).
- Busse-Wicher, M., et al. Evolution of Xylan Substitution Patterns in Gymnosperms and Angiosperms: Implications for Xylan Interaction with Cellulose. Plant Physiol. 171 (4), 2418-2431 (2016).
- Mortimer, J., et al. Absence of branches from xylan in Arabidopsis gux mutants reveals potential for simplification of lignocellulosic biomass. Proc Nat Acad Sci USA. 107 (40), 17409-17414 (2010).
- Anders, N., et al. Glycosyl transferases in family 61 mediate arabinofuranosyl transfer onto xylan in grasses. Proc Nat Acad Sci USA. 109 (3), 989-993 (2012).
- Goubet, F., et al. Cell wall glucomannan in Arabidopsis is synthesised by CSLA glycosyltransferases, and influences the progression of embryogenesis. Plant J. 60 (3), 527-538 (2009).
- Rogowski, A., et al. Evidence That GH115 alpha-Glucuronidase Activity, Which Is Required to Degrade Plant Biomass, Is Dependent on Conformational Flexibility. J Biol Chem. 289 (1), 53-64 (2014).
- Rogowski, A., et al. Glycan complexity dictates microbial resource allocation in the large intestine. Nat Commun. 6, 7481 (2015).
- Handford, M. G., et al. Localisation and characterisation of cell wall mannan polysaccharides in Arabidopsis thaliana. Planta. 218 (1), 27-36 (2003).
- Boyes, D. C., et al. Growth stage-based phenotypic analysis of Arabidopsis: a model for high throughput functional genomics in plants. Plant Cell. 13 (7), 1499-1510 (2001).
- . . The Carbohydrate Active Enzyme Database. , (2017).
- Hogg, D., et al. The modular architecture of Cellvibrio japonicus mannanases in glycoside hydrolase families 5 and 26 points to differences in their role in mannan degradation. Biochem J. 371, 1027-1043 (2003).
- Brennan, Y., et al. Unusual microbial xylanases from insect guts. Appl Environ Microbiol. 70 (6), 3609-3617 (2004).
- Li, X., et al. Development and application of a high throughput carbohydrate profiling technique for analyzing plant cell wall polysaccharides and carbohydrate active enzymes. Biotechnol Biofuels. 6, (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten