Method Article
Caractérisation des Polysaccharides pariétaux Mannan chez les plantes à l’aide de rythme
Dans cet article
Résumé
Un protocole pour l’analyse structurale des polysaccharides par électrophorèse sur gel (APCE), à l’aide de mannane à titre d’exemple, est décrite.
Résumé
Polysaccharides pariétaux plante sont notoirement difficiles à analyser, et la plupart des méthodes nécessitent des équipements coûteux, opérateurs qualifiés et grandes quantités de matériel purifié. Nous décrivons ici une simple méthode pour gagner polysaccharide structurelle des informations détaillées, y compris la résolution des isomères structuraux. Pour l’analyse des polysaccharides par électrophorèse sur gel (APCE), matériel de la paroi cellulaire végétale est hydrolysé avec glycosyl hydrolases spécifiques au polysaccharide d’intérêt (p. ex., mannanases de maure). Gels de polyacrylamide de grand format sont ensuite utilisés pour séparer les oligosaccharides libérés, qui ont été étiquetés fluorescent. Gels peuvent être visualisées avec un gel mis à jour le système d’imagerie (voir Table des matières). L’empreinte d’oligosaccharide qui en résulte peut soit être comparé qualitativement ou, avec la réplication, quantitativement. Liens et informations branches peuvent être établies à l’aide supplémentaire glycosyl hydrolases (p. ex., mannosidases et galactosidases). Alors que ce protocole décrit une méthode d’analyse de structure de glucomannane, il peut être appliqué à toute polysaccharide pour lesquelles caractérisés glycosyl hydrolases existent. Alternativement, il peut être utilisé pour caractériser le roman glycosyl hydrolases en utilisant des substrats de polysaccharide définis.
Introduction
Polysaccharide analyse par électrophorèse sur gel (APCE) est une méthode de caractérisation détaillée des polysaccharides1,2,3. Polysaccharides pariétaux plante sont notoirement difficiles à analyser, et la plupart des méthodes nécessitent des équipements coûteux, opérateurs qualifiés et grandes quantités de matériel purifié. Nous décrivons ici une simple méthode pour gagner polysaccharide structurelle des informations détaillées, y compris la résolution des isomères structuraux.
Structure de polysaccharides pariétaux compréhension végétale est nécessaire pour ces chercheurs Explorer plante biosynthèse de la paroi de la cellule ou le rôle de la paroi cellulaire végétale dans le développement de la plante. Récemment, cependant, la composition des parois cellulaires végétales est devenue intéressante pour un plus grand nombre de chercheurs en raison de l’accent sur l’utilisation de la biomasse végétale (essentiellement la paroi cellulaire) comme matière première pour produire des biocarburants et des produits biochimiques4. À titre d’exemple, efficace saccharification enzymatique de ce matériel nécessite une compréhension détaillée des structures polysaccharide, afin que le cocktail enzymatique optimisé peut être sélectionné5.
RYTHME a plusieurs avantages sur les méthodes alternatives qui le rendent idéal pour l’analyse rapide des structures complexes glycane. Tout d’abord, il ne nécessite pas de purification du polysaccharide en question, étant requise pour la solution de résonance magnétique nucléaire (RMN) état6. Deuxièmement, le rythme peut résoudre isomères structuraux, contrairement à la spectrométrie de masse (MS, par exemple, matrix-assisté laser désorption-ionisation (MALDI) et ionisation par électrospray (ESI)), qui peut aussi être difficile à effectuer par chromatographie liquide (LC) 7. Troisièmement, le rythme est très sensible, avec une résolution basse-picomole, contrairement à la chromatographie sur couche mince (CCM) ou la chromatographie sur papier. Enfin, il ne nécessite pas de coûteux équipements ou spécialiste des connaissances, comme c’est le cas pour les MS, RMN et LC.
La méthode de rythme s’appuie sur la spécificité des glycosyl hydrolase (GH) enzymes, qui ciblent certains glycosidiques dans un mélange de polysaccharides. Lorsque l’enzyme GH agit sur la chaîne polysaccharidique, il révèle une extrémité réductrice qui peut ensuite être chimiquement dérivatisée, dans ce cas avec une étiquette fluorescente. La partie hydrolysée de l’échantillon est donc rendue indétectable par cette méthode. Les oligosaccharides étiquetés sont alors séparés dans un gel d’acrylamide grand format par électrophorèse. Cela donne excellente résolution des molécules très semblables, par exemple, les trisaccharides Glc-homme-homme et homme-Glc-Glc aura un différent Rf.
RYTHME a été largement utilisé pour caractériser les structures différentes de xylane l’ensemble d’espèces végétales8, afin d’identifier des glycosyltransférase mutants d’Arabidopsis6,9,10,11 , faire une glycosyltransférase essais9et de caractériser les roman GH activités12,13. Nous l’avons récemment utilisé pour caractériser les mannan de paroi cellulaire de levure (Manon et Mortimer, en préparation). Nous décrivons ici une méthode permettant de caractériser la structure de glucomannane de paroi cellulaire végétale, issu des précédents rapports11,14.
Protocole
1. récolte du matériel végétal
- récolte des végétaux frais (environ 20 mg) et immédiatement il plonger dans de l’éthanol 96 % (v/v) et incuber à 70 ° C pendant 30 min ; Ceci désactive toute dégradant les enzymes présentes les parois cellulaires. Pour les matériaux secs, commencez à l’étape 2.
ATTENTION : L’éthanol est inflammable.
Remarque : Une seule feuille de souches ou rosettes fournira assez de matériel pour l’analyse. Toutefois, moins d’erreurs surviennent si une grande quantité de tissu est regroupée et analysée puisque c’est plus facile de peser et de gérer. - Enregistrer soigneusement le type de tissu et stade de développement, comme structure polysaccharidique varie avec les deux. Par exemple, avec Arabidopsis thaliana (utilisé ici), étape du tissu selon les méthodes de Boyes et al. 15
Remarque : dans ce protocole, nous avons utilisé la moitié inférieure de la tige de l’inflorescence, où le premier silique est entièrement allongé mais ne pas de jaunissement.
2. résidu Insoluble préparation de l’alcool (AIR)
- Prepare AIR, suivant la méthode de Mortimer et al. 9 ou autre méthode similaire, afin de produire une poudre manque de sucres solubles, tels que le saccharose et amidon.
3. Aliquotage et avant le traitement de l’AIR
Remarque : la quantité d’AIR nécessaire pour chaque échantillon dépendra de (a) l’abondance du polysaccharide d’intérêt dans le matériel et (b) la taille moyenne des oligosaccharides sorti exacte la GH. La méthode ajoute une seule molécule fluorescente à l’extrémité réductrice de chaque oligosaccharide, afin que le nombre des oligosaccharides détermine la sensibilité de l’expérience. Comme ligne directrice, de glucomannane dans Arabidopsis tige digéré avec GH5/GH26 (comme décrit), 500 µg est recommandé 11, tandis que pour le xylane dans Arabidopsis tige digéré avec GH11, 100µg est recommandé comme dans Mortimer ' étude s 3.
- peser AIR (10-15 mg) dans un tube à centrifuger de 15 mL et ajouter H 2 O à une concentration finale de 2 mg/mL. Vortex pour obtenir une suspension de même. Si cela pose problème, puis utilisez un verre homogénéisateur pour aider ce processus.
- Aliquot 500 µg dans des microtubes tubes. Sécher les parties aliquotes à l’aide d’une centrifugeuse à vide (voir la Table des matières) durant la nuit à 30 ° C.
- AIR prétraiter avec 1 NaOH M (20 µL) pendant 1 h à température ambiante ; ceci hors acétyle les polysaccharides et gonfle les microfibrilles de cellulose, perturbant la structure de la biomasse et permettant l’accès de GH.
Remarque : Cette étape peut être sautée pour polysaccharides purifiées. ATTENTION – acide/base forte.- Comprennent une partie aliquote d’un contrôle d’AIR non-enzyme (le même traitement que tous les échantillons, sauf le point 4.1. est exclu).
- Ajouter 200 µL d’H 2 O et 20 µL 1 M HCl à neutraliser. Test que le pH est environ 6-7 en enlevant 1 µL et il spotting sur bandes de papier pH indicateur.
- Ammonium de 1 M ajouter 50 µL de tampon d’acétate, pH 6.0 (ou n’importe quel pH est approprié pour le SGH utilisé dans l’étude) et H 2 O pour obtenir un volume total de 500 µL.
Remarque : Acétate d’Ammonium est utilisé puisqu’il se sublime après séchage, et donc il n’ajoute pas de sel supplémentaire à l’échantillon. Un excès de sel peut conduire à la mauvaise forme de bande et de la résolution sur le gel de l’APCE.
4. Hydrolyse d’AIR avec Glycosyl Hydrolases (GHs)
Remarque : comme indiqué dans la Discussion, la pureté du SGH est critique. L’utilisation seule façon hétérologue exprimées, affinité purifié des enzymes. Dès réception de chaque lot du fabricant, hydrolysent aliquotes définies du substrat (par exemple, 500 µg AIR) avec des quantités croissantes de GH pendant la nuit (par exemple, 0,5, 1, 2, 5, 10, 15, 20 µL) (3 unités/µL). Quand il y a un excès de GH, l’empreinte de rythme cherchera identique. Un excès d’enzyme est tenu de produire un résultat reproductible car il doit être certain que la réaction d’hydrolyse est proche du point de terminaison.
Contrôle- Ajouter un montant prédéterminé (voir ci-dessus) de mannanases ( 11 GH5 et GH26) pour les aliquotes d’AIR dans le tampon de l’étape 3.5, mais aussi un positif (30 µg de glucomannane de konjac) et un témoin négatif no-AIR (mélange enzymatique dans une tube vide). Vortex et un essorage puis brièvement pour rassembler le mélange réactionnel dans le fond du tube.
- Incuber une nuit à 37 ° C (ou la température appropriée pour la GH de choix) avec agitation modérée (~ 100 tr/min).
- Arrêter la réaction en incubant à 95 ° C pendant 20 min.
Remarque : Les bouchons peuvent être utilisés pour sceller des microtubes basculant.- Centrifuger utilisant une microcentrifugeuse dessus de banc à vitesse maximale pendant 10 min et conserver le liquide surnageant.
- Resuspendre le culot dans 250 µL H 2 O, centrifugeuse comme ci-dessus et conserver le liquide surnageant.
- Combiner les deux surnageants et sécher dans une centrifugeuse sous vide (voir la Table des matières) à 30 ° C (~ 3 h ou toute la nuit sans chauffage).
5. Élaboration de normes d’Oligosaccharide
- stock de 1 mM de préparer des solutions en H 2 O de mannose (homme), mannobiose (Man 2), libèrent (Man 3), mannotétraose (Man 4), mannopentaose (Man 5) et mannohexaose (Man 6), tous les β, 1-4 lié. Aliquote et conserver à-20 ° C jusqu'à leur utilisation.
- Préparer 3 concentrations différentes d’un homme 1-6 mélange en combinant 1 µL (Standard S1), 2 µL (S2) ou 5 µL (S3) tous les six.
- Sec dans une centrifugeuse sous vide (voir la Table des matières) à 30 ° C (~ 1 h).
6. Dérivé d’Oligosaccharides
- Prepare une solution mère de fourmis de 0,2 M (8-aminonaphthalènes-1,3,6-trisulfonique acide) dans H 2 O : acide acétique 17:3. Stock chaude à 60 ° C, jusqu'à dissolution complète du solide. Conserver à-20 ° C, abri de la lumière pendant 2-3 mois.
- Préparer une solution 0,2 M du 2-picoline borane (2-PB) dans le DMSO. C’est extrêmement hygroscopique, resuspendre immédiatement toute la poudre à la réception dans le DMSO. Aliquote et les conserver à-20 ° C pendant 1 à 2 ans. Décongeler les aliquotes comme requis (magasin à 4 ° C pendant 2 semaines et puis jeter).
- Préparer le tampon de dérivatisation de H 2 O : acide acétique : DMSO à 17:03:20.
- Pour chaque échantillon, ajouter 5 µL de fourmis, 5 µL de 2-PB et 10 µL de tampon de dérivation. Essorage brièvement pour s’accumuler dans le fond du tube, vortex soigneusement et puis tourner de nouveau brièvement. Voir la Figure 1 pour une description de la réaction.
- Échantillons incuber une nuit à 37 ° C, abri de la lumière.
- Sec dans une centrifugeuse sous vide (voir la Table des matières) à 30 ° C (~ 2 h).
- Remettre les échantillons et standard dans 100 µL 3 M d’urée. Conserver à-20 ° C, abri de la lumière jusqu'à ce que nécessaire.
7. Préparation de l’APCE gélifie
Remarque : assemblage de l’équipement de coulage de gel va dépendre de la marque. Ici, nous avons usoi un système d’électrophorèse verticale (voir Table des matières), équipé de plaques de verre de 18 x 24 cm et 1,5 mm entretoises.
- Assembler des équipements de coulée de gel par le fabricant ' instructions de s. Tampon de rythme x 10
- make (1 M Tris-Borate, pH 8,2) comme suit : Ajouter 121,14 g de Tris-Base à ~ 400 mL de H 2 O et mélanger pour dissoudre. Ajuster le pH à 8,2 par addition d’acide borique solide (environ 60 g) et ensuite faire volume jusqu'à 1 L.
- Faire un ammonium 10 % (p/v) stock de persulfate (APS) dans H 2 O. aliquote et stocker une fois à aliquotes de dégel-20 ° C., conserver à 4 ° C et jeter après 2 semaines.
- Faire et verser le gel résolution. Pour le matériel ci-dessus, 1 gel correspond à 50 mL. Dans un tube à centrifuger 50 mL, mélanger H 2 O (20,2 mL), 5 mL x 10 PACE tampon, 24,6 mL 40 % d’acrylamide/Bis-acrylamide (acrylamide:Bis 29 : 1). (Attention : toxique).
- Ajouter 200 µL d’APS et 20 µL de N, N, N, N´-tétraméthyl-éthylènediamine (TEMED). Inverser doucement pour bien mélanger (pour éviter d’introduire des bulles d’air). Verser le gel à l’aide d’un sérologique ou autre pipette de volume important, à environ 4 cm au-dessous du sommet des plaques de verre. Faites attention à la possibilité de bulles d’air se pris au piège dans le gel. Si ils faire cesser de verser et inclinaison/robinet le gel pour les libérer.
- Le gel avec de l’isopropanol (inflammable attention :) ou, avec soin, avec H 2 O. Allow gel à polymériser (20-30 minutes), puis verser sur la couche supérieure de superposition. Si isopropanol a été utilisée, puis laver 2 x avec H 2 O. Dry tout excès de liquide à l’aide de papier buvard.
- Faire et verser le gel de concentration. Mélanger 6,8 mL H 2 O, 1 mL de tampon de rythme x 10, 2,8 mL acrylamide/Bis-acrylamide (attention : toxiques), 80 µL APS et 8 µL de TEMED dans un tube à centrifuger 15 mL. Inverser pour mélanger et superposer sur le dessus de gel polymérisé de résoudre. Insérer délicatement les peignes, en évitant les bulles d’air de piégeage sous les dents du peigne.
- Autoriser gel polymériser (20-30 min), enveloppement dans le tissu humide, puis dans une pellicule plastique et conserver à 4 ° C jusqu'à leur utilisation. Magasin avec les peignes en place.
Remarque : L’APCE gels peuvent être stockés pour un maximum de 2 semaines (bien que moins d’une semaine est idéale), si elles sont gardées humides.
8. En cours d’exécution un rythme Gel
- Utilisez un marqueur permanent pour marquer les positions bien sur le verre, qui vous aideront à garder la trace de l’ordre de chargement, et à identifier où les puits sont une fois retiré le peigne.
- Supprimer le peigne. Remplir les puits avec du tampon de rythme de 1 x.
- Utiliser une microseringue µL 10 pour charger 2 µL de normes et d’échantillons dans les puits. Évitez d’utiliser les voies ultrapériphériques, qui ont tendance à courir les échantillons mal.
- Assembler la chambre haute de l’appareil de gel de manque d’eau et placer le gel dans une cuve en cours d’exécution refroidi (environ 10 ° C) (10 ° C) contenant 1 x tampon de rythme. Remplir la chambre supérieure avec du tampon de rythme de 1 x.
- Allumez la puissance et exécuter le gel à 200 V (constante V) pour 30 minutes, puis augmentation de tension jusqu'à 1000 V pour 1 h 40 min. Protéger des gels de la lumière (par exemple, en encapsulant des chars dans des sacs poubelle noirs).
Remarque : Vérifiez sur les gels ~ 5 min après avoir mis la tension et puis un autre 5 minutes après l’augmentation de la tension à 1 000 V. Si le bloc d’alimentation est incapable de maintenir la tension il y a probablement une fuite de mémoire tampon. Enlever le gel de la cuve. Remonter la chambre haute, en vérifiant soigneusement mise en place de tous les joints. Une grande puce sur le bord supérieur de la plaque de verre peut empêcher la plaque formant une bonne étanchéité avec un joint. Cela peut généralement être temporairement résolu en ajoutant une goutte de gel d’agarose fondu de 5 % (p/v) à la partie écaillée de la vitre, avant d’ajouter la chambre supérieure.
9. Visualisation d’un gel de rythme
Remarque : utilisez un gel d’imagerie système équipé d’ampoules UV de longueur d’onde dans la courte longueur d’onde et un filtre d’émission pour la caméra qui est adapté pour le fluorophore, ici 530 nm. Par ailleurs, un scanner laser peut également être utilisé, tel que décrit dans le Goubet 2.
- Assurer le gel système d’imagerie est sans poussière en l’essuyant avec le tissu pelucheux humide.
- Enlever le gel de la cuve de rythme et afficher brièvement alors que le gel est encore dans les plaques de verre (< 80 ms) pour déterminer si l’avant de la teinture est toujours sur le gel.
- Ouvrez le gel à l’aide d’un outil de coin et tandis que le gel est encore sur une vitre, utilisez un couteau à pizza pour enlever le gel de concentration et, si le front de colorant est toujours sur le gel, l’extrémité du gel.
- ~ 5 mL H 2 O, mettez sur la surface de la courte longueur d’onde et puis transférez le gel directement sur la courte longueur d’onde. La valeur du filtre UV 605 et allumez le transilluminateur de grande longueur d’onde UV (voir Table des matières) à l’aide du logiciel.
Remarque : Le fluorophore de fourmis utilisé ici a une excitation/émission de 353/520 nm. - Prendre plusieurs images à différents temps d’exposition (p. ex., 100 ms à 10 s). Veiller à ce que la lumière UV est éteint entre les images en cliquant sur le bouton lumière UV (pour désactiver) pour éviter de dégrader la fluorescence. Assurer d’avoir au moins 2 des images sans bandes saturées (le gel logiciel d’imagerie indiquera ceci).
- Enregistrer les fichiers sous forme d’images haute-resolution.tif.
Remarque : Des Images peuvent être analysées à l’aide du logiciel fourni avec le gel, système d’imagerie, ou en utilisant le logiciel d’analyse image librement disponibles, par exemple ImageJ (https://imagej.nih.gov/ij/). Reportez-vous à la section résultats pour une analyse de la quantification.
Résultats
Ici, nous montrons un gel de rythme exemple exécuté par le protocole, ainsi que des descriptions pour aider à l’interprétation des données et de dépannage, et elle est suivie d’un guide général de réussite de l’APCE gel interprétation13,16. Un gel représentatif d’un rythme standard dosage de la teneur en mannan pariétale est illustré à la Figure 2et est décrite voie par voie.
Normes
Routes 1, 2 et 3 montrent une échelle des oligosaccharides achetés dans le commerce (Man1- Man6) à 5 (S1), 10 (S2) et 50 (S3) pmol concentration. Lorsque vous recevez un nouveau lot d’un oligosaccharide commercial, il est important de vérifier la pureté sur un gel. Nombreux oligosaccharides, particulièrement tetrasacccharides et plus, peuvent avoir une contamination importante avec les oligosaccharides des autres degrés de polymérisation (DPs), comme ici pour homme6 (marqués avec *). Tout en quantifiant un gel, il est important d’avoir au moins 3 concentrations des normes, étant donné que c’est nécessaire pour calculer la courbe standard. Calcul de la courbe d’étalonnage peut aussi être utile pour s’assurer que la réaction de dérivation est essentiellement à l’achèvement. Normes de concentrations connues permettent des comparaisons entre les gels et sont un contrôle utile pour la qualité de la séparation et la qualité de la dérivation.
Contrôle positif
4 Lane montre une digestion mannanase de glucomannane de konjac. Glucomannane de konjac est disponible dans le commerce, et alors qu’il n’a pas la même structure que celle, par exemple, trouvé chez Arabidopsis, il sert à deux fins. Tout d’abord, c’est un contrôle important pour la digestion enzymatique. Le chercheur devrait établir à quoi ressemble un substrat commercial digéré avec leur SGH de choix lorsqu’elle est assimilée aux achèvement (c'est-à-dire, un vaste excédent de GH est ajouté à la réaction). Si à l’avenir des expériences le modèle change, cela peut indiquer soit une perte d’activité ou la contamination du stock GH. Deuxièmement, il assure un contrôle de la réaction de dérivation en présence de sels de l’enzyme et le tampon. Si les normes semblent bonnes, mais le contrôle positif est faible, cela peut indiquer qu’un composant de la réaction d’hydrolyse est inhibitrice de la dérivation.
Arabidopsis de type sauvage (WT) tige AIR + mannanase cocktail (GH5 + GH26)
5 Lane montre l’empreinte de rythme d’une tige de WT Arabidopsis (Comparez avec références11,,14).
csla9 Arabidopsis tige AIR + mannanase cocktail (GH5 + GH26)
6 Lane montre montre l’empreinte de rythme de la tige de l’Arabidopsis planter manque le major tige mannane synthase11. Comparez le poids et le contrôle négatif empreintes digitales. Alors que la majorité de la maure est absente dans cette plante, une petite quantité reste, comme en témoignent les intensités de bande réduite pour tous les dérivés mannanase oligosaccharides c’est synthétisé par mannan supplémentaires synthases (CSLA2, 3)11.
Contrôle négatif - enzyme seulement
8 Lane montre des bandes sur le gel qui ne sont pas spécifiques qui dérivent de contaminants dans le cocktail de mannanase et devraient être exclus de l’analyse (marqués avec *).
Contrôle négatif - WT AIR seulement
Lane 9 montre des bandes sur le gel qui ne sont pas spécifiques et devraient être exclus de l’analyse (marqués avec *).
Contrôle négatif- csla9 AIR seulement
Lane 10 montre des bandes sur le gel qui ne sont pas spécifiques et devraient être exclus de l’analyse (marqués avec *).
Pin bois AIR + mannanase cocktail (GH5 + GH26)
Voie 7 montre l’empreinte de rythme de bois de pin, qui contient galactoglucomannan. Cela a clairement un modèle différent des oligosaccharides libérés d’Arabidopsis, grâce à sa structure différente.
Contrôle négatif - pin clair
Lane 11 montre des bandes sur le gel qui ne sont pas spécifiques et devraient être exclus de l’analyse (marqués avec *).
Interpréter un gel de rythme est relativement simple, mais nécessite la connaissance des points suivants. Pour des données fiables, il est recommandé d’effectuer PACE au moins 3 indépendamment cultivé biologique réplique, et il est recommandé d’effectuer au moins 2 réplicats techniques sur chaque réplicat biologique. Les contrôles décrits sont critiques pour l’interprétation, comme les bandes non spécifique doivent être exclus. Nous vous recommandons également de charger les échantillons dans un ordre différent sur les gels répétées, d’exclure les effets qui résultent de l’éclairage inégal de la courte longueur d’onde. Interprétation précise il faut analyser les bandes qui ne sont pas saturées. Puisque certaines empreintes d’oligosaccharides peuvent contenir les deux polysaccharides très élevé et de faible abondance, nous vous recommandons d’analyser des expositions multiples du même gel. Les normes permet de normaliser entre différentes images.
Pour certains types d’expériences, il peut être souhaitable de quantifier la quantité de polysaccharide dans la préparation de l’AIR. S’il est possible de quantifier d’un gel de rythme, il exige une connaissance de l’identité moléculaire exacte de chaque oligosaccharide libéré par le GHs et où il se trouve sur le rythme gel. Ceci n’est actuellement pas entièrement connue pour mannan, mais il a été déterminé pour les autres polysaccharides par exemple xylane3. Les normes fournissent un moyen de normalisation entre les gels, même lorsque le dosage n’est pas effectuée et donc aidera à toute analyse qualitative ou semi-quantitative.
Identifier la structure des oligosaccharides individuels peut être réalisé à l’aide de cocktails de Sequential GHs. Ajout de davantage de GHs peut révéler des détails sur les liens et les remplacements des oligosaccharides publiés (par exemple, l’ajout de β - 1, 4 - glucosidase qui agit sur l’extrémité non réductrice révélera les oligosaccharides dans le mélange contiennent cette fonctionnalité). Enzymes disponibles incluent galactosidases, glucuronidases et glucosidases (voir la base de données de CAZy16 pour plus d’informations) ; voir Hogg, d. et al. 17 à titre d’exemple.
Le protocole ci-dessus peut être utilisé pour caractériser l’activité du SGH inconnu. Dans ce cas, une biomasse définie, tels que l’Arabidopsis tige ou konjac glucomannane, devrait être utilisée pour dépister l’inconnu GHs13.
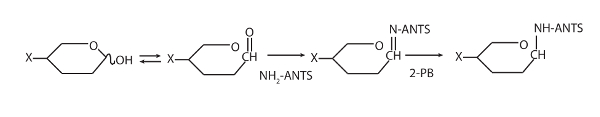
Figure 1 : Cela montre le schéma pour la dérivation fluorescent des oligosaccharides de fourmis. Modification du Goubet2.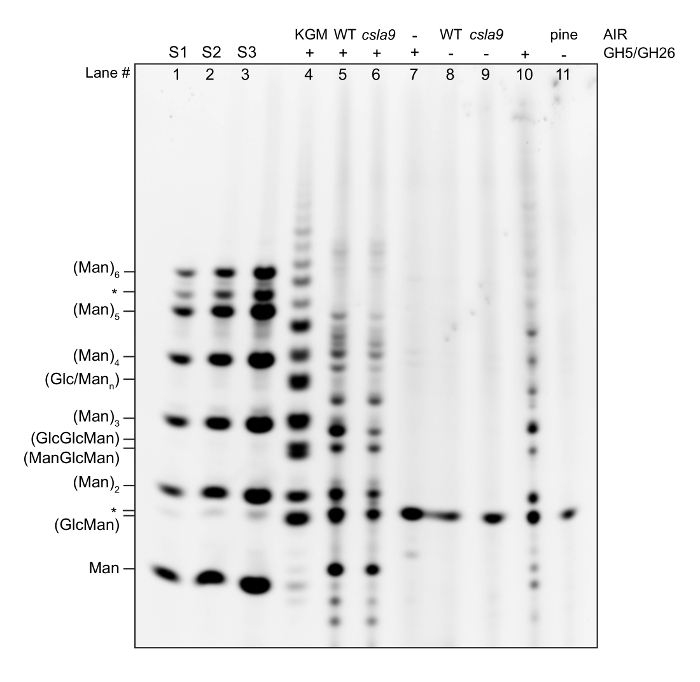
Figure 2 : Gel de rythme représentative montrant l’empreinte maure de l’Arabidopsis, de pins et d’un mutant de l’Arabidopsis (csla9) qui a affaibli la biosynthèse mannan. AlR a été hydrolysé avec un cocktail de mannanase, et les oligosaccharides libérés étaient dérivatisés avec un fluorophore. Les oligosaccharides sont séparés par électrophorèse sur gel sur la base de la taille, la forme et frais. Une échelle de manno-oligosaccharides (Man1-6) est indiquée pour aider à identifier la mobilité relative des oligosaccharides libérés, et une hydrolyse de mannan purifiée (dérivé de konjac) est présentée comme un témoin positif. * = bandes non spécifiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
PACE est une méthode simple pour caractériser la structure polysaccharidique. Il peut être appliqué à un polysaccharide pour lesquels il est connue GHs avec activité caractérisée, voir de nombreux exemples dans la littérature1,6,9,11. TT a également été appliquée à la caractérisation de nouveaux GHs12,13,18 et glycosyltransférases9, en utilisant des substrats de polysaccharide définis et des accepteurs.
Des résultats reproductibles, interprétables dépendent de trois étapes principales. Tout d’abord, le SGH utilisé devrait être exempt de contamination des activités. C’est mieux atteint en utilisant seulement exprimée de façon hétérologue, affinité purifié des enzymes. Deuxièmement, pour la plupart des expériences, il est important que l’hydrolyse enzymatique des substrats est à la fin. Cela garantira que la biomasse même hydrolysée avec la GH même donne la même empreinte dans chaque expérience. Enfin, il devrait y avoir un excès de fluorophore dans la réaction de dérivation. Cela garantit que les extrémités de réduction disponibles soient étiquetées à près de 100 %. Cela se traduira par la grande reproductibilité des résultats, ainsi que des données quantitatives.
Gel et réactif de qualité sont essentiels pour assurer des données reproductibles. Tampons de mauvaise qualité, en particulier du pH incorrect, bulles dans le gel d’air, et les échantillons avec un excès de sel peuvent tout affect facteur de résolution et de la rétention des oligosaccharides. Toutefois, inclusion des contrôles recommandées décrite dans la section protocole et les résultats permettront de dépannage.
RYTHME est limitée par sa capacité à identifier des oligosaccharides. Pour certaines expériences, une empreinte digitale simple est tout ce qui est nécessaire. Toutefois, pour réellement doser la quantité de glucomannane dans un échantillon d’AIR, par exemple, l’identité de tous les oligosaccharides libérés est requise, qui est un processus long. C’est plus facile pour les moins complexes polysaccharides tels que xylane3. Puisqu’il y a peu de normes oligosaccharide commercialement disponible, il peut être pas toujours possible ou souhaitable d’identifier toutes les bandes. Dans ce cas, le rythme peut fournir des données très élogieux à la spectrométrie de masse (c'est-à-dire, MALDI-CID9 ou ESI-MS7et NMR6). Pour ces méthodes, il est souvent utile de faire une préparation à grande échelle, séparés par chromatographie d’exclusion stérique et puis analyser chaque fraction par deux rythme avant MS ou NMR. Alors qu’il a été signalé que les bandes peuvent être excisées et identifiés par MALDI-CID, dans la pratique nous avons constaté que cela a un faible taux de succès (peut-être à cause des interactions des oligosaccharides étiquetées avec le gel d’acrylamide lorsqu’ils sont exposés aux rayons ultraviolets).
L’autre limitation importante de l’APCE est le débit. Pour avoir de bonne qualité, des gels interprétables avec les contrôles appropriés, chaque gel aura seulement ~ 10 échantillons expérimentaux, et un chercheur peut s’attendre à exécuter gels rythme ~ 4 par jour. Une version de rythme à l’aide de l’électrophorèse capillaire (EC) a récemment développé19, qui permet la préparation d’échantillons en plaques 96 puits. Il a été utilisé avec succès pour caractériser l’activité enzymatique glycosyltransferase et polysaccharide structures6,19, bien que cela nécessite un accès à une machine CE qui peut être coûteux à acheter et à entretenir.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La méthode de rythme a été développée et optimisée par divers membres du groupe Dupree (Université de Cambridge, Royaume-Uni) au cours des années, et nous apprécions tous leurs contributions. Ce travail a été financé dans le cadre de la DOE Joint BioEnergy Institute (http://www.jbei.org) pris en charge par l’u. s. Department of Energy, Office of Science, Office of Biological and Environmental Research, par le biais de contrat DE-AC02-05CH11231 entre Laurent Berkeley National Laboratory et l’u. s. Ministère de l’énergie. Nous remercions aussi Thea Pick et Vy Ngo pour aide à la préparation des échantillons de csla9 .
matériels
| Name | Company | Catalog Number | Comments |
| Oligosaccaharide Standards | |||
| Mannose | Sigma-Aldrich | CAS 3458-28-4 | |
| Mannobiose | Megazyme | CAS: 14417-51-7 | |
| Mannotriose | Megazyme | CAS: 28173-52-6 | |
| Mannotetraose | Megazyme | CAS: 51327-76-5 | |
| Mannopentaose | Megazyme | CAS: 70281-35-5 | |
| Mannhexaose | Megazyme | CAS: 70281-36-6 | |
| Glucomannan (Konjac; Low Viscosity) | Megazyme | P-GLCML | |
| Name | Company | Catalog Number | Comments |
| Other specialty chemicals | |||
| 8-Aminonaphthalene-1,3,6-trisulfonic acid | (Molecular probes) Thermo | A350 | |
| 2-picoline borane | TCI | B3018 | |
| 40 % acrylamide/Bis-acrylamide (29:1 acrylamide:Bis) | Bio-rad | 1610146 | |
| Name | Company | Catalog Number | Comments |
| Specialty Equipment | |||
| Gel casting kit | Hoefer | SE660 kit | 18x24 cm glass plates, 0.75 mm spacers |
| Cooling recirculating water bath | Hoefer | RCB20-plus 115v | Needs to be able to maintain temperature at ~10 C |
| G:Box Chemi XRQ Imaging System | Syngene | 05-GBOX-CHEMI-XRQ | Order with filters appropriate to fluorphore, and transilluminator should be fitted with long-wave UV light bulbs |
| High Voltage Power Pack | Thermo | EC1000XL | 1000V |
| Vacuum centrifuge(Speedvac) | Savant | SPD131 | |
| Vertical Gel electrophoresis system | Hoefer | SE660 | |
| Glycosyl hydrolases | |||
| These can be obtained from companies e.g. Megazyme (https://www.megazyme.com/) or Prozomix (http://www.prozomix.com/), or can be expressed in house by requesting the plasmid from the relevant research group. | |||
| Name | Company | Catalog Number | Comments |
| Lab supplies | |||
| 15 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-918 | |
| 50 ml Centrifuge tube ( Falcon Centrifuge Tubes, Polypropylene, Sterile, Corning) | VWR | 21008-951 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Gel imaging software ( Genesys) | Syngene |
Références
- Barton, C. J., et al. Enzymatic fingerprinting of Arabidopsis pectic polysaccharides using polysaccharide analysis by carbohydrate gel electrophoresis (PACE). Planta. 224 (1), 163-174 (2006).
- Goubet, F., Jackson, P., Deery, M. J., Dupree, P. Polysaccharide analysis using carbohydrate gel electrophoresis: A method to study plant cell wall polysaccharides and polysaccharide hydrolases. Anal Biochem. 300 (1), 53-68 (2002).
- Mortimer, J. C. Structural Analysis of Cell Wall Polysaccharides Using PACE. Methods Mol Biol. 1544, 223-231 (2017).
- Pauly, M., Keegstra, K. Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J. 54 (4), 559-568 (2008).
- Lopez-Casado, G., Urbanowicz, B. R., Damasceno, C. M., Rose, J. K. Plant glycosyl hydrolases and biofuels: a natural marriage. Curr Opin Plant Biol. 11 (3), 329-337 (2008).
- Mortimer, J. C., et al. An unusual xylan in Arabidopsis primary cell walls is synthesised by GUX3, IRX9L, IRX10L and IRX14. Plant J. 83 (3), 413-426 (2015).
- Ridlova, G., Mortimer, J. C., Maslen, S. L., Dupree, P., Stephens, E. Oligosaccharide relative quantitation using isotope tagging and normal-phase liquid chromatography/mass spectrometry. Rapid Commun Mass Spectrom. 22 (17), 2723-2730 (2008).
- Busse-Wicher, M., et al. Evolution of Xylan Substitution Patterns in Gymnosperms and Angiosperms: Implications for Xylan Interaction with Cellulose. Plant Physiol. 171 (4), 2418-2431 (2016).
- Mortimer, J., et al. Absence of branches from xylan in Arabidopsis gux mutants reveals potential for simplification of lignocellulosic biomass. Proc Nat Acad Sci USA. 107 (40), 17409-17414 (2010).
- Anders, N., et al. Glycosyl transferases in family 61 mediate arabinofuranosyl transfer onto xylan in grasses. Proc Nat Acad Sci USA. 109 (3), 989-993 (2012).
- Goubet, F., et al. Cell wall glucomannan in Arabidopsis is synthesised by CSLA glycosyltransferases, and influences the progression of embryogenesis. Plant J. 60 (3), 527-538 (2009).
- Rogowski, A., et al. Evidence That GH115 alpha-Glucuronidase Activity, Which Is Required to Degrade Plant Biomass, Is Dependent on Conformational Flexibility. J Biol Chem. 289 (1), 53-64 (2014).
- Rogowski, A., et al. Glycan complexity dictates microbial resource allocation in the large intestine. Nat Commun. 6, 7481 (2015).
- Handford, M. G., et al. Localisation and characterisation of cell wall mannan polysaccharides in Arabidopsis thaliana. Planta. 218 (1), 27-36 (2003).
- Boyes, D. C., et al. Growth stage-based phenotypic analysis of Arabidopsis: a model for high throughput functional genomics in plants. Plant Cell. 13 (7), 1499-1510 (2001).
- . . The Carbohydrate Active Enzyme Database. , (2017).
- Hogg, D., et al. The modular architecture of Cellvibrio japonicus mannanases in glycoside hydrolase families 5 and 26 points to differences in their role in mannan degradation. Biochem J. 371, 1027-1043 (2003).
- Brennan, Y., et al. Unusual microbial xylanases from insect guts. Appl Environ Microbiol. 70 (6), 3609-3617 (2004).
- Li, X., et al. Development and application of a high throughput carbohydrate profiling technique for analyzing plant cell wall polysaccharides and carbohydrate active enzymes. Biotechnol Biofuels. 6, (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon