Method Article
Gleichzeitige Zuordnung und Quantifizierung der Purine im menschlichen mitochondrialen DNA
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode zugänglich gleichzeitig quantitate und genomweite Karte Purine in höchst intakte DNA bei Einzel-Nukleotid-Auflösung, Kombination von enzymatischen Spaltung von genomischer DNA mit seinen alkalische Hydrolyse und anschließende 5´-Ende Sequenzierung.
Zusammenfassung
Etablierte Ansätze zur Schätzung der Anzahl der Purine im ein Genom beschränken sich auf die Quantifizierung der eingearbeitete Purine mit kurzen synthetischen DNA-Fragmente oder Plasmide als Vorlagen und rechnet man dann die Ergebnisse für die gesamte Genom. Alternativ kann die Anzahl der Purine in einem Genom vorhanden mit alkalischen Gele oder Southern Blots geschätzt werden. Neuere in Vivo Ansätze beschäftigen Sequenzierung der nächsten Generation ermöglicht genomweite Kartierung der Purine, Bereitstellung der Stellung und Identität des eingebetteten Purine. Jedoch erlauben sie nicht Quantifizierung der Anzahl der Purine, die in einem Genom integriert sind. Hier beschreiben wir, wie gleichzeitig zuordnen und quantitate die Anzahl der Purine, die in menschliche mitochondrische DNA in Vivo durch Sequenzierung der nächsten Generation integriert sind. Wir verwenden sehr intakte DNA und Reihenfolge bestimmte Doppelstrang Brüche einzuführen, indem mit einer Endonuklease, anschließend Eisensalz eingearbeitete Purine mit Alkali zu verdauen. Die generierten Enden sind mit Adapter ligiert und diese Ziele sind auf einem Next-Generation Sequenzierung sequenziert. Die absolute Zahl der Purine kann als die Anzahl der Lesevorgänge außerhalb der Anerkennung Website pro durchschnittliche Anzahl der Lesevorgänge auf dem Gelände der Anerkennung für die Sequenz-spezifische Endonuklease berechnet werden. Dieses Protokoll kann auch genutzt werden, um Karte und quantitate freie Kerben in der DNA und ermöglicht die Anpassung an andere DNA-Läsionen, die verarbeitet werden können, 5´-OH Karte enden oder 5´-Phosphat enden. Darüber hinaus kann diese Methode auf jeden Organismus angewendet werden, angesichts der Tatsache, dass eine geeignete Referenz Genom vorhanden ist. Dieses Protokoll stellt daher ein wichtiges Instrument zur Untersuchung der DNA-Replikation, 5´-End-Verarbeitung, DNA-Schäden und DNA-Reparatur.
Einleitung
In einer eukaryotischen Zelle ist die Konzentration der Purine (rNTPs) viel höher als die Konzentration von Deoxyribonucleotides (dNTPs)1. DNA-Polymerasen diskriminieren Purine, aber diese Diskriminierung ist nicht perfekt, und infolgedessen können Purine statt tierische in Genomen integriert werden, während der DNA-Replikation. Purine können die am häufigsten nicht-kanonischen Nukleotide in der Genom-2integriert werden. Die meisten diese Purine sind während der Okazaki Fragment Reifung durch RNase H2 initiierten Ribonukleotidreduktase Exzision Nachbesserung (RER) oder Topoisomerase 1 (rezensiert in Referenz3) entfernt. Purine, die nicht entfernt werden können bleiben stabil integrierte in die DNA-2,4 und können es auf schädliche und vorteilhafte Weise (rezensiert in bewertete5) beeinträchtigen. Neben der Möglichkeit, als positive Signale zu handeln, zum Beispiel in der Paarung Art wechseln in Schizosaccharomyces Pombe6 und Markierung der entstehenden DNA-Strangs bei Fehlanpassung Reparatur (MMR)7,8, Purine Einfluss auf die Struktur-9 und Stabilität der umliegenden DNA durch die Winkel2 Hydroxylgruppe ihrer Ribose10, wodurch replikativen Stress und Genom Instabilität11. Die Fülle der Purine in genomischer DNA (gDNA) und deren Relevanz in Replikation und Reparaturmechanismen, sowie die Auswirkungen auf die Genomstabilität, Anlass, ihre genaue vorkommen und Häufigkeit in einer genomweiten Weise zu untersuchen.
RNase H2 Tätigkeit nicht in den menschlichen Mitochondrien gefunden wurde und Purine sind daher nicht effizient in der mitochondrialen DNA (MtDNA) entfernt. Mehrere Wege in der Versorgung von Nukleotiden zu menschlichen Mitochondrien beteiligt sind und um zu untersuchen, ob Störungen in der mitochondrialen Nukleotid-Pool eine erhöhte Anzahl der Purine in menschlicher MtDNA verursachen, entwickelten wir ein Protokoll, um Karte und quantitate Diese Purine im menschlichen MtDNA von Fibroblasten, HeLa-Zellen und geduldige Zelle Linien12isoliert.
Die meisten in-vitro- Ansätze (rezensiert in überprüften13) ermitteln, DNA-Polymerasen Selektivität gegen rNTPs basieren auf einzelnen Ribonukleotidreduktase einfügen oder Grundierung Erweiterung Experimente wo konkurrierende rNTPs in der Reaktion enthalten sind Mischen Sie, so dass die Ermittlung oder relative Quantifizierung der Ribonukleotidreduktase Gründung in kurzen DNA-Vorlagen. Quantitative Ansätze auf kurze Sequenzen können nicht reflektieren dNTP und rNTP Pools im zellulären Konzentrationen und daher bieten Einblick in die Polymerase Selektivität sind aber von geringer Bedeutung bezüglich ganzer Genome. Es hat sich gezeigt, dass die relative Menge der Purine aufgenommen während der Replikation einer längeren DNA-Vorlage, wie ein Plasmid auf eine Sequenzierung Gel mit radioaktiven dNTPs und hydrolysieren DNA in einem alkalischen Milieu14visualisiert werden kann. Darüber hinaus wurde gDNA auf Southern Blots alkalische Hydrolyse folgen, so dass Strang-spezifische Sondierung und Bestimmung der absoluten Preise Ribonukleotidreduktase Einbindung in Vivo15analysiert. Diese Ansätze ermöglichen einen relativen Vergleich der Übernahme-Frequenz aber keinen Einblick in die Position oder die Identität des eingearbeiteten Purine zu liefern. Neuere Ansätze den Ribonukleotidreduktase Inhalt gDNA in Vivo, wie HydEn-Seq16, Ribose-Seq17, Pu-Seq-18oder EmRiboSeq19, nutzen Sie die eingebettete Purine zu analysieren Empfindlichkeit gegenüber alkalischen oder H2 RNase-Behandlung, bzw., und beschäftigen Next Generation Sequencing, Purine genomweite zu identifizieren. Diese Methoden bieten Einblick in die absolute Aufnahme-Frequenz des erkannten Purine nicht. Durch das Hinzufügen des Schrittdes der Reihenfolge bestimmte enzymatische Spaltung HydEn-Seq-Protokolls, die Methode, die wir hier, bequem beschreiben erstreckt sich den Erkenntnissen aus eine Sequenzierung Ansatz, so dass gleichzeitige Zuordnung und Quantifizierung von eingebettet Purine12. Diese Methode ist anwendbar auf nahezu jedem Organismus, angesichts der Tatsache, dass sehr intakte DNA Extrakte erzeugt werden können und eine geeignete Referenz-Genom verfügbar ist. Die Methode könnte quantitate und bestimmen Sie den Speicherort einer Läsion, die kann durch eine Nuklease verdaut werden und hinterlässt eine 5´-Phosphat oder eine 5´-OH-Ende angepasst werden.
Um Karte und Purine in genomischer DNA quantitate, verbindet die Methode Spaltung durch eine bestimmte Sequenz-Endonuklease und alkalische Hydrolyse erzeugt 5´-Phosphat endet an Standorten, wo die spezifische Erkennungssequenz für die Endonuklease befindet und 5´- OH endet an Stellen wo Purine befanden. Da die erzeugten freien Enden anschließend mit Adapter ligiert werden und sequenziert mit Next Generation Sequencing, ist es von Bedeutung zu verwenden sehr intakte DNA und vermeiden zufällige Fragmentierung während DNA-Extraktion und Bibliothek Vorbereitung. Beurteilung dieser liest normiert auf die Lesevorgänge an die Endonuklease Spaltstellen ermöglicht eine gleichzeitige Quantifizierung und Kartierung der erkannten Purine. Freie 5´-enden werden in Experimente erkannt, wo die alkalische Hydrolyse von DNA durch Behandlung mit KCl ersetzt wird. Die erfassten Daten geben Einblick in Ribonukleotidreduktase Lage und Menge und können Analysen in Bezug auf Ribonukleotidreduktase Inhalt und Übernahme-Frequenz.
Protokoll
dieses Protokoll ist in Abbildung 1 dargestellt und beinhaltet die Isolierung der gDNA, Verdauung mit Restriktionsenzymen in der Lage sein, die Anzahl der Purine, Behandlung mit Alkali, Hydrolyseneigung quantitate die Phosphodiester-Bande der Purine in gDNA, Phosphorylierung des freien 5´-OH enden, SsDNA Ligatur der Adapter, zweiten Strang Synthese und PCR Verstärkung vor Sequenzierung aufgenommen.
1. Adapter und Index Primer
- zu erhalten ARC49, ARC140 Oligonukleotide, ARC76/77, Adapter und ARC78-ARC107-Index-Primer (siehe Tabelle 1).
Hinweis: Oligonukleotide sollte HPLC gereinigt werden. ARC76/77 sind als Maisonette bestellt. - Vorbereiten 100 µM Stammlösungen der jedes Oligonukleotid in Tris-EDTA (TE)-Puffer (siehe die Tabelle der Materialien) und Lagerung bei-20 ° c
- Bereiten 10 µM-Lösungen von ARC67/77 und 2 µM ARC49 und Index Zündkapseln durch Verdünnung im Elution Buffer (EB; siehe Tabelle of Materials). Shop bei-20 ° c
2. Wachstum und Ernte der Zellen
- wachsen HeLa-Zellen in 70 mL Dulbecco ' s Modified Eagle Medium (DMEM) ergänzt mit 10 % fötalen Rinderserum in einem 250 mL-Spinner-Kolben bei 37 ° c
- Die Anzahl der Zellen und 5 x 10 6 Zellen in einen 50-mL-Tube, Zentrifuge für 5 min bei 200 X g, sammeln und entsorgen Sie überstand.
- Waschen der Zellen mit 20 mL 1 X PBS, Zentrifuge für 5 min bei 200 X g, und den Überstand verwerfen.
- Die Pellets bei-20 ° C eingefroren oder fahren Sie mit DNA Reinigung.
3. DNA-Reinigung und Quantifizierung
- gDNA mit Phenol-Chloroform Extraktion, wie unten beschrieben reinigen.
- Aufschwemmen der Zellen in 2 mL Lyse Puffer (siehe die Tabelle der Materialien) und inkubieren Sie für 30 min bei 42 ° C auf einem Heizblock.
Vorsicht: Lysis Puffer enthält gefährliche Komponenten. SDS-Lösung ist irritierend, Proteinase K ist sensibilisierend, irritierend und giftig. Tragen Sie Schutzkleidung und Handschuhe. - Teilen die Probe in zwei 2 mL-Tuben und fügen Sie 1 Volumen (V) von Phenol-Chloroform-Isoamyl Alkohol (25:24:1).
Achtung: Phenol-Chloroform-Isoamyl Alkohol ist toxisch, mutagen, korrosive und gefährlich für die aquatischen Umwelt. Verwenden Sie in einer Dampfhaube, Schutzkleidung und Handschuhe zu tragen und in speziellen Phenol-Chloroform Abfälle entsorgen. - Mix durch Umkehrung für 30-60 s und Zentrifuge für 5 min bei 15.000 x g bei Raumtemperatur.
Hinweis: Verwenden Sie nicht Wirbel DNA zu vermeiden zufällige Strangbrüche, welche die Ergebnisse verfälschen würde. - Übertragen die obere, wässrige Phase zu einem neuen 2-mL-Tube geben und 1 V von Phenol-Chloroform-Isoamyl Alkohol (25:24:1).
- Mix durch Umkehrung und Zentrifuge für 5 min bei 15.000 x g bei 4 ° c
- Übertragen die obere, wässrige Phase um eine neue 2 mL tube und fügen Sie 20 µL NaCl (5 M) und 1 V von kaltem Isopropanol.
Achtung: Isopropanol ist brennbar, irritierend und giftig. Speichern Sie es in einem belüfteten Schrank, Schutzkleidung und Handschuhe zu tragen und Flammen fernhalten. - Mix durch Umkehrung und inkubieren Sie für mindestens 1 h bei-20 ° c
- Zentrifuge für 20 min bei 15.000 x g, 4 ° C und überstand verwerfen.
- Waschen DNA-Pellet mit 200 µL kaltem 70 % igem Ethanol, für 20 min bei 15.000 x g bei 4 ° C zentrifugiert und überstand verwerfen.
Achtung: 70 % Ethanol ist brennbar und irritierend. Halten Sie funktionierende Lösung bei-20 ° C, sonst laden in belüfteten Schrank, tragen Sie schützende Kleidung und Handschuhe, und Flammen fernhalten. - Trocknen Sie das DNA-Pellet bei Raumtemperatur für 20-25 min.
- Lösen sich DNA Pellets in 100 µL TE-Puffer und bündeln die Proben in einem Rohr.
- Aufschwemmen der Zellen in 2 mL Lyse Puffer (siehe die Tabelle der Materialien) und inkubieren Sie für 30 min bei 42 ° C auf einem Heizblock.
- Quantitate DNA-Konzentration mit Hilfe eines DsDNA Quantifizierung Reagenzes laut Hersteller ' s Spezifikationen (siehe die Tabelle der Werkstoffe).
Hinweis: Verwenden einer DsDNA Quantifizierung Reagenz, da spektralfotometrische DNA Quantifizierung durch passives Phenol beeinflusst werden kann. - Store DNA bei-20 ° C oder fahren Sie mit der Behandlung von HincII.
4. HincII Behandlung und alkalische Hydrolyse
- Digest 1 µg DNA in einer Reaktion Mischung mit 5 µL 10-fach Puffer 3.1, 1 µL (10 U) HincII und Nuklease-freie H 2 O zu einem Endvolumen von 50 µL.
Hinweis: Um optimale Bedingungen für die Ligatur zu erreichen, zweiten Strang Synthese und PCR Verstärkung, es möglicherweise notwendig, die Menge von input-DNA zu erhöhen, wenn es erwartet wird, dass die DNA eine sehr geringe Anzahl von Purine enthält. In ähnlicher Weise ggf. Eingabe DNA zu verringern, wenn die Anzahl der Purine sehr hoch ist. - 30 min bei 37 ° c inkubieren
- Reinigen HincII DNA mit paramagnetischen Beads behandelt.
Hinweis: Halten Sie das Rohr geöffneten Deckel in den folgenden Schritten um Pellets nicht zu stören, durch die Öffnung der Rohre.- Fügen Sie 1,8 V paramagnetischen Beads zu jedem probieren, durch pipettieren, sorgfältig mischen und Inkubation bei Raumtemperatur für 10 min.
- Verwenden eine magnetische Rack, pellet-die Perlen für 5 min, dann entfernen und entsorgen überstand.
- Waschen das Pellet mit 150 µL 70 % Ethanol (Raumtemperatur) für ca. 30 s dann entfernen und entsorgen des Überstands.
- Waschen das Pellet mit 200 µL 70 % Ethanol (Raumtemperatur) für ca. 30 s dann entfernen und entsorgen des Überstands.
Hinweis: Passives Ethanol kann mit einer 10 µL Pipette entfernt werden. Tröpfchen können sich kurz vorher gesponnen werden. - Trocknen die Proben bei Raumtemperatur für ca. 15-20 min.
Hinweis: Die genaue Zeit hängt der Umfang der Perlen und die Form des Geschosses, daher sollte die Pellets visuell kontrolliert werden. - Rohre aus der magnetischen Halterung entfernen und eluieren Pellet in 45 µL EB, Mix von sorgfältig pipettieren.
- Inkubieren für 5 min dann Pellets die Perlen auf das magnetische Gitter und 45 µL gereinigte DNA in Schritt 4.4.
- Hinzufügen 5 µL KOH (3 M) oder KCl (3 M) an der DNA erstellen ein Gesamtvolumen von 50 µL.
Achtung: 3 M KOH-Lösung ist ätzend. Tragen Sie Schutzkleidung und Handschuhe. - Inkubation für 2 h bei 55 ° C in einer Hybridisierung Ofen gefolgt von 5 min auf Eis
Hinweis: Es wird empfohlen, führen Sie die KOH-Behandlung in einem Ofen anstatt einem Heizblock zu erhalten eine gleichmäßige Erwärmung des Rohres und Kondensation an den Deckel. - Niederschlag DNA durch Zugabe von 10 µL Natriumacetat (3 M, pH = 5,2) und 125 µL kalt 100 % Ethanol. Inkubation auf Eis für 5 min.
Achtung: 100 % Ethanol ist brennbar und irritierend. Speichern in einem belüfteten Schrank, Schutzkleidung und Handschuhe zu tragen und Flammen fernhalten. - Pellet gDNA durch Zentrifugieren bei 21.000 x g, 4 ° C für 5 min und den Überstand verwerfen.
- Waschen DNA-Pellet mit 250 µL kaltem 70 % EtOH, 21.000 x g, 4 ° C für 5 min Zentrifugieren und entsorgen des Überstands.
Hinweis: Um Tröpfchen zu entfernen, das Rohr kann sein gesponnen unten kurz wieder und überstand mit einer 10 µl Pipette entnehmbar. - Lassen Sie die Tablette in ein offenes Rohr für ca. 5-10 min trocknen, bis eine sichtbare Flüssigkeit verdampft ist.
- Lassen Sie DNA-Pellets lösen sich im 20 µL EB für 30 min bei Raumtemperatur.
5. 5´ Ende Phosphorylierung
- bereiten die Reaktion Mischung für jede Probe vorab Nachteilegung von 2,5 µL 10 x T4-Polynukleotid-Kinase Reaktion Puffer, 1 µL (10 U) 3´-Phosphatase-Minus T4 Polynukleotid Kinase und 2,5 µL ATP (10 mM).
- Transfer 19 µL jeder DNA-Probe in ein neues Rohr 200 µL und denaturieren für 3 min bei 85 ° C in einem Thermo-Cycler.
- Cool DNA Proben auf Eis und jede Probe 6 µL Reaktion Mix hinzu.
- Incubate Reaktion mischt bei 37 ° C für 30 min und stoppen die Reaktion durch Inkubation der Proben bei 65 ° C für 20 min.
- Reinigen DNA wie beschrieben unter 4.3, mit 1,8 V paramagnetischen Beads aber eluieren in 14 µL EB.
6. SsDNA Ligation
- bereiten die Reaktion Mischung für jede Probe vorab bestehend aus 0,5 µL ATP (2 mM), 5 µL 10 x T4 RNA Ligase Reaktion Puffer, 5 µL CoCl 3 (NH 3) 6 (10 mM), 0,5 µL ARC140 (100 µM), und 25 µL 50 % PEG 8000. Mischung gut durch pipettieren.
Achtung: CoCl 3 (NH 3) 6 ist krebserregend, sensibilisierende und gefährlich für die aquatische Umwelt. Tragen Sie Schutzkleidung und Handschuhe. - Transfer 13 µL gereinigte DNA aus Schritt 5.5 zu einem neuen 200 µL Schlauch und denaturieren für 3 min bei 85 ° C in einem Thermo-Cycler.
- Die DNA auf Eis abkühlen und 36 µL Reaktion-Mix, jede Probe, mischen, indem Sie pipettieren und spin-down kurz.
- Add 1 µL (10 U) T4 RNA Ligase, jede Reaktion durch Pipettieren mischen und spin-down kurz.
- Der Proben bei Raumtemperatur in der dunklen Nacht inkubieren.
7. Zweiten Strang Synthese
- Purify ligiert DNA wie unter 4.3, aber verwenden Sie 0,8 V paramagnetischen Beads, pellet-die Perlen für 10 min und eluieren in 20 µL EB.
Hinweis: Aufgrund der höheren Viskosität des Ligatur-Reaktion-Mix, der erste Pelletierwerk Schritt verlängert. - Transfer 20 µL DNA-Probe zu einem neuen 200 µL PCR Schlauch. Wiederholen Sie die Reinigung mit 0,8 V paramagnetischen Beads nach Hersteller ' s Spezifikationen und eluieren in 14 µL EB.
- Vorbereitung den Reaktion-Mix für jede Probe vorab bestehend aus 2 µL 10 x T7 DNA-Polymerase Reaktion Puffer, 2 µL ARC76/77 (2 µM), 2 µL dNTPs (2 mM) und 0,8 µL BSA (1 mg/mL).
- Transfer 12,8 µL DNA zu einem neuen 200 µL Schlauch gereinigt, für 3 min bei 85 ° C in einem Thermo-Cycler denaturieren.
- Kühl, die DNA auf Eis und fügen 6,8 µL Reaktion Mischung zu jeder Probe, mischen, indem Sie pipettieren, spin-down kurz und 5 min bei Raumtemperatur inkubieren.
- 0.4 µL (4 U) T7 DNA-Polymerase zu jeder Reaktion hinzufügen und 5 min bei Raumtemperatur inkubieren.
- Reinigen DNA wie beschrieben unter 4.3, mit 0,8 V paramagnetischen Beads und eluieren in 11 µL EB.
8. PCR-Amplifikation und Quantifizierung der Bibliothek
- bereiten die Reaktion Mischung für jede Probe in eine neue 200 µL Rohr im Voraus bestehend aus 7,5 µL ARC49 (2 µM), 7,5 µL Index Primer (2 µM, einzigartig für jede Probe) und 25 µL 2 x hot-Start Fertigmischung.
- Fügen Sie 10 µL DNA-Probe, jede Reaktion. Die Bibliothek mit den folgenden Bedingungen zu verstärken: denaturieren bei 95 ° C für 45 s, gefolgt von 18 Zyklen von 98 ° C für 15 s, 65 ° C für 30 s, 72 ° C für 30 s, endet mit einer abschließenden Dehnung bei 72 ° C für 2 min. halten Proben bei 4 ° C nach Verstärkung.
- Reinigen Bibliotheken wie in 4.3, mit 0,8 V paramagnetischen Beads, beschrieben und in 20 µL TE-Puffer eluieren.
- Bibliotheken mit DsDNA Quantifizierung Reagens, nach Angaben des Herstellers quantitate ' s Spezifikationen (siehe die Tabelle der Werkstoffe).
- Proben bei-20 ° C zu speichern oder weiter mit Bibliotheksanalyse.
9. Bibliotheksanalyse und Pooling
- bestimmt die Qualität der einzelnen Bibliotheken und schätzen Sie die durchschnittliche Fragmentgröße mit einem digitalen Elektrophorese System.
Hinweis: Die durchschnittliche Fragmentgröße wird bewertet durch Schätzung, wo die Fläche unter der Kurve der Electropherogram halbiert wird, abgesehen von Gipfeln von Markern. Repräsentative Ergebnisse der entsprechenden Bibliothek Profile nach KOH oder KCl Behandlung sind in Abbildung 2A angegeben. - Berechnung die Konzentration (nM) der Bibliotheken als:
/(p*650) (3)] * 10 9
wo c ist die Konzentration der Bibliothek in ng/µL und p ist die durchschnittliche Fragmentgröße bei bp, als geschätzte in 9.1. - Pool gleiche molare Mengen von bis zu 24 Bibliotheken verstärkt mit anderen Index-Primer zur Sequenzierung. TE-Puffer hinzu einem Endvolumen von 25 µL und eine Konzentration von 10 nM.
Hinweis: Abhängig von der Anzahl der Bibliotheken, gebündelt werden, ist die Menge von DNA aus jeder Bibliothek angepasst. Beim Erkennen von Grundierung Dimere in Schritt 9.1 als eine unterschiedliche Spitze ca. 130 bp, der letzte Band der Bibliothek Pool kann 25 µL übersteigen, weil der Reinigungsstufe wiederholt wird, wie unter 4.3, mit 0,8 V paramagnetischen Beads und DNA ist in 25 µL TE Buf eluiert Fer.- Bestimmen Sie die neue Bibliothek Pool Konzentration mit Hilfe eines DsDNA Quantifizierung Reagenzes laut Hersteller ' s Spezifikationen und die durchschnittliche Größe Spitze, wie oben beschrieben. Weiter zur Sequenzierung und Datenanalyse (§ § 10 und 11).
10. Sequenzierung
- führen 75-Basis gepaart-End Sequenzierung auf gepoolten Bibliotheken 12.
11. Datenanalyse
- Trim alle Lesevorgänge Adapter Sequenzen entfernen Filtern nach Qualität und Länge zu lesen.
Hinweis: Dies kann mit dem Befehl Cutadapt 1.2.1 20 ' Cutadapt -f Fastq - Match-lesen-Platzhalter - ruhig -m 15 - Q 10 - ein NNNNNNN < Datei > ", wobei NNNNNNN mit der tatsächlichen Adapter Sequenz ersetzt wird und < Datei > ist ersetzt mit dem Dateinamen Fastq. - Entfernen Sie Verknüpfungen liest, die verworfen wurden im vorherigen Schritt mithilfe von benutzerdefinierten Skripts.
- Richten Sie Mate 1 verbleibenden Paare auf einen Index mit der Sequenz alle Oligonukleotide, die in der Bibliothek-Herstellung verwendet (z. B. mit Fliege 0.12.8 21 und die Befehlszeile-Optionen - m1-v2). Entsorgen Sie alle Paare mit erfolgreichen Ausrichtungen.
- Richten Sie verbleibende Paare auf den Organismus Referenz Genom mit Fliege mit der Befehlszeile Optionen - v2 -X 10000--Best.
- Karte liest dieser Zeitspanne zwischen mitochondrialen Molekül Anfang und Ende durch eine Angleichung Mate 1 alle unaligned Paare (mit Fliege mit der Befehlszeile-Optionen - v2).
- Bestimmen die Anzahl der 5´-Enden für alle Einzel- und gekoppelten Ende Ausrichtungen. Die Position dieser durch eine Basis flussaufwärts in die Position, wo die hydrolysierten Purine waren, zu verlagern.
- Export von Daten aus der Fliege-Datei format in ein Bedgraph Dateiformat, die Verwendung von benutzerdefinierten Skripts für Visualisierung gemeinsam Genom Browsern. Normalisieren der liest für jeden Teilbereich für Lesevorgänge pro million.
- Mit der Position und Grafen aus der Bedgraph-Datei verweisen die Genomsequenz Organismus zur Ermittlung der Identität von IncorpFol-Purine.
Hinweis: Für die menschlichen mitochondrialen Genoms aus den Regionen 16.200-300 und 5.747-5.847 für liest jeder Strang ausgeschlossen werden sollte, da diese Regionen viele freie 5´-enden in keinem Zusammenhang mit Ribonukleotidreduktase Aufnahme von DNA-Polymerase γ enthalten. - Unterteilen die Gesamtanzahl der Lesezugriffe, nicht einschließlich liest in den elf HincII lagen, mit die mittlere Anzahl der Lesevorgänge pro HincII Website, um die Anzahl der Purine pro Einzelstrang Pause, (d.h. die Anzahl der Purine pro mitochondriale Molekül).
Ergebnisse
Zur Veranschaulichung der Methodik, die oben beschriebene, repräsentative Daten erstellten Analyse der mitochondrialen DNA von HeLa-Zellen12. Abbildung 2 b zeigt die zusammengefassten liest überhaupt HincII Websites in Heavy (HS) und leichte Strang (LS) menschliche mtDNA nach KCl Behandlung (linken Panels). Lokalisieren Sie rund 70 % aller erkannten 5´-enden auf die Schnitt-Websites, demonstrieren die hohe Effizienz der Verdauung HincII. Behandlung von Bibliotheken mit KOH, Hydrolyseneigung die DNA an eingebettete Purine verringert die Anzahl der Lesevorgänge an HincII Standorten, etwa 40 % (Abb. 2 b, richtigen Platten). Dies dürfte da zahlreicher 5´-enden an den Standorten der Ribonukleotidreduktase Aufnahme erzeugt werden, und ist bezeichnend für eine ausreichende Qualität der Bibliothek. Abbildung 2 veranschaulicht die Lokalisierung und die Häufigkeit der 5´-enden (grün) Nachdem KCl Behandlung und liest generiert durch HydEn-Seq (Magenta) nach KOH Behandlung, Erkennung von freien 5´-enden und enden bei Purine durch alkalische Hydrolyse erzeugt. Freie 5´-enden und Purine, die Lokalisierung der HS menschlicher mtDNA ergeben sich in der linken Leiste und die Lokalisierung, die LS werden im rechten Fensterbereich angezeigt. Die relativen Zahlen des rohen lautet Purine (Abbildung 2D, obere Leiste) oder HincII (untere Leiste) auf HS und LS mtDNA zeigen jeweils eine 14-fold oder 31-fold stärkere Deckung des LS im Vergleich zu der HS, während eine ähnliche Tendenz nicht für beobachtet wurde Kern-DNA. Dieser Strang Voreingenommenheit kann durch den deutlichen Unterschied in Basenzusammensetzung der beiden Stränge erklärt und veranschaulicht die Bedeutung der Normalisierung, liest an HincII Standorten.
Lesen Sie normalisieren zählt zu HincII gibt ein quantitatives Maß für die Anzahl der Purine pro mitochondrialen Genom (Abb. 3A). Wie in Abbildung 3 bdargestellt, zeigen das liest nach KOH Behandlung für jedes Ribonukleotidreduktase der Sequenz Zusammensetzung jeder Strang Normalisierung eine Verhältnis anders als 1, zeigt eine nicht-zufällige Verteilung der liest, was auf eine deutliche Ribonukleotidreduktase Muster und eine hohe Bibliothek-Qualität. Dieses Verhältnis ist unabhängig von vorherigen Verdauung mit HincII, das Enzym Spaltung Spezifität zu überprüfen. Normalisierung der liest an den Standorten der eingebetteten Purine bei HincII Spaltstellen sowie der Genom-Nukleotid-Inhalt generiert ein quantitatives Maß für die pro 1.000 komplementären Basen ( wie viele von jedem Ribonukleotidreduktase aufgenommen werden Abbildung 3).
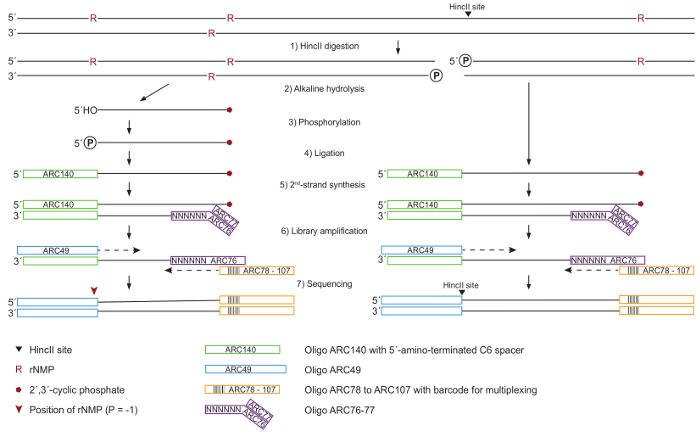
Abbildung 1: schematische für DNA-Verarbeitung und Zubereitung Bibliothek. (1) ganz genomischer DNA ist von HincII für die Normalisierung in der anschließenden Quantifizierung der Purine, abgespalten generieren stumpfe enden an HincII Standorten (schwarze Pfeilspitze). (2) die DNA wird mit KOH, Ribonukleotidreduktase Standorten Hydrolyseneigung behandelt führt zu Winkel2, 3´-zyklische Phosphat (rote Pentagon) an 3´-enden und kostenlose 5´-OH enden. (3) 5´-OH Enden sind durch T4-Polynukleotid-Kinase 3´-Phosphatase-Minus phosphoryliert. (4) alle tragen eine Phosphat-Gruppe-5´-Enden sind um ARC140 Oligonukleotid von T4 RNA Ligase ligiert. (5) der zweite Strang wird mit T7-DNA-Polymerase und die ARC76-77-Oligonukleotide mit zufälligen N6 Sequenzen synthetisiert. (6) die Bibliothek wird durch ein High-Fidelity-DNA-Polymerase mit ARC49 und eines ARC78 zu ARC107-Index-Primer, enthält einen eindeutigen Barcode für multiplexing verstärkt. (7) 5´-Enden befinden sich gepaart-End Sequenzierung. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Methodenvalidierung. Repräsentative Electropherograms (A) erzeugt mit einem automatisierten Elektrophorese-System zur Bestimmung der Qualität der erzeugten Bibliotheken behandelt mit KOH oder KCl. (B) zusammenfassende Signal an HincII Standorten in Heavy (HS) und leichte Strang (LS) menschlicher MtDNA nach KCl (linken Panels) oder KOH (richtigen Platten) Behandlung. (C) Circos Abbildung des freien 5´-enden (grün) und von HydEn-Seq (freien 5´-enden und Purine, Magenta) in HS (links) und menschliche MtDNA LS (rechte Abbildung). Spitzen sind normiert auf pro million mal gelesen und der höchste Gipfel ist die maximale Anzahl der Lesevorgänge HydEn-Seq-Bibliothek angepasst. (D) zusammenfassende roh liest an Purine (obere Abdeckung) und HincII (untere Leiste) in schweren (H) und leicht (L) Strang in menschlicher MtDNA (Mito) oder rückwärts (RV) oder nach vorne (FW) Strang in nuklearen (Nuc.) DNA. Abb. B, C und D sind von Verweis12angepasst. Fehlerbalken repräsentieren den Standardfehler des Mittelwerts. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Vertreter Ergebnisse. (A) die Relative Anzahl der Purine auf Lesevorgänge an HincII Standorten für KOH behandelt Bibliotheken auf die Heavy (H) oder leicht (L) Strang normalisiert. (B) Verhältnis von Ribonukleotidreduktase Identität MtDNA Genoms Zusammensetzung für KOH behandelt (KOH) und HincII gespalten mit KOH behandelt (HincII + KOH) Bibliotheken auf die Heavy (H) oder leicht (L) Strang der MtDNA. (C) Ribonukleotidreduktase Frequenz normiert auf 1.000 komplementären Basen für HincII und KOH Bibliotheken auf die Heavy (H) oder leicht (L) Strang der MtDNA behandelt. Zahlen sind von Verweis12angepasst. Fehlerbalken repräsentieren den Standardfehler des Mittelwerts. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Name | Sequenz | |||
| ARC49 | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT | |||
| ARC76 | GTGACTGGAGTTCAGACGTGTGCTCTTCCGATCTNNNN * N * N | |||
| ARC77 | AGATCGGAAGAGCACACGTCTGAACTCCAGTC * A * C | |||
| ARC78 | CAAGCAGAAGACGGCATACGAGATCGTGATGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| ARC84 | CAAGCAGAAGACGGCATACGAGATACATCGGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| ARC85 | CAAGCAGAAGACGGCATACGAGATGCCTAAGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| ARC86 | CAAGCAGAAGACGGCATACGAGATTGGTCAGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT | |||
| ARC87 | CAAGCAGAAGACGGCATACGAGATCACTGTGTGACTGGAGTTCAGACGTGTGCTCTTCCGA | |||
Tabelle 1: Oligonukleotide. Aufgeführt sind die Oligonukleotide verwendet für HydEn-f Fettschrift zeigt Indizierung. * zeigt eine Phosphorothioat Bindung. ARC140 enthält eine 5´-Aminogruppe anstelle einer 5´-OH-Gruppe, in Kombination mit einem C6-Linker. Diese Änderung reduziert die Bildung von ARC140 Concatemers in Verbindung.
Diskussion
Hier präsentieren wir eine Technik, um gleichzeitig Karte und Purine in gDNA und MtDNA vor allem durch die einfache Einführung der Spaltung von DNA an bestimmten Standorten Sequenz des Genoms als Ergänzung zu den etablierten HydEn-Seq-Protokoll zu quantifizieren. Während dieser Studie konzentriert sich auf menschliche MtDNA, war ursprünglich die HydEn-Seq-Methode in Saccharomyces Cerevisiae, illustrieren die Methode Übersetzung auf andere Organismen12,16entwickelt.
Für zuverlässige Ergebnisse von diesem Ansatz, sollte einige wichtige Schritte beachtet werden: (A) Da Sequenzierung Adapter an alle verfügbaren 5´-Enden verbinden, ist es wichtig, mit höchst intakte DNA zu arbeiten. DNA isoliert werden sollten und Bibliotheken sollten vorzugsweise unmittelbar nach DNA-Isolierung erfolgen, oder die DNA kann bei-20 ° c gelagert werden Es wird nicht empfohlen, DNA in den Kühlschrank für eine lange Zeit zu speichern oder zu wiederholt Einfrieren und Auftauen es. (B) um geeignete Bibliotheken mit dieser Methode zu erzeugen, ist es entscheidend, die KOH Behandlung der DNA in einem Inkubation Ofen, anstatt einem Heizblock, versicherte homogene Erwärmung der gesamten Probe und quantitative Hydrolyse durchzuführen. (C) Darüber hinaus ist es wichtig, die Qualitätskontrolle der Bibliotheken vor der Zusammenlegung und Sequenzierung. Die DNA quantifiziert werden sollte und entsprechende Fragment Größen bestätigen analysiert mit einem automatisierte Elektrophorese-System um ausreichende Mengen an Bibliothek DNA, zu gewährleisten, und überprüfen Sie Grundierung Dimere.
Für eine aussagekräftige Datenanalyse ist es auch wichtig zu beachten, dass die Aussagekraft dieser Methode entsprechende Kontrollen Hintergrund zählt und Sequenz oder Strang Vorurteile bewerten abhängig ist. Eine Zuordnung Effizienz in KCl Proben von fast 70 % erreichen wir routinemäßig, wenn nur mit der Sequenz spezifische Endonuklease (Abb. 2 b, linken Platten) zu verdauen. Darüber hinaus ist es wichtig zu bestätigen, dass die Endonuklease Behandlung nicht die gesamte beeinflussen Erkennung von eingearbeitete Purine durch den Vergleich HincII behandelt und unbehandelt Proben (Abb. 3 b). In diesen Experimenten haben wir HincII verwendet, ortsspezifische Kürzungen einzuführen, obwohl andere High-Fidelity-Restriktionsenzyme auch genutzt werden kann.
Das Protokoll kann angepasst werden, andere Arten von DNA-Läsionen zu studieren, das 5´-Phosphat oder 5´-OH verarbeitbar ist beendet. Die Genauigkeit der Ergebnisse ist abhängig von der Spezifität der Verarbeitung und erfordert geeignete Kontrollen (z. B. Wildtyp oder unbehandelt) für die Überprüfung. Darüber hinaus sollte bei der Anpassung dieser Methode für andere Anwendungen oder für die Verwendung mit anderen Organismen man bedenken, dass die Methode in seiner aktuellen Setup ca. 1 µg DNA erfordert, die zu einer Bibliothek verarbeitet wird. Da die Zahl der Enden abhängig von der Anzahl der eingebetteten Purine ist, die variiert je nach Organismus oder Mutant, Proben, einschließlich einer geringeren Anzahl von Purine müsste mehr Eingang DNA, um eine ausreichende Anzahl von endet in erzeugen die nachfolgende Bibliotheksbau. Ähnlich, wenn DNA-Proben eine viel höhere Anzahl von Purine haben, müssten es auch, mit weniger input DNA, um optimale Bedingungen für die Ligatur, der zweite Strang Synthese und PCR Verstärkung zu erhalten. Es ist bemerkenswert, dass der Bibliotheksbau wie beschrieben in diesem Protokoll auch Daten über das Kerngenom generiert (wie in Abbildung 2Dangezeigt) und nur die Datenanalyse sich auf MtDNA konzentrierte. Dies zeigt, dass größere Genome mit mäßig niedriger Ribonukleotidreduktase Frequenzen auch von dieser Methode erfasst werden.
Wenn diese Methode in Betracht ziehen, sollten gewisse Einschränkungen Rechnung getragen werden: Obwohl diese Methode in der Theorie, auf nahezu jedem Organismus anwendbar sein sollte, eine geeignete Referenz-Genom ist notwendig für die Ausrichtung der mal gelesen. Darüber hinaus stellen die Ergebnisse aus unserem Protokoll der liest aus einer großen Anzahl von Zellen dar. Durch diesen Ansatz werden nicht spezifische Ribonukleotidreduktase Gesellschaftsgründung Muster einer Teilmenge von Zellen identifiziert. Wenn Purine in größeren Genomen mit einer sehr geringen Anzahl von Purine zugeordnet sind, kann es schwierig sein, Purine aus zufälligen Nicknamen zu unterscheiden und entsprechende Kontrollen sind daher notwendig.
Die Methode, die wir hier beschreiben erweitert die verfügbaren in Vivo Techniken wie HydEn-Seq16, Ribose-Seq17, Pu-Seq-18oder EmRiboSeq19. Diese Ansätze nutzen die eingebetteten Purine Empfindlichkeit gegenüber alkalischen oder H2 RNase-Behandlung, bzw. Einsatz von Next Generation Sequencing Ermittlung Purine genomweite, wodurch ihre Zuordnung und den Vergleich der relative ver- Durch Spaltung der DNA-Sequenz speziell, können wie oben beschrieben, zusätzlich alkalische Hydrolyse bei eingebetteten Purine, die liest für Purine auf diesen Spaltstellen, so dass nicht nur die Identifizierung und Kartierung von normalisiert werden Purine, sondern auch deren Quantifizierung für jedes DNA-Molekül. Der Einsatz unserer Technik im Zusammenhang mit Krankheiten im Zusammenhang mit DNA-Replikation, könnten DNA-Reparatur und TLS ein tieferes Verständnis der Rolle der Purine in zugrunde liegenden molekularen Mechanismen und Genom Integrität im Allgemeinen geben.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Studie wurde vom schwedischen Forschungsrat unterstützt (www.vr.se) vergibt an ARC (2014-6466 und der schwedischen Stiftung für strategische Forschung (www.stratresearch.se), ARC (ICA14-0060). Chalmers University of Technology hat finanzielle Unterstützung zu MKME während dieser Arbeit. Die Geldgeber hatten keine Rolle beim Studiendesign, Datenerhebung und Analyse, Entscheidung, zu veröffentlichen oder der Manuskripterstellung.
Materialien
| Name | Company | Catalog Number | Comments |
| 10x T4 Polynucleotide Kinase Reaction Buffer | New England Biolabs | B0201S | |
| 10x T4 RNA Ligase Reaction Buffer | New England Biolabs | B0216L | |
| 1x PBS | Medicago | 09-9400-100 | dissolve 1 tablet in H2O to a final volume of 1 L |
| 2-Propanol | Sigma-Aldrich | 33539-1L-GL-R | |
| 2100 Bioanalyzer | Agilent Technologies | G2940CA | |
| 50 mL Centrifuge Tube | VWR | 525-0610 | |
| Adenosine 5'-Triphosphate (ATP, 10 mM) | New England Biolabs | P0756S | dilute with EB to 2 mM |
| Agilent DNA 1000 Kit | Agilent Technologies | 5067-1504 | |
| BSA, Molecular Biology Grade (20 mg/mL) | New England Biolabs | B9000S | diltue with nuclease-free H2O to 1 mg/mL |
| Buffer EB | QIAGEN | 19086 | referred to as EB |
| CleanPCR paramagnetic beads | CleanNA | CPCR-0050 | |
| Deoxynucleotide (dNTP) Solution Mix (10 mM each) | New England Biolabs | N0447L | dilute with EB to 2 mM |
| DMEM, high glucose, GlutaMAX Supplement | Gibco | 61965026 | |
| DynaMag 96 Side | Thermo Fisher | 12331D | |
| Ethanol 99.5% analytical grade | Solveco | 1395 | dilute with milliQ water to 70% |
| Ethylenediaminetetraacetic acid solution (EDTA, 0.5 M) | Sigma-Aldrich | 03690-100ML | |
| Fetal bovine serum | Gibco | 10500056 | |
| HEPES buffer pH 8.0 (1 M) sterile BC | AppliChem | A6906,0125 | |
| Hexammine cobalt(III) chloride (CoCl3(NH3)6) | Sigma-Aldrich | H7891-5G | dissolve in nuclease-free H2O for 10 M solution, sterile filter. CAUTION: carcinogenic, sensitizing and hazardous to aquatic environment. |
| HincII | New England Biolabs | R0103S | supplied with NEBuffer 3.1 |
| Hybridiser HB-1D | Techne | FHB4DD | |
| KAPA HiFi HotStart ReadyMix (2X) | Kapa Biosystems | KK2602 | |
| Lysis buffer | 50 mM EDTA, 20 mM HEPES, NaCl 75 mM, Proteinase K (200 µg/mL), 1% SDS | ||
| Micro tube 1.5 mL | Sarstedt | 72.690.001 | |
| Microcentrifuge 5424R | Eppendorf | 5404000014 | |
| Microcentrifuge MiniStar silverline | VWR | 521-2844 | |
| Multiply µStripPro 0.2 mL tube | Sarstedt | 72.991.992 | |
| Nuclease-free water | Ambion | AM9937 | |
| Phenol – chloroform – isoamyl alcohol (25:24:1) | Sigma-Aldrich | 77617-500ML | |
| Potassium chloride (KCl) | VWR | 26764.232 | dissolve in nuclease-free H2O for 3 M solution, sterile filter |
| Potassium hydroxide (KOH) | VWR | 26668.296 | dissolve in nuclease-free H2O for 3 M solution, sterile filter |
| Proteinase K | Ambion | AM2546 | |
| Qubit 3.0 Fluorometer | Invitrogen | Q33216 | |
| Qubit Assay Tubes | Invitrogen | Q32856 | |
| Qubit dsDNA BR Assay Kit | Invitrogen | Q32850 | CAUTION: Contains flammable and toxic components |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32851 | CAUTION: Contains flammable and toxic components |
| Refrigerated Centrifuge 4K15 | Sigma Laboratory Centrifuges | No. 10740 | |
| SDS Solution, 10% | Invitrogen | 15553-035 | |
| Sodium acetate buffer solution, pH 5.2, 3 M (NaAc) | Sigma-Aldrich | S7899 | |
| Sodium chloride (NaCl) | VWR | 27810.295 | dissolve in nuclease-free H2O for 5 M solution, sterile filter |
| T100 Thermal Cycler | Bio-Rad | 1861096 | |
| T4 Polynucleotide Kinase (3' phosphatase minus) | New England Biolabs | M0236L | |
| T4 RNA Ligase 1 (ssRNA Ligase) | New England Biolabs | M0204L | supplied with PEG 8000 (50%) |
| T7 DNA Polymerase (unmodified) | New England Biolabs | M0274S | supplied with 10x T7 DNA Polymerase Reaction Buffer |
| TE Buffer | Invitrogen | 12090015 | |
| ThermoMixer F2.0 | Eppendorf | 5387000013 |
Referenzen
- Traut, T. W. Physiological Concentrations of Purines and Pyrimidines. Mol. Cell. Biochem. 140, 1-22 (1994).
- McElhinny, S. A. N., et al. Abundant ribonucleotide incorporation into DNA by yeast replicative polymerases. Proc. Natl. Acad. Sci. USA. 107, 4949-4954 (2010).
- Williams, J. S., Lujan, S. A., Kunkel, T. A. Processing ribonucleotides incorporated during eukaryotic DNA replication. Nat. Rev. Mol. Cell Biol. 17, 350-363 (2016).
- Clausen, A. R., Zhang, S., Burgers, P. M., Lee, M. Y., Kunkel, T. A. Ribonucleotide incorporation, proofreading and bypass by human DNA polymerase delta. DNA Repair. 12, 121-127 (2013).
- Potenski, C. J., Klein, H. L. How the misincorporation of ribonucleotides into genomic DNA can be both harmful and helpful to cells. Nucleic Acids Res. 42, 10226 (2014).
- Vengrova, S., Dalgaard, J. Z. RNase-sensitive DNA modification(s) initiates S. pombe mating-type switching. Gene. Dev. 18, 794-804 (2004).
- Lujan, S. A., Williams, J. S., Clausen, A. R., Clark, A. B., Kunkel, T. A. Ribonucleotides Are Signals for Mismatch Repair of Leading-Strand Replication Errors. Mol. Cell. 50, 437-443 (2013).
- Ghodgaonkar, M. M., et al. Ribonucleotides Misincorporated into DNA Act as Strand-Discrimination Signals in Eukaryotic Mismatch Repair. Mol. Cell. 50, 323-332 (2013).
- DeRose, E. F., Perera, L., Murray, M. S., Kunkel, T. A., London, R. E. Solution Structure of the Dickerson DNA Dodecamer Containing a Single Ribonucleotide. Biochemistry. 51, 2407-2416 (2012).
- Li, Y. F., Breaker, R. R. Kinetics of RNA degradation by specific base catalysis of transesterification involving the 2 '-hydroxyl group. J. Am. Chem. Soc. 121, 5364-5372 (1999).
- McElhinny, S. A. N., et al. Genome instability due to ribonucleotide incorporation into DNA. Nat. Chem. Biol. 6, 774-781 (2010).
- Berglund, A. K., et al. Nucleotide pools dictate the identity and frequency of ribonucleotide incorporation in mitochondrial DNA. Plos Genet. 13, (2017).
- Brown, J. A., Suo, Z. C. Unlocking the Sugar "Steric Gate" of DNA Polymerases. Biochemistry. 50, 1135-1142 (2011).
- Sparks, J. L., et al. RNase H2-Initiated Ribonucleotide Excision Repair. Mol. Cell. 47, 980-986 (2012).
- Miyabe, I., Kunkel, T. A., Carr, A. M. The Major Roles of DNA Polymerases Epsilon and Delta at the Eukaryotic Replication Fork Are Evolutionarily Conserved. Plos Genet. 7, (2011).
- Clausen, A. R., et al. Tracking replication enzymology in vivo by genome-wide mapping of ribonucleotide incorporation. Nat. Struct. Mol. Biol. 22, 185-191 (2015).
- Koh, K. D., Balachander, S., Hesselberth, J. R., Storici, F. Ribose-seq: global mapping of ribonucleotides embedded in genomic DNA. Nat. Methods. 12, 251 (2015).
- Keszthelyi, A., Daigaku, Y., Ptasinska, K., Miyabe, I., Carr, A. M. Mapping ribonucleotides in genomic DNA and exploring replication dynamics by polymerase usage sequencing (Pu-seq). Nat. Protoc. 10, 1786-1801 (2015).
- Ding, J., Taylor, M. S., Jackson, A. P., Reijns, M. A. M. Genome-wide mapping of embedded ribonucleotides and other noncanonical nucleotides using emRiboSeq and EndoSeq. Nat. Protoc. 10, 1433-1444 (2015).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17, 10-12 (2011).
- Langmead, B., Trapnell, C., Pop, M., Salzberg, S. L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biol. 10, (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten